सिलेक्टेड रिएक्शन मॉनिटरिंग
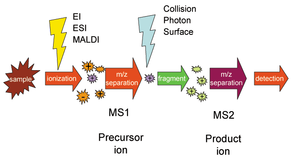
सिलेक्टेड रिएक्शन मॉनिटरिंग (एसआरएम), जिसे मल्टीपल रिएक्शन मॉनिटरिंग (एमआरएम) भी कहा जाता है, अग्रानुक्रम द्रव्यमान स्पेक्ट्रोमेट्री में उपयोग की जाने वाली एक विधि है जिसमें एक विशेष द्रव्यमान के आयन को अग्रानुक्रम द्रव्यमान स्पेक्ट्रोमीटर के पहले चरण में चुना जाता है और एक आयन उत्पाद का चयन किया जाता है। पता लगाने के लिए दूसरे मास स्पेक्ट्रोमीटर चरण में अग्रदूत आयनों की विखंडन प्रतिक्रिया का चयन किया जाता है।[1]
वेरिएंट
एसआरएम के एक सामान्य मामले का प्रतिनिधित्व निम्न द्वारा किया जा सकता है
जहां पूर्ववर्ती आयन ABCD+ को मास स्पेक्ट्रोमेट्री (MS1) के पहले चरण द्वारा चुना जाता है, अणु AB और उत्पाद आयन CD+ में अलग कर दिया जाता है, और बाद वाले को मास स्पेक्ट्रोमेट्री (MS2) के दूसरे चरण द्वारा चुना जाता है और पता लगाया जाता है। अग्रदूत और उत्पाद आयन जोड़ी को एसआरएम "संक्रमण" कहा जाता है।[2]
क्रमिक प्रतिक्रिया निगरानी (कोनसेक्युटिवे रिएक्शन मॉनिटरिंग (सीआरएम)) एसआरएम के लिए मास स्पेक्ट्रोमेट्री के तीन या अधिक चरणों का क्रमिक अनुप्रयोग है, जिसे एक साधारण मामले में दर्शाया गया है
जहां MS1 द्वारा ABCD+ का चयन किया जाता है, यह अणु AB और आयन CD+ में अलग हो जाता है।[3] आयन को दूसरे मास स्पेक्ट्रोमेट्री चरण MS2 में चुना जाता है और फिर आयन D+ बनाने के लिए और अधिक विखंडन से गुजरता है जिसे तीसरे मास स्पेक्ट्रोमेट्री चरण MS3 में चुना जाता है और पता लगाया जाता है।
मल्टीपल रिएक्शन मॉनिटरिंग (MRM) एक या अधिक अग्रदूत आयनों से कई उत्पाद आयनों के लिए चयनित रिएक्शन मॉनिटरिंग का अनुप्रयोग है,[3][4] उदाहरण के लिए
जहां ABCD+ MS1 द्वारा चुना जाता है और दो रास्तों से अलग हो जाता है, जिससे या तो AB+ या CD+ बन जाता है। आयनों को MS2 द्वारा क्रमिक रूप से चुना जाता है और पता लगाया जाता है। समानांतर प्रतिक्रिया निगरानी (पैरेलल रिएक्शन मॉनिटरिंग (पीआरएम)) एक उच्च रिज़ॉल्यूशन मास स्पेक्ट्रोमीटर का उपयोग करके एकल विश्लेषण में सभी संक्रमणों के समानांतर पता लगाने के साथ एसआरएम का अनुप्रयोग है।[5]
प्रोटिओमिक्स
मास स्पेक्ट्रोमेट्री द्वारा लक्षित मात्रात्मक प्रोटिओमिक्स के लिए एसआरएम का उपयोग किया जा सकता है।[6] उदाहरण के लिए, एक इलेक्ट्रोस्प्रे स्रोत में आयनीकरण के बाद, एक पेप्टाइड अग्रदूत को पहले अधिकतर इच्छित प्रजातियों की पर्याप्त आयन आबादी प्राप्त करने के लिए अलग किया जाता है। फिर इस जनसंख्या को उत्पाद आयन प्राप्त करने के लिए खंडित किया जाता है, जिसके सिग्नल बहुतायत नमूने में पेप्टाइड की प्रचुरता का संकेत देते हैं। यह प्रयोग ट्रिपल क्वाड्रुपोल मास स्पेक्ट्रोमीटर पर किया जा सकता है, जहां द्रव्यमान-रिज़ॉल्यूशन Q1 अग्रदूत को अलग करता है, q2 एक टकराव सेल के रूप में कार्य करता है, और द्रव्यमान-रिज़ॉल्यूशन Q3 को उत्पाद आयनों के माध्यम से चक्रित किया जाता है, जो एक इलेक्ट्रॉन गुणक द्वारा अंतिम क्वाड्रुपोल से बाहर निकलने पर पता लगाया जाता है। एक अग्रदूत/उत्पाद जोड़ी को प्रायः संक्रमण के रूप में जाना जाता है। यह सुनिश्चित करने के लिए बहुत काम किया जाता है कि ऐसे बदलावों का चयन किया जाए जिनमें अधिकतम विशिष्टता हो।
एकाग्रता मानकों के रूप में एक जटिल आव्यूह में भारी लेबल वाले पेप्टाइड्स के साथ समस्थानिक लेबलिंग का उपयोग करके (जैसे, D, 13C, or 15N), एसआरएम का उपयोग एक अंशांकन वक्र बनाने के लिए किया जा सकता है जो मूल, हल्के पेप्टाइड और विस्तार से (यानी, प्रतिलिपि संख्या प्रति कोशिका (जीव विज्ञान)), इसके मूल प्रोटीन की पूर्ण मात्रा प्रदान कर सकता है।[2]
एसआरएम का उपयोग जंगली-प्रकार और उत्परिवर्ती जीन (उत्परिवर्ती प्रोटीन) द्वारा एन्कोड किए गए प्रोटीन की पहचान करने और ट्यूमर और जैविक तरल पदार्थों में उनकी पूर्ण प्रतिलिपि संख्या निर्धारित करने के लिए किया गया है, इस प्रकार एक कोशिका में प्रोटीन की पूर्ण प्रतिलिपि संख्या के बारे में मुलभुत प्रश्नों का उत्तर दिया जाता है, जो स्तनधारी कोशिकाओं और मानव शरीर के डिजिटल मॉडलिंग और ट्यूमर में आनुवंशिक रूप से असामान्य प्रोटीन के सापेक्ष स्तर में आवश्यक होगा, और नैदानिक अनुप्रयोगों के लिए उपयोगी हुए हैं।[7][8] एसआरएम का उपयोग पेप्टाइड्स के पूर्ण उत्पाद आयन स्कैन को ट्रिगर करने की एक विधि के रूप में भी किया गया है a) एसआरएम संक्रमण की विशिष्टता की पुष्टि करें, या b) विशिष्ट पोस्ट-ट्रांसलेशनल संशोधनों का पता लगाएं जो मानक MS विश्लेषणों की पहचान की सीमा से नीचे हैं।[9] 2017 में, एसआरएम को एक अत्यधिक संवेदनशील और प्रतिलिपि प्रस्तुत करने योग्य मास स्पेक्ट्रोमेट्री-आधारित प्रोटीन लक्षित डिटेक्शन प्लेटफॉर्म ("सेफ-एसआरएम" शीर्षक) के रूप में विकसित किया गया है, और यह प्रदर्शित किया गया है कि एसआरएम-आधारित नई पाइपलाइन के नैदानिक प्रोटिओमिक्स अनुप्रयोगों में प्रमुख फायदे हैं। पारंपरिक एसआरएम पाइपलाइनों पर, और इसने एंटीबॉडी-आधारित प्रोटीन बायोमार्कर डायग्नोस्टिक विधियों, जैसे कि एलिसा की तुलना में नाटकीय रूप से उच्च नैदानिक प्रदर्शन का प्रदर्शन किया है।[10]
यह भी देखें
- मात्रात्मक प्रोटिओमिक्स
- प्रोटीन मास स्पेक्ट्रोमेट्री
संदर्भ
- ↑ E. de Hoffmann (1996). "Tandem Mass Spectrometry: a Primer" (PDF). Journal of Mass Spectrometry. 31 (2): 129–137. Bibcode:1996JMSp...31..129D. doi:10.1002/(SICI)1096-9888(199602)31:2<129::AID-JMS305>3.0.CO;2-T.
- ↑ 2.0 2.1 Lange, Vinzenz; Picotti, Paola; Domon, Bruno; Aebersold, Ruedi (2008). "Selected reaction monitoring for quantitative proteomics: a tutorial". Molecular Systems Biology. 4: 222. doi:10.1038/msb.2008.61. ISSN 1744-4292. PMC 2583086. PMID 18854821.
- ↑ 3.0 3.1 Murray, Kermit K.; Boyd, Robert K.; Eberlin, Marcos N.; Langley, G. John; Li, Liang; Naito, Yasuhide (2013). "Definitions of terms relating to mass spectrometry (IUPAC Recommendations 2013)". Pure and Applied Chemistry. 85 (7): 1515–1609. doi:10.1351/PAC-REC-06-04-06. ISSN 1365-3075.
- ↑ Kondrat, R. W.; McClusky, G. A.; Cooks, R. G. (1978). "Multiple reaction monitoring in mass spectrometry/mass spectrometry for direct analysis of complex mixtures". Analytical Chemistry. 50 (14): 2017–2021. doi:10.1021/ac50036a020. ISSN 0003-2700.
- ↑ Peterson, A. C.; Russell, J. D.; Bailey, D. J.; Westphall, M. S.; Coon, J. J. (2012). "उच्च संकल्प और उच्च द्रव्यमान सटीकता मात्रात्मक, लक्षित प्रोटिओमिक्स के लिए समानांतर प्रतिक्रिया निगरानी". Molecular & Cellular Proteomics. 11 (11): 1475–1488. doi:10.1074/mcp.O112.020131. ISSN 1535-9476. PMC 3494192. PMID 22865924.
- ↑ Picotti, Paola; Aebersold, Ruedi (2012). "Selected reaction monitoring–based proteomics: workflows, potential, pitfalls and future directions". Nature Methods. 9 (6): 555–566. doi:10.1038/nmeth.2015. ISSN 1548-7091. PMID 22669653. S2CID 205420574.
- ↑ Wang Q, Chaerkady R, Wu J, et al. (February 2011). "उत्परिवर्ती प्रोटीन कैंसर-विशिष्ट बायोमार्कर के रूप में।". Proc. Natl. Acad. Sci. U.S.A. 108 (6): 2444–9. Bibcode:2011PNAS..108.2444W. doi:10.1073/pnas.1019203108. PMC 3038743. PMID 21248225.
- ↑ "निरपेक्ष प्रोटीन परिमाणीकरण के लिए चयनित रिएक्शन मॉनिटरिंग मास स्पेक्ट्रोमेट्री". Journal of Visualized Experiments.
- ↑ Unwin RD, Griffiths JG, et al. (August 2005). "उच्च संवेदनशीलता वाले प्रोटीन फास्फोराइलेशन की साइटों की पहचान करने के लिए एकाधिक प्रतिक्रिया निगरानी।". Molecular & Cellular Proteomics. 4 (8): 1134–44. doi:10.1074/mcp.M500113-MCP200. PMID 15923565.
- ↑ Wang Q, Zhang M, Tomita T, et al. (December 2017). "पेप्टाइड बायोमार्कर को मान्य करने के लिए चयनित प्रतिक्रिया निगरानी दृष्टिकोण।". Proc. Natl. Acad. Sci. U.S.A. 114 (51): 13519–13524. doi:10.1073/pnas.1712731114. PMC 5754789. PMID 29203663.
बाहरी संबंध
- एसआरएमatlas; quantify proteins in complex proteome digests by mass spectrometry