कॉपर प्रोटीन
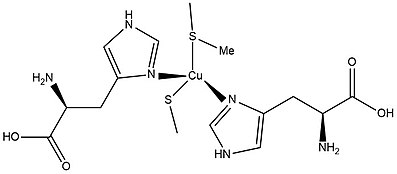
ताँबा प्रोटीन वे प्रोटीन होते हैं जिनमें कृत्रिम समूहों के रूप में एक या अधिक कॉपर आयन होते हैं। कॉपर प्रोटीन वायु-श्वास जीवन के सभी रूपों में पाए जाते हैं। ये प्रोटीन आमतौर पर ऑक्सीजन (O) की भागीदारी के साथ या उसके बिना इलेक्ट्रॉन हस्तांतरण से जुड़े होते हैं2). कुछ जीव लौह प्रोटीन के स्थान पर ऑक्सीजन ले जाने के लिए तांबे के प्रोटीन का भी उपयोग करते हैं। मनुष्यों में एक प्रमुख कॉपर प्रोटीन साइटोक्रोम सी ऑक्सीडेज (सीसीओ) में है। एंजाइम सीसीओ नियंत्रित दहन में मध्यस्थता करता है जो एडेनोसाइन ट्रायफ़ोस्फेट का उत्पादन करता है।[1]
कक्षाएं
कॉपर प्रोटीन में धातु केंद्रों को कई प्रकारों में वर्गीकृत किया जा सकता है:[2]
- टाइप I कॉपर सेंटर (T1Cu) की विशेषता एक एकल कॉपर परमाणु है जो दो हिस्टिडीन अवशेषों और एक त्रिकोणीय समतल संरचना में एक सिस्टीन अवशेष और एक चर अक्षीय लिगैंड द्वारा समन्वित होता है। कॉपर बाइंडिंग प्रोटीन (जैसे एमिसिएनिन, प्लास्टोसायनिन और स्यूडोएज़ुरिन) के प्लास्टोसायनिन परिवार में अक्षीय लिगैंड मेथिओनिन का गंधक है, जबकि मेथियोनीन (जैसे glutamine ) के अलावा अन्य अमीनो एसिड वर्ग II T1Cu कॉपर प्रोटीन को जन्म देते हैं। रिन आसु में तीसरे प्रकार के T1Cu केंद्र होते हैं: एक अक्षीय स्थिति में मेथियोनीन के अलावा, उनमें एक दूसरा अक्षीय लिगैंड (ग्लाइसिन अवशेष का कार्बोनिल) होता है। T1Cu-युक्त प्रोटीन को आमतौर पर कप्रेडॉक्सिन कहा जाता है, और समान त्रि-आयामी संरचनाएं, अपेक्षाकृत उच्च कमी क्षमता (> 250 mV), और 600 एनएम (सल्फर→कॉपर ल्यूमिनोफोर के कारण) के करीब मजबूत अवशोषण दिखाते हैं, जो आमतौर पर नीले रंग को जन्म देता है। . क्यूप्रेडॉक्सिन को अक्सर ब्लू कॉपर प्रोटीन कहा जाता है। यह भ्रामक हो सकता है, क्योंकि कुछ T1Cu केंद्र भी लगभग 460 एनएम अवशोषित करते हैं और इसलिए हरे होते हैं। जब इलेक्ट्रॉन स्पिन प्रतिध्वनि स्पेक्ट्रोस्कोपी द्वारा अध्ययन किया जाता है, तो T1Cu केंद्र स्पेक्ट्रम के समानांतर क्षेत्र में छोटे हाइपरफाइन विभाजन दिखाते हैं (सामान्य तांबा समन्वय यौगिकों की तुलना में)।[3]
- टाइप II कॉपर सेंटर (T2Cu) N या N/O लिगेंड्स द्वारा एक वर्गाकार तलीय समन्वय प्रदर्शित करते हैं। वे नियमित तांबा समन्वय यौगिकों के समान समानांतर क्षेत्र में तांबे की अति सूक्ष्म संरचना के साथ एक अक्षीय इलेक्ट्रॉन स्पिन अनुनाद स्पेक्ट्रम प्रदर्शित करते हैं। चूंकि कोई सल्फर बंधाव मौजूद नहीं है, इसलिए इन केंद्रों के ऑप्टिकल स्पेक्ट्रा में विशिष्ट विशेषताओं का अभाव है। T2Cu केंद्र एंजाइमों में होते हैं, जहां वे ऑक्सीकरण या ऑक्सीजनेशन में सहायता करते हैं।[4]
- प्रकार III तांबे के केंद्र (T3Cu) में तांबे के केंद्रों की एक जोड़ी होती है, प्रत्येक तीन हिस्टिडीन अवशेषों द्वारा समन्वित होता है। ब्रिजिंग लिगैंड के साथ उनके सहसंयोजक ओवरलैप के कारण दो एस = 1/2 धातु आयनों के बीच मजबूत एंटीफेरोमैग्नेटिक युग्मन (यानी स्पिन जोड़ी) के कारण ये प्रोटीन कोई ईपीआर सिग्नल प्रदर्शित नहीं करते हैं। ये केंद्र कुछ ऑक्सीडेज और संक्रमण धातु डाइऑक्सीजन कॉम्प्लेक्स | ऑक्सीजन-परिवहन प्रोटीन (जैसे hemocyanin और टायरोसिनेज़ ) में मौजूद हैं।[5]
- द्विन्यूक्लियर कॉपर ए केंद्र (CuA) साइटोक्रोम सी ऑक्सीडेज|साइटोक्रोम सी ऑक्सीडेज और नाइट्रस-ऑक्साइड रिडक्टेस में पाए जाते हैं (EC 1.7.99.6). तांबे के दो परमाणु दो हिस्टिडाइन, एक मेथियोनीन, एक प्रोटीन बैकबोन कार्बोनिल ऑक्सीजन और दो ब्रिजिंग सिस्टीन अवशेषों द्वारा समन्वित होते हैं।[6]
- कॉपर बी केंद्र (CuB) साइटोक्रोम सी ऑक्सीडेज|साइटोक्रोम सी ऑक्सीडेज में पाए जाते हैं। त्रिकोणीय पिरामिडीय ज्यामिति में तांबे का परमाणु तीन हिस्टिडाइन द्वारा समन्वित होता है।
- एक टेट्रान्यूक्लियर कॉपर जेड केंद्र (CuZ) नाइट्रस-ऑक्साइड रिडक्टेस में पाया जाता है। चार तांबे के परमाणु सात हिस्टिडीन अवशेषों द्वारा समन्वित होते हैं और एक सल्फर परमाणु द्वारा पुल किए जाते हैं।
नीला तांबा प्रोटीन
नीले तांबे के प्रोटीन का नाम उनके गहरे नीले रंग (Cu(II)) के कारण पड़ा है। नीले तांबे के प्रोटीन को अक्सर "प्रोटीन चांदनी " कहा जाता है, जिसका अर्थ है कि एक प्रोटीन एक से अधिक कार्य कर सकता है। वे Cu(I) और Cu(II) के बीच सक्रिय साइट शट्लिंग के साथ, इलेक्ट्रॉन स्थानांतरण एजेंटों के रूप में कार्य करते हैं। Cuऑक्सीकृत अवस्था में 2+ Cu बनाने के लिए एक इलेक्ट्रॉन स्वीकार कर सकता है1+कम प्रोटीन में। Cu केंद्र की ज्यामिति का इसके रेडॉक्स गुणों पर बड़ा प्रभाव पड़ता है। जाह्न-टेलर विरूपण नीले तांबे के प्रोटीन पर लागू नहीं होता है क्योंकि तांबे की साइट में कम समरूपता होती है जो डी-ऑर्बिटल मैनिफोल्ड में अध: पतन का समर्थन नहीं करती है। बड़े पुनर्गठन परिवर्तनों की अनुपस्थिति उनके इलेक्ट्रॉन स्थानांतरण की दर को बढ़ाती है। टाइप-I ब्लू कॉपर प्रोटीन की सक्रिय साइट। समन्वय क्षेत्र में दो 2-हिस्टिडाइन, 1 मेथिओनिन और 1 सिस्टीन मौजूद हैं। टाइप-I ब्लू कॉपर प्रोटीन के उदाहरण प्लास्टोसायनिन, अज़ुरिन और नाइट्राइट रिडक्टेस, हेमोसायनिन और टायरोसिनेज़ हैं।
ब्लू कॉपर प्रोटीन प्रकार I कॉपर केंद्रों की संरचना
ब्लू कॉपर प्रोटीन, टाइप 1 कॉपर प्रोटीन का एक वर्ग, छोटे प्रोटीन होते हैं जिनमें एक कप्रेडॉक्सिन फोल्ड और एक एकल प्रकार I कॉपर आयन होता है जो दो हिस्टिडीन एन-डोनर, एक सिस्टीन थियोलेट एस-डोनर और एक मेथियोनीन थिओथर एस-डोनर द्वारा समन्वित होता है।[7] ऑक्सीकृत अवस्था में, Cu2+|Cu+2आयन या तो एक त्रिकोणीय द्विपिरामिडल या टेट्राहेड्रल समन्वय बनाएगा।[7]टाइप 1 कॉपर प्रोटीन को नीले कॉपर प्रोटीन के रूप में पहचाना जाता है क्योंकि लिगैंड से धातु चार्ज 600 एनएम पर एक तीव्र बैंड को स्थानांतरित करता है जो इलेक्ट्रॉन अवशोषण स्पेक्ट्रम में मौजूद गहरे नीले रंग की विशेषता देता है।[8]
टाइप 1 ब्लू कॉपर प्रोटीन, एमिसिएनिन की प्रोटीन संरचना, पॉलीपेप्टाइड सिलवटों से बनी होती है जो आमतौर पर ब्लू कॉपर प्रोटीन β सैंडविच संरचना में पाए जाते हैं।[9] संरचना प्लास्टोसायनिन और अज़ुरिन के समान है क्योंकि वे टाइप 1 कॉपर प्रोटीन के रूप में भी पहचाने जाते हैं।[9]प्रत्येक कॉपर प्रोटीन के कॉपर साइट की ज्यामिति के कारण भी वे एक दूसरे के समान हैं। प्रोटीन अज़ुरिन में लम्बी अक्षीय ग्लाइसिन और मेथोइनियोन सल्फर लिगेंड के साथ एक त्रिकोणीय द्विपिरामिडल ज्यामिति है। प्लास्टोसायनिन में अक्षीय स्थिति पर एक अतिरिक्त मेथिओनिन सल्फर लिगैंड होता है। प्रत्येक कॉपर प्रोटीन का मुख्य अंतर यह है कि प्रत्येक प्रोटीन में कॉपर केंद्र से समन्वयित लिगैंड की अलग-अलग संख्या और प्रजातियां होती हैं।
नीले कॉपर प्रोटीन प्रकार I कॉपर कॉम्प्लेक्स की इलेक्ट्रॉनिक संरचना
कॉपर आयन और सिस्टीन सल्फर के बीच मजबूत बंधन सिस्टीन सल्फर पर गैर-बंधित इलेक्ट्रॉन को निम्न/उच्च स्पिन अवस्था कॉपर आयन, डी दोनों पर मौजूद होने की अनुमति देता है।x2-dy2ऑर्बिटल और सिस्टीन सल्फर का पी कक्षीय[8]अधिकांश तांबे (II) कॉम्प्लेक्स जाह्न-टेलर प्रभाव प्रदर्शित करेंगे | जाह्न-टेलर प्रभाव जब कॉम्प्लेक्स एक ऑक्टाहेड्रल आणविक ज्यामिति कॉम्प्लेक्स ज्यामिति का टेट्रागोनल विरूपण बनाता है।[10] नीले तांबे के प्रोटीन के साथ, मजबूत भूमध्यरेखीय सिस्टीन लिगैंड और कमजोर अक्षीय मेथिओनिन लिगैंड के कारण एक विकृत टेट्राहेड्रल आणविक ज्यामिति बनेगी।[10]दो तटस्थ हिस्टिडाइन लिगैंड प्रोटीन लिगैंड द्वारा स्थित होते हैं इसलिए ज्यामिति विकृत टेट्राहेड्रल होती है। इसके कारण वे चतुष्फलकीय या वर्गाकार समतल के रूप में पूर्णतः समन्वय करने में सक्षम नहीं हो पाएंगे।
तापमान के साथ वर्णक्रमीय परिवर्तन
तापमान कम करने से बदलाव बदल सकते हैं। लगभग 16000 सेमी पर तीव्र अवशोषण−1को नीले तांबे की अवशोषण विशेषता की विशेषता बताई गई थी। मध्यम अवशोषण तीव्रता वाला दूसरा निम्न ऊर्जा फ़ीचर बैंड था। प्लास्टोसायनिन पर ध्रुवीकृत सिग्नल-क्रिस्टल अवशोषण डेटा से पता चला कि दोनों बैंडों में समान ध्रुवीकरण अनुपात है जो Cu(II)-S(Cys) बंधन से जुड़ा है। यह समझाया गया है कि सामान्य क्यूप्रिक कॉम्प्लेक्स में उच्च ऊर्जा तीव्र सिग्मा और कम ऊर्जा कमजोर π बांड होते हैं। हालाँकि, नीले तांबे के प्रोटीन मामले में कम ऊर्जा तीव्र सिग्मा और उच्च ऊर्जा कमजोर π बांड होते हैं क्योंकि सीटी तीव्रता सीटी प्रक्रिया में दाता और स्वीकर्ता ऑर्बिटल्स के ओवरलैप को दर्शाती है। इसके लिए आवश्यक है कि 3डी(x2-y2 ) नीले तांबे की साइट की कक्षा को इस प्रकार उन्मुख किया जाए कि इसकी पालियाँ Cu-S(Cys) बंधन को द्विभाजित करें, जिससे प्रमुख π सीधे सल्फर के साथ ओवरलैप हो जाए। अंत में, नीले कॉपर प्रोटीन की जमीनी अवस्था तरंग फ़ंक्शन की प्रकृति इलेक्ट्रॉन अवशोषण स्पेक्ट्रम में समृद्ध है।
आंतरिक और बाहरी क्षेत्र धातु समन्वय
सिस्टीन सल्फर कॉपर (II) आयन बांड 2.6 से 3.2 Å तक होते हैं।[11] कॉपर (आई) आयोडाइड के कम रूप के साथ, प्रोटीन संरचनाएं अभी भी 0.1 Å या उससे कम लंबे बंधनों के साथ बनती हैं। ऑक्सीकृत और कम प्रोटीन संरचनाओं के साथ, वे सुपरइम्पोज़ेबल हैं। एमिसिएनिन के साथ, हिस्टिडाइन के लिगेटेड होने के कारण एक अपवाद है और यह कॉपर आयोडाइड से बंधा नहीं है।[11]अज़ुरिन में, सिस्टीन 112 थायोलेट asparagine और फेनिलएलनिन114 के एमाइड बैकबोन से हाइड्रोजन बांड स्वीकार करता है, और हिस्टिडाइन46 एस्पेरेगिन10 के कार्बोनिल बैकबोन को एक हाइड्रोजन बांड दान करता है। प्लास्टोसायनिन का सिस्टीन84 थिओलेट एक एमाइड बैकबोन, एस्परगिन38 से हाइड्रोजन बंधन को स्वीकार करता है, और हिस्टिडाइन37 एलानिन33 के कार्बोनिल बैकबोन के साथ दृढ़ता से और ल्यूसीन5, ग्लाइसिन34 के कार्बोनिल बैकबोन और फेनिलएलनिन35 के एमाइड बैकबोन के साथ अधिक कमजोर रूप से इंटरैक्ट करता है।[11]

ब्लू कॉपर एंटैटिक स्टेट प्रोटीन
साथ2+ कॉम्प्लेक्स में आमतौर पर धीमी स्थानांतरण दर होती है। एक उदाहरण Cu है2+/+aquo, जो 5 x 10 है−7एम−1.सेकंड-1नीले कॉपर प्रोटीन की तुलना में जो 1ms-01μs है।[12] इलेक्ट्रॉन स्थानांतरण पर ऑक्सीकृत Cuनीले कॉपर प्रोटीन सक्रिय स्थल पर 2+स्थिति न्यूनतम हो जाएगी क्योंकि जाह्न-टेलर प्रभाव न्यूनतम हो गया है। विकृत ज्यामिति जाह्न-टेलर विकृति को रोकती है। असममित लिगैंड क्षेत्र के कारण कक्षीय विकृति दूर हो जाती है।[10]असममित लिगैंड क्षेत्र मजबूत भूमध्यरेखीय सिस्टीन लिगैंड और कमजोर अक्षीय मेथिओनिन लिगैंड से प्रभावित होता है। चित्र 2 में, एक ऊर्जा स्तर आरेख तीन अलग-अलग प्रासंगिक ज्यामिति और उनके डी-ऑर्बिटल विभाजन को दर्शाता है और जाह्न-टेलर प्रभाव को नीले रंग में दिखाया गया है।[10](i) टेट्राहेड्रल ज्यामिति ऊर्जा स्तर आरेख को दिखाता है जो कि पतित है। टेट्राहेड्रल संरचना विकृत ऑर्बिटल्स के कारण जाह्न-टेलर विरूपण से गुजर सकती है। (ii) सी दिखाता है3v एक के साथ सममित ज्यामिति ऊर्जा स्तर विभाजन आरेख 2ई जमीनी अवस्था जो पतित हो। सी3v ज्यामिति का निर्माण घटी हुई जगह पर लम्बे मेथियोनीन थिओथर बंधन द्वारा किया गया था। अयुग्मित इलेक्ट्रॉन जाह्न-टेलर प्रभाव की ओर ले जाते हैं। (iii) सी की जमीनी स्थिति ऊर्जा स्तर विभाजन आरेख दिखाता हैs लंबे थियोएस्टर बंधन और बाद में छोटे थियोलेट बंधन के साथ ज्यामिति। यह नीले कॉपर प्रोटीन की उचित ज्यामिति है। इससे पता चलता है कि जाह्न-टेलर प्रभाव की कोई उपस्थिति नहीं है। ऊर्जा आरेख से पता चलता है कि छोटे Cu-S(Cys) बंधन की विषमता और अत्यधिक विकृत Cu-L बंधन कोणों के कारण ऑर्बिटल्स की विकृति दूर हो जाती है और इस तरह जाह्न-टेलर प्रभाव दूर हो जाता है, जो कमजोर होने के कारण होता है Cu-S(Met) पर दाता और Cu-S(Met) पर मजबूत दाता।[10]
यह भी देखें
संदर्भ
- ↑ Lontie R, ed. (2018). कॉपर प्रोटीन और कॉपर एंजाइम. Vol. III. CRC Press. ISBN 9781315891798.
- ↑ Holm RH, Kennepohl P, Solomon EI (November 1996). "जीव विज्ञान में धातु स्थलों के संरचनात्मक और कार्यात्मक पहलू". Chemical Reviews. 96 (7): 2239–2314. doi:10.1021/cr9500390. PMID 11848828.
- ↑ Arcos-López, Trinidad; Schuth, Nils; Quintanar, Liliana (2020), "Chapter 3: The Type 1 Blue Copper Site: From Electron Transfer to Biological Function", in Sosa Torres, Martha E.; Kroneck, Peter M.H. (eds.), Transition Metals and Sulfur: A Strong Relationship for Life, Metal Ions in Life Sciences (Series editors Astrid Sigel, Eva Freisinger and Roland K.O. Sigel), vol. 20, Berlin/Boston: de Gruyter, doi:10.1515/9783110589757-003
- ↑ Klinman JP (November 1996). "तंत्र जिससे मोनोन्यूक्लियर कॉपर प्रोटीन कार्बनिक सब्सट्रेट्स को क्रियाशील करते हैं". Chemical Reviews. 96 (7): 2541–2562. doi:10.1021/cr950047g. PMID 11848836..
- ↑ Lewis EA, Tolman WB (2004). "डाइऑक्सीजन-कॉपर सिस्टम की प्रतिक्रियाशीलता". Chemical Reviews. 104 (2): 1047–1076. doi:10.1021/cr020633r. PMID 14871149.
- ↑ Solomon EI, Sundaram UM, Machonkin TE (November 1996). "मल्टीकॉपर ऑक्सीडेस और ऑक्सीजनेज". Chemical Reviews. 96 (7): 2563–2606. doi:10.1021/cr950046o. PMID 11848837.
- ↑ 7.0 7.1 Malmström BG (1994). "Rack-induced bonding in blue-copper proteins". EJB Reviews 1994. Berlin Heidelberg: Springer. pp. 157–164. doi:10.1007/978-3-642-79502-2_12. ISBN 978-3-540-58830-6.
- ↑ 8.0 8.1 Bertini I (2007-07-01). Biological inorganic chemistry: structure and reactivity. S2CID 93183803.
- ↑ 9.0 9.1 De Rienzo F, Gabdoulline RR, Menziani MC, Wade RC (August 2000). "Blue copper proteins: a comparative analysis of their molecular interaction properties". Protein Science. 9 (8): 1439–54. doi:10.1110/ps.9.8.1439. PMC 2144732. PMID 10975566.
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 Solomon EI, Hadt RG (April 2011). "नीले तांबे के प्रोटीन को समझने में हालिया प्रगति". Coordination Chemistry Reviews. 255 (7–8): 774–789. doi:10.1016/j.ccr.2010.12.008.
- ↑ 11.0 11.1 11.2 Warren JJ, Lancaster KM, Richards JH, Gray HB (October 2012). "नीले तांबे के प्रोटीन में आंतरिक और बाहरी क्षेत्र का धातु समन्वय". Journal of Inorganic Biochemistry. 115: 119–26. doi:10.1016/j.jinorgbio.2012.05.002. PMC 3434318. PMID 22658756.
- ↑ Comba, Peter (May 2000). "एंटाटिक अवस्था में समन्वय यौगिक". Coordination Chemistry Reviews. 200–202: 217–245. doi:10.1016/s0010-8545(00)00265-4. ISSN 0010-8545.