कार्बेनियम आयन
एक कार्बेनियम आयन संरचना के साथ एक धनायन है RR′R″C+, यानी, वैलेंस (रसायन विज्ञान) कार्बन वाली एक रासायनिक प्रजाति जो +1 औपचारिक चार्ज वहन करती है।
पुराने साहित्य में इस वर्ग के लिए कार्बोनियम आयन नाम का इस्तेमाल किया गया था, लेकिन अब यह विशेष रूप से कार्बोकेशन के एक अन्य परिवार, कार्बोनियम आयनों को संदर्भित करता है, जहां चार्ज कार्बन वैलेंस (रसायन विज्ञान) है।[1] वर्तमान परिभाषाएँ 1972 में रसायनज्ञ जॉर्ज एंड्रयू ओलाह द्वारा प्रस्तावित की गई थीं,[2] और अब व्यापक रूप से स्वीकार किए जाते हैं।
इलेक्ट्रॉनों के अधूरे अष्टक नियम होने के कारण कार्बोनियम आयन आमतौर पर अत्यधिक प्रतिक्रियाशील होते हैं; हालाँकि, कुछ कार्बेनियम आयन, जैसे ट्रोपिलियम धनायन आयन, कार्बन परमाणुओं के बीच धनात्मक आवेश के निरूपित होने के कारण अपेक्षाकृत स्थिर होते हैं।
नामकरण
कार्बेनियम आयनों को प्राथमिक कार्बन , द्वितीयक कार्बन , या तृतीयक कार्बन के रूप में वर्गीकृत किया जाता है, जो इस बात पर निर्भर करता है कि आयनित कार्बन से बंधे कार्बन परमाणुओं की संख्या 1, 2, या 3 है। (आयनित कार्बन से जुड़े शून्य कार्बन वाले आयन, जैसे मिथेनियम , CH+
3, आमतौर पर प्राथमिक कक्षा में शामिल होते हैं)।
प्रतिक्रियाशीलता
स्थिरता आमतौर पर चार्ज-असर कार्बन से बंधे अल्काइल समूहों की संख्या के साथ बढ़ जाती है। द्वितीयक कार्बोकेशन की तुलना में तृतीयक कार्बोकेशन अधिक स्थिर (और अधिक आसानी से बनते हैं), क्योंकि वे अतिसंयुग्मन द्वारा स्थिर होते हैं। प्राथमिक कार्बोकेशन अत्यधिक अस्थिर होते हैं। इसलिए, SN1 अभिक्रिया|S . जैसी अभिक्रियाएँN1 प्रतिक्रिया और E1 उन्मूलन प्रतिक्रिया आम तौर पर तब नहीं होती है जब प्राथमिक कार्बेनियम बनता है।
हालांकि, आयनित कार्बन के साथ दोगुना बंधन वाला कार्बन अनुनाद (रसायन विज्ञान) द्वारा आयन को स्थिर कर सकता है। एलिल केशन जैसे धनायन, CH
2=CH−CH+
2, और लोबान कटियन, C
6H
5−CH+
2अधिकांश अन्य कार्बोकेशन की तुलना में अधिक स्थिर होते हैं। अणु जो एलिल या बेंजाइल कार्बेनियम बना सकते हैं, विशेष रूप से प्रतिक्रियाशील होते हैं। कार्बोनियम आयनों को heteroatom द्वारा भी स्थिर किया जा सकता है।[3]
कार्बेनियम आयन कम स्थिर संरचनाओं से समान रूप से स्थिर या अधिक स्थिर वाले 10 से अधिक दर स्थिरांक के साथ पुनर्व्यवस्था प्रतिक्रिया ओं से गुजर सकते हैं9 एस-1. यह तथ्य कई यौगिकों के सिंथेटिक रास्ते को जटिल बनाता है। उदाहरण के लिए, जब पेंटन-3-ओल को जलीय एचसीएल के साथ गर्म किया जाता है, तो शुरू में गठित 3-पेंटाइल कार्बोकेशन 3-पेंटाइल और 2-पेंटाइल के सांख्यिकीय मिश्रण में पुनर्व्यवस्थित होता है। ये धनायन क्लोराइड आयन के साथ प्रतिक्रिया करके लगभग 1:2 के अनुपात में 3-क्लोरोपेंटेन और 2-क्लोरोपेंटेन बनाते हैं।
कार्बेनियम आयनों के प्रकार
एसाइलियम आयन
एक हाइड्राइड आयन को हटाकर कार्बेनियम आयनों को सीधे अल्केन्स से तैयार किया जा सकता है, H−
, एक मजबूत एसिड के साथ। उदाहरण के लिए, मैजिक एसिड , सुरमा पेंटाफ्लोराइड का मिश्रण (SbF
5) और फ्लोरोसल्फ्यूरिक एसिड (FSO
3H), आइसोब्यूटेन को ट्राइमेथिलकार्बेनियम केशन में बदल देता है, (CH
3)
3C+
.[4]
सुगंधित कार्बेनियम आयन
ट्रोपिलियम आयन सूत्र के साथ एक सुगंधित प्रजाति है C
7H+
7.[5] इसका नाम अणु उष्णकटिबंधीय (स्वयं अणु एट्रोपिन के लिए नामित) से निकला है। ट्रोपिलियम केशन के लवण स्थिर हो सकते हैं, उदा। ट्रोपिलियम टेट्राफ्लोरोबोरेट । इसे साइक्लोहेप्टाट्रिएन (ट्रोपिलिडीन) और ब्रोमिन या फास्फोरस पेंटाक्लोराइड से बनाया जा सकता है[6]
यह एक तलीय, चक्रीय, सप्तकोणीय आयन है; इसमें 6 -इलेक्ट्रॉन (4n + 2, जहां n = 1) है, जो Hückel के सुगन्धितता के नियम को पूरा करता है। यह धातु परमाणुओं के लिए एक लिगैंड के रूप में समन्वय कर सकता है।
दिखाई गई संरचना सात अनुनाद योगदानकर्ता ओं का एक सम्मिश्रण है जिसमें प्रत्येक कार्बन धनात्मक आवेश का हिस्सा वहन करता है।
1891 में जी. मर्लिंग ने साइक्लोहेप्टाट्रिएन और ब्रोमीन की प्रतिक्रिया से पानी में घुलनशील नमक प्राप्त किया।[7] 1954 में विलियम वॉन एगर्स डोअरिंग और नॉक्स द्वारा संरचना को स्पष्ट किया गया था।[8][9]
एक अन्य सुगंधित कार्बेनियम आयन साइक्लोप्रोपेनिल या साइक्लोप्रोपेनियम आयन है, C
3H+
3, 1970 में रोनाल्ड ब्रेस्लो और जॉन टी. ग्रोव्स द्वारा प्राप्त किया गया।[10] हालांकि ट्रोपिलियम केशन से कम स्थिर, यह कार्बेनियम आयन कमरे के तापमान पर भी लवण बना सकता है। ऐसे लवणों के समाधान ब्रेस्लो और ग्रोव्स द्वारा एक सुगन्धित कार्बेनियम आयन के लिए अपेक्षाओं से मेल खाने वाले स्पेक्ट्रोस्कोपिक और रासायनिक गुणों के लिए पाए गए थे।
ट्राइफेनिलमेथाइल (ट्रिटाइल) कटियन
ट्राइफेनिलकार्बेनियम या ट्राइफेनिलमेथाइल केशन, [C(C
6H
5)
3]+
, विशेष रूप से स्थिर है क्योंकि धनात्मक आवेश को 10 कार्बन परमाणुओं (तीन फिनाइल समूहों में से प्रत्येक के ऑर्थो और पैरा स्थिति में 3 कार्बन परमाणु, साथ ही केंद्रीय कार्बन परमाणु) के बीच वितरित किया जा सकता है। यह यौगिक ट्राइफेनिलमेथाइल हेक्साफ्लोरोफॉस्फेट में मौजूद है [C(C
6H
5)
3]+
[PF
6]−
, ट्राइफेनिलमेथाइल टेट्राफ्लोरोबोरेट [C(C
6H
5)
3]+
[BF
4]−
, और ट्राइफेनिलमेथाइल परक्लोरेट [C(C
6H
5)
3]+
[ClO
4]−
.[11] इसके डेरिवेटिव में ट्राईरिलमीथेन डाई शामिल हैं।
एरेनियम आयन

एक एरेनियम आयन एक साइक्लोहेक्साडेनिल धनायन है जो इलेक्ट्रोफिलिक सुगंधित प्रतिस्थापन में एक प्रतिक्रियाशील मध्यवर्ती के रूप में प्रकट होता है।[12] ऐतिहासिक कारणों से इस परिसर को वेलैंड इंटरमीडिएट भी कहा जाता है,[13] या -कॉम्प्लेक्स।
 एक कार्बन से बंधे दो हाइड्रोजन परमाणु बेंजीन वलय के लंबवत तल में स्थित होते हैं।[14] एरेनियम आयन अब सुगंधित प्रजाति नहीं है; हालाँकि, यह डेलोकलाइज़ेशन के कारण अपेक्षाकृत स्थिर है: सकारात्मक चार्ज को 5 कार्बन परमाणुओं पर पाई ऑर्बिटल | π सिस्टम के माध्यम से निरूपित किया जाता है, जैसा कि निम्नलिखित अनुनाद संरचनाओं पर दर्शाया गया है:
एक कार्बन से बंधे दो हाइड्रोजन परमाणु बेंजीन वलय के लंबवत तल में स्थित होते हैं।[14] एरेनियम आयन अब सुगंधित प्रजाति नहीं है; हालाँकि, यह डेलोकलाइज़ेशन के कारण अपेक्षाकृत स्थिर है: सकारात्मक चार्ज को 5 कार्बन परमाणुओं पर पाई ऑर्बिटल | π सिस्टम के माध्यम से निरूपित किया जाता है, जैसा कि निम्नलिखित अनुनाद संरचनाओं पर दर्शाया गया है: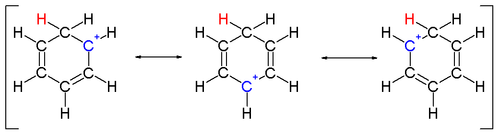 एरेनियम आयनों की स्थिरता में एक अन्य योगदान बेंजीन और जटिल इलेक्ट्रोफाइल के बीच मजबूत बंधन के परिणामस्वरूप ऊर्जा लाभ है।
एरेनियम आयनों की स्थिरता में एक अन्य योगदान बेंजीन और जटिल इलेक्ट्रोफाइल के बीच मजबूत बंधन के परिणामस्वरूप ऊर्जा लाभ है।
सबसे छोटा एरेनियम आयन प्रोटोनेटेड बेंजीन है, C
6H+
7. बेंजीन को एक स्थिर यौगिक के रूप में अलग किया जा सकता है जब बेंजीन को कार्बोरेन सुपरएसिड , एच (सीबी) द्वारा प्रोटॉन किया जाता है।11एच (सीएच3)5बीआर6).[15] बेंजेनियम नमक 150 डिग्री सेल्सियस तक थर्मल स्थिरता के साथ क्रिस्टलीय है। एक्स - रे क्रिस्टलोग्राफी से काटे गए बॉन्ड की लंबाई एक साइक्लोहेक्साडेनिल केशन संरचना के अनुरूप है।
एसाइलियम आयन
एसाइलियम आयन सूत्र RCO . के साथ एक धनायन है+</सुप>.[16] संरचना को R−C≡O . के रूप में वर्णित किया गया है+ या R−=ओ. यह एक एसाइल कार्बोकेशन का सिन्थॉन है, लेकिन वास्तविक संरचना में ऑक्सीजन और कार्बन एक ट्रिपल बॉन्ड से जुड़े होते हैं। इस तरह की प्रजातियां सामान्य प्रतिक्रियाशील मध्यवर्ती हैं, उदाहरण के लिए, फ्रिडेल-क्राफ्ट्स एसाइलेशन में भी कई अन्य कार्बनिक प्रतिक्रिया ओं जैसे कि हयाशी पुनर्व्यवस्था में। एसाइल हैलाइड से हैलाइड को हटाकर एसाइलियम आयनों वाले लवण उत्पन्न किए जा सकते हैं:
- आरसीओसीएल + एसबीसीएल5 → आरसीओ+SbCl−
6
इन धनायनों में C–O दूरी 1.1 ngströms के करीब है, जो कार्बन मोनोआक्साइड से भी कम है।[17] एसाइलियम केशन कीटोन के ईआई-मास स्पेक्ट्रा में देखे गए विशिष्ट टुकड़े हैं।
यह भी देखें
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
- कटियन
- औपचारिक आरोप
- ओकटेट नियम
- एल्काइल समूह
- दर लगातार
- एल्केन
- खुशबूदार
- सातकोणक
- ट्रायरिलमीथेन डाई
- अनुनाद संरचनाएं
- बॉन्ड लंबाई
संदर्भ
- ↑ IUPAC Gold Book carbonium ion
- ↑ "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions" George Andrew Olah; J. Am. Chem. Soc.; 1972; 94(3); 808–820.
- ↑ Hansjörg Grützmacher, Christina M. Marchand (1997), "Heteroatom stabilized carbenium ions", Coord. Chem. Rev., 163, 287–344. doi:10.1016/S0010-8545(97)00043-X
- ↑ George A. Olah and Joachim Lukas (1967), "Stable Carbonium Ions. XLVII. Alkylcarbonium ion formation from alkanes via hydride (alkide) ion abstraction in fluorosulfonic acid-antimony pentafluoride-sulfuryl chlorofluoride solution". J. Am. Chem. Soc. 89 (18), 4739–4744 doi:10.1021/ja00994a030
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "molecule". doi:10.1351/goldbook.M04002
- ↑ "Tropylium tetrafluorate" Organic Syntheses, Coll. Vol. 5, p.1138 (1973); Vol. 43, p.101 (1963). link Archived 2012-08-29 at the Wayback Machine
- ↑ Merling, G. (1891), "Ueber Tropin". Berichte der deutschen chemischen Gesellschaft, 24: 3108–3126. doi:10.1002/cber.189102402151
- ↑ "The Cycloheptatrienylium (Tropylium) Ion" W. von E. Doering, L. H. Knox J. Am. Chem. Soc., 1954, 76 (12), pp 3203–3206 doi:10.1021/ja01641a027
- ↑ "Aromaticity as a Cornerstone of Heterocyclic Chemistry" Alexandru T. Balaban, Daniela C. Oniciu, Alan R. Katritzky Chem. Rev., 2004, 104 (5), 2777–2812 doi:10.1021/cr0306790
- ↑ "Cyclopropenyl Cation. Synthesis and Characterization." R. Breslow and J. T. Groves J. Am. Chem. Soc. , 1970, 92 (4), 984–987 [1]
- ↑ N. C. Deno, J. J. Jaruzelski, and Alan Schriesheim (1955) "Carbonium ions. I. An acidity function (C0) derived from arylcarbonium ion equilibria." J. Am. Chem. Soc., 77 (11), 3044–3051. doi:10.1021/ja01616a036
- ↑ "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions" George A. Olah J. Am. Chem. Soc.; 1972; 94(3) 808–820; doi:10.1021/ja00758a020
- ↑ "A Quantum Mechanical Investigation of the Orientation of Substituents in Aromatic Molecules" G. W. Wheland J. Am. Chem. Soc.; 1942; 64(4) 900–908; doi:10.1021/ja01256a047
- ↑ A guidebook to mechanism in organic chemistry, Peter Sykes; pp 130–133
- ↑ "Isolating Benzenium Ion Salts" Christopher A. Reed, Kee-Chan Kim, Evgenii S. Stoyanov, Daniel Stasko, Fook S. Tham, Leonard J. Mueller, and Peter D. W. Boyd J. Am. Chem. Soc.; 2003; 125(7) 1796–1804; doi:10.1021/ja027336o
- ↑ Compendium of Chemical Terminology, acyl groups
- ↑ Chevrier, B.; Le Carpentier, J. M.; Weiss, R. (1972). "फ्रीडेल-क्राफ्ट्स इंटरमीडिएट एंटीमनी पेंटाक्लोराइड-पी-टोलुओयल क्लोराइड की दो क्रिस्टलीय प्रजातियों का संश्लेषण। दाता-स्वीकर्ता परिसर और आयनिक नमक की क्रिस्टल संरचनाएं". J. Am. Chem. Soc. 94 (16): 5718–5723. doi:10.1021/ja00771a031.

