डीएनए-बाध्यकारी प्रोटीन
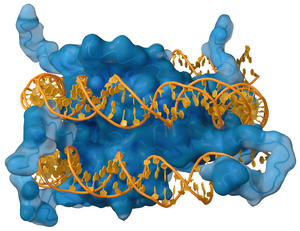
डीएनए-बाध्यकारी प्रोटीन ऐसे प्रोटीन होते हैं जिनमें डीएनए-बाध्यकारी क्षेत्र होते हैं और इस प्रकार एकल या युग्म-स्ट्रैंडेड डीएनए के लिए एक विशिष्ट या सामान्य संबंध होते हैं।[3][4][5] अनुक्रम-विशिष्ट डीएनए-बाध्यकारी प्रोटीन सामान्यतः पर बी-डीएनए के प्रमुख खांचे के साथ पारस्परिक क्रिया करते हैं, क्योंकि यह अधिक कार्यात्मक समूहों को उजागर करता है जो एक आधार जोड़ी की पहचान करते हैं। यद्यपि, कुछ ज्ञात लघु खाँचा डीएनए-बाध्यकारी लिगेंड हैं जैसे नेट्रोप्सिन, [6] डिस्टामाइसिन, होचस्ट 33258, पेंटामिडाइन, डीएपीआई और अन्य।[7]
उदाहरण
डीएनए-बाध्यकारी प्रोटीन में प्रतिलेखन कारक सम्मिलित होते हैं जो प्रतिलेखन की प्रक्रिया को नियंत्रित करते हैं, विभिन्न पोलीमरेज़, न्यूक्लीज़ जो डीएनए अणुओं को तोड़ते हैं, और हिस्टोन जो क्रोमोसोम संतुलन और कोशिका न्यूक्लियस में प्रतिलेखन में सम्मिलित होते हैं। डीएनए-बाध्यकारी प्रोटीन में ज़िंक फिंगर, हेलिक्स-टर्न-हेलिक्स और ल्यूसीन ज़िपर (कई अन्य लोगों के बीच) जैसे क्षेत्र सम्मिलित हो सकते हैं जो न्यूक्लिक अम्ल के लिए बाइंडिंग की सुविधा प्रदान करते हैं।प्रतिलेखन सक्रियकजैसे प्रभावी जैसे और भी असामान्य उदाहरण हैं।
गैर-विशिष्ट डीएनए-प्रोटीन पारस्परिक क्रिया
डीएनए को बांधने वाले संरचनात्मक प्रोटीन गैर-विशिष्ट डीएनए-प्रोटीन पारस्परिक क्रिया के अच्छी तरह से समझे जाने वाले उदाहरण हैं। गुणसूत्रों के भीतर, डीएनए को संरचनात्मक प्रोटीन के साथ परिसरों में रखा जाता है। ये प्रोटीन डीएनए को क्रोमेटिन नामक एक संक्षिप्त संरचना में व्यवस्थित करते हैं। यूकेरियोट्स में, इस संरचना में हिस्टोन नामक छोटे बुनियादी प्रोटीनों के एक जटिल के लिए डीएनए बाध्यकारी सम्मिलित है। प्रोकैरियोट्स में, कई प्रकार के प्रोटीन सम्मिलित होते हैं।[8][9] हिस्टोन एक डिस्क के आकार का जटिल बनाते हैं जिसे न्यूक्लियोसोम कहा जाता है, जिसमें इसकी सतह के चारों ओर लिपटे युग्म-स्ट्रैंडेड डीएनए के दो पूर्ण मोड़ होते हैं।ये गैर-विशिष्ट पारस्परिक क्रिया डीएनए के अम्लीय चीनी-फॉस्फेट रीढ़ की हड्डी में आयोनिक बंध बनाने वाले हिस्टोन में मूल अवशेषों के माध्यम से बनते हैं, और इसलिए आधार अनुक्रम से काफी हद तक स्वतंत्र होते हैं।[10] इन बुनियादी एमिनो अम्ल अवशेषों के रासायनिक संशोधनों में मेथिलिकरण, फास्फारिलीकरण और एसिटिलिकेशन सम्मिलितहैं।[11] ये रासायनिक परिवर्तन डीएनए और हिस्टोन के बीच पारस्परिक क्रिया की ताकत को बदलते हैं, डीएनए को प्रतिलेखन कारकों के लिए कम या ज्यादा सुलभ बनाते हैं और प्रतिलेखन की दर को बदलते हैं।[12] क्रोमैटिन में अन्य गैर-विशिष्ट डीएनए-बाध्यकारी प्रोटीन में उच्च-गतिशीलता समूह (एचएमजी) प्रोटीन सम्मिलित हैं, जो मुड़े हुए या विकृत डीएनए को बांधते हैं।[13]जैवभौतिकीय अध्ययनों से पता चलता है कि ये वास्तुकला संबधी एचएमजी प्रोटीन अपने जैविक कार्यों को करने के लिए डीएनए को बांधते, मोड़ते और लूप करते हैं।[14][15] ये प्रोटीन न्यूक्लियोसोम के सरणियों को मोड़ने और उन्हें क्रोमोसोम बनाने वाली बड़ी संरचनाओं में व्यवस्थित करने में महत्वपूर्ण हैं।[16] हाल ही में FK506 बाइंडिंग प्रोटीन 25 (FBP25) को डीएनए से गैर-विशेष रूप से बांधने करने के लिए भी दिखाया गया था जो डीएनए की मरम्मत में मदद करता है। [17]
प्रोटीन जो विशेष रूप से एकल-फंसे डीएनए को बांधते हैं
डीएनए-बांधने वाले प्रोटीन का एक अलग समूह डीएनए-बांधने वाले प्रोटीन है जो विशेष रूप से एकल-स्ट्रैंडेड डीएनए को बांधता है। मनुष्यों में, प्रतिकृति प्रोटीन ए इस परिवार का सबसे अच्छा समझा जाने वाला सदस्य है और इसका उपयोग उन प्रक्रियाओं में किया जाता है जहां युग्म हेलिक्स को अलग किया जाता है, जिसमें डीएनए प्रतिकृति, पुनर्संयोजन और डीएनए की मरम्मत सम्मिलितहै।[18] ऐसा लगता है कि ये बाध्यकारी प्रोटीन एकल-फंसे डीएनए को स्थिर करते हैं और इसे प्रातिपदिका लूप बनाने या न्यूक्लियस द्वारा अपमानित होने से बचाते हैं।
विशिष्ट डीएनए अनुक्रमों के लिए बाध्यकारी
इसके विपरीत, अन्य प्रोटीन विशिष्ट डीएनए अनुक्रमों से जुड़ने के लिए विकसित हुए हैं। इनमें से सबसे गहन अध्ययन विभिन्न प्रतिलेखन कारक हैं, जो प्रोटीन हैं जो प्रतिलेखन को नियंत्रित करते हैं। प्रत्येक प्रतिलेखन कारक डीएनए अनुक्रमों के एक विशिष्ट समुच्चय से जुड़ता है और जीन के प्रतिलेखन को सक्रिय या बाधित करता है जिनके संवर्धक के पास ये अनुक्रम होते हैं। प्रतिलेखन कारक इसे दो तरह से करते हैं। सबसे पहले, वे प्रतिलेखन के लिए जिम्मेदार आरएनए पोलीमरेज़ को या तो सीधे या अन्य मध्यस्थ प्रोटीन के माध्यम से बाँध सकते हैं; यह संवर्धक पर पोलीमरेज़ का पता लगाता है और इसे प्रतिलेखन शुरू करने की अनुमति देता है।[19] वैकल्पिक रूप से, प्रतिलेखन कारक एंजाइमों को बांध सकते हैं जो संवर्धक पर हिस्टोन को संशोधित करते हैं। यह डीएनए टेम्प्लेट की पोलीमरेज़ की पहुंच को बदल देता है।[20]
ये डीएनए लक्ष्य पूरे जीव के जीनोम में हो सकते हैं। इस प्रकार, एक प्रकार के प्रतिलेखन कारक की गतिविधि में परिवर्तन हजारों जीनों को प्रभावित कर सकता है।[21] इस प्रकार, ये प्रोटीन अक्सर संकेत पारगमन प्रक्रियाओं के लक्ष्य होते हैं जो पर्यावरण परिवर्तन या कोशिकीय भेदभाव और विकास के प्रति प्रतिक्रियाओं को नियंत्रित करते हैं। डीएनए के साथ इन प्रतिलेखन कारकों की पारस्परिक क्रिया की विशिष्टता डीएनए क्षार के किनारों पर कई संपर्क बनाने वाले प्रोटीन से आती है, जिससे उन्हें डीएनए अनुक्रम पढ़ने की अनुमति मिलती है। इनमें से अधिकांश क्षार-पारस्परिक क्रिया प्रमुख खांचे में बने होते हैं, जहां क्षार सबसे अधिक सुलभ होते हैं।[22] अनुक्रम-विशिष्टता को ध्यान में रखते हुए प्रोटीन-डीएनए बाइंडिंग के गणितीय विवरण, और विभिन्न प्रकार के प्रोटीनों के प्रतिस्पर्धी और सहकारी बंधन सामान्यतः पर लैटिस मॉडल की मदद से किए जाते हैं।[23] डीएनए बाध्यकारी अनुक्रम विशिष्टता की पहचान करने के लिए कम्प्यूटेशनल तरीकों को जीनोमिक युग के बाद प्रचुर मात्रा में अनुक्रम डेटा का अच्छा उपयोग करने का प्रस्ताव दिया गया है।[24]
प्रोटीन-डीएनए पारस्परिक क्रिया
प्रोटीन-डीएनए पारस्परिक क्रिया तब होता है जब एक प्रोटीन डीएनए के एक अणु को बांधता है, अक्सर डीएनए के जैविक कार्य को विनियमित करने के लिए, सामान्यतः पर एक की जीन अभिव्यक्ति। डीएनए को बाँधने वाले प्रोटीनों में प्रतिलेखन के कारक हैं जो डीएनए रूपांकनों और हिस्टोन से जुड़कर जीन अभिव्यक्ति को सक्रिय या दमन करते हैं जो डीएनए की संरचना का हिस्सा बनते हैं और इसे कम विशेष रूप से बांधते हैं। यूयद्यपिसिल-डीएनए ग्लाइकोसिलेज़ जैसे डीएनए की मरम्मत करने वाले प्रोटीन भी इसके साथ निकटता से संपर्क करते हैं।
सामान्य तौर पर, प्रोटीन प्रमुख खांचे में डीएनए से जुड़ते हैं; यद्यपि, इसके अपवाद हैं।[25] प्रोटीन-डीएनए पारस्परिक क्रिया मुख्य रूप से दो प्रकार के होते हैं, या तो विशिष्ट पारस्परिक क्रिया या गैर-विशिष्ट पारस्परिक क्रिया। हाल के एकल-अणु प्रयोगों से पता चला है कि लक्ष्य स्थल को पहचानने के लिए सही अभिविन्यास में बाध्य करने के लिए डीएनए बाध्यकारी प्रोटीन तेजी से रिबाइंडिंग से गुजरते हैं।[26]
डिजाइन
विशिष्ट डीएनए-बाध्यकारी स्थल वाले डीएनए-बाध्यकारी प्रोटीन को डिजाइन करना जैव प्रौद्योगिकी के लिए एक महत्वपूर्ण लक्ष्य रहा है। जिंक फिंगर प्रोटीन को विशिष्ट डीएनए अनुक्रमों से बाँधने के लिए डिज़ाइन किया गया है और यह जिंक फिंगर न्यूक्लीज का आधार है। हाल ही में प्रतिलेखन एक्टिवेटर-लाइक इफ़ेक्ट न्यूक्लीज़ (TALENs) बनाए गए हैं जो ज़ैंथोमोनास बैक्टीरिया द्वारा उनके प्रकार III स्राव प्रणाली के माध्यम से स्रावित प्राकृतिक प्रोटीन पर आधारित होते हैं जब वे विभिन्न पौधों की प्रजातियों को संक्रमित करते हैं।[27]
पता लगाने के तरीके
कई इन विट्रो और इन विवो तकनीकें हैं जो डीएनए-प्रोटीन पारस्परिक क्रिया का पता लगाने में उपयोगी हैं। निम्नलिखित वर्तमान में उपयोग में आने वाली कुछ विधियों को सूचीबद्ध करता है:[28] ज्ञात डीएनए बाध्यकारी प्रोटीन के प्रोटीन-डीएनए पारस्परिक क्रिया का अध्ययन करने के लिए इलेक्ट्रोफोरमैटिक मोबिलिटी शिफ्ट परख (ईएमएसए) एक व्यापक गुणात्मक तकनीक है।[29][30] डीएनए-प्रोटीन-पारस्परिक क्रिया - एंजाइम-लिंक्ड इम्यूनोसॉर्बेंट परख (डीपीआई-एलिसा) इन विट्रो में ज्ञात प्रोटीनों की डीएनए-बाध्यकारी प्राथमिकताओं के गुणात्मक और मात्रात्मक विश्लेषण की अनुमति देता है।[31][32] यह तकनीक प्रोटीन कॉम्प्लेक्स के विश्लेषण की अनुमति देती है जो डीएनए (डीपीआई-भर्ती-एलिसा) से जुड़ती है या इसके मानक एलिसा प्लेट फॉर्मेट के कारण कई न्यूक्लियोटाइड जांच की स्वचालित जांच के लिए उपयुक्त है।[33] [34].DNase फुटप्रिंटिंग परख का उपयोगक्षारपेयर रिज़ॉल्यूशन पर डीएनए के लिए प्रोटीन के बंधन की विशिष्ट स्थलों की पहचान करने के लिए किया जा सकता है।[35] ज्ञात प्रतिलेखन कारक के इन विवो डीएनए लक्ष्य क्षेत्रों की पहचान करने के लिए क्रोमैटिन इम्यूनोप्रूवेरेशन का उपयोग किया जाता है। इस तकनीक को जब उच्च संदेश प्रवाह अनुक्रमण के साथ जोड़ा जाता है तो इसे चिप-सेक के रूप में जाना जाता है और जब इसे माइक्रोएरे के साथ जोड़ा जाता है तो इसे चिप-चिप के रूप में जाना जाता है। यीस्ट वन-हाइब्रिड सिस्टम (Y1H) का उपयोग यह पहचानने के लिए किया जाता है कि कौन सा प्रोटीन एक विशेष डीएनए खंड को बांधता है। बैक्टीरियल एक-संकर प्रणाली (B1H) का उपयोग यह पहचानने के लिए किया जाता है कि कौन सा प्रोटीन एक विशेष डीएनए खंड से जुड़ता है। एक्स - रे क्रिस्टलोग्राफी का उपयोग कर संरचना निर्धारण का उपयोग प्रोटीन-डीएनए पारस्परिक क्रिया के अत्यधिक विस्तृत परमाणु दृश्य देने के लिए किया गया है।इन विधियों के अलावा, अन्य तकनीकों जैसे SELEX, PBM (प्रोटीन बाइंडिंग माइक्रोएरे), DNA माइक्रोएरे स्क्रीन, DamID, FAIRE या हाल ही में DAP-seq का उपयोग प्रयोगशाला में विवो और इन विट्रो में डीएनए-प्रोटीन पारस्परिक क्रिया की जांच के लिए किया जाता है।
बातचीत में हेरफेर
प्रोटीन-डीएनए पारस्परिक क्रिया को बफर की आयनिक शक्ति, बृहदाण्विक अधिसंख्यन, जैसे उत्तेजनाओं का उपयोग करके संशोधित किया जा सकता है।[26]तापमान, पीएच और विद्युत क्षेत्र। इससे प्रोटीन-डीएनए कॉम्प्लेक्स का प्रतिवर्ती पृथक्करण/जुड़ाव हो सकता है।[36][37]
यह भी देखें
- bZIP क्षेत्र
- चिप-एक्सो
- न्यूक्लिक अम्ल सिमुलेशन सॉफ्टवेयर की तुलना
- डीएनए-बाध्यकारी क्षेत्र
- हेलिक्स पाश-हेलिक्स
- हेलिक्स-टर्न-हेलिक्स
- एचएमजी-बॉक्स
- ल्यूसीन जिपर
- लेक्सिट्रॉप्स (एक अर्ध-सिंथेटिक डीएनए-बाइंडिंग लिगैंड)
- डीऑक्सीराइबोन्यूक्लियोप्रोटीन
- प्रोटीन-डीएनए पारस्परिक क्रिया स्थल प्रेडिक्टर | प्रोटीन-डीएनए पारस्परिक क्रिया स्थल प्रेडिक्शन सॉफ्टवेयर
- आरएनए-बाध्यकारी प्रोटीन
- एकल-स्ट्रैंड बाइंडिंग प्रोटीन
- जिंक फिंगर
संदर्भ
- ↑ Created from PDB 1LMB
- ↑ Created from PDB 1RVA
- ↑ Travers, A. A. (1993). DNA-protein interactions. London: Springer. ISBN 978-0-412-25990-6.
- ↑ Pabo CO, Sauer RT (1984). "Protein-DNA recognition". Annu. Rev. Biochem. 53 (1): 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Dickerson R.E. (1983). "The DNA helix and how it is read". Sci Am. 249 (6): 94–111. Bibcode:1983SciAm.249f..94D. doi:10.1038/scientificamerican1283-94.
- ↑ Zimmer C, Wähnert U (1986). "Nonintercalating DNA-binding ligands: specificity of the interaction and their use as tools in biophysical, biochemical and biological investigations of the genetic material". Prog. Biophys. Mol. Biol. 47 (1): 31–112. doi:10.1016/0079-6107(86)90005-2. PMID 2422697.
- ↑ Dervan PB (April 1986). "Design of sequence-specific DNA-binding molecules". Science. 232 (4749): 464–71. Bibcode:1986Sci...232..464D. doi:10.1126/science.2421408. PMID 2421408.
- ↑ Sandman K, Pereira S, Reeve J (1998). "Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome". Cell Mol Life Sci. 54 (12): 1350–64. doi:10.1007/s000180050259. PMID 9893710. S2CID 21101836.
- ↑ Dame RT (2005). "The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin". Mol. Microbiol. 56 (4): 858–70. doi:10.1111/j.1365-2958.2005.04598.x. PMID 15853876.
- ↑ Luger K, Mäder A, Richmond R, Sargent D, Richmond T (1997). "Crystal structure of the nucleosome core particle at 2.8 A resolution". Nature. 389 (6648): 251–60. Bibcode:1997Natur.389..251L. doi:10.1038/38444. PMID 9305837. S2CID 4328827.
- ↑ Jenuwein T, Allis C (2001). "Translating the histone code". Science. 293 (5532): 1074–80. CiteSeerX 10.1.1.453.900. doi:10.1126/science.1063127. PMID 11498575. S2CID 1883924.
- ↑ Ito T (2003). "Nucleosome Assembly and Remodeling". Nucleosome assembly and remodelling. pp. 1–22. doi:10.1007/978-3-642-55747-7_1. ISBN 978-3-642-62909-9. PMID 12596902.
{{cite book}}:|journal=ignored (help) - ↑ Thomas J (2001). "HMG1 and 2: architectural DNA-binding proteins". Biochem Soc Trans. 29 (Pt 4): 395–401. doi:10.1042/BST0290395. PMID 11497996.
- ↑ Murugesapillai, Divakaran; McCauley, Micah J.; Huo, Ran; Nelson Holte, Molly H.; Stepanyants, Armen; Maher, L. James; Israeloff, Nathan E.; Williams, Mark C. (2014). "DNA bridging and looping by HMO1 provides a mechanism for stabilizing nucleosome-free chromatin". Nucleic Acids Research. 42 (14): 8996–9004. doi:10.1093/nar/gku635. PMC 4132745. PMID 25063301.
- ↑ Murugesapillai, Divakaran; McCauley, Micah J.; Maher, L. James; Williams, Mark C. (2017). "Single-molecule studies of high-mobility group B architectural DNA bending proteins". Biophysical Reviews. 9 (1): 17–40. doi:10.1007/s12551-016-0236-4. PMC 5331113. PMID 28303166.
- ↑ Grosschedl R, Giese K, Pagel J (1994). "HMG domain proteins: architectural elements in the assembly of nucleoprotein structures". Trends Genet. 10 (3): 94–100. doi:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ↑ Prakash, Ajit; Shin, Joon; Rajan, Sreekanth; Yoon, Ho Sup (2016-04-07). "Structural basis of nucleic acid recognition by FK506-binding protein 25 (FKBP25), a nuclear immunophilin". Nucleic Acids Research. 44 (6): 2909–2925. doi:10.1093/nar/gkw001. ISSN 0305-1048. PMC 4824100. PMID 26762975.
- ↑ Iftode C, Daniely Y, Borowiec J (1999). "Replication protein A (RPA): the eukaryotic SSB". Crit Rev Biochem Mol Biol. 34 (3): 141–80. doi:10.1080/10409239991209255. PMID 10473346.
- ↑ Myers L, Kornberg R (2000). "Mediator of transcriptional regulation". Annu Rev Biochem. 69 (1): 729–49. doi:10.1146/annurev.biochem.69.1.729. PMID 10966474.
- ↑ Spiegelman B, Heinrich R (2004). "Biological control throughs regulated transcriptional coactivators". Cell. 119 (2): 157–67. doi:10.1016/j.cell.2004.09.037. PMID 15479634. S2CID 14668705.
- ↑ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B (2003). "A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells". Proc Natl Acad Sci USA. 100 (14): 8164–9. Bibcode:2003PNAS..100.8164L. doi:10.1073/pnas.1332764100. PMC 166200. PMID 12808131.
- ↑ Pabo C, Sauer R (1984). "Protein-DNA recognition". Annu Rev Biochem. 53 (1): 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Teif V.B.; Rippe K. (2010). "Statistical-mechanical lattice models for protein-DNA binding in chromatin". Journal of Physics: Condensed Matter. 22 (41): 414105. arXiv:1004.5514. Bibcode:2010JPCM...22O4105T. doi:10.1088/0953-8984/22/41/414105. PMID 21386588. S2CID 103345.
- ↑ Wong KC, Chan TM, Peng C, Li Y, Zhang Z (2013). "DNA Motif Elucidation using belief propagation". Nucleic Acids Research. 41 (16): e153. doi:10.1093/nar/gkt574. PMC 3763557. PMID 23814189.
- ↑ Bewley CA, Gronenborn AM, Clore GM (1998). "Minor groove-binding architectural proteins: structure, function, and DNA recognition". Annu Rev Biophys Biomol Struct. 27: 105–31. doi:10.1146/annurev.biophys.27.1.105. PMC 4781445. PMID 9646864.
- ↑ 26.0 26.1 Ganji, Mahipal; Docter, Margreet; Le Grice, Stuart F. J.; Abbondanzieri, Elio A. (2016-09-30). "DNA binding proteins explore multiple local configurations during docking via rapid rebinding". Nucleic Acids Research. 44 (17): 8376–8384. doi:10.1093/nar/gkw666. ISSN 0305-1048. PMC 5041478. PMID 27471033.
- ↑ Clark KJ, Voytas DF, Ekker SC (September 2011). "A TALE of two nucleases: gene targeting for the masses?". Zebrafish. 8 (3): 147–9. doi:10.1089/zeb.2011.9993. PMC 3174730. PMID 21929364.
- ↑ Cai YH, Huang H (July 2012). "Advances in the study of protein–DNA interaction". Amino Acids. 43 (3): 1141–6. doi:10.1007/s00726-012-1377-9. PMID 22842750. S2CID 310256.
- ↑ Fried M, Crothers DM (1981). "Equilibria and kinetics of lac repressor-operator interactions by polyacrylamide gel electrophoresis". Nucleic Acids Res. 9 (23): 6505–6525. doi:10.1093/nar/9.23.6505. PMC 327619. PMID 6275366.
- ↑ Garner MM, Revzin A (1981). "A gel electrophoresis method for quantifying the binding of proteins to specific DNA regions: application to components of the Escherichia coli lactose operon regulatory system". Nucleic Acids Res. 9 (13): 3047–3060. doi:10.1093/nar/9.13.3047. PMC 327330. PMID 6269071.
- ↑ Brand LH, Kirchler T, Hummel S, Chaban C, Wanke D (2010). "DPI-ELISA: a fast and versatile method to specify the binding of plant transcription factors to DNA in vitro". Plant Methods. 25 (6): 25. doi:10.1186/1746-4811-6-25. PMC 3003642. PMID 21108821.
- ↑ Fischer SM, Böser A, Hirsch JP, Wanke D (2016). Quantitative Analysis of Protein-DNA Interaction by qDPI-ELISA. Methods Mol. Biol. Vol. 1482. pp. 49–66. doi:10.1007/978-1-4939-6396-6_4. ISBN 978-1-4939-6394-2. PMID 27557760.
- ↑ Hecker A, Brand LH, Peter S, Simoncello N, Kilian J, Harter K, Gaudin V, Wanke D (2015). "The Arabidopsis GAGA-Binding Factor BASIC PENTACYSTEINE6 Recruits the POLYCOMB-REPRESSIVE COMPLEX1 Component LIKE HETEROCHROMATIN PROTEIN1 to GAGA DNA Motifs". Plant Physiol. 163 (3): 1013–1024. doi:10.1104/pp.15.00409. PMC 4741334. PMID 26025051.
- ↑ Brand LH, Henneges C, Schüssler A, Kolukisaoglu HÜ, Koch G, Wallmeroth N, Hecker A, Thurow K, Zell A, Harter K, Wanke D (2013). "Screening for protein-DNA interactions by automatable DNA-protein interaction ELISA". PLOS ONE. 8 (10): e75177. doi:10.1371/journal.pone.0075177. PMC 3795721. PMID 24146751.
- ↑ Galas DJ, Schmitz A (1978). "DNAse footprinting: a simple method for the detection of protein-DNA binding specificity". Nucleic Acids Res. 5 (9): 3157–3170. doi:10.1093/nar/5.9.3157. PMC 342238. PMID 212715.
- ↑ Hianik T, Wang J (2009). "Electrochemical Aptasensors – Recent Achievements and Perspectives". Electroanalysis. 21 (11): 1223–1235. doi:10.1002/elan.200904566.
- ↑ Gosai A, et al. (2016). "Electrical Stimulus Controlled Binding/Unbinding of Human Thrombin-Aptamer Complex". Sci. Rep. 6: 37449. Bibcode:2016NatSR...637449G. doi:10.1038/srep37449. PMC 5118750. PMID 27874042.
बाहरी संबंध
- Protein-DNA binding: data, tools & models (annotated list, constantly updated)
- Abalone tool for modeling DNA-ligand interactions.
- DBD database of predicted transcription factors Uses a curated set of DNA-binding domains to predict transcription factors in all completely sequenced genomes
- DNA-Binding+Proteins at the US National Library of Medicine Medical Subject Headings (MeSH)



