सोडियम डाइथियोनाइट
| |

| |

| |
| Names | |
|---|---|
| Other names
D-Ox, Hydrolin, Reductone
sodium hydrosulfite, sodium sulfoxylate, Sulfoxylate Vatrolite, Virtex L Hydrosulfit, Prayon Blankit, Albite A, Konite Zepar, Burmol, Arostit | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| EC Number |
|
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 1384 |
| |
| |
| Properties | |
| Na2S2O4 | |
| Molar mass | 174.107 g/mol (anhydrous) 210.146 g/mol (dihydrate) |
| Appearance | white to grayish crystalline powder light-lemon colored flakes |
| Odor | faint sulfur odor |
| Density | 2.38 g/cm3 (anhydrous) 1.58 g/cm3 (dihydrate) |
| Melting point | 52 °C (126 °F; 325 K) |
| Boiling point | Decomposes |
| 18.2 g/100 mL (anhydrous, 20 °C) 21.9 g/100 mL (Dihydrate, 20 °C) | |
| Solubility | slightly soluble in alcohol |
| Hazards | |
| GHS labelling: | |
 
| |
| Danger | |
| H251, H302 | |
| P235+P410, P264, P270, P280, P301+P312, P330, P407, P413, P420, P501 | |
| NFPA 704 (fire diamond) | |
| Flash point | 100 °C (212 °F; 373 K) |
| 200 °C (392 °F; 473 K) | |
| Related compounds | |
Other anions
|
Sodium sulfite Sodium sulfate |
Related compounds
|
Sodium thiosulfate Sodium bisulfite Sodium metabisulfite Sodium bisulfate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
सोडियम डाइथियोनाइट (सोडियम हाइड्रोसल्फाइट के रूप में भी जाना जाता है) एक गंधक गंध के साथ एक सफेद क्रिस्टलीय पाउडर है। यद्यपि यह शुष्क हवा में स्थिर है, यह गर्म पानी में और अम्ल विलयन (रसायन विज्ञान) में विघटित हो जाता है।
संरचना
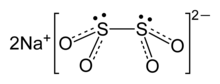
रमन स्पेक्ट्रोस्कोपी और एकल-क्रिस्टल एक्स-रे विवर्तन द्वारा संरचना की जांच की गई है। डायथियोनाइट डायियनियन में C
2 समरूपता है।, लगभग 16° O-S-S-O मरोड़ी कोण के साथ ग्रहण किया गया। निर्जलित रूप में (Na
2S
2O
4·2H
2O), डाइथियोनाइट आयनों में गौचे 56°O-S-S-O मरोड़ कोण होता है।[1]
एक कमजोर S-S बंध को 239 pm की S-S दूरी द्वारा इंगित किया जाता है, जो एक विशिष्ट S-S बन्ध के सापेक्ष ca.30 pm द्वारा बढ़ाया जाता है। [2] क्योंकि यह बंध दुर्बल है, डाइथियोनाइट आयन विलयन में [SO2]− रेडिकल्स में अलग हो जाता है, जैसा कि EPR स्पेक्ट्रोस्कोपी द्वारा पुष्टि की गई है। यह भी देखा गया है 35S, S2O42− और SO2 के बीच तटस्थ या अम्लीय विलयन में तेजी से आदान-प्रदान करता है, जो कि आयनों में कमजोर S-S बन्ध के अनुरूप है।[3]
A weak S-S bond is indicated by the S-S distance of 239 pm, which is elongated by ca. 30 pm relative to a typical S-S bond. Because this bond is fragile, the dithionite anion dissociates in solution into the [SO2]− radicals, as has been confirmed by EPR spectroscopy. It is also observed that 35S undergoes rapid exchange between S2O42− and SO2 in neutral or acidic solution, consistent with the weak S-S bond in the anion.
तैयारी
सोडियम डाइथियोनाइट सल्फर डाइऑक्साइड की कमी से औद्योगिक रूप से उत्पादित होता है। 1990 में लगभग 300,000 टन का उत्पादन किया गया था।[4] जिंक पाउडर का उपयोग करने वाला मार्ग दो चरणों वाली प्रक्रिया है:
2 SO2 + Zn → ZnS2O4
ZnS2O4 + 2 NaOH → Na2S2O4 + Zn(OH)2
सोडियम बोरोहाइड्राइड विधि निम्नलिखित स्टोइकोमेट्री का पालन करती है:
NaBH4 + 8 NaOH + 8 SO2 → 4 Na2S2O4 + NaBO2 + 6 H2O
H के प्रत्येक समतुल्य सल्फर डाइऑक्साइड के दो समकक्षों को कम करता है। प्रारूप को अपचायक के रूप में भी इस्तेमाल किया गया है।
गुण और प्रतिक्रियाएँ
हाइड्रोलिसिस
सोडियम डाइथियोनाइट सूखने पर स्थिर होता है, लेकिन निम्न प्रतिक्रिया के कारण जलीय विलयन दूषित हो जाता है:
- 2 S2O42− + H2O → S2O32− + 2 HSO3−
यह व्यवहार डायथियोनस अम्ल की अस्थिरता के अनुरूप है। इस प्रकार, सोडियम डाइथियोनाइट के विलयन को लंबे समय तक संग्रहीत नहीं किया जा सकता है।[3] निर्जल सोडियम डाइथियोनाइट वायु में 90 डिग्री सेल्सियस से ऊपर सोडियम सल्फेट और सल्फर डाइऑक्साइड में विघटित हो जाता है। वायु की अनुपस्थिति में, यह 150 डिग्री सेल्सियस से ऊपर सोडियम सल्फ़ाइट ,सोडियम थायोसल्फ़ेट , सल्फर डाइऑक्साइड और सल्फर की मात्रा का पता लगाने के लिए शीघ्र विघटित हो जाता है।
रेडॉक्स प्रतिक्रियाएं
सोडियम डाइथियोनाइट एक अपचायी कर्मक है। pH 7 पर, सामान्य हाइड्रोजन इलेक्ट्रोड की तुलना में क्षमता -0.66 वी है। रिडॉक्स बाइसल्फ़ाइट के गठन के साथ होता है:[5]
S2O42- + 2 H2O → 2 HSO3− + 2 e− + 2 H+
सोडियम डाइथियोनाइट ऑक्सीजन के साथ प्रतिक्रिया करता है:
Na2S2O4 + O2 + H2O → NaHSO4 + NaHSO3
ये प्रतिक्रियाएँ जटिल pH-निर्भर संतुलन प्रदर्शित करती हैं जिसमें बाइसल्फाइट, थायोसल्फेट और सल्फर डाइऑक्साइड सम्मिलित हैं।
कार्बनिक कार्बोनिल्स के साथ
एल्डिहाइड की उपस्थिति में, सोडियम डाइथियोनाइट या तो कमरे के तापमान पर α-हाइड्रॉक्सी-सल्फ़िनेट बनाने के लिए प्रतिक्रिया करता है या एल्डिहाइड को 85 डिग्री सेल्सियस के तापमान से ऊपर संबंधित ऐल्कोहल में कम करता है।[6][7] इसी तरह की परिस्थितियों में कुछ कीटोन्स भी कम हो जाते हैं।
अनुप्रयोग
उद्योग
जल में घुलनशील होने के कारण, सोडियम डाइथियोनाइट का उपयोग कुछ औद्योगिक रंगाई प्रक्रियाओं में अपचायी कर्मक के रूप में किया जाता है। सल्फर डाई और वैट डाई की स्थिति में,अन्यथा जल में अघुलनशील डाई को जल में घुलनशील क्षार धातु नमक (जैसे इंडिगो डाई) में कम किया जा सकता है।[8] सोडियम डाइथियोनाइट का उपयोग जल उपचार, एक्वैरियम जल कंडीशनर, गैस शोधन, सफाई और अलग करने के लिए भी किया जा सकता है। इसे सल्फोनिंग पदार्थ के रूप में भी अनुप्रयुक्त किया गया है। वस्त्र उद्योग के अतिरिक्त, इस यौगिक का उपयोग चमड़ा, खाद्य पदार्थ, बहुलक, छायाचित्रण, और कई अन्य उद्योगों से संबंधित उद्योगों में किया जाता है, जो प्राय: रंगहीन करने वाले पदार्थ के रूप में होता है। यह सफेद कपड़े धोने के लिए एक विरंजन पदार्थ के रूप में घरेलू स्तर पर भी उपयोग किया जाता है, जब यह उच्च तापमान धोने के चक्र में फिसलने वाले रंगे हुए आइटम के माध्यम से गलती से दाग हो जाता है। यह साधारणतः नमक के प्राचीन नाम के बाद हाइड्रोसल्फाइट कहे जाने वाले 5 ग्राम पाउच में उपलब्ध होता है।
यह एक वाणिज्यिक जंग उत्पाद "आयरन आउट रस्ट स्टेन रिमूवर" का एक सक्रिय संघटक है।[9]
प्रयोगशाला
सोडियम डाइथियोनाइट का उपयोग प्रायःशरीर क्रिया विज्ञान प्रयोगों में विलयन की अवकरण विभव (Eo' -0.66 V बनाम SHE pH 7 पर) को कम करने के साधन के रूप में किया जाता है। [10] पोटेशियम फेरिकैनाइड साधारणतः ऐसे प्रयोगों में ऑक्सीकरण रसायन के रूप में प्रयोग किया जाता है (Eo' ~.436 V pH 7 पर)। इसके अतिरिक्त, प्राथमिक सिलिकेट खनिजों में शामिल नहीं होने वाले आयरन की मात्रा निर्धारित करने के लिए सोडियम डाइथियोनाइट का उपयोग प्रायः मृदा रसायन प्रयोगों में किया जाता है। इसलिए, सोडियम डाइथियोनाइट द्वारा निकाले गए आयरन को मुक्त आयरन भी कहा जाता है।डाइथियोनाइट आयन की द्वि- और त्रिसंयोजी धातु धनायनों (M2+, M3+) के लिए प्रबल बंधुता इसे आयरन की घुलनशीलता को बढ़ाने की अनुमति देता है, और इसलिए डाइथियोनाइट एक उपयोगी कीलेटिंग कर्मक है।
सोडियम डाइथियोनाइट के जलीय विलयन का उपयोग एक बार गैस की धारा से ऑक्सीजन को हटाने के लिए 'फिशर के विलयन' के उत्पादन के लिए किया जाता था।[11] थिओल कार्यात्मक समूह को प्रस्तुत करने के लिए सोडियम डाइथियोनाइट का उपयोग करके प्रतिस्थापन प्रतिक्रिया के बाद एक उपयुक्त पेरासिड के साथ N-ऑक्साइड को ऑक्सीकरण द्वारा 2-ब्रोमोपाइरीडीन से दो-चरणीय संश्लेषण में पाइरिथियोन तैयार किया जा सकता है।[12]
फोटोग्राफी
इसका उपयोग कोडक फॉगिंग डेवलपर, FD-70 में किया जाता है। इसका उपयोग स्लाइड बनाने के लिए काले और सफेद सकारात्मक छवियों को संसाधित करने के दूसरे चरण में किया जाता है। यह कोडक डायरेक्ट पॉजिटिव फिल्म डेवलपिंग आउटफिट का हिस्सा है।[13]
सुरक्षा
सोडियम डाइथियोनाइट का व्यापक उपयोग इसकी कम विषाक्तता के कारण होता है LD50 2.5 ग्राम/किग्रा (चूहों, मौखिक) पर।[4]
यह भी देखें
संदर्भ
- ↑ Weinrach, J. B.; Meyer, D. R.; Guy, J. T.; Michalski, P. E.; Carter, K. L.; Grubisha, D. S.; Bennett, D. W. (1992). "A structural study of sodium dithionite and its ephemeral dihydrate: A new conformation for the dithionite ion". Journal of Crystallographic and Spectroscopic Research. 22 (3): 291–301. doi:10.1007/BF01199531. S2CID 97124638.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ 3.0 3.1 Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 16: The group 16 elements". Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- ↑ 4.0 4.1 José Jiménez Barberá; Adolf Metzger; Manfred Wolf (15 June 2000). "Sulfites, Thiosulfates, and Dithionites". उलमन्स एनसाइक्लोपीडिया ऑफ इंडस्ट्रियल केमिस्ट्री. Wiley Online Library. doi:10.1002/14356007.a25_477. ISBN 978-3527306732.
- ↑ Mayhew, S. G. (2008). "The Redox Potential of Dithionite and SO−2 from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase". European Journal of Biochemistry. 85 (2): 535–547. doi:10.1111/j.1432-1033.1978.tb12269.x. PMID 648533.
- ↑ J. Org. Chem., 1980, 45 (21), pp 4126–4129, http://pubs.acs.org/doi/abs/10.1021/jo01309a011
- ↑ "एल्डिहाइड सल्फोक्सिलेट प्रणालीगत कवकनाशी". google.com. Archived from the original on 27 April 2018. Retrieved 27 April 2018.
- ↑ Božič, Mojca; Kokol, Vanja (2008). "वैट और सल्फर डाई के साथ रंगाई में कमी और ऑक्सीकरण प्रक्रियाओं के पारिस्थितिक विकल्प". Dyes and Pigments. 76 (2): 299–309. doi:10.1016/j.dyepig.2006.05.041.
- ↑ https://www.popularmechanics.com/home/tools/g2312/best-liquid-rust-removers-test/#product-13a4a293-8e39-4bbf-93b1-74a14dc07cfa-anchor
- ↑ MAYHEW, Stephen G. (1978). "The Redox Potential of Dithionite and SO-2 from Equilibrium Reactions with Flavodoxins, Methyl Viologen and Hydrogen plus Hydrogenase". European Journal of Biochemistry. 85 (2): 535–547. doi:10.1111/j.1432-1033.1978.tb12269.x. ISSN 0014-2956. PMID 648533.
- ↑ Kenneth L. Williamson "Reduction of Indigo: Sodium Hydrosulfite as a Reducing Agent" J. Chem. Educ., 1989, volume 66, p 359. doi:10.1021/ed066p359.2
- ↑ Knight, David W.; Hartung, Jens (15 September 2006). "1-Hydroxypyridine-2(1H)-thione". 1-Hydroxypyridine-2(1H)-thione. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rh067.pub2. ISBN 978-0471936237.
- ↑ "Kodak Direct Positive Film 5246" (PDF). 125px.com. Kodak. Retrieved 6 November 2019.
बाहरी संबंध
- Sodium dithionite - ipcs inchem[1]
- ↑ "Sodium dithionite - ipcs inchem" (PDF). www.inchem.org. Berliln, Germany. 2004. Retrieved 15 June 2018.
