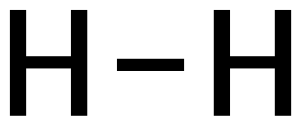एकल बंधन
रसायन विज्ञान में, एकल बंधन दो वैलेंस इलेक्ट्रॉनों वाले दो परमाणुओं के बीच का एक रासायनिक बंधन होता है। अर्थात्, परमाणु रासायनिक संयोजन इलेक्ट्रॉन को साझा करते है जहां बंधन बनता है।[1] इसलिए, एकल बंधन एक प्रकार का सहसंयोजक बंधन होता है। जब साझा किया जाता है, तो सम्मलित दो इलेक्ट्रॉनों में से प्रत्येक उस कक्षीय के एकमात्र अधिकार में नहीं रह जाता है जिसमें इसकी उत्पत्ति हुई होती है। लुईस संरचना के रूप में, एकल बंधन को AːA या A-A के रूप में दर्शाया जाता है, जिसके लिए A एक तत्व का प्रतिनिधित्व करता है।[2] पहले प्रतिपादन में, प्रत्येक बिंदु एक साझा इलेक्ट्रॉन का प्रतिनिधित्व करता है, और दूसरे प्रतिपादन में, एकल बंधन में साझा किए गए दोनों इलेक्ट्रॉनों का प्रतिनिधित्व करता है।
एक सहसंयोजक बंधन एक दोहरा बंधन या एक तिगुना बंधन भी हो सकता है। एक एकल बंधन या तो दोहरे बंधन या तिहरे बंधन से कमजोर होता है। ताकत में इस अंतर को उन घटक बंधनों की जांच करके समझाया जा सकता है जिनमें से प्रत्येक प्रकार के सहसंयोजक बंधन होते है (मूर, स्टैनिट्स्की और जर्स 393)।
सामान्यतः, एकल बंधन सिग्मा बंधन होता है। डायबोरॉन में बंधन एक अपवाद है, जो एक पी बंधन होता है। इसके विपरीत, दोहरे बंधन में एक सिग्मा बंधन और एक पी बंधन होता है, और एक तिगुना बंधन में एक सिग्मा बंधन और दो पी बंधन होते है (मूर, स्टैनिट्स्की और जर्स 396)। घटक बंधनों की संख्या वह होती है जो ऊर्जा असमानता को निर्धारित करता है। इसका कारण यह है कि एकल बंधन तीनों में सबसे कमजोर होता है क्योंकि इसमें केवल एक सिग्मा बंधन होता है, और दोहरे बंधन या तिगुना बंधन में न केवल इस प्रकार के घटक बंधन होते है जबकि कम से कम एक अतिरिक्त बंधन भी होता है।
एकल बंधन में घूमने की क्षमता होती है, जो दोहरे बंधन या तिगुना बंधन के पास नहीं होती है। पी बंधन की संरचना आवर्तन की अनुमति नहीं देती है (कम से कम 298 K पर नहीं), इसलिए इसके कारण दोहरे बंधन और तिगुना बंधन जिसमें पी बंधन होते है। सिग्मा बंधन इतना प्रतिबंधात्मक नहीं होता है, और एकल बंधन सिग्मा बंधन को आवर्तन की धुरी के रूप में उपयोग करने में सक्षम होते है (मूर, स्टैनिट्स्की और जर्स 396-397)।
बंधन की लंबाई में एक तुलना भी की जा सकती है। एकल बंधन तीन प्रकार के सहसंयोजक बंधनों में सबसे लंबे होते है क्योंकि दो अन्य प्रकारों, दोहरे और तिगुने में अंतर-परमाणु आकर्षण अधिक होता है। घटक बंधनों में वृद्धि इस आकर्षण वृद्धि का कारण होता है क्योंकि बंधन परमाणुओं (मूर, स्टैनिट्स्की, और जर्स 343) के बीच अधिक इलेक्ट्रॉनों को साझा किया जाता है।
द्विपरमाणुक अणुओं में एकल बंधन अधिकांशतः देखे जाते है। एकल बंधन के इस उपयोग के उदाहरणों में H2, F2 और HCl सम्मलित है।
एकल बंध दो से अधिक परमाणुओं से बने अणुओं में भी देखे जाते है। एकल बंधन के इस उपयोग के उदाहरणों में सम्मलित है:
- दोनों बंधन H2O
- CH4 में सभी 4 बंधन
एकल बंधन अणुओं में मीथेन से बड़े हाइड्रोकार्बन के रूप में जटिल दिखाई देता है। इन अणुओं के रासायनिक नामकरण में हाइड्रोकार्बन में सहसंयोजक बंधन का प्रकार अत्यंत महत्वपूर्ण होता है। हाइड्रोकार्बन जिनमें केवल एकल बांड होते है उन्हें अल्केन्स (मूर, स्टैनिट्स्की और जर्स 334) कहा जाता है। विशिष्ट अणुओं के नाम जो इस समूह से संबंधित होते है, प्रत्ययन -एने के साथ समाप्त होते है। उदाहरणों में ईथेन, 2-मिथाइलब्यूटेन और साइक्लोपेंटेन (मूर, स्टैनिटस्की और जर्स 335) सम्मलित है।
यह भी देखें
संदर्भ
- ↑ "सहसंयोजक बंधन - एकल बंधन". Chemguide.co.uk. Retrieved 2012-08-12.
- ↑ Steehler, Jack K. (December 2001). "Chemistry: The Molecular Science (Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C.)". Journal of Chemical Education. 78 (12): 1598. doi:10.1021/ed078p1598. ISSN 0021-9584.