आयोडीन ऑक्साइड

आयोडीन ऑक्साइड ऑक्सीजन और आयोडीन के रासायनिक यौगिक हैं। आयोडीन में केवल दो स्थिर ऑक्साइड होते हैं जो बल्क, आयोडीन टेट्रोक्साइड और आयोडीन पेंटोक्साइड में अलग-थलग होते हैं, लेकिन कई अन्य ऑक्साइड ट्रेस मात्रा में बनते हैं या मौजूद होने की परिकल्पना की गई है।
इन यौगिकों का रसायन जटिल है, केवल कुछ ही अच्छी तरह से चित्रित किए गए हैं। कई वायुमंडल में पाए गए हैं और समुद्री सीमा परत में विशेष रूप से महत्वपूर्ण माना जाता है।[1]
| आण्विक सूत्र | I2O | IO[3] | IO2 | I2O4 | I2O5 | I4O9 |
|---|---|---|---|---|---|---|
| नाम | डायोडीन ऑक्साइड | आयोडीन मोनोऑक्साइड | आयोडीन डाइऑक्साइड | आयोडीन टेट्रॉक्साइड
(डायोडीन टेट्रोक्साइड) |
आयोडीन पेंटोक्साइड
(डायोडाइन पेंटऑक्साइड) |
टेट्रायोडीन नॉनऑक्साइड |
| संचरना | I2O | IO | IO2 | (IO2)2 | O(IO2)2 | I(OIO2)3 |
| अणु प्रतिरूप | 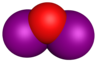
|

|

|
File:Iodine-tetroxide-3D-vdW.png | 
|
|
| सी ए एस रजिस्टरी | 39319-71-6 | 14696-98-1 | 13494-92-3 | 1024652-24-1 | 12029-98-0 | 66523-94-2 |
| आकार | अज्ञात | बैंगनी गैस | पीला ठोस | पीला ठोस | सफेद क्रिस्टलीय ठोस | गहरा पीला ठोस |
| ऑक्सीकरण अवस्था | +1 | +2 | +4 | +3 और +5 | +5 | +3 और +5 |
| गलनांक | पृथक नहीं | पृथक नहीं | पृथक नहीं | अपघटन. 100 °C | अपघटन. 300–350 °C | अपघटन 75 °C |
| आपोक्षिक घनत्व | 4.2 | 4.8 | ||||
| पानी में घुलनशीलता | अपघटन. से HIO3 + I2 | 187 g/100 mL | अपघटन. से HIO3 + I2 |
आयोडीन मोनोऑक्साइड काफी हद तक सैद्धांतिक अध्ययन का विषय रहा है, [4] लेकिन कुछ सबूत हैं कि यह HgO और I2 के बीच प्रतिक्रिया के माध्यम से डाइक्लोरीन मोनोऑक्साइड के समान तरीके से तैयार किया जा सकता है। [5] यौगिक अत्यधिक अस्थिर प्रतीत होता है, लेकिन हलोजन वाले उत्पादों को देने के लिए एल्केन्स के साथ प्रतिक्रिया कर सकता है।[4] रेडिकल आयोडीन ऑक्साइड (IO), आयोडीन डाइऑक्साइड (IO2) और आयोडीन टेट्रोक्साइड ((IO2)2) सभी में महत्वपूर्ण और परस्पर वायुमंडलीय रसायन है।। वे बहुत कम मात्रा में, डायोडोमीथेन के फोटोयुक्त द्वारा समुद्री सीमा परत पर बनते हैं, जो समुद्री शैवाल जैसे मैक्रोएल्गा द्वारा या समुद्री सतह पर मौजूद गैसीय ओजोन और आयोडाइड की प्रतिक्रिया से उत्पन्न आणविक आयोडीन के ऑक्सीकरण के माध्यम से उत्पन्न होता है।[5][6] कम मात्रा में उत्पादित होने के बावजूद (आमतौर पर भाग-प्रति अंकन के नीचे) उन्हें शक्तिशाली ओजोन रिक्तीकरण एजेंट माना जाता है।[7][8] आयोडीन पेंटोक्साइड (I2O5) आयोडिक अम्ल का अम्ल एनहाइड्राइड है और आयोडीन ऑक्सीअम्ल का एकमात्र स्थिर एनहाइड्राइड है।
टेट्राआयोडीन नॉनऑक्साइड (I4O9) I2 की गैस-चरण प्रतिक्रिया द्वारा तैयार किया गया है O3 के साथ लेकिन व्यापक अध्ययन नहीं किया गया है।[9]
आयोडेट आयन
आयोडीन ऑक्साइड भी नकारात्मक रूप से चार्ज किए गए आयनों का निर्माण करते हैं, जो (पूरक उद्धरणों से जुड़े) अम्ल या लवण के घटक होते हैं। इनमें आयोडेट और आवधिक शामिल हैं।
उनके संयुग्मी अम्ल हैं:
| आयोडीन ऑक्सीकरण अवस्था | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| नाम | हाइड्रोजन आयोडाइड* | हाइपोइडस एसिड | आयोडस अम्ल | आयोडिक अम्ल | आवधिक अम्ल |
| सूत्र | HI | HIO | HIO2 | HIO3 | HIO4 or H5IO6 |
• -1 ऑक्सीकरण अवस्था, हाइड्रोजन आयोडाइड, एक ऑक्साइड नहीं है, लेकिन इसे पूर्णता के लिए इस तालिका में शामिल किया गया है।
पीरियड्स में दो वेरिएंट शामिल हैं: मेटापेरियोडेट IO−
4 और ऑर्थोपरियोडेट IO5−
6.
यह भी देखें
संदर्भ
- ↑ Kaltsoyannis, Nikolas; Plane, John M. C. (2008). "Quantum chemical calculations on a selection of iodine-containing species (IO, OIO, INO3, (IO)2, I2O3, I2O4 and I2O5) of importance in the atmosphere". Physical Chemistry Chemical Physics. 10 (13): 1723–33. Bibcode:2008PCCP...10.1723K. doi:10.1039/B715687C. PMID 18350176.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Nikitin, I V (31 August 2008). "Halogen monoxides". Russian Chemical Reviews. 77 (8): 739–749. Bibcode:2008RuCRv..77..739N. doi:10.1070/RC2008v077n08ABEH003788. S2CID 250898175.
- ↑ Cambie, Richard C.; Hayward, Rodney C.; Lindsay, Barry G.; Phan, Alice I. T.; Rutledge, Peter S.; Woodgate, Paul D. (1976). "एल्केन्स के साथ आयोडीन ऑक्साइड की प्रतिक्रिया". Journal of the Chemical Society, Perkin Transactions 1 (18): 1961. doi:10.1039/P19760001961.
- ↑ Hoffmann, Thorsten; O'Dowd, Colin D.; Seinfeld, John H. (15 May 2001). "Iodine oxide homogeneous nucleation: An explanation for coastal new particle production" (PDF). Geophysical Research Letters. 28 (10): 1949–1952. Bibcode:2001GeoRL..28.1949H. doi:10.1029/2000GL012399.
- ↑ Carpenter, Lucy J.; MacDonald, Samantha M.; Shaw, Marvin D.; Kumar, Ravi; Saunders, Russell W.; Parthipan, Rajendran; Wilson, Julie; Plane, John M.C. (13 January 2013). "वायुमंडलीय आयोडीन का स्तर अकार्बनिक आयोडीन के समुद्र की सतह के उत्सर्जन से प्रभावित होता है" (PDF). Nature Geoscience. 6 (2): 108–111. Bibcode:2013NatGe...6..108C. doi:10.1038/ngeo1687.
- ↑ Saiz-Lopez, A.; Fernandez, R. P.; Ordóñez, C.; Kinnison, D. E.; Gómez Martín, J. C.; Lamarque, J.-F.; Tilmes, S. (10 December 2014). "क्षोभमंडल में आयोडीन रसायन और ओजोन पर इसका प्रभाव". Atmospheric Chemistry and Physics. 14 (23): 13119–13143. Bibcode:2014ACP....1413119S. doi:10.5194/acp-14-13119-2014.
- ↑ Cox, R. A.; Bloss, W. J.; Jones, R. L.; Rowley, D. M. (1 July 1999). "OIO और आयोडीन का वायुमंडलीय चक्र" (PDF). Geophysical Research Letters. 26 (13): 1857–1860. Bibcode:1999GeoRL..26.1857C. doi:10.1029/1999GL900439. S2CID 128402214.
- ↑ Sunder, S.; Wren, J. C.; Vikis, A. C. (December 1985). "Raman spectra of I4O9 formed by the reaction of iodine with ozone". Journal of Raman Spectroscopy. 16 (6): 424–426. Bibcode:1985JRSp...16..424S. doi:10.1002/jrs.1250160611.