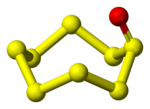
लोअर सल्फर ऑक्साइड
निचले सल्फर ऑक्साइड सूत्र SmOn के साथ अकार्बनिक यौगिकों का समूह है, जहां 2m > n हैं। ये प्रजातियां प्रायः अस्थिर होती हैं और इस प्रकार रोजमर्रा के जीवन में संभवता ही कभी इसका सामना करना पड़ता है। वे मौलिक सल्फर के दहन में महत्वपूर्ण मध्यवर्ती हैं।[1] कुछ उचित प्रकारो से चित्रित उदाहरणों में सम्मिलित है, सल्फर मोनोऑक्साइड (SO), इसका डिमर S2O2 और चक्रीय सल्फर ऑक्साइड की श्रृंखला, SnOx (x = 1, 2), चक्रीय Sn छल्लों पर आधारित है।
स्थलीय वायुमंडलीय सल्फर प्रदूषण को समझने की आवश्यकता और बृहस्पति के चंद्रमाओं में से, आयो (चंद्रमा), और शुक्र के बाह्य-स्थलीय वातावरण में सल्फर ऑक्साइड की महत्वपूर्ण मात्रा होने की शोध के कारण निचले सल्फर ऑक्साइड में रुचि बढ़ी है। प्रारंभिक कार्यकर्ताओं द्वारा रिपोर्ट किए गए कुछ यौगिक जैसे कि ब्लू सेसक्विओक्साइड, S2O3 तरल SO3 में सल्फर को मिश्रण से बनता है, जो S42+ और S82+ आयनों के पॉलीसल्फेट लवणों का मिश्रण प्रतीत होता है।[1]
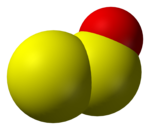
सल्फर मोनोऑक्साइड, डाइसल्फ़र डाइऑक्साइड, डाइसल्फ़र मोनोऑक्साइड
इन प्रजातियों की गैस अवस्था में अच्छी तरह से विशेषता है, लेकिन उन्हें ठोस या तरल के रूप में अलग नहीं किया जा सकता है। इसके बजाय, संघनित होने पर, वे डिमराइज़ेशन और ओलिगोमेराइज़ेशन से गुजरते हैं, आमतौर पर सल्फर डाइऑक्साइड और मौलिक सल्फर उत्पन्न करते हैं। कुछ मिलीबार दाब पर सापेक्षिक स्थिरताएँ S होती हैं2ओ > एस2O2 > तो।[2] सल्फर मोनोऑक्साइड (SO) और इसका डिमर (S2O2) कम तापमान पर फंस गए हैं। डिसल्फर डाइऑक्साइड (एस2O2) सल्फर मोनोऑक्साइड का डिमर है। इसमें सी है2v संरचना (प्लानर)।
डाइसल्फ़ाइड मोनोऑक्साइड (एस2O) सल्फर डाइऑक्साइड का एक एनालॉग है। जैसे इतना2 साथ ही ओजोन (ओ3), और ट्राइसल्फर (एस3), यह एक मुड़ी हुई संरचना को अपनाता है। S-S बॉन्ड की लंबाई 188.4 pm है, S-O बॉन्ड की लंबाई 146.5 pm है और SSO का कोण 117.88° है। दो द्विध्रुव आघूर्ण घटक μ हैंa = 0.875 डी और μb = 1.18 डी।[3] यह प्रजाति अपघटित होकर पॉलीमेरिक सल्फर ऑक्साइड (पीएसओ) देती है जिसका अनुमानित सूत्र [एस3हे]n. पीएसओ कमरे के तापमान पर प्राथमिक सल्फर और एसओ में विघटित हो जाता है2. पीएसओ को आईओ (चंद्रमा) के रंग के लिए जिम्मेदार होने का प्रस्ताव दिया गया है।[4] ट्राइसल्फर मोनोऑक्साइड, एस3O एक अस्थिर अणु है। न्यूट्रलाइजेशन-रीआयनाइजेशन मास स्पेक्ट्रोमेट्री का उपयोग करके गैस चरण में इसका पता लगाया गया है। चक्रीय और शृंखला दोनों प्रकार की संरचनाएँ पाई गईं।[5]
चक्रीय एसnOx (एक्स = 1, 2)
बड़ी संख्या में मोनोऑक्साइड एसnओ जाना जाता है जहां एन = 5-10। ऑक्सीजन परमाणु एक्सोसाइक्लिक है।[2] वे ट्राइफ्लोरोपरोक्सीएसेटिक एसिड के साथ होमोसायकल्स को ऑक्सीकरण करके तैयार किए जा सकते हैं:[1]
- एसn + सीएफ3सी (ओ) ऊह → एसnओ + सीएफ3सी (ओ) ओह
यौगिक पीले या नारंगी रंग के होते हैं और कमरे के तापमान के पास ऊष्मीय रूप से अस्थिर होते हैं।[1]
| formula | color (25° C) | m.p. (°C)[2] |
|---|---|---|
| S6O | yellow | 39 |
| S7O | orange | 55 |
| S7O2 | intense orange | 60–62 (decomp.) |
| S8O | orange | 78 (decomposition) |
| S9O | intensely yellow | 32-34 |
| S10O | orange | 51 (decomp.) |
एक डाइऑक्साइड अच्छी तरह से विशेषता है: गहरा नारंगी एस7O2 (एमपी 60–62 °C अपघटन के साथ), जो ट्राइफ्लोरोपरोक्सोएसेटिक एसिड का उपयोग करके उत्पन्न होता है।[1]
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ 2.0 2.1 2.2 R. Steudel (2003). "Sulfur-Rich Oxides SnO and SnO2". In Steudel, R. (ed.). एलिमेंटल सल्फर और सल्फर-समृद्ध यौगिक II. Berlin-Heidelberg: Springer. doi:10.1007/b13185. ISBN 9783540449515.
- ↑ Meschi, D.J.; Myers R.J. (1959). "डाइसल्फर मोनोऑक्साइड का माइक्रोवेव स्पेक्ट्रम, संरचना और द्विध्रुवीय क्षण". Journal of Molecular Spectroscopy. 3 (1–6): 405–416. Bibcode:1959JMoSp...3..405M. doi:10.1016/0022-2852(59)90036-0.
- ↑ Baklouti D., D; Schmitt, B.; Brissaud, O. (November 2004). "आयो की सतह पर कम सल्फर ऑक्साइड का इन्फ्रारेड अध्ययन". Bulletin of the American Astronomical Society. 36: 1099. Bibcode:2004DPS....36.1607B.
- ↑ de Petris, G; Rosi M Troiani A (2006). "S3O and S3O+ in the gas phase: ring and open-chain structures". Chemical Communications (42): 4416–4418. doi:10.1039/b609646h. PMID 17057862.