कैरोटिड बॉडी
| Carotid body | |
|---|---|
 Section of part of human carotid body. Highly magnified. Numerous blood vessels are seen in section among the cells. | |
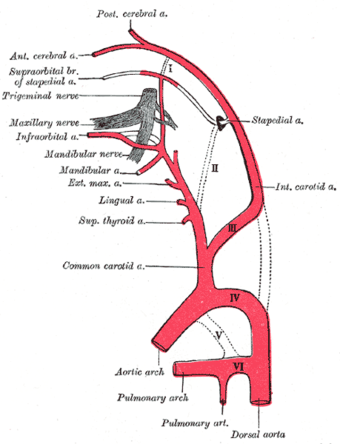 Diagram showing the origins of the main branches of the carotid arteries. | |
| Details | |
| Nerve | branch of glossopharyngeal nerve to carotid sinus |
| Identifiers | |
| Latin | glomus caroticum |
| Anatomical terminology | |
कैरोटिड बॉडी रसायनग्राही का एक छोटा समूह है और इसके एडिटिविया में प्रत्येक सामान्य कैरोटिड धमनी के द्विभाजन पर स्थित स्थायी कोशिका का समर्थन करता है।[1][2]
कैरोटिड बॉडी इसके माध्यम से बहने वाले धमनी रक्त की संरचना में परिवर्तन का पता लगाता है, मुख्य रूप से धमनी ऑक्सीजन का आंशिक दबाव किंतु कार्बन डाइऑक्साइड का भी यह रक्त पीएच और तापमान में परिवर्तन के प्रति भी संवेदनशील है।
संरचना
कैरोटिड बॉडी सामान्य कैरोटिड धमनी के द्विभाजन के पीछे के पहलू पर स्थित है।[3]
कैरोटिड बॉडी दो प्रकार की कोशिकाओं से बनी होती है, जिन्हें ग्लोमस कोशिकाएँ कहा जाता है: ग्लोमस टाइप I कोशिकाएँ परिधीय कीमोरिसेप्टर होती हैं और ग्लोमस टाइप II कोशिकाएँ निरंतर सहायक कोशिकाएँ होती हैं।
- ग्लोमस टाइप I कोशिकाएँ तंत्रिका शिखा से प्राप्त होती हैं।[4] वे विभिन्न प्रकार के स्नायुसंचारी छोड़ते हैं, जिनमें एसिटाइलकोलाइन, एडेनोसाइन ट्रायफ़ोस्फेट और डोपामाइन सम्मिलित हैं जो श्वसन केंद्र की ओर जाने वाले सिनैप्सड न्यूरॉन्स में उत्तेजक पोस्टसिनेप्टिक क्षमता को ट्रिगर करते हैं। वे ग्लोसोफेरीन्जियल तंत्रिका के अक्षतंतु द्वारा संक्रमित होते हैं जिन्हें सामूहिक रूप से कैरोटिड साइनस तंत्रिका कहा जाता है।
- ग्लोमस टाइप II कोशिकाएं न्यूरोग्लिया से मिलती-जुलती हैं ग्लियल मार्कर एस-100 प्रोटीन व्यक्त करती हैं और सहायक कोशिकाओं के रूप में कार्य करती हैं।
प्रकार्य
कैरोटीड बॉडी एक सेंसर के रूप में कार्य करती है: यह एक उत्तेजना का उत्तर देती है मुख्य रूप से O2 आंशिक दबाव जिसे टाइप I (ग्लोमस) कोशिकाओं द्वारा पता लगाया जाता है और ग्लोसोफरीन्जियल तंत्रिका के अभिवाही तंतुओं के माध्यम से एक क्रिया क्षमता को ट्रिगर करता है जो केंद्रीय तंत्रिका तंत्र को सूचना देता है।
प्रोत्साहन
कैरोटिड बॉडी पेरीफेरल केमोरिसेप्टर मुख्य रूप से ऑक्सीजन के आंशिक दबाव (PO2) में कमी के प्रति संवेदनशील होते हैं। यह मेडुला ऑब्लांगेटा में केंद्रीय कीमोरिसेप्टर्स के विपरीत है जो मुख्य रूप से pH और PO2 ( pH में कमी और PO2 में वृद्धि) में परिवर्तन के प्रति संवेदनशील हैं। कैरोटीड बॉडी केमोरेसेप्टर्स भी pH और PCO2 के प्रति संवेदनशील होते हैं, किंतु केवल गौण रूप से अधिक विशेष रूप से जब पीएच कम हो जाता है और PCO2 बढ़ जाता है तो कैरोटिड बॉडी केमोरेसेप्टर्स की कम PO2 की संवेदनशीलता अधिक होती है।
कैरोटीड निकायों के लिए आवेग दर विशेष रूप से धमनी PO2 में 60 से 30 मिमी एचजी की सीमा में परिवर्तन के प्रति संवेदनशील है, एक सीमा जिसमें ऑक्सीजन के साथ हीमोग्लोबिन संतृप्ति तेजी से घट जाती है।[5]
कैरोटिड निकायों का उत्पादन लगभग 100mmHg (13,3 kPa) (सामान्य शारीरिक पीएच पर) से ऊपर के ऑक्सीजन आंशिक दबाव पर कम होता है, किंतु 60mmHg से नीचे टाइप I (ग्लोमस) कोशिकाओं की गतिविधि हीमोग्लोबिन में कमी के कारण तेजी से बढ़ती है- ऑक्सीजन संतृप्ति 90% से नीचे है।
जांच
PO2 में कमी का पता लगाने के तंत्र की पहचान अभी की जानी है कई तंत्र हो सकते हैं और प्रजातियों के बीच भिन्न हो सकते हैं। हाइपोक्सिया का पता लगाने को सिस्टैथियोनाइन गामा-लाईज़ द्वारा उत्पादित हाइड्रोजन सल्फाइड उत्पादन में वृद्धि पर निर्भर करने के लिए दिखाया गया है क्योंकि चूहों में हाइपोक्सिया का पता लगाना कम हो जाता है जिसमें यह एंजाइम खटखटाया जाता है या फार्माकोलॉजिकल रूप से बाधित होता है। पता लगाने की प्रक्रिया में सिस्टैथियोनाइन गामा-लाईज़ की हेमोऑक्सीजिनेज़-2 के साथ परस्पर क्रिया और कार्बन मोनोऑक्साइड का उत्पादन सम्मिलित है। फिर भी कुछ अध्ययनों से पता चलता है कि हाइड्रोजन सल्फाइड की शारीरिक सांद्रता ऐसी प्रतिक्रियाओं को ट्रिगर करने के लिए पर्याप्त शसक्त नहीं हो सकती है।
अन्य सिद्धांतों का सुझाव है कि इसमें माइटोकॉन्ड्रियल ऑक्सीजन सेंसर और हेम युक्त साइटोक्रोम सम्मिलित हो सकते हैं जो ऑक्सीडेटिव-फॉस्फोराइलेशन के समय प्रतिवर्ती एक-इलेक्ट्रॉन कमी से गुजरते हैं। हैम विपरीत रूप से O2 को कैरोटीड बॉडी के समान एक आत्मीयता के साथ बांधता है यह सुझाव देता है कि हेम युक्त प्रोटीन की O2 में भूमिका हो सकती है संभवतः यह ऑक्सीडेटिव-फॉस्फोराइलेशन में सम्मिलित परिसरों में से एक हो सकता है। इससे प्रतिक्रियाशील ऑक्सीजन प्रजातियों में वृद्धि होती है और इंट्रासेल्युलर Ca2+ में वृद्धि होती है। चूँकि क्या हाइपोक्सिया प्रतिक्रियाशील ऑक्सीजन प्रजातियों में वृद्धि या कमी की ओर जाता है अज्ञात है। हाइपोक्सिया संवेदन में प्रतिक्रियाशील ऑक्सीजन प्रजातियों की भूमिका भी सवालों के घेरे में है।[6]
हाइपोक्सिया सेंसर के रूप में ऑक्सीजन पर निर्भर एंजाइम हेम-ऑक्सीडेज को भी आगे रखा गया है। नॉर्मोक्सिया में हेम-ऑक्सीजनेज़ कार्बन मोनोऑक्साइड (CO) उत्पन्न करता है, सीओ बड़े प्रवाहकत्त्व वाले कैल्शियम-सक्रिय पोटेशियम चैनल बीके को सक्रिय करता है। CO में गिरावट जो हाइपोक्सिया के परिणाम के रूप में होती है इस पोटेशियम चैनल को बंद करने की ओर ले जाती है और इससे झिल्ली का विध्रुवण होता है और कैरोटिड बॉडी का सक्रियण होता है।[7] हाइपोक्सिया सेंसिंग में एनर्जी सेंसर एएमपी-एक्टिवेटेड प्रोटीन किनेज (एएमपीके ) की भूमिका भी प्रस्तावित की गई है। यह एंजाइम हाइपोक्सिया सहित शुद्ध ऊर्जा उपयोग और मेटाबोलिक तनाव के समय सक्रिय होता है। एएमपीके के कई लक्ष्य हैं और ऐसा प्रतीत होता है कि कैरोटिड बॉडी में जब एएमपीके हाइपोक्सिया द्वारा सक्रिय होता है, तो यह दोनों O2 के डाउनस्ट्रीम पोटेशियम चैनल को बंद कर देता है।
बढ़ी हुई PCO2 का पता लगाया जाता है[8] क्योंकि CO2 कोशिका में फैल जाती है जहाँ यह कार्बोनिक अम्ल और इस प्रकार प्रोटॉन की सांद्रता को बढ़ाती है। CO2 संवेदन का सटीक तंत्र अज्ञात है, हालांकि यह प्रदर्शित किया गया है कि CO2 और कम पीएच एक टास्क-जैसे पोटेशियम चालन को रोकते हैं जिससे पोटेशियम का प्रवाह कम हो जाता है। इससे कोशिका झिल्ली का विध्रुवण होता है जिससे Ca2+ प्रवेश होता है ग्लोमस कोशिकाओं का उत्तेजन होता है और परिणामस्वरूप न्यूरोट्रांसमीटर रिलीज होता है[9]
धमनी एसिडोसिस (या तो चयापचय या परिवर्तित PCO2 से) एसिड-बेस ट्रांसपोर्टर्स (जैसे Na+-H+) को रोकता है जो इंट्रासेल्युलर पीएच बढ़ाता है और ट्रांसपोर्टर्स (जैसे Cl−-HCO3−) को सक्रिय करता है जो इसे कम करता है। सेल के अंदर एसिडोसिस (या अल्कलोसिस से विपरीत) के कारण प्रोटॉन एकाग्रता में परिवर्तन PCO2 संवेदन में सम्मिलित समान मार्गों को उत्तेजित करता है।
एक अन्य तंत्र ऑक्सीजन संवेदनशील पोटेशियम चैनलों के माध्यम से है। घुलित ऑक्सीजन में एक बूंद इन चैनलों को बंद करने की ओर ले जाती है जिसके परिणामस्वरूप विध्रुवण होता है। यह ग्लोसोफेरीन्जियल में न्यूरोट्रांसमीटर डोपामाइन और वैसोमोटर क्षेत्र में वेगस अभिवाही की रिहाई की ओर जाता है।
कार्य क्षमता
कैरोटिड (और महाधमनी निकायों) में टाइप I (ग्लोमस) कोशिकाएं न्यूरोएक्टोडर्म से प्राप्त होती हैं और इस प्रकार विद्युत रूप से उत्तेजनीय होती हैं। ऑक्सीजन आंशिक दबाव में कमी कार्बन डाइऑक्साइड आंशिक दबाव में वृद्धि और धमनी पीएच में कमी सभी कोशिका झिल्ली के विध्रुवण का कारण बन सकते हैं और वे पोटैशियम धाराओं को अवरुद्ध करके इसे प्रभावित करते हैं। झिल्ली क्षमता में यह कमी वोल्टेज गेटेड कैल्शियम चैनल विवर्त है जिससे इंट्रासेल्युलर कैल्शियम एकाग्रता में वृद्धि होती है। यह सिनैप्टिक पुटिका के एक्सोसाइटोसिस का कारण बनता है जिसमें विभिन्न प्रकार के न्यूरोट्रांसमीटर होते हैं जिनमें एसिटाइलकोलाइन, नॉरएड्रिनेलिन, डोपामाइन, एडेनोसाइन, एडेनोसिन ट्राइफॉस्फेट, पदार्थ पी और मौसम-एनकेफालिन सम्मिलित हैं। अभिवाही तंत्रिका तंतुओं पर रिसेप्टर (जैव रसायन) पर ये कार्य करते हैं जो ग्लोमस सेल के संबंध में एक क्रिया क्षमता का कारण बनते हैं।
रिले
कैरोटिड बॉडी से प्रतिक्रिया ग्लोसोफेरीन्जियल तंत्रिका की अभिवाही शाखाओं के माध्यम से मेडुला ऑबोंगेटा में कार्डियोरेसपिरेटरी केंद्रों को भेजी जाती है। महाधमनी बॉडी केमोरेसेप्टर्स के अपवाही तंतुओं को वेगस तंत्रिका द्वारा रिले किया जाता है। ये केंद्र बदले में श्वास और रक्तचाप को नियंत्रित करते हैं हाइपोक्सिया के कारण वेंटिलेशन में वृद्धि होती है।
नैदानिक महत्व

पैरागैंगलियोमा
एक पैरागैंगलियोमा एक ट्यूमर है जिसमें कैरोटीड बॉडी सम्मिलित हो सकती है और सामान्यतः सौम्य होती है। संभवतः ही कभी एक घातक न्यूरोब्लास्टोमा कैरोटीड बॉडी से उत्पन्न हो सकता है।
संदर्भ
- ↑ "कैरोटिड बॉडी और कैरोटिड साइनस - सामान्य जानकारी". Iowa Head and Neck Protocols. medicine.uiowa.edu. Retrieved 23 October 2019.
- ↑ Hall, John Edward (20 May 2015). गाइटन और हॉल टेक्स्टबुक ऑफ मेडिकल फिजियोलॉजी (13th ed.). Philadelphia, PA. ISBN 978-1-4557-7005-2. OCLC 900869748.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Kadasne, D. K. (2009). कदासने की एनाटॉमी की पाठ्यपुस्तक (1st ed.). New Delhi: Jaypee Brothers Medical Publishers. p. 916. ISBN 978-81-8448-455-7. OCLC 682534511.
- ↑ Gonzalez C, Almaraz L, Obeso A, Rigual R (1994). "Carotid body chemoreceptors: from natural stimuli to sensory discharges". Physiol. Rev. 74 (4): 829–98. doi:10.1152/physrev.1994.74.4.829. PMID 7938227.
- ↑ Hall, John Edward (20 May 2015). गाइटन और हॉल टेक्स्टबुक ऑफ मेडिकल फिजियोलॉजी (13th ed.). Philadelphia, PA. ISBN 978-1-4557-7005-2. OCLC 900869748.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Gonzalez C, Sanz-Alfayate G, Agapito MT, Gomez-Niño A, Rocher A, Obeso A (2002). "संदर्भ में ऑक्सीजन सेंसर।". Respir Physiol Neurobiol. 132 (1): 17–41. doi:10.1016/S1569-9048(02)00047-2. PMID 12126693. S2CID 25674998.
- ↑ Williams SE, Wootton P, Mason HS, Bould J, Iles DE, Riccardi D, Peers C, Kemp PJ (2004). "Hemoxygenase-2 is an oxygen sensor for a calcium-sensitive potassium channel". Science. 306 (5704): 2093–7. Bibcode:2004Sci...306.2093W. doi:10.1126/science.1105010. PMID 15528406. S2CID 41811182.
- ↑ Wyatt CN, Mustard KJ, Pearson SA, Dallas ML, Atkinson L, Kumar P, Peers C, Hardie DG, Evans AM (2007). "एएमपी-सक्रिय प्रोटीन किनेज हाइपोक्सिया द्वारा कैरोटिड बॉडी एक्साइटमेंट की मध्यस्थता करता है". J Biol Chem. 282 (11): 8092–8. doi:10.1074/jbc.M608742200. PMC 1832262. PMID 17179156.
- ↑ Buckler KJ, Williams BA, Honore E (2000). "चूहे की धमनी कीमोरिसेप्टर कोशिकाओं में एक ऑक्सीजन-, एसिड- और एनेस्थेटिक-सेंसिटिव TASK-जैसी पृष्ठभूमि पोटेशियम चैनल". J. Physiol. 525 (1): 135–142. doi:10.1111/j.1469-7793.2000.00135.x. PMC 2269923. PMID 10811732.