फोटोट्रोपिज्म
जीव विज्ञान में, फोटोट्रोपिज्म एक प्रकाश उत्तेजना (फिजियोलॉजी) के जवाब में एक जीव का पौधा विकास है। Phototropism अक्सर पौधों में देखा जाता है, लेकिन यह कवक जैसे अन्य जीवों में भी हो सकता है। पौधे पर कोशिका (जीव विज्ञान) जो प्रकाश से सबसे दूर हैं, में auxin नामक एक हार्मोन होता है जो फोटोट्रोपिज्म होने पर प्रतिक्रिया करता है। इसके कारण पौधे में प्रकाश से सबसे दूर की ओर लम्बी कोशिकाएँ होती हैं। Phototropism कई पौधों tropisms, या आंदोलनों में से एक है, जो बाहरी उत्तेजनाओं का जवाब देते हैं। प्रकाश स्रोत की ओर बढ़ने को सकारात्मक फोटोट्रोपिज्म कहा जाता है, जबकि प्रकाश से दूर की ओर बढ़ने को नकारात्मक फोटोट्रोपिज्म कहा जाता है। नकारात्मक फोटोट्रोपिज्म को स्कोटोट्रोपिज्म के साथ भ्रमित नहीं होना है, जिसे अंधेरे की ओर बढ़ने के रूप में परिभाषित किया गया है, जबकि नकारात्मक फोटोट्रोपिज्म या तो विकास को प्रकाश स्रोत से दूर या अंधेरे की ओर संदर्भित कर सकता है।[1] अधिकांश पौधे प्ररोह सकारात्मक प्रकाशानुवर्तन प्रदर्शित करते हैं, और प्रकाश संश्लेषक ऊर्जा को अधिकतम करने और विकास को बढ़ावा देने के लिए पत्तियों में अपने क्लोरोप्लास्ट को पुनर्व्यवस्थित करते हैं।[2][3] कुछ बेल शूट टिप्स नकारात्मक फोटोट्रोपिज्म प्रदर्शित करते हैं, जो उन्हें अंधेरे, ठोस वस्तुओं की ओर बढ़ने और उन पर चढ़ने की अनुमति देता है। फोटोट्रोपिज्म और गुरुत्वाकर्षण का संयोजन पौधों को सही दिशा में बढ़ने की अनुमति देता है।[4]
तंत्र
ऐसे कई सिग्नलिंग अणु हैं जो पौधे को यह निर्धारित करने में मदद करते हैं कि प्रकाश स्रोत कहां से आ रहा है, और ये कई जीनों को सक्रिय करते हैं, जो हार्मोन ग्रेडियेंट को बदलते हैं जिससे पौधे को प्रकाश की ओर बढ़ने की अनुमति मिलती है। पौधे के सिरे को प्रांकुरिका के रूप में जाना जाता है, जो प्रकाश संवेदन के लिए आवश्यक है।[2]प्रांकुरिका का मध्य भाग वह क्षेत्र है जहां प्ररोह वक्रता होती है। 20वीं सदी की शुरुआत में विकसित चोलोड्नी-वेंट मॉडल | चोलोड्नी-वेंट परिकल्पना, भविष्यवाणी करती है कि असममित प्रकाश की उपस्थिति में, ऑक्सिन छायांकित पक्ष की ओर बढ़ेगा और उस तरफ कोशिकाओं के बढ़ाव को बढ़ावा देगा जिससे पौधे की ओर वक्र हो जाएगा। प्रकाश स्रोत।[5] Auxins प्रोटॉन पंप को सक्रिय करते हैं, पौधे के अंधेरे पक्ष में कोशिकाओं में पीएच को कम करते हैं। कोशिका भित्ति क्षेत्र का यह अम्लीकरण विस्तारक के रूप में जाने वाले एंजाइम को सक्रिय करता है जो कोशिका भित्ति संरचना में हाइड्रोजन बंधों को बाधित करता है, जिससे कोशिका भित्ति कम कठोर हो जाती है। इसके अलावा, बढ़ी हुई प्रोटॉन पंप गतिविधि से पौधे के अंधेरे पक्ष में पौधे की कोशिकाओं में अधिक विलेय प्रवेश होता है, जो इन पौधों की कोशिकाओं के सिम्प्लास्ट और एपोप्लास्ट के बीच आसमाटिक प्रवणता को बढ़ाता है।[6] पानी तब अपने आसमाटिक ढाल के साथ कोशिकाओं में प्रवेश करता है, जिससे टगर दबाव में वृद्धि होती है। सेल की दीवार की ताकत में कमी और एक उपज सीमा के ऊपर टर्गर दबाव में वृद्धि[7] कोशिकाओं में सूजन का कारण बनता है, यांत्रिक दबाव बढ़ाता है जो फोटोट्रोपिक आंदोलन को चलाता है।
जीन के दूसरे समूह, पिन जीन द्वारा एन्कोड किए गए प्रोटीन को फोटोट्रोपिज्म में प्रमुख भूमिका निभाने के लिए पाया गया है। वे ऑक्सिन ट्रांसपोर्टर हैं, और यह माना जाता है कि वे ऑक्सिन स्थान के ध्रुवीकरण के लिए जिम्मेदार हैं। विशेष रूप से PIN3 को प्राथमिक ऑक्सिन वाहक के रूप में पहचाना गया है।[8] यह संभव है कि फोटोट्रोपिन प्रकाश प्राप्त करते हैं और पिनोएड किनेज (पीआईडी) की गतिविधि को रोकते हैं, जो फिर पिन3 की गतिविधि को बढ़ावा देता है। PIN3 के इस सक्रियण से ऑक्सिन का असममित वितरण होता है, जो तने में कोशिकाओं के असममित विस्तार की ओर जाता है। pin3 म्यूटेंट में जंगली-प्रकार की तुलना में छोटे हाइपोकोटिल और जड़ें थीं, और ऑक्सिन एफ्लक्स इनहिबिटर के साथ उगाए गए पौधों में समान फेनोटाइप देखा गया था।[9] एंटी-पिन3 इम्युनोगोल्ड लेबलिंग का उपयोग करते हुए, पिन3 प्रोटीन की गति देखी गई। PIN3 सामान्य रूप से हाइपोकोटिल और स्टेम की सतह पर स्थानीयकृत होता है, लेकिन एक एक्सोसाइटोसिस अवरोधक ब्रेफेलिन ए (बीएफए) की उपस्थिति में भी आंतरिक होता है। यह तंत्र एक पर्यावरणीय उत्तेजना के जवाब में PIN3 को पुनर्स्थापित करने की अनुमति देता है। PIN3 और PIN7 प्रोटीनों को पल्स-प्रेरित फोटोट्रोपिज्म में भूमिका निभाने के लिए सोचा गया था। पिन 3 म्यूटेंट में वक्रता प्रतिक्रियाएं काफी कम हो गईं, लेकिन पिन 7 म्यूटेंट में केवल थोड़ी कम हुई। PIN1 , PIN3 , और PIN7 के बीच कुछ अतिरेक है, लेकिन यह माना जाता है कि PIN3 पल्स-प्रेरित फोटोट्रोपिज्म में अधिक भूमिका निभाता है।[10] ऐसे फोटोट्रोपिन हैं जो कोलोप्टाइल के ऊपरी क्षेत्र में अत्यधिक अभिव्यक्त होते हैं। दो मुख्य फोटोट्रोपिज्म हैं वे फोटो1 और फोटो2 हैं। फोटो 2 सिंगल म्यूटेंट में वाइल्ड-टाइप की तरह फोटोट्रोपिक प्रतिक्रियाएं होती हैं, लेकिन फोटो 1 फोटो 2 डबल म्यूटेंट कोई फोटोट्रोपिक प्रतिक्रिया नहीं दिखाते हैं।[4]PHOT1 और PHOT2 की मात्रा पौधे की उम्र और प्रकाश की तीव्रता के आधार पर अलग-अलग होती है। परिपक्व अरबिडोप्सिस पत्तियों में उच्च मात्रा में PHOT2 मौजूद होता है और यह चावल के ऑर्थोलॉग में भी देखा गया था। नीले या लाल प्रकाश की उपस्थिति के आधार पर PHOT1 और PHOT2 की अभिव्यक्ति बदलती है। प्रकाश की उपस्थिति में PHOT1 mRNA का डाउनरेगुलेशन था, लेकिन PHOT2 ट्रांसक्रिप्ट का अपरेगुलेशन। पौधे में मौजूद एमआरएनए और प्रोटीन का स्तर पौधे की उम्र पर निर्भर था। इससे पता चलता है कि पत्तियों की परिपक्वता के साथ फोटोट्रोपिन अभिव्यक्ति का स्तर बदल जाता है।[11] परिपक्व पत्तियों में क्लोरोप्लास्ट होते हैं जो प्रकाश संश्लेषण में आवश्यक होते हैं। प्रकाश संश्लेषण को अधिकतम करने के लिए विभिन्न प्रकाश वातावरणों में क्लोरोप्लास्ट पुनर्व्यवस्था होती है। प्लांट फोटोट्रोपिज्म में NPH1 और NPL1 जीन सहित कई जीन शामिल हैं। वे दोनों क्लोरोप्लास्ट पुनर्व्यवस्था में शामिल हैं।[3]Nph1 और npl1 डबल म्यूटेंट में फोटोट्रोपिक प्रतिक्रियाएं कम पाई गईं। वास्तव में, दोनों जीन तने की वक्रता का निर्धारण करने में बेमानी हैं।
हाल के अध्ययनों से पता चलता है कि PHOT1 और PHOT2 को छोड़कर, कई AGC किनेसेस प्लांट फोटोट्रोपिज्म में शामिल हैं। सबसे पहले, PINOID, एक प्रकाश-प्रेरक अभिव्यक्ति पैटर्न प्रदर्शित करता है, एक प्रत्यक्ष फास्फारिलीकरण के माध्यम से फोटोट्रोपिक प्रतिक्रियाओं के दौरान PIN3 के उपकोशिकीय स्थानांतरण को निर्धारित करता है। दूसरे, D6PK और इसके D6PKL होमोलोग्स PIN3 की ऑक्सिन परिवहन गतिविधि को नियंत्रित करते हैं, साथ ही फॉस्फोराइलेशन के माध्यम से भी। तीसरा, D6PK/D6PKLs, PDK1.1 और PDK1.2 का अपस्ट्रीम इन AGC किनेसेस के लिए एक आवश्यक उत्प्रेरक का काम करता है। दिलचस्प बात यह है कि फोटोट्रोपिक प्रतिक्रिया की प्रगति के दौरान अलग-अलग एजीसी किनेसेस अलग-अलग चरणों में भाग ले सकते हैं। D6PK/D6PKLs PINOID की तुलना में अधिक फॉस्फोराइलेट करने की क्षमता प्रदर्शित करते हैं।
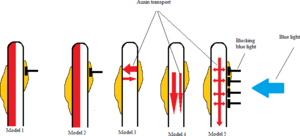
=== फोटोट्रोपिज्म === में ऑक्सिन वितरण के पांच मॉडल 2012 में, सकाई और हागा[12]रेखांकित किया कि कैसे अलग-अलग ऑक्सिन सांद्रता तने के छायांकित और हल्के पक्ष पर उत्पन्न हो सकती हैं, जिससे फोटोट्रोपिक प्रतिक्रिया को जन्म मिलता है। अध्ययन संयंत्र के रूप में अरबीडोफिसिस थालीआना का उपयोग करते हुए पौधे का तना फोटोट्रोपिज्म के संबंध में पांच मॉडल प्रस्तावित किए गए हैं।
; पहला मॉडल
पहले मॉडल में आने वाला प्रकाश पौधे के प्रकाश पक्ष पर ऑक्सिन को निष्क्रिय कर देता है जिससे छायांकित भाग बढ़ता रहता है और अंततः पौधे को प्रकाश की ओर झुका देता है।[12]
- दूसरा मॉडल
दूसरे मॉडल में प्रकाश पौधे के प्रकाश पक्ष पर ऑक्सिन जैवसंश्लेषण को रोकता है, इस प्रकार अप्रभावित पक्ष के सापेक्ष ऑक्सिन की सांद्रता कम हो जाती है।[12]
तीसरा मॉडल तीसरे मॉडल में पौधे के प्रकाश और अंधेरे दोनों तरफ से ऑक्सिन का क्षैतिज प्रवाह होता है। आने वाली रोशनी अधिक ऑक्सिन को उजागर पक्ष से छायांकित पक्ष में प्रवाहित करने का कारण बनती है, छायांकित पक्ष पर ऑक्सिन की एकाग्रता में वृद्धि होती है और इस प्रकार अधिक वृद्धि होती है।[12]
चौथा मॉडल चौथे मॉडल में यह दिखाता है कि प्रकाश प्राप्त करने वाला पौधा ऑक्सिन बेसिपेटल को उजागर पक्ष में नीचे की ओर रोकता है, जिससे ऑक्सिन केवल छायांकित पक्ष में प्रवाहित होता है।[12]
- पांचवां मॉडल
मॉडल पांच में मॉडल 3 और 4 दोनों के तत्व शामिल हैं। इस मॉडल में मुख्य ऑक्सिन प्रवाह पौधे के शीर्ष से नीचे की ओर लंबवत रूप से पौधे के आधार की ओर आता है, जिसमें से कुछ ऑक्सिन मुख्य ऑक्सिन प्रवाह से क्षैतिज रूप से यात्रा करते हुए दोनों तरफ आते हैं। पौधा। प्रकाश प्राप्त करना क्षैतिज ऑक्सिन प्रवाह को मुख्य ऊर्ध्वाधर ऑक्सिन प्रवाह से विकिरणित उजागर पक्ष में रोकता है। और सकाई और हागा के अध्ययन के अनुसार, देखे गए असममित ऑक्सिन वितरण और बाद में हाइपोकोटिल्स में फोटोट्रोपिक प्रतिक्रिया इस पांचवें परिदृश्य के साथ सबसे अधिक सुसंगत लगती है।[12]
तरंग दैर्ध्य का प्रभाव
अरबिडोप्सिस थालियाना जैसे पौधों में फोटोट्रोपिज्म नीले प्रकाश रिसेप्टर्स द्वारा निर्देशित होता है जिसे फोटोट्रोपिन कहा जाता है।[13] पौधों में अन्य सहज रिसेप्टर्स में फाइटोक्रोम शामिल हैं जो लाल बत्ती का बोध कराते हैं[14] और क्रिप्टोक्रोम जो नीले प्रकाश का बोध कराते हैं।[15] पौधे के विभिन्न अंग प्रकाश के विभिन्न तरंग दैर्ध्य के लिए अलग-अलग फोटोट्रोपिक प्रतिक्रियाएं प्रदर्शित कर सकते हैं। स्टेम टिप्स नीले प्रकाश के लिए सकारात्मक फोटोट्रोपिक प्रतिक्रियाओं को प्रदर्शित करते हैं, जबकि रूट टिप्स नीले प्रकाश के लिए नकारात्मक फोटोट्रोपिक प्रतिक्रियाओं को प्रदर्शित करते हैं। रूट टिप्स और अधिकांश स्टेम टिप्स दोनों लाल बत्ती के लिए सकारात्मक फोटोट्रोपिज्म प्रदर्शित करते हैं।[citation needed] क्रिप्टोक्रोम फोटोरिसेप्टर हैं जो नीले/यूवी-ए प्रकाश को अवशोषित करते हैं, और वे पौधों में सर्कैडियन लय और फूलों के समय को नियंत्रित करने में मदद करते हैं। फाइटोक्रोम फोटोरिसेप्टर हैं जो लाल/दूर-लाल प्रकाश को महसूस करते हैं, लेकिन वे नीले प्रकाश को भी अवशोषित करते हैं; वे अन्य बातों के साथ-साथ वयस्क पौधों में पुष्पन और बीजों के अंकुरण को नियंत्रित कर सकते हैं। फाइटोक्रोम और क्रिप्टोक्रोम से प्रतिक्रियाओं का संयोजन पौधे को विभिन्न प्रकार के प्रकाश का जवाब देने की अनुमति देता है।[16] साथ में फाइटोक्रोमेस और क्रिप्टोक्रोम्स हाइपोकोटाइल में ग्रेविट्रोपिज्म को रोकते हैं और फोटोट्रोपिज्म में योगदान करते हैं।[2]
गैलरी
Phycomyces, एक कवक, फोटोट्रोपिज्म भी प्रदर्शित करता है
Phalaenopsis पर उदाहरण
Azuki सेम पर उदाहरण
कीण्षासा , कांगो लोकतांत्रिक गणराज्य में दो इमारतों के बीच रावनला बढ़ रहा है। इन दो पौधों का विमान (यहाँ उत्तर-दक्षिण अक्ष के लंबवत) दिन के उजाले के अवशोषण को अधिकतम करने के लिए उन्मुख है
यह भी देखें
- स्कोटोबायोलॉजी
- चोलोडनी–चले गए मॉडल
संदर्भ
- ↑ Strong & Ray 1975.
- ↑ 2.0 2.1 2.2 Goyal, A., Szarzynska, B., Fankhauser C. (2012). Phototropism: at the crossroads of light-signaling pathways. Cell 1-9.
- ↑ 3.0 3.1 Sakai, T.; Kagawa, T.; Kasahara, M.; Swartz, T.E.; Christie, J.M.; Briggs, W.R.; Wada, M.; Okada, K. (2001). "Arabidopsis nph1 and npl1: Blue light receptors that mediate both phototropism and chloroplast relocation". PNAS. 98 (12): 6969–6974. Bibcode:2001PNAS...98.6969S. doi:10.1073/pnas.101137598. PMC 34462. PMID 11371609.
- ↑ 4.0 4.1 Liscum, E. (2002). Phototropism: Mechanisms and Outcomes. Arabidopsis Book 1-21.
- ↑ Christie, J.M.; Murphy, A.S. (2013). "Shoot phototropism in higher plants: New light through old concepts". American Journal of Botany. 100 (1): 35–46. doi:10.3732/ajb.1200340. PMID 23048016.
- ↑ Hager, Achim (2003-12-01). "Role of the plasma membrane H+-ATPase in auxin-induced elongation growth: historical and new aspects". Journal of Plant Research. 116 (6): 483–505. doi:10.1007/s10265-003-0110-x. ISSN 1618-0860. PMID 12937999. S2CID 23781965.
- ↑ Cosgrove, Daniel J.; Van Volkenburgh, Elizabeth; Cleland, Robert E. (September 1984). "Stress relaxation of cell walls and the yield threshold for growth: Demonstration and measurement by micro-pressure probe and psychrometer techniques". Planta. 162 (1): 46–54. doi:10.1007/BF00397420. ISSN 0032-0935. PMID 11540811. S2CID 6870501.
- ↑ Ding, Z.; Galván-Ampudia, C.S.; Demarsy, E.; Langowski, L.; Kleine-Vehn, J.; Fan, Y.; Morita, M.T.; Tasaka, M.; Fankhauser, C.; Offringa, R.; Friml, J. (2011). "Light-mediated polarization of the PIN3 auxin transporter for the phototropic response in Arabidopsis". Nature Cell Biology. 13 (4): 447–453. doi:10.1038/ncb2208. PMID 21394084. S2CID 25049558.
- ↑ Friml, J.; Wisniewska, J.; Benkova, E.; Mendgen, K.; Palme, K. (2002). "Lateral relocation of auxin efflux regulator PIN3 mediates tropism in Arabidopsis". Nature. 415 (6873): 806–809. Bibcode:2002Natur.415..806F. doi:10.1038/415806a. PMID 11845211. S2CID 4348635.
- ↑ Haga, K.; Sakai, T. (2012). "पिन औक्सिन एफ्लक्स कैरियर पल्स-प्रेरित के लिए आवश्यक हैं लेकिन अरबिडोप्सिस में निरंतर प्रकाश-प्रेरित फोटोट्रोपिज्म नहीं". Plant Physiology. 160 (2): 763–776. doi:10.1104/pp.112.202432. PMC 3461554. PMID 22843667.
- ↑ Labuz, J.; Sztatelman, O.; Banas, A. K.; Gabrys, H. (2012). "The expression of phototropins in Arabidopsis leaves: developmental and light regulation". Journal of Experimental Botany. 63 (4): 1763–1771. doi:10.1093/jxb/ers061. PMID 22371325.
- ↑ 12.0 12.1 12.2 12.3 12.4 12.5 Sakai, T; Haga, K (2012). "अरबिडोप्सिस में फोटोट्रोपिज्म का आणविक आनुवंशिक विश्लेषण". Plant & Cell Physiology. 53 (9): 1517–34. doi:10.1093/pcp/pcs111. PMC 3439871. PMID 22864452.
- ↑ "Phototropins: Photoreceptors that provide a novel photochemical mechanism for signaling". Archived from the original on 2015-11-18. Retrieved 2016-04-16.
- ↑ "फाइटोक्रोम". plantphys.info. Retrieved 2016-04-16.
- ↑ Eckardt, N. A. (1 May 2003). "क्रिप्टोक्रोम ब्लू लाइट सिग्नलिंग पाथवे का एक घटक". The Plant Cell Online. 15 (5): 1051–1052. doi:10.1105/tpc.150510. PMC 526038.
- ↑ McCoshum, S., Kiss, J.Z. (2011). Green light affects blue-light based phototropism in hypocotyls of Arabidopsis thaliana. Journal of the Torrey Botanical Society 138(4), 409-417. doi:10.3159/TORREY-D-11-00040.1. JSTOR 41475107.
ग्रन्थसूची
- Strong, Donald R.; Ray, Thomas S. (1 January 1975). "Host Tree Location Behavior of a Tropical Vine (Monstera gigantea) by Skototropism". Science. 190 (4216): 804–806. Bibcode:1975Sci...190..804S. doi:10.1126/science.190.4216.804. JSTOR 1741614. S2CID 84386403.
बाहरी संबंध
 Media related to Phototropism at Wikimedia Commons
Media related to Phototropism at Wikimedia Commons- Time lapse films, Plants-In-Motion