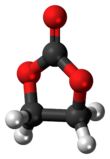
एथिलीन कार्बोनेट
|
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
1,3-Dioxolan-2-one | |||
| Other names
ethylene glycol carbonate[1]
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Number |
| ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
| |||
| |||
| Properties | |||
| C3H4O3 | |||
| Molar mass | 88.062 g·mol−1 | ||
| Appearance | White to yellow solid | ||
| Density | 1.3210 g/cm3 | ||
| Melting point | 34 to 37 °C (93 to 99 °F; 307 to 310 K) | ||
| Boiling point | 243.0 °C (469.4 °F; 516.1 K) | ||
| Soluble | |||
| Hazards[2] | |||
| GHS labelling: | |||
 
| |||
| Warning | |||
| H302, H319, H373 | |||
| P260, P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P310, P312, P314, P321, P330, P332+P313, P337+P313, P362, P403+P233, P405, P501 | |||
| Flash point | 150 °C (302 °F; 423 K) | ||
| 465 °C (869 °F; 738 K) | |||
| Safety data sheet (SDS) | External MSDS | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
एथिलीन कार्बोनेट (कभी-कभी संक्षिप्त रूप में EC) एक कार्बनिक यौगिक है जिसका सूत्र (CH2O)2CO है। इसे इथाइलीन ग्लाइकॉल और कार्बोनिक अम्ल के चक्रीय यौगिक कार्बोनेट एस्टर के रूप में वर्गीकृत किया गया है। कमरे के तापमान (25 °C) पर एथिलीन कार्बोनेट एक पारदर्शी क्रिस्टलीय ठोस, व्यावहारिक रूप से गंधहीन और रंगहीन, और पानी में कुछ विलेय होता है। द्रव अवस्था में (एमपी 34-37 °C) में यह रंगहीन, गंधहीन तरल है।[3]
उत्पादन और प्रतिक्रियाएं
इथिलीन ऑक्साइड और कार्बन डाईऑक्साइड के मध्य प्रतिक्रिया से एथिलीन कार्बोनेट का उत्पादन होता है। प्रतिक्रिया विभिन्न प्रकार के धनायनों और परिसरों द्वारा उत्प्रेरित होती है:[4][5]
- (CH2)2O + CO2 → (CH2O)2CO
प्रयोगशाला में, 150 °C के तापमान और 3 kPa के दाब पर उत्प्रेरक के रूप मेंज़िंक ऑक्साइड का उपयोग करके यूरिया और एथिलीन ग्लाइकॉल की प्रतिक्रिया से एथिलीन कार्बोनेट को भी उत्पादन किया जा सकता है:[6]
- (NH2)2CO + HO−CH2CH2−OH → (CH2O)2CO + 2 NH3
एथिलीन कार्बोनेट (और प्रोपलीन कार्बोनेट) को मेथनॉल द्वारा ट्रान्सएस्टरीफिकेशन के माध्यम से डाइमिथाइल कार्बोनेट (एक उपयोगी विलायक और एक हल्का मिथाइलेटिंग एजेंट) में परिवर्तित किया जा सकता है:
- C2H4CO3 + 2 CH3OH → CH3OCO2CH3 + HOC2H4OH
मेथनॉल द्वारा एथिलीन कार्बोनेट के ट्रांसएस्टरफिकेशन को एक उच्च सतह क्षेत्र (ताप अपशल्कित) ग्रेफाइटिक कार्बन नाइट्राइड (g-C3N4) पदार्थ द्वारा उत्प्रेरित किया जा सकता है। यह विधि धातु या हलाइड संदूषण की संभावना को कम करती है, और 393 K के तापमान पर 60% तक उपज प्रदान कर सकती है।[7]
डाइमिथाइल कार्बोनेट को फॉस्जीन-विकल्प, डिफेनिल कार्बोनेट के समान ही ट्रांसएस्टरीकृत किया जा सकता है:[4]
- CH3OCO2CH3 + 2 PhOH → PhOCO2Ph + 2 MeOH
अनुप्रयोग
एथिलीन कार्बोनेट का उपयोग ध्रुवीय विलायक के रूप में 4.9 D के आणविक द्विध्रुव क्षण के साथ किया जाता है,[8][9] जो प्रोपलीन कार्बोनेट की तुलना में केवल 0.1D कम है।
इसका उपयोग लिथियम बैटरी और लिथियम आयन बैटरी में इलेक्ट्रोलाइट के उच्च विद्युतशीलता घटक के रूप में किया जा सकता है। श्यानता और गलनांक को कम करने के लिए उन इलेक्ट्रोलाइट्स में डायथाइल कार्बोनेट, एथिल मिथाइल कार्बोनेट, डाइमिथाइल कार्बोनेट और मिथाइल एसीटेट जैसे अन्य घटक जोड़े जा सकते हैं।[10]
एक विशिष्ट सोडियम अंतर्निवेशन प्रकार की बैटरी एक इलेक्ट्रोलाइट का उपयोग करेगी जिसमें सम्मिलित हैं: फ्लोरोएथिलीन कार्बोनेट (FEC) (99%), धात्विक Na (99.9%), और एथिलीन कार्बोनेट और डायथाइल कार्बोनेट (EC/DEC) में 1.0 M सोडियम पर्क्लोरेट (NaClO4) विलयन, 1:1 v/v% बैटरी-ग्रेड, FEC के साथ मिश्रित (वजन के अनुसार 10%)।[11]
एथिलीन कार्बोनेट का उपयोग प्लास्टिसाइज़र के रूप में और विनाइलीन कार्बोनेट के अग्रदूत के रूप में भी किया जाता है, जिसका उपयोग पॉलिमर और कार्बनिक संश्लेषण में किया जाता है।
ऑक्सालिल क्लोराइड का उत्पादन व्यावसायिक रूप से एथिलीन कार्बोनेट से किया जाता है। फोटोक्लोरिनेशन से टेट्राक्लोरोएथिलीन कार्बोनेट देता है:[12]
- C2H4O2CO + 4 Cl2 → C2Cl4O2CO + 4 HCl
टेट्राक्लोराइड को अमीन उत्प्रेरकों द्वारा ऑक्सीलिल क्लोराइड में निम्नीकृत किया जाता है।
- C2Cl4O2CO → C2O2Cl2 + COCl2
यह भी देखें
- प्रोपलीन कार्बोनेट
- विनीलीन कार्बोनेट
- डायथाइल कार्बोनेट
- ट्राइमेथिलीन कार्बोनेट
- कार्बोनेट एस्टर
- एथिलीन ट्राइथियोकार्बोनेट
बाहरी संबंध
संदर्भ
- ↑ "CID 7303 -- PubChem Compound Summary". pubchem.ncbi.nlm.nih.gov. Retrieved 2008-03-15.
- ↑ "C&L Inventory". echa.europa.eu.
- ↑ JEFFSOL ETHYLENE CARBONATE Archived 2012-07-22 at the Wayback Machine catalog entry at www.huntsman.com. Accessed on 2010-02-18.
- ↑ 4.0 4.1 Buysch, Hans-Josef (2012). "Carbonic Esters". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_197.
- ↑ Comerford, James W.; Ingram, Ian D. V.; North, Michael; Wu, Xiao (2015). "पांच-सदस्यीय छल्ले वाले चक्रीय कार्बोनेट के संश्लेषण के लिए टिकाऊ धातु-आधारित उत्प्रेरक". Green Chemistry. 17 (4): 1966–1987. doi:10.1039/C4GC01719F. S2CID 96255105.
- ↑ Bhalchandra M. Bhanage; Shin-ichiro Fujita (2003). "यूरिया आधारित डाइमिथाइल कार्बोनेट संश्लेषण के लिए एक महत्वपूर्ण कदम के रूप में एथिलीन कार्बोनेट में यूरिया और एथिलीन ग्लाइकॉल का ट्रांसएस्टरीकरण". Green Chemistry. 5 (4): 429–432. doi:10.1039/b304182d. S2CID 97286880.
- ↑ Gan, Yu-Lin; Hu, Xiao-Qian; Wen, Lin-Zhi; Xu, Jie; Xue, Bing (2020-02-24). "ग्रेफाइटिक कार्बन नाइट्राइड सामग्री द्वारा उत्प्रेरित एथिलीन कार्बोनेट के ट्रांसएस्टरीफिकेशन के माध्यम से डाइमिथाइल कार्बोनेट का धातु-मुक्त संश्लेषण". New Journal of Chemistry (in English). 44 (8): 3215–3223. doi:10.1039/C9NJ04530A. ISSN 1369-9261. S2CID 213404364.
- ↑ Ralph P. Seward; Ernest C. Vieira (1958). "एथिलीन कार्बोनेट के ढांकता हुआ स्थिरांक और पानी, मेथनॉल, बेंजीन और प्रोपलीन कार्बोनेट में एथिलीन कार्बोनेट के समाधान". J. Phys. Chem. 62 (1): 127–128. doi:10.1021/j150559a041.
- ↑ Richard Payne; Ignatius E. Theodorou (1972). "ढांकता हुआ गुण और एथिलीन कार्बोनेट और प्रोपलीन कार्बोनेट में छूट". J. Phys. Chem. 76 (20): 2892–2900. doi:10.1021/j100664a019.
- ↑ E. R. Logan; J. R. Dahn (2018). "एस्टर युक्त ली-आयन बैटरी इलेक्ट्रोलाइट्स के भौतिक गुणों का अध्ययन". J. Electrochem. Soc. 165 (2): A21–A30. doi:10.1149/2.0271802jes. OSTI 1469344.
- ↑ Youssef Sayed, Sayed; Kalisvaart, W. Peter; Olsen, Brian; Luber, Erik; Buriak, Jillian (2020-07-13). "सिलिकॉन के साथ मिश्रित करके सोडियम-आयन बैटरियों में टिन एनोड्स को स्थिर करना". figshare (in English). doi:10.26434/chemrxiv.12642956.v1. S2CID 243291502. Retrieved 2021-02-24.
- ↑ Pfoertner, Karl-Heinz (2000). "Photochemistry". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_573.