सेल आसंजन
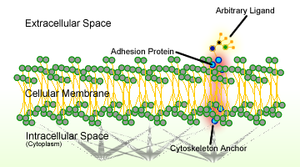
कोशिका आसंजन वह प्रक्रिया है जिसके द्वारा कोशिकाएँ कोशिका की सतह के विशेष अणुओं के माध्यम से निकटवर्ती कोशिकाओं से संपर्क करती हैं और जुड़ती हैं। यह प्रक्रिया या तो कोशिका संधि या अप्रत्यक्ष अन्योन्य क्रिया जैसे कोशिका सतहों के बीच सीधे संपर्क के माध्यम से हो सकती है, जहां कोशिकाएं निकट के बाह्य आव्यूह से जुड़ती हैं, जेल जैसी संरचना जिसमें कोशिकाओं द्वारा उनके बीच रिक्त स्थान में अणुओं को छोड़ दिया जाता है।[1] कोशिका आसंजन कोशिका आसंजन अणुओं के बीच अन्योन्य क्रिया से होता है,[2] कोशिका की सतह पर स्थित ट्रांसमेम्ब्रेन प्रोटीन है। कोशिका आसंजन कोशिकाओं को विभिन्न विधियों से जोड़ता है और निकट के परिवर्तनों का पता लगाने और प्रतिक्रिया देने के लिए कोशिकाओं के संकेत पारगमन में सम्मिलित हो सकता है।[1][3] इस प्रकार से कोशिका आसंजन द्वारा विनियमित अन्य कोशिकीय प्रक्रियाओं में बहुकोशिकीय जीवों में कोशिका अभिगमन और ऊतक विकास सम्मिलित हैं।[4] कोशिका आसंजन में परिवर्तन महत्वपूर्ण कोशिकीय प्रक्रियाओं को बाधित कर सकता है और कैंसर और गठिया सहित विभिन्न प्रकार की रोगों को जन्म दे सकता है[5][6][7] रोग उत्पन्न करने के लिए जीवाणु या विषाणु जैसे संक्रामक जीवों के लिए कोशिका आसंजन भी आवश्यक है।[8][9]
सामान्य तंत्र
इस प्रकार से सीएएम को चार प्रमुख वर्गों में वर्गीकृत किया गया है: इंटेग्रिन, इम्युनोग्लोबुलिन अधिकुल|इम्युनोग्लोबुलिन (Ig) अधिकुल, कैडरिन और चयनकर्ता[2] कैडरिन और आईजीएसएफ समलैंगिकतापूर्ण सीएएम हैं, क्योंकि वे सीधे ही प्रकार के सीएएम को दूसरे कोशिका पर बांधते हैं, जबकि इंटीग्रिन और सेलेक्टिन हेटेरोफिलिक सीएएम हैं जो विभिन्न प्रकार के सीएएम से जुड़ते हैं।[2] इनमें से प्रत्येक आसंजन अणु का अलग कार्य होता है और विभिन्न लिगेंड को पहचानता है। कोशिका आसंजन में दोष सामान्यतः सीएएम की अभिव्यक्ति में दोषों के कारण होता है।
बहुकोशिकीय जीवों में, सीएएम के बीच बंधन कोशिकाओं को दूसरे का एडहेरेन्स करने की अनुमति देते हैं और कोशिका संधि नामक संरचनाएं बनाते हैं। इस प्रकार से उनके कार्यों के अनुसार, कोशिका संधि को इस प्रकार वर्गीकृत किया जा सकता है:[1]
- स्थिरक संधि (एडहेरेन्स संधि, डेस्मोसोम और हेमाइड्समोसोम), जो कोशिकाओं को साथ बनाए रखते हैं और कोशिकाओं के बीच संपर्क को दृढ करते हैं।
- सम्मिलित संधि (अच्छिद्र संधि), जो कोशिका-कोशिका संपर्क के माध्यम से कोशिकाओं के बीच अंतराल को सील करते हैं, प्रसार के लिए अभेद्य अवरोध बनाते हैं
- चैनल बनाने वाले संधि (रिक्ति संयोजन), जो आसन्न कोशिकाओं के साइटोप्लाज्म को जोड़ते हैं जिससे कोशिकाओं के बीच अणुओं के परिवहन की अनुमति मिलती है
- संकेत-प्रसारण संधि, जो तंत्रिका तंत्र में अन्तर्ग्रथन हो सकते हैं
इस प्रकार से वैकल्पिक रूप से, कोशिका संधि को कोशिका के साथ अन्योन्य क्रिया करने के अनुसार दो मुख्य प्रकारों में वर्गीकृत किया जा सकता है: जैसे कि कोशिका-कोशिका संधि, मुख्य रूप से कैडरिन द्वारा मध्यस्थ, और कोशिका-आव्यूह संधि, मुख्य रूप से इंटीग्रिन द्वारा मध्यस्थ आदि।
कोशिका-कोशिका संधि
अतः कोशिका-कोशिका संधि विभिन्न रूपों में हो सकते हैं। एडहेरेन्स संधि और डेस्मोसोम जैसी कोशिकाओं के बीच स्थिरक संधि में, स्थित मुख्य सीएएम कैडरिन हैं। सीएएम का यह वर्ग झिल्ली प्रोटीन है जो अपने बाह्य प्रांत के माध्यम से कोशिका-कोशिका आसंजन में मध्यस्थता करता है और उचित रूप से कार्य करने के लिए बाह्य कोशिकीय Ca2+ आयनों की आवश्यकता होती है।[2] कैडेरिन आपस में समलैंगिकतापूर्ण बंधन बनाते हैं, जिसके परिणामस्वरूप समान प्रकार की कोशिकाएं एक साथ चिपक जाती हैं और चयनात्मक कोशिका आसंजन को जन्म दे सकती हैं, जिससे कशेरुक कोशिकाओं को संनिर्मित ऊतकों में एकत्रित होने की अनुमति मिलती है।[1] कैडरिन बहुकोशिकीय जीवों में कोशिका-कोशिका आसंजन और कोशिका संकेतन के लिए आवश्यक हैं और इन्हें दो प्रकारों में विभाजित किया जा सकता है: शास्त्रीय कैडरिन और गैर-शास्त्रीय कैडरिन।[2]
एडहेरेंस संधि
इस प्रकार से एडहेरेंस संधि मुख्य रूप से ऊतकों के आकार को बनाए रखने और कोशिकाओं को साथ रखने के लिए कार्य करते हैं। संधि का एडहेरेन्स करने में, निकटवर्ती कोशिकाओं के बीच कैडरिन अपने बाह्य प्रांत के माध्यम से अन्योन्य क्रिया करते हैं, जो उनके बाह्य प्रांत में संरक्षित कैल्शियम-संवेदनशील क्षेत्र साझा करते हैं। जब यह क्षेत्र Ca2+ आयनों के संपर्क में आता है, तो कैडेरिन के बाह्यकोशिकीय प्रांत समलैंगिकतापूर्ण बंधन से गुजरने के लिए निष्क्रिय प्रोटीन गतिशीलता से अधिक कठोर संरचना में निर्माणात्मक परिवर्तन से गुजरते हैं। कैडरिन के अंतःकोशिकी प्रांत भी अत्यधिक संरक्षित हैं, क्योंकि वे कैटेनिन नामक प्रोटीन से बंधते हैं, कैटेनिन-कैडरिन संकुल बनाते हैं। ये प्रोटीन संकुल कैडरिन को एक्टिन फिलामेंट से जोड़ते हैं। इस प्रकार से कोशिका-कोशिका आसंजन को स्थिर करने के लिए संधि का एडहेरेन्स करने के लिए एक्टिन फिलामेंट के साथ यह संयुग्मन आवश्यक है।[10][11][12] एक्टिन फिलामेंट के साथ सहभागिता कैडरिनों के क्लस्टरिंग को भी बढ़ावा दे सकती है, जो एडहेरेन्स संधि की समन्वायोजन में सम्मिलित हैं। यह तब से है जब कैडरिन क्लस्टर एक्टिन फिलामेंट बहुलकीकरण को बढ़ावा देते हैं, जो इसके स्थान पर संधि पर बनने वाले कैडरिन-कैटेनिन संकुल से जुड़कर एडहेरेन्स संधि की समन्वायोजन को बढ़ावा देता है।[citation needed]
डेसमोसोम
अतः डेसमोसोम संरचनात्मक रूप से एडहेरेन्स संधि के समान होते हैं परन्तु विभिन्न घटकों से बने होते हैं। शास्त्रीय कैडरिन के अतिरिक्त, गैर-शास्त्रीय कैडरिन जैसे डेस्मोग्लिन और डेस्मोकोलिन्स आसंजन अणुओं के रूप में कार्य करते हैं और वे एक्टिन फिलामेंट के अतिरिक्त मध्यवर्ती फिलामेंट से जुड़े होते हैं।[13] डेस्मोसोम में कोई कैटेनिन स्थित नहीं है क्योंकि डेस्मोसोमल कैडरिन के अंतःकोशिकी प्रांत डेस्मोसोमल प्लाक प्रोटीन के साथ अन्योन्य क्रिया करते हैं, जो डेस्मोसोम में मोटी साइटोप्लास्मिक प्लेक बनाते हैं और कैडरिन को मध्यम फिलामेंट से जोड़ते हैं।[14] डेसमोसोम नम्य परन्तु नम्य मध्यवर्ती तंतुओं पर बल को उतारकर यांत्रिक तनाव को शक्ति और प्रतिरोध प्रदान करता है, कुछ ऐसा जो कठोर एक्टिन तंतुओं के साथ नहीं हो सकता है।[13] यह डेसमोसोम को उन ऊतकों में महत्वपूर्ण बनाता है जो उच्च स्तर के यांत्रिक तनाव का सामना करते हैं, जैसे कि हृदय की मांसपेशी और उपकला, और बताते हैं कि यह इस प्रकार के ऊतकों में प्रायः क्यों दिखाई देता है।
अच्छिद्र संधि
इस प्रकार से अच्छिद्र संधि सामान्यतः एपिथेलियम और अंतर्कलीय ऊतकों में स्थित होते हैं, जहां वे अंतराल को सील करते हैं और इन ऊतकों में विलेय और बाह्य तरल पदार्थों के पैराकोशिकीय परिवहन को नियंत्रित करते हैं जो बाधाओं के रूप में कार्य करते हैं।[15] अतः क्लॉडिन्स, अधिविष्ट और ट्राईसेल्युलिन सहित ट्रांसमेम्ब्रेन प्रोटीन द्वारा अच्छिद्र संधि का निर्माण किया जाता है, जो समलैंगिकतापूर्ण विधि से आसन्न झिल्लियों पर दूसरे से निकटता से बंधते हैं।[1] स्थिरक संधि के समान, इन अच्छिद्र संधि प्रोटीनों के अंतःकोशिकी प्रांत मचान प्रोटीन से बंधे होते हैं जो इन प्रोटीनों को गुच्छों में रखते हैं और अच्छिद्र संधि की संरचना को बनाए रखने के लिए उन्हें एक्टिन फिलामेंट से जोड़ते हैं।[16] क्लॉडिन्स, अच्छिद्र संधि के निर्माण के लिए आवश्यक, पराकोशिकीय छिद्र बनाते हैं जो अच्छिद्र संधि में विशिष्ट आयनों के चयनात्मक मार्ग की अनुमति देते हैं जिससे बाधा चयनित रूप से पारगम्य हो जाती है।[15]
अंतराल संधि
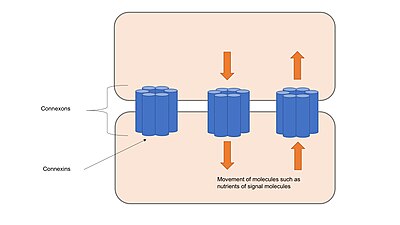
इस प्रकार से अंतराल संधि संपर्क नामक चैनलों से बने होते हैं, जिसमें ट्रांसमेम्ब्रेन प्रोटीन होते हैं, जिन्हें कनेक्सॉन कहा जाता है, जो छह के समूहों में गुच्छित होते हैं।[17] अतः जब वे संपर्क में आते हैं और एक दूसरे के साथ संरेखित होते हैं, तो आसन्न कोशिकाओं के संबंध निरंतर चैनल बनाते हैं। ये चैनल दो आसन्न कोशिकाओं के साइटोप्लाज्म के बीच आयनों और छोटे अणुओं के परिवहन की अनुमति देते हैं, इसके अतिरिक्त कोशिकाओं को साथ रखते हैं और स्थिरक संधि या अच्छिद्र संधि जैसी संरचनात्मक स्थिरता प्रदान करते हैं।[1] अंतराल संधि चैनल विशिष्ट आयनों के लिए चयनित रूप से पारगम्य होते हैं, जिसके आधार पर सयोजित संपर्क बनाते हैं, जो जैव रासायनिक सोपानी में सम्मिलित अणुओं के हस्तांतरण को विनियमित करके अंतराल संधि को कोशिका संकेतन में सम्मिलित करने की अनुमति देता है।[18] चैनल कई अलग-अलग उत्तेजनाओं का उत्तर दे सकते हैं और गतिशील रूप से या तो तीव्रता से तंत्र द्वारा नियंत्रित होते हैं, जैसे कि वोल्टता-गेटेड आयन चैनल, या मंद तंत्र द्वारा, जैसे अंतराल संधि में स्थित चैनलों की संख्या को बदलना।[17]
सिलेक्टिन द्वारा मध्यस्थता वाला एडहेसन
इस प्रकार से सेलेक्टिन संचार प्रणाली में होने वाले क्षणिक कोशिका-कोशिका आसंजन में सम्मिलित विशेष सीएएम का वर्ग है। वे मुख्य रूप से श्वेत रक्त कोशिकाओं (ल्यूकोसाइट्स) के संचलन में श्वेत रक्त कोशिकाओं को चयन के प्रतिवर्ती बंधनों के माध्यम से अंतःकला कोशिकाओं पर वलित करने की अनुमति देकर मध्यस्थता करते हैं।[19] अतः सेलेक्टिन्स हेट्रोफिलिक बंधन से गुजरते हैं, क्योंकि इसका बाह्य प्रांत अन्य चयनकर्ताओं के अतिरिक्त आसन्न कोशिकाओं पर कार्बोहाइड्रेट से बंधता है, जबकि इसे कार्य करने के लिए Ca2+ कीआयनों की भी आवश्यकता होती है, कैडेरिन के समान।[1] अंतःकला कोशिकाओं के लिए ल्यूकोसाइट का कोशिका-कोशिका आसंजन प्रतिरक्षा प्रतिक्रिया के लिए महत्वपूर्ण है क्योंकि ल्यूकोसाइट इस तंत्र के माध्यम से संक्रमण या चोट की साइटों की यात्रा कर सकते हैं।[20] इन साइटों पर, वलयित श्वेत रक्त कोशिकाओं पर इंटीग्रिन सक्रिय होते हैं और स्थानीय अंतःकला कोशिकाओं को दृढ़ता से बांधते हैं, जिससे ल्यूकोसाइट को विस्थापित करना संवृत हो जाता है और अंतःकला अवरोध में स्थानांतरित हो जाता है।[20]
इम्युनोग्लोबुलिन अधिकुल के सदस्यों द्वारा मध्यस्थता किए गए आसंजन
इस प्रकार से इम्युनोग्लोबुलिन अधिकुल (आईजीएसएफ) शरीर में प्रोटीन के सबसे बड़े अधिकुल में से है और इसमें विभिन्न कार्यों में सम्मिलित कई विविध सीएएम सम्मिलित हैं। इन ट्रांसमेम्ब्रेन प्रोटीनों में या से अधिक इम्युनोग्लोबुलिन प्रांत जैसे प्रांत उनके बाह्य प्रांत में होते हैं और आसन्न कोशिकाओं पर लिगेंड के साथ कैल्शियम-स्वतंत्र बंधन से गुजरते हैं।[21] अतः कुछ आईजीएसएफ सीएएम, जैसे तंत्रिका कोशिका आसंजन अणु (एनसीएएम), समलैंगिकतापूर्ण बंधन का प्रदर्शन कर सकते हैं, जबकि अन्य, जैसे कि अन्तः कोशिकीय आसंजन अणु (Iसीएएमs) या वीसीएएम-1 (वीसीएएम) कार्बोहाइड्रेट या इंटीग्रिन जैसे अणुओं के साथ हेट्रोफिलिक बंधन से गुजरते हैं।[22] आईसीएएम और वीसीएएम दोनों को संवहनी अंतःकला कोशिकाओं पर व्यक्त किया जाता है और वे ल्यूकोसाइट पर इंटीग्रिन के साथ अन्योन्य क्रिया करते हैं ताकि ल्यूकोसाइट बंधन और अंतःकला अवरोध के पार इसकी गति में सहायता मिल सके।[22]
कोशिका-आव्यूह संधि
अतः इस प्रकार से कोशिकाएं अपने निकट के बाह्य अंतरिक्ष में अणुओं को मुक्त करके बाह्य आव्यूह बनाती हैं। कोशिकाओं में विशिष्ट सीएएम होते हैं जो बाह्य आव्यूह में अणुओं को बांधते हैं और आव्यूह को अंतःकोशिकी कोशिकापंजर से जोड़ते हैं।[1] कोशिका बाह्य आव्यूह कोशिकाओं को ऊतकों में व्यवस्थित करते समय समर्थन के रूप में कार्य कर सकता है और सीएएम से बंधे होने पर अंतःकोशिकी मार्ग को सक्रिय करके कोशिका संकेतन में भी सम्मिलित हो सकता है।[2] कोशिका-आव्यूह संधि मुख्य रूप से इंटीग्रिन द्वारा मध्यस्थ होते हैं, जो फर्म आसंजन बनाने के लिए कैडरिन जैसे क्लस्टर भी होते हैं। इंटीग्रिन अलग-अलग α और β उप इकाई द्वारा निर्मित ट्रांसमेम्ब्रेन विषमद्वितय हैं, दोनों उप इकाई अलग-अलग प्रांत संरचनाओं के साथ हैं।[23] अतः इंटीग्रिन दोनों दिशाओं में संकेत कर सकते हैं: अंदर-बाहर संकेतन, अंतःकोशिकी प्रांत को संशोधित करने वाले अंतःकोशिकी संकेत, उनके लिगेंड के लिए इंटीग्रिन की आत्मीयता को विनियमित कर सकते हैं, जबकि बाहरी-इन संकेतन, कोशिका बाह्य प्रांत के लिए बाध्यकारी बाह्य लिगेंड, इंटीग्रिन में निर्माणात्मक परिवर्तन को प्रेरित कर सकते हैं और संकेतन सोपानी आरंभ कर सकते हैं।[23] इंटीग्रिन के कोशिका बाह्य प्रांत हेटेरोफिलिक बंधन के माध्यम से अलग-अलग लिगेंड से बंध सकते हैं, जबकि अंतःकोशिकी प्रांत या तो मध्यम फिलामेंट से जुड़े हो सकते हैं, हेमाइड्समोसोम बनाते हैं, या एक्टिन फिलामेंट से नाभीय आसंजन बनाते हैं।[24]
हेमाइड्समोसोम
इस प्रकार से हेमाइड्समोसोम में, इंटीग्रिन बेसल पटल में लैमिनिन नामक बाह्य आव्यूह प्रोटीन से जुड़ते हैं, जो उपकला कोशिकाओं द्वारा स्रावित बाह्य आव्यूह है।[1] इंटिग्रिन कोशिका बाह्य आव्यूह को केरातिन मध्यम फिलामेंट से श्रेणीकरण करते हैं, जो एडेप्टर प्रोटीन जैसे पेलेटिन और बीपी230 के माध्यम से इंटीग्रिन के अंतःकोशिकी प्रांत के साथ अन्योन्य क्रिया करता है।[25] बाह्य आव्यूह के माध्यम से अप्रत्यक्ष रूप से उन्हें साथ जोड़कर उपकला कोशिकाओं की संरचनात्मक स्थिरता बनाए रखने में हेमाइड्समोसोम महत्वपूर्ण हैं।
नाभीय आसंजन
इस प्रकार से नाभीय आसंजनों में, इंटीग्रिन फ़ाइब्रोनेक्टिन, बाह्य आव्यूह में घटक, कोशिकाओं के भीतर एक्टिन फिलामेंट को जोड़ते हैं।[24] एडेप्टर प्रोटीन, जैसे टैलिन (प्रोटीन), विनकुलिन, α-एक्टिनिनऔर फिलामिन, इंटीग्रिन के अंतःकोशिकी प्रांत पर जटिल बनाते हैं और एक्टिन फिलामेंट से जुड़ते हैं।[26] अतः एक्टिन फिलामेंट को इंटीग्रिन से जोड़ने वाला यह मल्टी-प्रोटीन संकुल संकेतन संकुल की समन्वायोजन के लिए महत्वपूर्ण है जो कोशिका के विकास और कोशिका की गतिशीलता के लिए संकेत के रूप में कार्य करता है।[26]
अन्य जीव
यूकेरियोट्स
इस प्रकार से पादप कोशिकाएं एक-दूसरे से निकटता से जुड़ी होती हैं और प्लाज्माडेस्मैटिक के माध्यम से जुड़ी होती हैं, चैनल जो पादप कोशिका की दीवारों को पार करते हैं और आसन्न पादप कोशिकाओं के साइटोप्लाज्म को जोड़ते हैं।[27] अतः अणु जो या तो पोषक तत्व हैं या विकास के लिए आवश्यक संकेत हैं, या तो निष्क्रिय रूप से या चयनित रूप से, प्लास्मोडेस्माटा के माध्यम से पौधों की कोशिकाओं के बीच।[27]
इस प्रकार से प्रोटोजोआ विभिन्न विशिष्टताओं वाले कई आसंजन अणुओं को व्यक्त करते हैं जो उनके पोषी कोशिकाओं की सतहों पर स्थित कार्बोहाइड्रेट से जुड़ते हैं।[28] कोशिका-कोशिका आसंजन रोगजनक प्रोटोज़ोन के लिए महत्वपूर्ण है ताकि वे अपने पोषी कोशिकाओं में प्रवेश कर सकें। रोगजनक प्रोटोजोआ का उदाहरण मलेरिया परजीवी (प्लाज्मोडियम फाल्सीपेरम) है, जो लिवर कोशिकाओं के बंधन के लिए सर्कमस्पोरोज़ोइट प्रोटीन नामक आसंजन अणु का उपयोग करता है,[29] और अन्य आसंजन अणु जिसे लाल रक्त कोशिकाओं के बंधन के लिए मेरोजाइट सतह प्रोटीन कहा जाता है।[30]
अतः रोगजनक कवक बाह्य आव्यूह में पोषी कोशिकाओं या फाइब्रोनेक्टिन को प्रोटीन-प्रोटीन या प्रोटीन-कार्बोहाइड्रेट अन्योन्य क्रिया के माध्यम से संलग्न करने के लिए अपनी कोशिका दीवार पर स्थित फंगल चिपकने का उपयोग करते हैं।[31][32]
प्रोकैरियोट्स
इस प्रकार से प्रोकैरियोट्स में कोशिका आसंजन के लिए इसके पिलुस (फिम्ब्रिया (बैक्टीरियोलॉजी)) और कशाभिका का उपयोग करने के अतिरिक्त, उनकी कोशिका की सतह पर अधेसिन अणु होते हैं जिन्हें जीवाणु कहा जाता है।[8] अधेसिन पोषी कोशिका सतहों पर स्थित विभिन्न प्रकार के लिगेंड और बाह्य आव्यूह में घटकों को भी पहचान सकते हैं। ये अणु पोषी विशिष्टता को भी नियंत्रित करते हैं और अपने लिगेंड के साथ अन्योन्य क्रिया के माध्यम से सभी कोशिकाओं को संक्रमित (ऊतक-या कोशिका-विशिष्ट अन्योन्य क्रिया) को नियंत्रित करते हैं।[33]
विषाणु
अतः विषाणुओं में आसंजन अणु भी होते हैं जो पोषी कोशिकाओं को वायरल बंधन के लिए आवश्यक होते हैं। उदाहरण के लिए, इंफ्लुएंजा विषाणु की सतह पर हेमाग्लूटिनिन होता है जो पोषी कोशिका की सतह के अणुओं पर चीनी सियालिक एसिड की पहचान के लिए आवश्यक होता है।[34] एचआईवी में अधेसिन अणु होता है जिसे जीपी120 कहा जाता है जो इसके लिगैंड सीडीसीएच 4 से जुड़ता है, जो लिम्फोसाइट पर व्यक्त होता है।[35] विषाणु पोषी कोशिकाओं में प्रवेश करने के लिए कोशिका संधि के घटकों को भी लक्षित कर सकते हैं, जो तब होता है जब हेपेटाइटिस सी विषाणु यकृत कोशिकाओं में प्रवेश करने के लिए अच्छिद्र संधि में अधिविष्ट और क्लाउडिन को लक्षित करता है।[9]
नैदानिक प्रभाव
इस प्रकार से कोशिका आसंजन की शिथिलता कैंसर रूप-परिवर्तन के समय होती है। विक्षेपी अर्बुद कोशिकाओं में कोशिका-कोशिका आसंजन की हानि उन्हें अपने मूल स्थान से बचने और संचार प्रणाली के माध्यम से फैलने की अनुमति देता है।[5] कैंसर में निर्विनियमन सीएएम का उदाहरण कैडरिन हैं, जो या तो आनुवंशिक उत्परिवर्तन या अन्य अर्बुदीय संकेतन अणुओं द्वारा निष्क्रिय होते हैं, जिससे कैंसर कोशिकाएं विस्थापित हो जाती हैं और अधिक आक्रामक हो जाती हैं।[6] अन्य सीएएम, जैसे सेलेक्टिंस और इंटीग्रिन, अन्य दूर के ऊतकों के अंतःकला कोशिकाओं के साथ संचार प्रणाली में विक्षेपी अर्बुद कोशिकाओं को स्थानांतरित करने के बीच कोशिका-कोशिका अन्योन्य क्रिया की मध्यस्थता करके विक्षेपी की सुविधा प्रदान कर सकते हैं।[36] सीएएम और कैंसर विक्षेपी के बीच संबंध के कारण, ये अणु कैंसर के उपचार के लिए संभावित चिकित्सीय लक्ष्य हो सकते हैं।
अतः विशिष्ट आसंजन अणुओं को व्यक्त करने में असमर्थता के कारण अन्य मानव आनुवंशिकी रोग भी हैं। उदाहरण ल्यूकोसाइट आसंजन की कमी-I (लैड-I) है, जहां β2 इंटीग्रिन उप इकाई की अभिव्यक्ति कम या लुप्त जाती है।[37] इससे β2 इटीग्रिन विषमद्वितय की अभिव्यक्ति कम हो जाती है, जो संक्रमण से लड़ने के लिए ल्यूकोसाइट को सूजन वाले स्थानों पर अंतःकला दीवार से द्रढ़ता से जुड़ने के लिए आवश्यक होते हैं।[38] लैड-I रोगियों के ल्यूकोसाइट अंतःकला कोशिकाओं का एडहेरेन्स करने में असमर्थ हैं और रोगी संक्रमण के गंभीर प्रकरण प्रदर्शित करते हैं जो जीवन के लिए संकट हो सकते हैं।
पेम्फीगस नामक स्व-प्रतिरक्षी रोग भी कोशिका आसंजन की हानि के कारण होती है, क्योंकि यह स्वप्रतिपिंडों के परिणामस्वरूप किसी व्यक्ति के अपने डेसमोसोमल कैडरिन को लक्षित करती है जो एपिडर्मल कोशिकाओं को एक दूसरे से अलग करती है और त्वचा के फफोले का कारण बनती है।[39]
इस प्रकार से बैक्टीरिया, विषाणु और प्रोटोजोआ सहित रोगजनक सूक्ष्मजीवों को पूर्व संक्रमित करने और रोगों का कारण बनने के लिए पोषी कोशिकाओं का एडहेरेन्स करना पड़ता है। आसंजन अणुओं को या तो रोगज़नक़ या पोषी कोशिका पर लक्षित करके संक्रमण को रोकने के लिए प्रति-आसंजन चिकित्सा का उपयोग किया जा सकता है।[40] आसंजन अणुओं के उत्पादन को बदलने के अतिरिक्त, प्रतिस्पर्धी अवरोधक जो कोशिकाओं के बीच बंधन को रोकने के लिए अधेसिन अणुओं को बांधते हैं, उन्हें अधेसिन एजेंटों के रूप में कार्य करने के लिए भी उपयोग किया जा सकता है।[41]
यह भी देखें
- कोशिका संचार (जीव विज्ञान)
- उपकला
- साइटोस्केलेटन
- विभेदक आसंजन परिकल्पना
- तंत्रिका विकास में कोशिका आसंजनों की भूमिका
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Morgan, David; Raff, Martin; Roberts, Keith; Walter, Peter (2014). कोशिका का आणविक जीवविज्ञान। (6th ed.). Garland Science. ISBN 9780815344322.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 Lodish, Harvey; Berk, Arnold; Matsudaira, Paul; Kaiser, Chris A.; Krieger, Monty; Scott, Matthew P.; Zipursky, Lawrence; Darnell, James (2003). आणविक कोशिका जीव विज्ञान (5th ed.). W.H. Freeman. ISBN 978-0716743668.
- ↑ Gumbiner, Barry M. (1996). "Cell Adhesion: The Molecular Basis of Tissue Architecture and Morphogenesis". Cell. 84 (3): 345–357. doi:10.1016/S0092-8674(00)81279-9. PMID 8608588. S2CID 13443584.
- ↑ Sumigray, Kaelyn D.; Lechler, Terry (2015). एपिडर्मल डेवलपमेंट और बैरियर फॉर्मेशन में सेल एडहेसन. pp. 383–414. doi:10.1016/bs.ctdb.2014.11.027. ISBN 9780124077584. PMC 4737682. PMID 25733147.
{{cite book}}:|journal=ignored (help) - ↑ 5.0 5.1 Okegawa, T; Pong, RC; Li, Y; Hsieh, JT (2004). "कैंसर की प्रगति में कोशिका आसंजन अणु की भूमिका और कैंसर चिकित्सा में इसका अनुप्रयोग।". Acta Biochimica Polonica. 51 (2): 445–57. doi:10.18388/abp.2004_3583. PMID 15218541.
- ↑ 6.0 6.1 Hirohashi, Setsuo; Kanai, Yae (2003). "सेल आसंजन प्रणाली और मानव कैंसर मोर्फोजेनेसिस". Cancer Science. 94 (7): 575–581. doi:10.1111/j.1349-7006.2003.tb01485.x. PMID 12841864. S2CID 22154824.
- ↑ Szekanecz, Zoltan; Koch, Alisa E (2000). "Cell–cell interactions in synovitis: Endothelial cells and immune cell migration". Arthritis Research. 2 (5): 368–373. doi:10.1186/ar114. PMC 130138. PMID 11094450.
- ↑ 8.0 8.1 Pizarro-Cerdá, Javier; Cossart, Pascale (2006). "बैक्टीरियल आसंजन और मेजबान कोशिकाओं में प्रवेश". Cell. 124 (4): 715–727. doi:10.1016/j.cell.2006.02.012. PMID 16497583. S2CID 5769387.
- ↑ 9.0 9.1 Mateo, M.; Generous, A.; Sinn, P. L.; Cattaneo, R. (2015). "कनेक्शन मायने रखता है - वायरस सेलसेल आसंजन घटकों का उपयोग कैसे करते हैं". Journal of Cell Science. 128 (3): 431–439. doi:10.1242/jcs.159400. PMC 4311127. PMID 26046138.
- ↑ Meng, W.; Takeichi, M. (2009). "Adherens Junction: Molecular Architecture and Regulation". Cold Spring Harbor Perspectives in Biology. 1 (6): a002899. doi:10.1101/cshperspect.a002899. PMC 2882120. PMID 20457565.
- ↑ Nicholl ID, Matsui T, Weiss TM, Stanley CB, Heller WT, Martel A, Farago B, Callaway DJ, Bu Z (Aug 21, 2018). "समाधान में और एफ-एक्टिन के साथ जटिल में अल्फा-कैटेनिन संरचना और नैनोस्केल गतिशीलता". Biophysical Journal. 115 (4): 642–654. Bibcode:2018BpJ...115..642N. doi:10.1016/j.bpj.2018.07.005. PMC 6104293. PMID 30037495.
- ↑ Harris, Tony J. C.; Tepass, Ulrich (2010). "Adherens junctions: from molecules to morphogenesis". Nature Reviews Molecular Cell Biology. 11 (7): 502–514. doi:10.1038/nrm2927. PMID 20571587. S2CID 13638902.
- ↑ 13.0 13.1 Johnson, J. L.; Najor, N. A.; Green, K. J. (2014). "Desmosomes: Regulators of Cellular Signaling and Adhesion in Epidermal Health and Disease". Cold Spring Harbor Perspectives in Medicine. 4 (11): a015297. doi:10.1101/cshperspect.a015297. PMC 4208714. PMID 25368015.
- ↑ Delva, E.; Tucker, D. K.; Kowalczyk, A. P. (2009). "द डेसमोसोम". Cold Spring Harbor Perspectives in Biology. 1 (2): a002543. doi:10.1101/cshperspect.a002543. PMC 2742091. PMID 20066089.
- ↑ 15.0 15.1 Steed, Emily; Balda, Maria S.; Matter, Karl (2010). "तंग जंक्शनों की गतिशीलता और कार्य". Trends in Cell Biology. 20 (3): 142–149. doi:10.1016/j.tcb.2009.12.002. PMID 20061152.
- ↑ Niessen, Carien M. (2007). "Tight Junctions/Adherens Junctions: Basic Structure and Function". Journal of Investigative Dermatology. 127 (11): 2525–2532. doi:10.1038/sj.jid.5700865. PMID 17934504.
- ↑ 17.0 17.1 Goodenough, D. A.; Paul, D. L. (2009). "रिक्ति संयोजन". Cold Spring Harbor Perspectives in Biology. 1 (1): a002576. doi:10.1101/cshperspect.a002576. PMC 2742079. PMID 20066080.
- ↑ Meşe, Gülistan; Richard, Gabriele; White, Thomas W. (2007). "Gap Junctions: Basic Structure and Function". Journal of Investigative Dermatology. 127 (11): 2516–2524. doi:10.1038/sj.jid.5700770. PMID 17934503.
- ↑ McEver, Rodger P. (2015). "Selectins: initiators of leucocyte adhesion and signalling at the vascular wall". Cardiovascular Research. 107 (3): 331–339. doi:10.1093/cvr/cvv154. PMC 4592324. PMID 25994174.
- ↑ 20.0 20.1 Barthel, Steven R; Gavino, Jacyln D; Descheny, Leyla; Dimitroff, Charles J (2007). "सूजन और कैंसर में चयनकर्ताओं और चयनकर्ताओं को लक्षित करना". Expert Opinion on Therapeutic Targets. 11 (11): 1473–1491. doi:10.1517/14728222.11.11.1473. PMC 2559865. PMID 18028011.
- ↑ Wong, Chee Wai; Dye, Danielle E.; Coombe, Deirdre R. (2012). "कैंसर मेटास्टेसिस में इम्युनोग्लोबुलिन सुपरफैमिली सेल आसंजन अणु की भूमिका". International Journal of Cell Biology. 2012: 340296. doi:10.1155/2012/340296. PMC 3261479. PMID 22272201.
- ↑ 22.0 22.1 Aricescu, A Radu; Jones, E Yvonne (2007). "Immunoglobulin superfamily cell adhesion molecules: zippers and signals". Current Opinion in Cell Biology. 19 (5): 543–550. doi:10.1016/j.ceb.2007.09.010. PMID 17935964.
- ↑ 23.0 23.1 Takada, Yoshikazu; Ye, Xiaojing; Simon, Scott (2007). "एकीकृत". Genome Biology. 8 (5): 215. doi:10.1186/gb-2007-8-5-215. PMC 1929136. PMID 17543136.
- ↑ 24.0 24.1 Lodish, Harvey; Berk, Arnold; Zipursky, S Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). आणविक कोशिका जीव विज्ञान (4th ed.). W.H. Freeman. ISBN 978-0-7167-3136-8.
- ↑ Borradori, Luca; Sonnenberg, Arnoud (1999). "Structure and Function of Hemidesmosomes: More Than Simple Adhesion Complexes". Journal of Investigative Dermatology. 112 (4): 411–418. doi:10.1046/j.1523-1747.1999.00546.x. PMID 10201522.
- ↑ 26.0 26.1 Critchley, David R (2000). "Focal adhesions – the cytoskeletal connection". Current Opinion in Cell Biology. 12 (1): 133–139. doi:10.1016/S0955-0674(99)00067-8. PMID 10679361.
- ↑ 27.0 27.1 Cilia, Michelle Lynn; Jackson, David (2004). "प्लास्मोडेस्माटा फॉर्म और फ़ंक्शन". Current Opinion in Cell Biology. 16 (5): 500–506. doi:10.1016/j.ceb.2004.08.002. PMID 15363799.
- ↑ Singh, Ram Sarup; Walia, Amandeep Kaur; Kanwar, Jagat Rakesh (2016). "Protozoa lectins and their role in host–pathogen interactions". Biotechnology Advances. 34 (5): 1018–1029. doi:10.1016/j.biotechadv.2016.06.002. PMID 27268207.
- ↑ Rathore, Dharmendar; Sacci, John B.; de la Vega, Patricia; McCutchan, Thomas F. (2002). "स्पोरोज़ोइट्स द्वारा लिवर कोशिकाओं का बंधन और आक्रमण". Journal of Biological Chemistry. 277 (9): 7092–7098. doi:10.1074/jbc.M106862200. PMID 11751898.
- ↑ Kadekoppala, Madhusudan; Holder, Anthony A. (2010). "Merozoite surface proteins of the malaria parasite: The MSP1 complex and the MSP7 family". International Journal for Parasitology. 40 (10): 1155–1161. doi:10.1016/j.ijpara.2010.04.008. PMID 20451527.
- ↑ Tronchin, Guy; Pihet, Marc; Lopes-Bezerra, Leila M.; Bouchara, Jean-Philippe (2008). "मानव रोगजनक कवक में पालन तंत्र". Medical Mycology. 46 (8): 749–772. doi:10.1080/13693780802206435. PMID 18651303.
- ↑ Lima, O. C.; Figueiredo, C. C.; Previato, J. O.; Mendonca-Previato, L.; Morandi, V.; Lopes Bezerra, L. M. (2001). "मानव फाइब्रोनेक्टिन के लिए स्पोरोथ्रिक्स शेंकी के आसंजन में फंगल सेल वॉल घटकों का समावेश". Infection and Immunity. 69 (11): 6874–6880. doi:10.1128/IAI.69.11.6874-6880.2001. PMC 100066. PMID 11598061.
- ↑ Klemm, Per; Schembri, Mark A. (2000). "Bacterial adhesins: function and structure". International Journal of Medical Microbiology. 290 (1): 27–35. doi:10.1016/S1438-4221(00)80102-2. PMID 11043979.
- ↑ Garman, E. F. (2015). "Antiviral adhesion molecular mechanisms for influenza: W. G. Laver's lifetime obsession". Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1661): 20140034. doi:10.1098/rstb.2014.0034. PMC 4275904. PMID 25533092.
- ↑ Capon, D J; Ward, R H R (1991). "The CD4-gpl20 Interaction and Aids Pathogenesis". Annual Review of Immunology. 9 (1): 649–678. doi:10.1146/annurev.iy.09.040191.003245. PMID 1910691.
- ↑ Bendas, Gerd; Borsig, Lubor (2012). "Cancer Cell Adhesion and Metastasis: Selectins, Integrins, and the Inhibitory Potential of Heparins". International Journal of Cell Biology. 2012: 676731. doi:10.1155/2012/676731. PMC 3296185. PMID 22505933.
- ↑ Harris, Estelle S.; Weyrich, Andrew S.; Zimmerman, Guy A. (2012). "Lessons from rare maladies: leukocyte adhesion deficiency syndromes". Current Opinion in Hematology. 20 (1): 16–25. doi:10.1097/MOH.0b013e32835a0091. PMC 3564641. PMID 23207660.
- ↑ Hanna, Suhair; Etzioni, Amos (2012). "ल्यूकोसाइट आसंजन की कमी". Annals of the New York Academy of Sciences. 1250 (1): 50–55. Bibcode:2012NYASA1250...50H. doi:10.1111/j.1749-6632.2011.06389.x. PMID 22276660. S2CID 33727687.
- ↑ Tamgadge, Sandhya; Bhatt, DaivatM; Pereira, Treville; Tamgadge, Avinash; Bhalerao, Sudhir (2011). "पेंफिगस वलगरिस". Contemporary Clinical Dentistry. 2 (2): 134–7. doi:10.4103/0976-237X.83074. PMC 3180831. PMID 21957393.
- ↑ Krachler, Anne Marie; Orth, Kim (2014). "Targeting the bacteria–host interface". Virulence. 4 (4): 284–294. doi:10.4161/viru.24606. PMC 3710331. PMID 23799663.
- ↑ Ofek, Itzhak; Hasty, David L; Sharon, Nathan (2003). "Anti-adhesion therapy of bacterial diseases: prospects and problems". FEMS Immunology & Medical Microbiology. 38 (3): 181–191. CiteSeerX 10.1.1.320.1480. doi:10.1016/S0928-8244(03)00228-1. PMID 14522453.
बाहरी संबंध
- The Cell by G. Cooper (online textbook)
- Molecular Cell Biology by Lodish et al. (online textbook)
- Molecular Biology of the Cell by Alberts et al. (online textbook)
- Cell Adhesion and Extracellular Matrix-The Virtual Library of Biochemistry, Molecular Biology and Cell Biology