हेक्सामेथिलफॉस्फोरामाइड
| |

| |
| Names | |
|---|---|
| Preferred IUPAC name
Hexamethylphosphoric triamide[1] | |
| Other names | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| KEGG | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| C6H18N3OP | |
| Molar mass | 179.20 g/mol |
| Appearance | clear, colorless liquid[2] |
| Odor | aromatic, mild, amine-like[2] |
| Density | 1.03 g/cm3 |
| Melting point | 7.20 °C (44.96 °F; 280.35 K) |
| Boiling point | 232.5 °C (450.5 °F; 505.6 K) CRC[3] |
| miscible[2] | |
| Vapor pressure | 0.03 mmHg (4.0 Pa) at 20 °C[2] |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
Main hazards
|
Suspected Carcinogen[2] |
| GHS labelling: | |

| |
| Danger | |
| H340, H350 | |
| P201, P202, P281, P308+P313, P405, P501 | |
| Flash point | 104.4 °C (219.9 °F; 377.5 K) |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
none[2] |
REL (Recommended)
|
Ca[2] |
IDLH (Immediate danger)
|
Ca [N.D.][2] |
| Safety data sheet (SDS) | Oxford MSDS |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
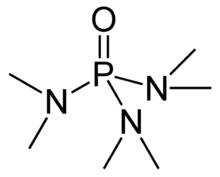
हेक्सामेथिलफॉस्फोरामाइड, जिसे अधिकांशतः संक्षिप्त रूप से एचएमपीए कहा जाता है, एक फॉस्फोरामाइड (फॉस्फोरिक अम्ल का एक एमाइड) है जिसका सूत्र [(CH3)2N]3PO.
है। यह रंगहीन द्रव कार्बनिक संश्लेषण में उपयोगी अभिकर्मक है।
संरचना और प्रतिक्रियाशीलता
एचएमपीए अत्यधिक मूलभूत तृतीयक फॉस्फीन हेक्सामेथिलफॉस्फोरस ट्रायमाइड (HMPT),P(NMe2)3 का ऑक्साइड है अन्य फॉस्फीन ऑक्साइड (जैसे ट्राइफेनिलफॉस्फ़ीन ऑक्साइड) की तरह, अणु में एक टेट्राहेड्रल कोर और एक P=O बंधन होता है जो अत्यधिक ध्रुवीकृत होता है, जिसमें ऑक्सीजन परमाणु पर महत्वपूर्ण ऋणात्मक चार्ज होता है।
नाइट्रोजन-फॉस्फोरस बंधन वाले यौगिकों को सामान्यतः हाइड्रोक्लोरिक अम्ल द्वारा प्रोटोनेटेड अमाइन और फॉस्फेट बनाने के लिए विघटित किया जाता है।
यह क्षार धातु के लवणों को घोलता है[4] और क्षार धातुएँ, नीले घोल बनाती हैं जो कुछ घंटों तक स्थिर रहती हैं। इन नीले विलयनों में सॉल्व्ड इलेक्ट्रॉन उपस्थित होते हैं।[5]
अनुप्रयोग
एचएमपीए पॉलिमर, गैसों और ऑर्गेनोमेटेलिक यौगिकों के लिए एक विशेष विलायक है। यह ब्यूटिल लिथियम जैसे लिथियम बेस के ऑलिगोमर्स को तोड़कर लिथियेशन प्रतिक्रियाओं की चयनात्मकता में सुधार करता है। क्योंकि एचएमपीए चुनिंदा रूप से धनायनों को घोलता है, यह अधिक नंगे आयनों को उत्पन्न करके अन्यथा धीमी SN2 प्रतिक्रियाओं को तेज करता है। HMPA में मूलभूत नाइट्रोजन केंद्र Li+ के साथ दृढ़ता से समन्वय करते हैं।[6]
एचएमपीए मोलिब्डेनम पेरोक्साइड परिसरों पर आधारित उपयोगी अभिकर्मकों में एक लिगैंड है, उदाहरण के लिए, MoO(O2)2(HMPA)(H2O) का उपयोग कार्बनिक संश्लेषण में ऑक्सीडेंट के रूप में किया जाता है।[7]
वैकल्पिक अभिकर्मक
डाइमिथाइल सल्फ़ोक्साइड का उपयोग अधिकांशतः एचएमपीए के स्थान पर कोसॉल्वेंट के रूप में किया जा सकता है। दोनों शसक्त हाइड्रोजन बंधन स्वीकर्ता हैं, और उनके ऑक्सीजन परमाणु धातु धनायनों को बांधते हैं। एचएमपीए के अन्य विकल्पों में N,N′-टेट्राएल्काइल्यूरिया डीएमपीयू (डाइमिथाइलप्रोपाइलीन्यूरिया)[8][9] या डीएमआई (1,3-डाइमिथाइल-2-इमिडाज़ोलिडिनोन) सम्मिलित हैं।[10] ट्रिपिरोलिडिनोफॉस्फोरिक अम्ल ट्रायमाइड (टीपीपीए) को समैरियम डायोडाइड के साथ रिडक्शन्स में एचएमपीए के लिए एक अच्छा विकल्प अभिकर्मक बताया गया है[11] और समैरियम केटिल्स से जुड़ी कई प्रतिक्रियाओं के लिए लुईस बेस एडिटिव के रूप में बताया गया है ।[11]
विषाक्तता
एचएमपीए केवल हल्का विषैला होता है किंतु चूहों में कैंसर का कारण बनता है।[6] एचएमपीए को हाइड्रोक्लोरिक अम्ल की क्रिया से निम्नीकृत किया जा सकता है।
संदर्भ
- ↑ 1.0 1.1 "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 NIOSH Pocket Guide to Chemical Hazards. "#0321". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 3-280. ISBN 978-1-43982077-3.
- ↑ Luehrs, Dean C.; Kohut, John P. (1974). "क्षार धातु लवणों के हेक्सामेथिलफॉस्फोरामाइड सॉल्वेट्स". Journal of Inorganic and Nuclear Chemistry. 36 (7): 1459–1460. doi:10.1016/0022-1902(74)80605-6.
- ↑ Gremmo, Norberto; Randles, John E. B. (1974). "Solvated electrons in hexamethylphosphoramide. Part 1.—Conductivity of solutions of alkali metals". Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases. 70: 1480–1487. doi:10.1039/F19747001480.
- ↑ 6.0 6.1 Dykstra, R. R. (2001). "हेक्सामेथिलफॉस्फोरिक ट्रायमाइड". हेक्सामेथिलफॉस्फोरिक ट्रायमाइड. Encyclopedia of Reagents for Organic Synthesis. New York, NY: John Wiley & Sons. doi:10.1002/047084289X.rh020. ISBN 978-0471936237.
- ↑ Dickman, Michael H.; Pope, Michael T. (1994). "क्रोमियम, मोलिब्डेनम और टंगस्टन के पेरोक्सो और सुपरॉक्सो कॉम्प्लेक्स". Chemical Reviews. 94 (3): 569–584. doi:10.1021/cr00027a002.
- ↑ Mukhopadhyay, T.; Seebach, D. (1982). "अत्यधिक प्रतिक्रियाशील न्यूक्लियोफाइल और बेस के लिए कोसॉल्वेंट के रूप में चक्रीय यूरिया डीएमपीयू द्वारा एचएमपीटी का प्रतिस्थापन". Helvetica Chimica Acta. 65 (1): 385–391. doi:10.1002/hlca.19820650141.
- ↑ Beck, A. K.; Seebach, D. (2001). "N,N′-Dimethylpropyleneurea". N,N′-Dimethylpropyleneurea. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.rd366. ISBN 978-0471936237.
- ↑ Lo, Chi-Chu; Chao, Pei-Min (1990). "कीट लिंग फेरोमोन संश्लेषण में डीएमआई द्वारा कार्सिनोजेनिक विलायक एचएमपीए का प्रतिस्थापन". Journal of Chemical Ecology. 16 (12): 3245–3253. doi:10.1007/BF00982095. PMID 24263426. S2CID 9859086.
- ↑ 11.0 11.1 McDonald, Chriss E.; Ramsey, Jeremy D.; Sampsell, David G.; Butler, Julie A.; Cecchini, Michael R. (2010). "समैरियम डायोडाइड रिडक्शन में एक उत्प्रेरक के रूप में ट्रिपिरोलिडिनोफॉस्फोरिक एसिड ट्रायमाइड". Organic Letters. 12 (22): 5178–5181. doi:10.1021/ol102040s. PMID 20979412.
बाहरी संबंध
- "Hexamethylphosphoramide CAS No. 680-31-9" (PDF). Report on Carcinogens (12th ed.). National Toxicology Program, Department of Health and Human Services. 2011.
- "Hexamethyl phosphoramide". NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention, Department of Health and Human Services. 2011.
- Merck Index. Vol. 4761 (12th ed.).