प्रोकैरियोटिक साइटोस्केलेटन
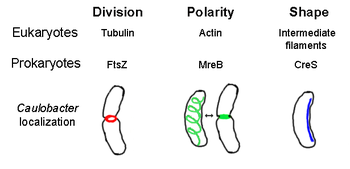
प्रोकैरियोट्स में सभी संरचनात्मक तंतुओं का सामूहिक नाम प्रोकैरियोटिक साइटोस्केलेटन है। एक बार यह सोचा गया था कि प्रोकैरियोटिक कोशिकाओं में साइटोस्केलेटन नहीं होते हैं, लेकिन दृश्य प्रौद्योगिकी और संरचना निर्धारण में प्रगति के कारण 1990 के दशक की प्रारम्भ में इन कोशिकाओं में फिलामेंट्स की खोज हुई।[2] न केवल प्रोकैरियोट्स में यूकेरियोट्स के सभी प्रमुख साइटोस्केलेटल प्रोटीन के एनालॉग पाए गए हैं, बल्कि बिना किसी ज्ञात यूकेरियोटिक होमोलॉग वाले साइटोस्केलेटल प्रोटीन की भी खोज की गई है।[3][4][5][6] साइटोस्केलेटल तत्व विभिन्न प्रोकैरियोट्स में कोशिका विभाजन, सुरक्षा, आकार निर्धारण और ध्रुवीयता निर्धारण में आवश्यक भूमिका निभाते हैं।[7][8]
ट्यूबुलिन सुपरफैमिली
एफटीएसजेड (FtsZ)
एफटीएसजेड, पहला पहचाना गया प्रोकैरियोटिक साइटोस्केलेटल तत्व, कोशिका के मध्य में स्थित फिलामेंटस रिंग संरचना बनाता है जिसे Z-रिंग कहा जाता है जो यूकेरियोट्स में एक्टिन-मायोसिन सिकुड़ा रिंग के समान, कोशिका विभाजन के दौरान संकुचित हो जाती है।[2] जेड-रिंग अत्यधिक गतिशील संरचना है जिसमें प्रोटोफिलामेंट्स के कई बंडल होते हैं जो विस्तारित और सिकुड़ते हैं, हालांकि जेड-रिंग संकुचन के पीछे का तंत्र और इसमें सम्मिलित प्रोटोफिलामेंट्स की संख्या स्पष्ट नहीं है।[1] एफटीएसजेड आयोजक प्रोटीन के रूप में कार्य करता है और कोशिका विभाजन के लिए आवश्यक है। यह साइटोकाइनेसिस के दौरान सेप्टम का पहला घटक है, और यह विभाजन स्थल पर अन्य सभी ज्ञात कोशिका विभाजन प्रोटीनों को भर्ती करता है।[9]
एक्टिन के साथ इस कार्यात्मक समानता के बावजूद, एफटीएसजेड यूकेरियल ट्यूबुलिन के अनुरूप है। यद्यपि एफटीएसजेड और ट्यूबुलिन की प्राथमिक संरचनाओं की तुलना से अशक्त संबंध का पता चलता है, उनकी त्रि-आयामी संरचनाएं उल्लेखनीय रूप से समान हैं। इसके अलावा, ट्युबुलिन की तरह, मोनोमेरिक एफटीएसजेड GTP से बंधा होता है और ट्युबुलिन डिमराइजेशन के समान एक तंत्र में जीटीपी के हाइड्रोलिसिस के साथ अन्य एफटीएसजेड मोनोमर्स के साथ पॉलिमराइज़ होता है।[10] चूंकि एफटीएसजेड बैक्टीरिया में कोशिका विभाजन के लिए आवश्यक है, इसलिए यह प्रोटीन नए एंटीबायोटिक दवाओं के डिजाइन के लिए एक लक्ष्य है।[11] वर्तमान में ऐसे कई मॉडल और तंत्र उपस्थित हैं जो ज़ेड-रिंग गठन को नियंत्रित करते हैं, लेकिन ये तंत्र प्रजातियों पर निर्भर करते हैं। एस्चेरिचिया कोली और कौलोबैक्टर क्रीसेंटस सहित कई छड़ के आकार की प्रजातियां, एफटीएसजेड असेंबली के एक या अधिक अवरोधकों का उपयोग करती हैं जो कोशिका में एक द्विध्रुवी ढाल बनाती हैं, जो कोशिका केंद्र में एफटीएसजेड के पोलीमराइजेशन को बढ़ाती हैं।[12] इन ग्रेडिएंट-फॉर्मिंग सिस्टमों में से एक में मिनसीडीई प्रोटीन होते हैं (नीचे देखें)।
एक्टिन सुपरफैमिली
एमआरईबी (MreB)
एमआरईबी एक जीवाणु प्रोटीन है जिसे यूकेरियल एक्टिन का समजात माना जाता है। एमआरईबी और एक्टिन में अशक्त प्राथमिक संरचना मेल खाती है लेकिन 3-डी संरचना और फिलामेंट पोलीमराइजेशन के स्तिथि में बहुत समान हैं।
लगभग सभी गैर-गोलाकार जीवाणु अपना आकार निर्धारित करने के लिए एमआरईबी पर निर्भर होते हैं। एमआरईबी कोशिका की पूरी लंबाई को कवर करते हुए, साइटोप्लाज्मिक झिल्ली के ठीक नीचे फिलामेंटस संरचनाओं के एक पेचदार नेटवर्क में इकट्ठा होता है।[13] एमआरईबी पेप्टिडोग्लाइकन को संश्लेषित करने वाले एंजाइमों की स्थिति और गतिविधि में मध्यस्थता करके और कोशिका झिल्ली के नीचे एक कठोर फिलामेंट के रूप में कार्य करके कोशिका के आकार को निर्धारित करता है जो कोशिका को आकार देने और मजबूत करने के लिए बाहरी दबाव डालता है।[1] एमआरईबी अपने सामान्य पेचदार नेटवर्क से संघनित होता है और कोशिका विभाजन से ठीक पहले काउलोबैक्टर क्रेसेंटस में सेप्टम पर एक तंग रिंग बनाता है, एक ऐसा तंत्र जिसके बारे में माना जाता है कि यह इसके ऑफ-सेंटर सेप्टम का पता लगाने में मदद करता है।[14] एमआरईबी ध्रुवीय बैक्टीरिया में ध्रुवीयता निर्धारण के लिए भी महत्वपूर्ण है, क्योंकि यह सी. क्रिसेंटस में कम से कम चार अलग-अलग ध्रुवीय प्रोटीनों की सही स्थिति के लिए जिम्मेदार है।[14]
पीएआरसी और सोपा (ParM and SopA)
पीएआरसी साइटोस्केलेटल तत्व है जिसकी संरचना एक्टिन के समान होती है, हालांकि यह ट्यूबुलिन की तरह कार्यात्मक रूप से व्यवहार करता है। इसके अलावा, यह द्विदिश रूप से पोलीमराइज़ होता है और यह गतिशील अस्थिरता प्रदर्शित करता है, जो दोनों व्यवहार ट्यूबुलिन पोलीमराइज़ेशन की विशेषता हैं।[4][15] यह पीएआरआर और पीएआरसी के साथ एक प्रणाली बनाता है जो R1 प्लास्मिड पृथक्करण के लिए ज़िम्मेदार है। पीएआरसी, पीएआरआर से जुड़ता है, डीएनए-बाइंडिंग प्रोटीन जो विशेष रूप से R1 प्लास्मिड पर पीएआरसी क्षेत्र में 10 प्रत्यक्ष दोहराव से बंधता है। यह बंधन पीएआरसी फ़िलामेंट के दोनों सिरों पर होता है। इसके बाद इस फिलामेंट को बढ़ाया जाता है, जिससे प्लास्मिड अलग हो जाते हैं।[16] यह प्रणाली यूकेरियोटिक गुणसूत्र पृथक्करण के समान है क्योंकि पीएआरसी माइटोटिक स्पिंडल में यूकेरियोटिक ट्यूबुलिन की तरह कार्य करता है, पीएआरआर किनेटोकोर कॉम्प्लेक्स की तरह कार्य करता है, और पीएआरसी गुणसूत्र के सेंट्रोमियर की तरह कार्य करता है।[17]
एफ प्लास्मिड पृथक्करण एक समान प्रणाली में होता है जहां एसओपीए साइटोस्केलेटल फिलामेंट के रूप में कार्य करता है और एसओपीबी क्रमशः कीनेटोकोर और सेंट्रोमियर की तरह एफ प्लास्मिड में एसओपीसी अनुक्रम से जुड़ता है।[17] हाल ही में ग्राम-पॉजिटिव जीवाणु बैसिलस थुरिंजिएन्सिस में एक एक्टिन जैसा पीएआरसी होमोलॉग पाया गया है, जो सूक्ष्मनलिका जैसी संरचना में एकत्रित होता है और प्लास्मिड पृथक्करण में सम्मिलित होता है।[18]
आर्कियल एक्टिन
क्रेनेक्टिन एक्टिन होमोलॉग है जो पुरातन साम्राज्य थर्मोप्रोटियोटा (पूर्व में क्रेनार्किओटा) के लिए अद्वितीय है जो थर्मोप्रोटीलेस और कैंडिडैटस कोरार्कियम क्रम में पाया गया है।[19] 2009 में इसकी खोज के समय, इसमें किसी भी ज्ञात एक्टिन होमोलॉग के यूकेरियोटिक एक्टिन के साथ उच्चतम अनुक्रम समानता थी।[20] क्रैनेक्टिन को पायरियोबाकुलम कैलिडिफोंटिस (ए3एमडब्ल्यूएन5) में अच्छी तरह से चित्रित किया गया है और एटीपी और जीटीपी के लिए उच्च विशिष्टता दिखाई गई है।[19] क्रेनेक्टिन युक्त सभी प्रजातियाँ छड़ या सुई के आकार की होती हैं। पी. कैलिडिफोंटिस में, क्रेनेक्टिन को कोशिका की लंबाई तक फैली हुई पेचदार संरचनाएं बनाते हुए दिखाया गया है, जो अन्य प्रोकैरियोट्स में एमआरईबी के समान आकार निर्धारण में क्रेनेक्टिन की भूमिका का सुझाव देता है।[19][21]
यूकेरियोटिक एक्टिन प्रणाली के भी करीब एस्गार्डार्किओटा के प्रस्तावित सुपरफाइलम में पाया जाता है। वे साइटोस्केलेटन को विनियमित करने के लिए प्रोफिलिन, जेल्सोलिन और कोफिलिन के आदिम संस्करणों का उपयोग करते हैं।
अद्वितीय समूह
क्रिसेंटिन
क्रिसेंटिन (सीआरईएस जीन द्वारा एन्कोड किया गया) यूकेरियोटिक इंटरमीडिएट फिलामेंट्स (IFs) का एनालॉग है। यहां चर्चा किए गए अन्य समान संबंधों के विपरीत, क्रीसेंटिन में त्रि-आयामी समानता के अलावा IF प्रोटीन के साथ एक बड़ी प्राथमिक समरूपता है - सीआरईएस के अनुक्रम में 25% पहचान मिलान और साइटोकैटिन 19 से 40% समानता और 24% पहचान मिलान और परमाणु लेमिन ए से 40% समानता है। इसके अलावा, क्रीसेंटिन फिलामेंट्स का व्यास लगभग 10 एनएम है और इस प्रकार यूकेरियल आईएफएस (8-15 एनएम) के लिए व्यास सीमा के भीतर आते हैं।[22] क्रिसेंटिन अर्धचंद्राकार जीवाणु कौलोबैक्टर क्रिसेंटस के आंतरिक, अवतल पक्ष के साथ-साथ ध्रुव से ध्रुव तक एक निरंतर फिलामेंट बनाता है। सी. क्रिसेंटस के अपने विशिष्ट आकार में अस्तित्व में रहने के लिए एमआरईबी और क्रिसेंटीन दोनों आवश्यक हैं; ऐसा माना जाता है कि एमआरईबी कोशिका को एक छड़ के आकार में ढालता है और क्रिसेंटिन इस आकार को एक अर्धचंद्र में मोड़ देता है।[1]
न्यूनतम सीडीई प्रणाली (MinCDE system)
मिनसीडीई प्रणाली फिलामेंट प्रणाली है जो एस्चेरिचिया कोलाई में कोशिका के मध्य में सेप्टम को सही ढंग से स्थित करती है। शिह एट अल के अनुसार, मिनसी जेड-रिंग के पोलीमराइजेशन को रोककर सेप्टम के गठन को रोकता है। न्यूनतम सी, न्यूनतम डी और न्यूनतम ई एक हेलिक्स संरचना बनाते हैं जो कोशिका के चारों ओर घूमती है और न्यूनतम डी द्वारा झिल्ली से बंधी रहती है। न्यूनतम सीडीई हेलिक्स एक ध्रुव पर स्थित होता है और ध्रुवीय क्षेत्र के सबसे मध्य किनारे पर न्यूनतम ई से बनी ई-रिंग नामक एक फिलामेंटस संरचना में समाप्त होता है। इस कॉन्फ़िगरेशन से, ई-रिंग सिकुड़ जाएगी और उस ध्रुव की ओर बढ़ जाएगी, जैसे-जैसे यह आगे बढ़ती है, न्यूनतम सीडीई हेलिक्स को अलग कर देती है। इसके साथ ही, अलग किए गए टुकड़े विपरीत ध्रुवीय छोर पर फिर से इकट्ठे हो जाएंगे, जिससे विपरीत ध्रुव पर न्यूनतम सीडीई कॉइल में सुधार होगा जबकि वर्तमान न्यूनतम सीडीई हेलिक्स टूट जाएगा। फिर यह प्रक्रिया दोहराई जाती है, जिसमें मिनसीडीई हेलिक्स एक ध्रुव से दूसरे ध्रुव तक दोलन करता है। यह दोलन कोशिका चक्र के दौरान बार-बार होता है, जिससे कोशिका के सिरों की तुलना में कोशिका के मध्य में न्यूनतम समय-औसत सांद्रता पर न्यूनतम सी (और इसका सेप्टम अवरोधक प्रभाव) रहता है।[23]
कोशिका झिल्ली की नकल के रूप में कृत्रिम लिपिड बाइलेयर का उपयोग करके मिन प्रोटीन के गतिशील व्यवहार को इन विट्रो में पुनर्गठित किया गया है। न्यूनतम ई और न्यूनतम डी एक प्रतिक्रिया-प्रसार जैसे तंत्र द्वारा समानांतर और सर्पिल प्रोटीन तरंगों में स्व-संगठित होते हैं।[24]
बैक्टोफिलिन
बैक्टोफिलिन (इंटरप्रो: IPR007607) β-हेलिकल साइटोस्केलेटल तत्व है जो रॉड के आकार के प्रोटीओबैक्टीरियम मायक्सोकोकस ज़ैंथस की कोशिकाओं में फिलामेंट बनाता है।[25] बैक्टोफिलिन प्रोटीन, बीएसीएम, उचित कोशिका आकार रखरखाव और कोशिका दीवार अखंडता के लिए आवश्यक है। बीएसीएम की कमी वाले एम. ज़ेन्थस कोशिकाओं में विकृत आकृति विज्ञान है जो मुड़े हुए कोशिका शरीर की विशेषता है, और बीएसीएम म्यूटेंट ने बैक्टीरिया कोशिका दीवार को लक्षित करने वाले एंटीबायोटिक दवाओं के प्रति प्रतिरोध को कम कर दिया है। पोलीमराइजेशन की अनुमति देने के लिए एम. ज़ैंथस बीएसीएम प्रोटीन को उसके पूर्ण-लंबाई वाले रूप से अलग किया जाता है। बैक्टोफिलिन को अन्य जीवाणुओं में कोशिका आकार नियमन में सम्मिलित किया गया है, जिसमें प्रोटियस मिराबिलिस कोशिकाओं की वक्रता,[26] कौलोबैक्टर क्रेसेंटस द्वारा डंठल का निर्माण,[27] और हेलिकोबैक्टर पाइलोरी का पेचदार आकार सम्मिलित है।[28]
सीएफपीए (CfpA)
फाइलम स्पिरोचैटेस के भीतर, कई प्रजातियां अलग-अलग फिलामेंट्स द्वारा बनाई गई एक फिलामेंटस साइटोप्लाज्मिक रिबन संरचना साझा करती हैं, जो कॉइल्ड-कॉइल प्रोटीन सीएफपीए (साइटोप्लाज्मिक फिलामेंट प्रोटीन ए, Q56336) से बनी होती है, जो घटकों को जोड़ने और आंतरिक झिल्ली के एंकर द्वारा एक साथ जुड़ी होती है।[29][30] हालांकि ट्रेपोनेमा, स्पाइरोचेटा, पिलोटिना, लेप्टोनेमा, हॉलैंडिना और डिप्लोकैलेक्स जेनेरा में उपस्थित हैं, हालांकि, ट्रेपोनिमा प्राइमिटिया के उदाहरण के अनुसार, वे कुछ प्रजातियों में अनुपस्थित हैं।[31][32][33][34] 5 x 6 एनएम (क्षैतिज/ऊर्ध्वाधर) के क्रॉस-सेक्शन आयाम के साथ वे यूकेरियल मध्यवर्ती फिलामेंट्स (आईएफ) (8-15 एनएम) की व्यास सीमा के भीतर आते हैं। सीएफपीए प्रोटीन की कमी वाली ट्रेपोनेमा डेंटिकोला कोशिकाएं क्रोमोसोमल डीएनए पृथक्करण दोष के साथ लंबी संयोजित कोशिकाएं बनाती हैं, फेनोटाइप भी इस जीव की रोगज़नक़ी को प्रभावित करता है।[35][36] एक अन्य कोशिका अल्ट्रास्ट्रक्चर, पेरिप्लास्मिक फ्लैगेला फिलामेंट बंडल की अनुपस्थिति, साइटोप्लाज्मिक रिबन की संरचना में परिवर्तन नहीं करती है।[37]
यह भी देखें
- कोशिका विभाजन
- सायनोबैक्टीरियल आकृति विज्ञान
- साइटोकाइनेसिस
- साइटोस्केलेटन
- प्रोकैरियोट्स
- प्रोटीन फिलामेंट
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 Gitai Z (March 2005). "The new bacterial cell biology: moving parts and subcellular architecture". Cell. 120 (5): 577–86. doi:10.1016/j.cell.2005.02.026. PMID 15766522. S2CID 8894304.
- ↑ 2.0 2.1 Bi EF, Lutkenhaus J (November 1991). "Escherichia coli में विभाजन से जुड़ी FtsZ रिंग संरचना". Nature. 354 (6349): 161–4. Bibcode:1991Natur.354..161B. doi:10.1038/354161a0. PMID 1944597. S2CID 4329947.
- ↑ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (June 2015). "रचनात्मक और कार्यात्मक रूप से अलग एक्टिन फिलामेंट्स का विकास". Journal of Cell Science. 128 (11): 2009–19. doi:10.1242/jcs.165563. PMID 25788699.
- ↑ 4.0 4.1 Popp D, Narita A, Lee LJ, Ghoshdastider U, Xue B, Srinivasan R, Balasubramanian MK, Tanaka T, Robinson RC (June 2012). "क्लोस्ट्रीडियम टेटानी से उपन्यास एक्टिन-जैसी फिलामेंट संरचना". The Journal of Biological Chemistry. 287 (25): 21121–9. doi:10.1074/jbc.M112.341016. PMC 3375535. PMID 22514279.
- ↑ Popp D, Narita A, Ghoshdastider U, Maeda K, Maéda Y, Oda T, Fujisawa T, Onishi H, Ito K, Robinson RC (April 2010). "बैक्टीरियल एक्टिन अल्फ़ा की पॉलिमरिक संरचनाएं और गतिशील गुण". Journal of Molecular Biology. 397 (4): 1031–41. doi:10.1016/j.jmb.2010.02.010. PMID 20156449.
- ↑ Wickstead B, Gull K (August 2011). "साइटोस्केलेटन का विकास". The Journal of Cell Biology. 194 (4): 513–25. doi:10.1083/jcb.201102065. PMC 3160578. PMID 21859859.
- ↑ Shih YL, Rothfield L (September 2006). "बैक्टीरियल साइटोस्केलेटन". Microbiology and Molecular Biology Reviews. 70 (3): 729–54. doi:10.1128/MMBR.00017-06. PMC 1594594. PMID 16959967.
- ↑ Michie KA, Löwe J (2006). "बैक्टीरियल साइटोस्केलेटन के गतिशील तंतु" (PDF). Annual Review of Biochemistry. 75: 467–92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499. Archived from the original (PDF) on November 17, 2006.
- ↑ Graumann PL (December 2004). "बैक्टीरिया में साइटोस्केलेटल तत्व". Current Opinion in Microbiology. 7 (6): 565–71. doi:10.1016/j.mib.2004.10.010. PMID 15556027.
- ↑ Desai A, Mitchison TJ (July 1998). "Tubulin and FtsZ structures: functional and therapeutic implications". BioEssays. 20 (7): 523–7. doi:10.1002/(SICI)1521-1878(199807)20:7<523::AID-BIES1>3.0.CO;2-L. PMID 9722999.
- ↑ Haydon DJ, Stokes NR, Ure R, Galbraith G, Bennett JM, Brown DR, Baker PJ, Barynin VV, Rice DW, Sedelnikova SE, Heal JR, Sheridan JM, Aiwale ST, Chauhan PK, Srivastava A, Taneja A, Collins I, Errington J, Czaplewski LG (September 2008). "शक्तिशाली और चयनात्मक एंटी-स्टैफिलोकोकल गतिविधि के साथ FtsZ का अवरोधक". Science. 321 (5896): 1673–5. Bibcode:2008Sci...321.1673H. doi:10.1126/science.1159961. PMID 18801997. S2CID 7878853.
- ↑ Haeusser DP, Margolin W (April 2016). "Splitsville: structural and functional insights into the dynamic bacterial Z ring". Nature Reviews. Microbiology. 14 (5): 305–19. doi:10.1038/nrmicro.2016.26. PMC 5290750. PMID 27040757.
- ↑ Kürner J, Medalia O, Linaroudis AA, Baumeister W (November 2004). "क्रायो-इलेक्ट्रॉन टोमोग्राफी का उपयोग करके यूकेरियोटिक और प्रोकैरियोटिक साइटोस्केलेटन के संरचनात्मक संगठन में नई अंतर्दृष्टि". Experimental Cell Research. 301 (1): 38–42. doi:10.1016/j.yexcr.2004.08.005. PMID 15501443.
- ↑ 14.0 14.1 Gitai Z, Dye N, Shapiro L (June 2004). "एक्टिन जैसा जीन बैक्टीरिया में कोशिका ध्रुवता निर्धारित कर सकता है". Proceedings of the National Academy of Sciences of the United States of America. 101 (23): 8643–8. doi:10.1073/pnas.0402638101. PMC 423248. PMID 15159537.
- ↑ Garner EC, Campbell CS, Mullins RD (November 2004). "डीएनए-पृथक्करण प्रोकैरियोटिक एक्टिन होमोलॉग में गतिशील अस्थिरता". Science. 306 (5698): 1021–5. Bibcode:2004Sci...306.1021G. doi:10.1126/science.1101313. PMID 15528442. S2CID 14032209.
- ↑ Møller-Jensen J, Jensen RB, Löwe J, Gerdes K (June 2002). "एक्टिन जैसे फिलामेंट द्वारा प्रोकैरियोटिक डीएनए पृथक्करण". The EMBO Journal. 21 (12): 3119–27. doi:10.1093/emboj/cdf320. PMC 126073. PMID 12065424.
- ↑ 17.0 17.1 Gitai Z (February 2006). "Plasmid segregation: a new class of cytoskeletal proteins emerges". Current Biology. 16 (4): R133-6. doi:10.1016/j.cub.2006.02.007. PMID 16488865.
- ↑ Jiang S, Narita A, Popp D, Ghoshdastider U, Lee LJ, Srinivasan R, Balasubramanian MK, Oda T, Koh F, Larsson M, Robinson RC (March 2016). "बैसिलस थुरिंगिएन्सिस से उपन्यास एक्टिन फिलामेंट्स प्लास्मिड डीएनए अलगाव के लिए नैनोट्यूबुल्स बनाते हैं". Proceedings of the National Academy of Sciences of the United States of America. 113 (9): E1200-5. Bibcode:2016PNAS..113E1200J. doi:10.1073/pnas.1600129113. PMC 4780641. PMID 26873105.
- ↑ 19.0 19.1 19.2 Ettema TJ, Lindås AC, Bernander R (May 2011). "आर्किया में एक एक्टिन-आधारित साइटोस्केलेटन". Molecular Microbiology. 80 (4): 1052–61. doi:10.1111/j.1365-2958.2011.07635.x. PMID 21414041.
- ↑ Yutin N, Wolf MY, Wolf YI, Koonin EV (February 2009). "फागोसाइटोसिस और यूकेरियोजेनेसिस की उत्पत्ति". Biology Direct. 4: 9. doi:10.1186/1745-6150-4-9. PMC 2651865. PMID 19245710.
- ↑ Ghoshdastider U, Jiang S, Popp D, Robinson RC (July 2015). "प्राइमर्डियल एक्टिन फिलामेंट की खोज में". Proceedings of the National Academy of Sciences of the United States of America. 112 (30): 9150–1. doi:10.1073/pnas.1511568112. PMC 4522752. PMID 26178194.
- ↑ Ausmees N, Kuhn JR, Jacobs-Wagner C (December 2003). "The bacterial cytoskeleton: an intermediate filament-like function in cell shape". Cell. 115 (6): 705–13. doi:10.1016/S0092-8674(03)00935-8. PMID 14675535. S2CID 14459851.
- ↑ Shih YL, Le T, Rothfield L (June 2003). "एस्चेरिचिया कोलाई में डिवीजन साइट चयन में कुंडलित संरचनाओं के भीतर न्यूनतम प्रोटीन का गतिशील पुनर्वितरण शामिल है जो दो सेल ध्रुवों के बीच विस्तारित होता है". Proceedings of the National Academy of Sciences of the United States of America. 100 (13): 7865–70. Bibcode:2003PNAS..100.7865S. doi:10.1073/pnas.1232225100. PMC 164679. PMID 12766229.
- ↑ Loose M, Fischer-Friedrich E, Ries J, Kruse K, Schwille P (May 2008). "बैक्टीरियल सेल डिवीजन के लिए स्थानिक नियामक इन विट्रो में सतह तरंगों में स्व-व्यवस्थित होते हैं". Science. 320 (5877): 789–92. Bibcode:2008Sci...320..789L. doi:10.1126/science.1154413. PMID 18467587. S2CID 27134918.
- ↑ Koch MK, McHugh CA, Hoiczyk E (May 2011). "BacM, Myxococcus xanthus का एक एन-टर्मली प्रोसेस्ड बैक्टोफिलिन, उचित कोशिका आकार के लिए महत्वपूर्ण है". Molecular Microbiology. 80 (4): 1031–51. doi:10.1111/j.1365-2958.2011.07629.x. PMC 3091990. PMID 21414039.
- ↑ Hay NA, Tipper DJ, Gygi D, Hughes C (April 1999). "कोशिका के आकार को प्रभावित करने वाला एक नया मेम्ब्रेन प्रोटीन और प्रोटियस मिराबिलिस का बहुकोशिकीय झुंड". Journal of Bacteriology. 181 (7): 2008–16. doi:10.1128/JB.181.7.2008-2016.1999. PMC 93611. PMID 10094676.
- ↑ Kühn J, Briegel A, Mörschel E, Kahnt J, Leser K, Wick S, Jensen GJ, Thanbichler M (January 2010). "बैक्टोफिलिन्स, साइटोस्केलेटल प्रोटीन का एक सर्वव्यापी वर्ग जो कौलोबैक्टर क्रेसेंटस में कोशिका भित्ति सिंथेज़ के ध्रुवीय स्थानीयकरण की मध्यस्थता करता है". The EMBO Journal. 29 (2): 327–39. doi:10.1038/emboj.2009.358. PMC 2824468. PMID 19959992.
- ↑ Sycuro LK, Pincus Z, Gutierrez KD, Biboy J, Stern CA, Vollmer W, Salama NR (May 2010). "पेप्टिडोग्लाइकन क्रॉसलिंकिंग विश्राम हेलिकोबैक्टर पाइलोरी के पेचदार आकार और पेट के उपनिवेशण को बढ़ावा देता है". Cell. 141 (5): 822–33. doi:10.1016/j.cell.2010.03.046. PMC 2920535. PMID 20510929.
- ↑ Izard J, McEwen BF, Barnard RM, Portuese T, Samsonoff WA, Limberger RJ (February 2004). "ट्रेपोनेमल साइटोप्लाज्मिक फिलामेंट्स के टोमोग्राफिक पुनर्निर्माण से उपन्यास ब्रिजिंग और एंकरिंग घटकों का पता चलता है". Molecular Microbiology. 51 (3): 609–18. doi:10.1046/j.1365-2958.2003.03864.x. PMID 14731266.
- ↑ You Y, Elmore S, Colton LL, Mackenzie C, Stoops JK, Weinstock GM, Norris SJ (June 1996). "ट्रेपोनिमा पैलिडम सबस्प के साइटोप्लाज्मिक फिलामेंट प्रोटीन जीन (सीएफपीए) की विशेषता। पैलिडम". Journal of Bacteriology. 178 (11): 3177–87. doi:10.1128/jb.178.11.3177-3187.1996. PMC 178068. PMID 8655496.
- ↑ Izard J (2006). "Cytoskeletal cytoplasmic filament ribbon of Treponema: a member of an intermediate-like filament protein family". Journal of Molecular Microbiology and Biotechnology. 11 (3–5): 159–66. doi:10.1159/000094052. PMID 16983193. S2CID 40913042.
- ↑ Murphy GE, Matson EG, Leadbetter JR, Berg HC, Jensen GJ (March 2008). "ट्रेपोनिमा प्रिमिटिया की नवीन अवसंरचना और गतिशीलता के लिए उनके निहितार्थ". Molecular Microbiology. 67 (6): 1184–95. doi:10.1111/j.1365-2958.2008.06120.x. PMC 3082362. PMID 18248579.
- ↑ Izard J, Renken C, Hsieh CE, Desrosiers DC, Dunham-Ems S, La Vake C, Gebhardt LL, Limberger RJ, Cox DL, Marko M, Radolf JD (December 2009). "क्रायो-इलेक्ट्रॉन टोमोग्राफी ट्रेपोनिमा पैलिडम, सिफिलिस स्पाइरोचेट की आणविक वास्तुकला को स्पष्ट करती है". Journal of Bacteriology. 191 (24): 7566–80. doi:10.1128/JB.01031-09. PMC 2786590. PMID 19820083.
- ↑ Izard J, Hsieh CE, Limberger RJ, Mannella CA, Marko M (July 2008). "क्रायो-इलेक्ट्रॉन टोमोग्राफी द्वारा पता चला ट्रेपोनिमा डेंटिकोला की मूल सेलुलर वास्तुकला". Journal of Structural Biology. 163 (1): 10–7. doi:10.1016/j.jsb.2008.03.009. PMC 2519799. PMID 18468917.
- ↑ Izard J, Samsonoff WA, Limberger RJ (February 2001). "ट्रेपोनिमा डेंटिकोला के साइटोप्लाज्मिक फिलामेंट-डिफिशिएंट म्यूटेंट में प्लियोट्रोपिक दोष हैं". Journal of Bacteriology. 183 (3): 1078–84. CiteSeerX 10.1.1.488.5178. doi:10.1128/JB.183.3.1078-1084.2001. PMC 94976. PMID 11208807.
- ↑ Izard J, Sasaki H, Kent R (2012). "ट्रेपोनिमा डेंटिकोला वाइल्ड-टाइप और म्यूटेंट स्ट्रेन की रोगजनकता माइक्रोइंजेक्शन का उपयोग करके पेरियोडोंटल संक्रमण के एक सक्रिय मोड द्वारा परीक्षण किया गया". International Journal of Dentistry. 2012: 549169. doi:10.1155/2012/549169. PMC 3398590. PMID 22829826.
- ↑ Izard J, Samsonoff WA, Kinoshita MB, Limberger RJ (November 1999). "जंगली प्रकार के ट्रेपोनिमा फेगेडेनिस और एक फ्लैगेलर फिलामेंट-डेफिशिएंट म्यूटेंट के साइटोप्लाज्मिक फिलामेंट्स का आनुवंशिक और संरचनात्मक विश्लेषण". Journal of Bacteriology. 181 (21): 6739–46. doi:10.1128/JB.181.21.6739-6746.1999. PMC 94139. PMID 10542176.