लैमिनिन
लैमिनिन्स एक प्रकार के ग्लाइकोप्रोटीन समूह होते हैं, जो सभी प्राणियों के बाह्यकोशिका आव्यूह के अंश होते हैं।[1] ये मुख्य रूप से बेसमेंट मेंम्ब्रेन की एक परत के महत्वपूर्ण घटक होते हैं, जो अधिकांश कोशिकाओं और अंगों के लिए प्रोटीन नेटवर्क का आधार बनाता है। लैमिनिन्स बेसल लामिना का एक महत्वपूर्ण और जीविकीय अंश होते हैं, जो कोशिका विभाजन, प्रवासन, और अधीनता पर प्रभाव डालते हैं।[2]
लैमिनिन्स वेरिट्राइमेरिक प्रोटीन होते हैं जिनका उच्च मॉलिकुलर मास (~400 से ~900 kDa) होता है। इनमें तीन विभिन्न श्रृंखलाएं होती हैं (अल्फा, बीटा और गामा), जिन्हें मानवों में पाँच, चार और तीन पैरालोगस जीन्स द्वारा एन्कोड किया जाता है। लैमिनिन मोलेक्यूल अपने श्रृंखला संरचना के अनुसार नामकरण किए जाते हैं। इस प्रकार, लैमिनिन-511 में अल्फा5 (α5), बीटा1 (β1), और गामा1 (γ1) श्रृंखलाएं होती हैं।[3] वास्तविकता में, इसके अतिरिक्त और चार्दह श्रृंखला संयोजन भी व्यक्ति में पहचाने गए हैं। ये त्रैमैरिक प्रोटीन एक क्रॉस-जैसी संरचना बनाते हैं जिससे अन्य कोशिका की मेम्ब्रेन और बाह्यकोशिका आव्यूह के मोलेक्यूलों से बाँध सकते हैं।[4] यह लैमिनिन मोलेक्यूल की विशेषता है कि उनमें से तीन छोटी पंखें अन्य लैमिनिन मोलेक्यूलों से जुड़ने में विशेष रूप से अच्छे होते हैं, जिससे वे शीट बना सकते हैं। लैमिनिन के लंबे पंख क्षमता सेकोशिकाओ से जुड़ सकते हैं, जो संगठित ऊतकीय कोशिकाएं बेसमेंट मेम्ब्रेन से जुड़ने में मदद करता है।
लैमिनिन ग्लाइकोप्रोटीन का समूह प्राणियों के लगभग हर ऊतक की संरचनात्मक सहायता का अभिन्न भाग होता है। ये कोशिका निकटस्थ बाह्यकोशिका आव्यूह में स्रावित किए जाते हैं और उसमें सम्मिलित हो जाते हैं। लैमिनिन ऊतकों की संरचना और जीवित रहने के लिए अत्यंत महत्वपूर्ण होता है। दोषित लैमिनिन मांसपेशियों के गलत तरीके से बनने का कारण, जिससे मस्क्युलर डिस्ट्रोफी के एक प्रकार के रोग का होना संभव होता है, जिसे लीथल स्किन ब्लिस्टरिंग रोग और किडनी के फिल्टर के दोष के रूप में जाना जाता है।[5]
प्रकार
मानव में, पंद्रह लैमिनिन ट्राइमर्स की पहचान की गई है। ये लैमिनिन विभिन्न अल्फा, बीटा, और गामा श्रृंखलाओं के संयोजन होते हैं। [6]
- पांच अल्फा-श्रृंखला आईसोफॉर्म हैं जो लैमिनिन समूह में पाए जाते हैं: LAMA1, LAMA2, LAMA3, LAMA4, LAMA5 ये विभिन्न अल्फा-श्रृंखलाएं लैमिनिन मोलेक्यूल के विभिन्न वैरिएंट्स हैं, जो अलग-अलग विकासित ऊतकों में महत्वपूर्ण भूमिका निभाते हैं। ये मोलेक्यूल ऊतकीय बायोलॉजी में विभिन्न क्रियाओं को नियंत्रित करते हैं, जैसे कोशिका की विकास, संगठन, और संरचना।
- चार बीटा-श्रृंखला आईसोफॉर्म हैं जो लैमिनिन समूह में पाए जाते हैं: LAMB1, LAMB2, LAMB3, LAMB4 यह ज्ञात लैमिनिन ट्राइमर के साथ संयोजन नहीं किया जाता है और इसका कार्य अभी भी अच्छी तरह से समझा नहीं जा सका है।
- तीन गामा-श्रृंखला आईसोफॉर्म हैं जो लैमिनिन फैमिली में पाए जाते हैं: LAMC1, LAMC2, LAMC3
प्रारंभ में, जैसे जैसे लैमिनिन मोलेक्यूलें खोजी जाती थीं, उन्हें उनके खोजकर्ताओं के अनुसार नंबरिंग किया जाता था, जैसे लैमिनिन-1, लैमिनिन-2, लैमिनिन-3 इत्यादि। लेकिन बाद में, इन्हें वर्णित किया गया कि प्रत्येक आईसोफॉर्म में कौन सी श्रृंखलाएं उपस्थित हैं, जैसे लैमिनिन-111, लैमिनिन-211 इत्यादि।[7][8]
| पुराना नामकरण | पुराने पर्यायवाची | शृंखला रचना | नया नामकरण |
|---|---|---|---|
| लैमिनिन-1 | ईएचएस लैमिनिन | α1β1γ1 | लैमिनिन-111 |
| लैमिनिन-2 | मेरोसिन | α2β1γ1 | लैमिनिन-211 |
| लैमिनिन3 | एस -लैमिनिन | α1β2γ1 | लैमिनिन-121 |
| लैमिनिन-4 | एस-मेरोसिन | α2β2γ1 | लैमिनिन-221 |
| लैमिनिन-5 / लैमिनिन-5A | कलिनिन, एपिलीग्रिन, नाइसिन, लैडसिन | α3Aβ3γ2 | लैमिनिन-332 / लैमिनिन3A32 |
| लैमिनिन-5B | α3Bβ3γ2 | लैमिनिन-3B32 | |
| लैमिनिन-6 / लैमिनिन6A | के-लैमिनिन | α3Aβ1γ1 | लैमिनिन-311 / लैमिनिन3A11 |
| लैमिनिन-7 /लैमिनिन-7A | के-लैमिनिन | α3Aβ2γ1 | लैमिनिन-321 / लैमिनिन-3A21 |
| लैमिनिन-8 | α4β1γ1 | लैमिनिन-411 | |
| लैमिनिन -9 | α4β2γ1 | लैमिनिन-421 | |
| लैमिनिन-10 | ड्रोसोफिला जैसा लैमिनिन | α5β1γ1 | लैमिनिन-511 |
| लैमिनिन-11 | α5β2γ1 | लैमिनिन-521 | |
| लैमिनिन-12 | α2β1γ3 | लैमिनिन-213 | |
| लैमिनिन14 | α4β2γ3 | लैमिनिन-423 | |
| α5β2γ2 | लैमिनिन-522 | ||
| लैमिनिन-15 | α5β2γ3 | लैमिनिन-523 |
कार्य
लैमिनिन एकाधीन नेटवर्क बनाते हैं और एंटैक्टिन, फाइब्रोनेक्टिन, और पर्लिकैन के माध्यम से टाइप IV कॉलेजन नेटवर्क के साथ जुड़े होते हैं। इसके अलावा, वे इंटेग्रिन्स और अन्य प्लाज्मा मेम्ब्रेन मोलेक्यूलों के माध्यम से कोशिका मेम्ब्रेन्स से जुड़ते हैं, जैसे डिस्ट्रोग्लाइकन ग्लायकोप्रोटीन कॉम्प्लेक्स और लुथेरन ब्लड ग्रुप ग्लायकोप्रोटीन।[9][10] लैमिनिन और उसके संबंधित मोलेक्यूलों के मध्य ये समन्वय कोशिका जोड़ और विभिन्न ऊतकीय प्रक्रियाओं में महत्वपूर्ण योगदान करते हैं। ये समन्वय कोशिका और प्रतिभेदन, कोशिका की आकार और गति, ऊतक फेनोटाइप के रखरखाव, और ऊतक की जीवित रहने की संरचना में महत्वपूर्ण भूमिका निभाते हैं। लैमिनिन के कुछ बायोलॉजिकल कार्य विशिष्ट एमिनो एसिड सीक्वेंसेज या लैमिनिन के टुकड़ों से जुड़े रहने से संबंधित हैं।[4] उदाहरण के रूप में, लैमिनिन के अल्फा-श्रृंखला पर स्थित पेप्टाइड अनुक्रम ने अंतःसांचरिक कोशिकाओं के संलग्नता को प्रोत्साहित करता है।[11]
लैमिनिन अल्फा-4 विभिन्न ऊतकों में पाया जाता है जिसमें पेरिफेरल नर्व, डॉर्सल रूट गैंगलियन, स्केलीटल मस्कल्स और कैपिलेरीज़ शामिल हैं। न्यूरोमस्कुलर जंक्शन में, यह सिनैप्टिक विशेषीकरण के लिए आवश्यक होता है। [12] लैमिनिन-जी डोमेन की संरचना का अनुमान पेंट्रैक्सिन की संरचना की तरह किया गया है। पेंट्रैक्सिन एक प्रकार का प्रोटीन है जो इम्यून संरचनाओं में भूमिका निभाता है। इसलिए, लैमिनिन-जी डोमेन के संरचना का अनुमान लगाया गया है कि यह भी विभिन्न प्रोटीन-प्रोटीन इंटरैक्शन में भूमिका निभा सकता है और ऊतकीय बायोलॉजी में महत्वपूर्ण हो सकता है।[13]
तंत्रिका विकास में भूमिका
लैमिनिन-111 एक प्रमुख सब्सट्रेट है जिसके साथ तंत्रिका अक्षतंतु विवो और इन विट्रो दोनों में विकसित होंगे,। उदाहरण के लिए,यह रेटिना से टेक्टम की ओर जा रहे विकसित रेटिनल गैंगलियन कोशिकाओ को राह बनाता है। इसे प्रायः कोशिका संवर्धन प्रयोगों में एक सब्सट्रेट के रूप में भी उपयोग किया जाता है। लैमिनिन-1 की उपस्थिति इस बात को प्रभावित कर सकती है कि विकास शंकु अन्य संकेतों पर कैसे प्रतिक्रिया करता है। उदाहरण के लिए, लैमिनिन-111 पर उगाए जाने पर विकास शंकु नेट्रिन द्वारा विकर्षित होते हैं, परंतु फ़ाइब्रोनेक्टिन पर उगाए जाने पर नेट्रिन की ओर आकर्षित होते हैं। लेमिनिन-111 का यह प्रभाव संभवतः इंट्राकोशिका यूलर चक्रीय एएमपी के कम होने से होता है।
परिधीय तंत्रिका के पुनर्निर्माण में भूमिका
पिछले पेरिफरल नस चोट के बाद लैमिनिन विकिरण स्थान पर आकर्षित होते हैं और ये श्वान कोशिकाएं इसे छिपाती हैं। पेरिफरल तंत्रिका तंत्र के न्यूरोन इंटीग्रिन रिसेप्टर्स का अभिव्यक्ति करते हैं जो लैमिनिन्स से जुड़ते हैं और चोट के बाद न्यूरोरीजनरेशन को प्रोत्साहित करते हैं।[14]
पैथोलॉजी
एक विशेष लैमिनिन, लैमिनिन-211 की नकारात्मक संरचना, जन्मजात मांसपेशीय डिस्ट्रोफी के एक रूप का कारण है।[15] लैमिनिन-211 एक लैमिनिन, अल्फा 2|α2, लैमिनिन, बीटा 1|β1 और लैमिनिन, गामा 1|γ1 श्रृंखलाओं से बना है। इस लेमिनिन के वितरण में मस्तिष्क और मांसपेशी फाइबर सम्मिलित, हैं। मांसपेशियों में, यह जी क्षेत्र के माध्यम से डिस्ट्रोग्लाइकेन अल्फा-डिस्ट्रोग्लाइकन और आईटीजीए7-सीडी29 से जुड़ता है, और दूसरे छोर से, यह बाह्यकोशिकीय आव्यूह से जुड़ता है।
असामान्य लैमिनिन-332, जो बेसमेंट झिल्ली के लिए उपकला कोशिका आसंजन के लिए आवश्यक है, जंक्शनल एपिडर्मोलिसिस बुलोसा नामक स्थिति की ओर ले जाता है, जिसमें सामान्यीकृत फफोले, त्वचा और म्यूकोसा के विपुल दानेदार ऊतक और दांतों में गड्ढे होते हैं।
किडनी फिल्टर में खराबी लैमिनिन-521 मूत्र में प्रोटीन के रिसाव और नेफ्रोटिक सिंड्रोम का कारण बनता है।[5]
कैंसर में भूमिका
लैमिनिन के कुछ आइसोफॉर्म को कैंसर पैथोफिज़ियोलॉजी में सम्मिलित, किया गया है। आंतरिक राइबोसोम प्रवेश स्थल (आईआरईएस) को धारण करने वाले अधिकांश प्रतिलेख संबंधित प्रोटीन के माध्यम से कैंसर के विकास में सम्मिलित, होते हैं। ट्यूमर की प्रगति में एक महत्वपूर्ण घटना जिसे उपकला से मेसेनकाइमल संक्रमण (ईएमटी) कहा जाता है, कार्सिनोमा कोशिकाओं को आक्रामक गुण प्राप्त करने की अनुमति देती है। ईएमटी के समय बाह्य आव्यूह घटक लैमिनिन बी1 का ट्रांसलेशनल सक्रियण हाल ही में आईआरईएस-मध्यस्थ तंत्र का सुझाव देते हुए रिपोर्ट किया गया है। इस अध्ययन में, लैमिनिन बी1 की आईआरईएस गतिविधि स्वतंत्र बाइसिस्ट्रोनिक रिपोर्टर के जांच द्वारा निर्धारित की गई थी।
मजबूत प्रमाण LamB1 के आईआरईएस-संचालित अनुवाद पर गुप्त प्रमोटर या स्प्लिस साइटों के प्रभाव को बाहर करते हैं। इसके अतिरिक्त , वैकल्पिक प्रतिलेखन प्रारंभ साइटों या पॉलीएडेनाइलेशन संकेतों से उत्पन्न होने वाली कोई अन्य LamB1 एमआरएनए प्रजाति का पता नहीं लगाया गया जो इसके अनुवाद संबंधी नियंत्रण के लिए जिम्मेदार हो। LamB1 5'-अनट्रांसलेटेड क्षेत्र की मैपिंग से स्टार्ट कोडन के -293 और -1 अपस्ट्रीम के बीच न्यूनतम LamB1 आईआरईएस मोटिफ का पता चला। विशेष रूप से, आरएनए आत्मीयता शुद्धि से पता चला कि ला प्रोटीन लैमबी1 आईआरईएस के साथ परस्पर क्रिया करता है। ईएमटी के दौरान इस अंतःक्रिया और इसके नियमन की पुष्टि राइबोन्यूक्लियोप्रोटीन इम्युनोप्रेसेपिटेशन द्वारा की गई थी। इसके अतिरिक्त , LamB1आईआरईएस अनुवाद को सकारात्मक रूप से संशोधित करने में सक्षम था। संक्षेप में, इन आंकड़ों से संकेत मिलता है कि LamB1 आईआरईएस, La से जुड़कर सक्रिय होता है जिससे हेपेटोकोशिका यूलर ईएमटी के समय अनुवादकीय उत्तेजना होती है।[16]
कोशिका, कल्चर में उपयोग
एसीएम के अन्य प्रमुख घटकों, जैसे कॉलाजन और फाइब्रोनेक्टिन के साथ मिलकर, लैमिनिन्स का उपयोग मैमलियन कोशिका कल्चर को बढ़ाने के लिए किया गया है, विशेष रूप से जनसंख्या-बहुपोषीत स्टेम कोशिका के विषय में, साथ ही कुछ प्राथमिक कोशिका कल्चरों के विषय में, जो अन्य उपस्तरों पर प्रसारित करना कठिन हो सकता है। प्राकृतिक स्रोत से दो प्रकार के लैमिनिन व्यापारिक रूप से उपलब्ध हैं। माउस सार्कोमास से निकाले गए लैमिनिन-111 एक प्रसिद्ध लैमिनिन प्रकार है, साथ ही मानव प्लेसेंटा से लैमिनिन मिश्रण भी व्यापारिक रूप से उपलब्ध हैं, जो प्राथमिक रूप से लैमिनिन-211, 411 या 511 से मेल खाते हैं, यह आपके आपूर्तक पर निर्भर करता है।[17] विभिन्न लैमिनिन आइसोफॉर्म को प्राकृतिक रूप से शुद्ध रूप में ऊतकों से अलग करना अत्यंत कठिन होता है क्योंकि इसमें विस्तारित क्रॉस-लिंकिंग और प्रोटेलोलिटिक एंजाइम्स या कम पीएच जैसे कठोर निकालने की आवश्यकता होती है, जो कीटाणु-विघटन का कारण बनती है। इसलिए, 2000 ईसवी से पहले ही रिकॉम्बिनेंट लैमिनिन उत्पन्न किया जा रहा है।[18]इससे यह संभव हुआ कि लैमिनिन्स जो मानव शरीर में हैं, उनका इन विट्रो में महत्वपूर्ण भूमिका हो सकता है। 2008 में, दो समूहों ने स्वतंत्र रूप से प्राकृतिक लैमिनिन-511 के ऊपर चूहे के भ्रूणीय स्टेम कोशिका को महीनों तक उगाया जा सकता है,[19][20]बाद में, रोडिन और उनके सहकर्मी ने दिखाया कि रिकॉम्बिनेंट लैमिनिन-511 का उपयोग करके पूरी तरह से जेनो-फ्री और परिभाषित कोशिका कल्चर वातावरण बनाया जा सकता है जिसमें मानव बहुपोषी स्टेम कोशिका और मानव इंडुस्ट्रियल औद्योगिक कोशिका को पालने के लिए उपयोग किया जा सकता है।[21]
लैमिनिन क्षेत्र
| Laminin Domain I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | Laminin_I | ||||||||
| Pfam | PF06008 | ||||||||
| InterPro | IPR009254 | ||||||||
| |||||||||
| Laminin Domain II | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | Laminin_II | ||||||||
| Pfam | PF06009 | ||||||||
| InterPro | IPR010307 | ||||||||
| |||||||||
| Laminin B (Domain IV) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | Laminin_B | ||||||||
| Pfam | PF00052 | ||||||||
| InterPro | IPR000034 | ||||||||
| |||||||||
| Laminin EGF-like (Domains III and V) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
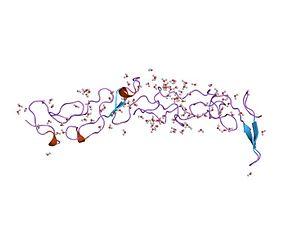 crystal structure of three consecutive laminin-type epidermal growth factor-like (le) modules of laminin gamma1 chain harboring the nidogen binding site | |||||||||
| Identifiers | |||||||||
| Symbol | Laminin_EGF | ||||||||
| Pfam | PF00053 | ||||||||
| Pfam clan | CL0001 | ||||||||
| InterPro | IPR002049 | ||||||||
| PROSITE | PDOC00021 | ||||||||
| SCOP2 | 1tle / SCOPe / SUPFAM | ||||||||
| |||||||||
| Laminin G domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
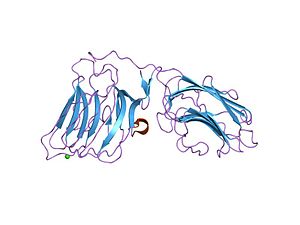 laminin alpha 2 chain lg4-5 domain pair, ca1 site mutant | |||||||||
| Identifiers | |||||||||
| Symbol | Laminin_G_1 | ||||||||
| Pfam | PF00054 | ||||||||
| Pfam clan | CL0004 | ||||||||
| InterPro | IPR012679 | ||||||||
| SCOP2 | 1qu0 / SCOPe / SUPFAM | ||||||||
| |||||||||
| Laminin G domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
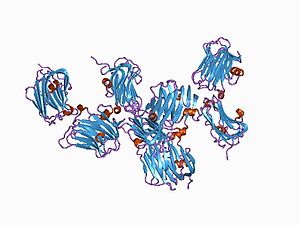 the structure of the ligand-binding domain of neurexin 1beta: regulation of lns domain function by alternative splicing | |||||||||
| Identifiers | |||||||||
| Symbol | Laminin_G_2 | ||||||||
| Pfam | PF02210 | ||||||||
| Pfam clan | CL0004 | ||||||||
| InterPro | IPR012680 | ||||||||
| SMART | TSPN | ||||||||
| |||||||||
| Laminin N-terminal (Domain VI) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||
| Symbol | Laminin_N | ||||||||
| Pfam | PF00055 | ||||||||
| Pfam clan | CL0202 | ||||||||
| InterPro | IPR008211 | ||||||||
| SMART | LamNT | ||||||||
| SCOP2 | 1klo / SCOPe / SUPFAM | ||||||||
| |||||||||
लैमिनिन में कई संरक्षित अनुक्रम प्रोटीन क्षेत्र होते हैं।
लैमिनिन I और लैमिनिन II
लैमिनिन ट्राइमेरिक अणु हैं; लैमिनिन-1 एक अल्फा1 बीटा1 गामा1 ट्रिमर है। यह सुझाव दिया गया है कि लैमिनिन ए, बी1 और बी2 से प्रोटीन क्षेत्र I और II एक साथ आकर एक ट्रिपल हेलिकल |कुंडलित-कुंडल माध्यमिक संरचना बना सकते हैं।[22]
लेमिनिन बी
अनुक्रम IV के रूप में भी ज्ञात लैमिनिन बी क्षेत्र एक बाह्यकक्ष है जिसका कार्य अज्ञात है। यह अनुक्रम IV कई विभिन्न प्रोटीन में पाया जाता है, जिसमें निम्नलिखित सम्मिलित हैं: बेसमेंट मेम्ब्रेन से हेपरान सल्फेट प्रोटेग्लाइकन, काईऩोर्हेब्डीटीज एलिगेंस से लेमिनिन जैसा प्रोटीन और लेमिनिन सम्मिलित, हैं। लैमिनिन IV क्षेत्र छोटी लैमिनिन श्रृंखलाओं में नहीं पाया जाता है।
लैमिनिन ईजीएफ-लाइक
[23][24] प्रत्येक लैमिनिन उपयोगी मेज के विभिन्न प्रकार के ग्लोब्यूलर डोमेन के अलावा, इसके पहले अर्ध में लगभग 60 एमिनो एसिड के लंबाई के संचार को शामिल किया गया है जो आठ संरक्षित सिस्टीन को सम्मिलित करते हैं। इस डोमेन की तृतीयक संरचना इसके N-टर्मिनस में ईजीएफ-जैसे मॉड्यूल के समान है।[23] [24]इसे 'एलई' या 'लैमिनिन-टाइप ईजीएफ-लाइक' क्षेत्र के रूप में भी जाना जाता है। लैमिनिन के विभिन्न रूपों में लैमिनिन ईजीएफ-जैसे क्षेत्र की प्रतियों की संख्या अत्यधिक परिवर्तनशील है; 3 से लेकर 22 तक प्रतियाँ मिली हैं। चूहे की मांसपेशी लैमिनिन गामा-1 श्रृंखला में, सातवें एलई क्षेत्र को एकमात्र ऐसा दिखाया गया है जो निडोजेन के लिए उच्च आत्मीयता के साथ आणविक बाइंडिंग करता है।[25] बाइंडिंग-साइट लूप C1-C3 और C5-C6 के भीतर सतह पर स्थित हैं।[23][24]लैमिनिन में लैमिनिन ईजीएफ-जैसे क्षेत्र की लंबी लगातार श्रृंखलाएं सीमित रॉड-जैसे तत्व बनाती हैं, जो बेसमेंट झिल्ली के लैमिनिन नेटवर्क के निर्माण में अंतर निर्धारित करती हैं।[26][27]
लेमिनिन जी
लैमिनिन गोलाकार (जी) क्षेत्र, जिसे एलएनएस (लैमिनिन-अल्फा, न्यूरेक्सिन और सेक्स हार्मोन-बाइंडिंग ग्लोब्युलिन) क्षेत्र के रूप में भी जाना जाता है, औसतन लंबाई में 177 अमीनो अम्ल होता है और विभिन्न लैमिनिनसमूह के सदस्यों में एक से छह प्रतियों में पाया जा सकता है। साथ ही बड़ी संख्या में अन्य बाह्य कोशिकीय प्रोटीन भी।[28] उदाहरण के लिए, सभी लैमिनिन अल्फा-चेन में पांच लैमिनिन जी क्षेत्र होते हैं, सभी कोलेजनसमूह प्रोटीन में एक लैमिनिन जी क्षेत्र होता है, सीएनटीएनएपी प्रोटीन में चार लैमिनिन जी क्षेत्र होते हैं, जबकि न्यूरेक्सिन 1 और 2 प्रत्येक में छह लैमिनिन जी क्षेत्र होते हैं। औसतन, लैमिनिन जी क्षेत्र रखने वाले प्रोटीन का लगभग एक चौथाई हिस्सा इन लैमिनिन जी क्षेत्र द्वारा स्वयं लिया जाता है। सबसे छोटा लैमिनिन जी क्षेत्र कोलेजन प्रोटीन (COL24A1; 77 AA) में से एक में पाया जा सकता है और सबसे बड़ा क्षेत्र TSPEAR (219 AA) में पाया जा सकता है।
लैमिनिन जी प्रोटीन क्षेत्र का सटीक कार्य मायावी बना हुआ है, और अलग-अलग लैमिनिन जी मॉड्यूल के लिए कई प्रकार के बाइंडिंग फ़ंक्शन बताए गए हैं। उदाहरण के लिए, लैमिनिन अल्फा 1 और अल्फा 2 चेन में प्रत्येक में पांच सी टर्मिनल लैमिनिन जी क्षेत्र होते हैं, जहां केवल एलजी 4 और एलजी 5 क्षेत्र में हेपरिन, सल्फेटाइड्स और कोशिका सतह रिसेप्टर डिस्ट्रोग्लाइकन के लिए बाध्यकारी साइट होती हैं।[29] ऐसा प्रतीत होता है कि लैमिनिन जी-युक्त प्रोटीन की कोशिका आसंजन, कोशिका, सिग्नलिंग, कोशिका, माइग्रेशन, संयोजन और विभेदन (कोशिका,ुलर) में विभिन्न प्रकार की भूमिकाएँ होती हैं।
लैमिनिन एन-टर्मिनल
बेसमेंट मेम्ब्रेन असेंबली एक सहकारी प्रक्रिया है जिसमें लेमिनिन अपने एन-टर्मिनल क्षेत्र (एलएन या क्षेत्र VI) के माध्यम से पोलीमराइज़ होते हैं और अपने जी क्षेत्र के माध्यम से कोशिका, (जीव विज्ञान) सतह पर लंगर डालते हैं। नेट्रिंस हेटरोटाइपिक एलएन क्षेत्र इंटरैक्शन के माध्यम से भी इस नेटवर्क से जुड़ सकते हैं।[27]इससे इंटेग्रिन और डिस्ट्रोग्लाइकेन (और संभवतः अन्य रिसेप्टर्स) के माध्यम से कोशिका, सिग्नलिंग को अनुयाई लैमिनिन में भर्ती किया जाता है। इस एलएन क्षेत्र-निर्भर स्व-असेंबली को बेसमेंट झिल्ली की अखंडता के लिए महत्वपूर्ण माना जाता है, जैसा कि अल्फा 2 लैमिनिन श्रृंखला से एलएन मॉड्यूल के विलोपन वाले मांसपेशीय दुर्विकास के आनुवंशिक रूपों द्वारा उजागर किया गया है।[30] लैमिनिन एन-टर्मिनल क्षेत्र लैमिनिन अल्फा 3ए, अल्फा 4 और गामा 2 को छोड़कर सभी लैमिनिन और नेट्रिन प्रोटीन सबयूनिट में पाया जाता है।
लैमिनिन क्षेत्र युक्त मानव प्रोटीन
- लैमिनिन क्षेत्र I: सभी लैमिनिन अल्फा चेन (LAMA1, LAMA2, LAMA3, LAMA4, LAMA5)
- लैमिनिन क्षेत्र II: सभी लैमिनिन अल्फा चेन (LAMA1, LAMA2, LAMA3, LAMA4, LAMA5)
- लैमिनिन बी (क्षेत्र IV): सभी लैमिनिन अल्फा चेन (LAMA1, LAMA2, LAMA3, LAMA4, LAMA5), गामा चेन (LAMC1, LAMC2, LAMC3), और पेरलेकन (HSPG2)
- लैमिनिन आँखें ीएफ-जैसे (क्षेत्र III और V): सभी लैमिनिन चेन (LAMA1, LAMA2, LAMA3, LAMA4, LAMA5, LAMB1, LAMB2, LAMB3, LAMB4, LAMC1, LAMC2, LAMC3), अट्रैक्टिंस (ATRN, ATRNL1), कैडेरिन EGF एलएजी सात-पास जी-प्रकार रिसेप्टर्स (सीईएलएसआर1, सीईएलएसआर2, सीईएलएसआर3), ईजीएफ-जैसे क्षेत्र प्रोटीन (सीआरईएलडी1, सीआरईएलडी2) के साथ सिस्टीन-समृद्ध, एकाधिक ईजीएफ-जैसे क्षेत्र प्रोटीन (जिप्सम, एमईजीएफ8, एमईजीएफ9, एमईजीएफ10, पीईएआर1), अधिकांश नेट्रिंस (एनटीएन1, एनटीएन3, एनटीएन4, एनटीएनजी1, एनटीएनजी2), म्यूसिन्स 3ए और 3बी (एमयूसी3ए, एमयूसी3बी), क्लास एफ स्केवेंजर रिसेप्टर्स (एससीएआरएफ1, एससीएआरएफ2), स्टेबिलिन्स (एसटीएबी1, एसटीएबी2), एग्रीन (एजीआरआईएन), एंजियोपोइटिन-1 रिसेप्टर ( टीईके टायरोसिन किनसे), पेर्लेकैन (एचएसपीजी2), टेनस्किन एन (टीएनएन (जीन)), और अशेरिन (यूएसएच2ए)।
- लैमिनिन जी क्षेत्र: सभी लैमिनिन अल्फा चेन (LAMA1, LAMA2, LAMA3, LAMA4, LAMA5), कैडेरिन EGF LAG सात-पास जी-टाइप रिसेप्टर्स (CELSR1, CELSR2, CELSR3), कॉन्टैक्टिन-जुड़े प्रोटीन (CNTNAP1, CNTNAP2, CNTNAP3, CNTNAP3B, CNTNAP4, CNTNAP5), कुछ कोलेजन (COL5A1, COL5A3, COL9A1, COL11A1, COL11A2, COL12A1, COL14A1, COL15A1, COL16A1, COL18A1, COL19A1, COL20A1, COL21A1, COL22A1, COL2 4ए1, सीओएल27ए1), क्रम्ब्स होमोलोग्स 1 और 2 (सीआरबी1 , CRB2), वसा होमोलोग्स (FAT1, FAT2, FAT3, FAT4), NEL-जैसे प्रोटीन (NELL1, NELL2), न्यूरेक्सिन (NRXN1, NRXN2, NRXN3), स्लिट होमोलोग्स (SLIT1, SLIT2, SLIT3), थ्रोम्बोस्पोंडिन्स (THBS1, THBS2) , THBS3, THBS4, TSPEAR), एग्रीन (AGRIN), चोंड्रोइटिन सल्फेट प्रोटीयोग्लाइकेन 4 (CSPG4), आईज़ शट होमोलोग (EYS), ग्रोथ अरेस्ट-स्पेसिफिक प्रोटीन 6 (GAS6), पेरलेकन (HSPG2), पिकाचुरिन (EGFLAM), प्रोटीन S (PROS1), सेक्स हार्मोन-बाइंडिंग ग्लोब्युलिन (SHBG) और अशेरिन (USH2A)
- लैमिनिन एन-टर्मिनल (क्षेत्र VI): अधिकांश लैमिनिन चेन (LAMA1, LAMA2, LAMA3, LAMA5, LAMB1, LAMB2, LAMB3, LAMB4, LAMC1, LAMC3), अधिकांश नेट्रिन (NTN1, NTN3, NTN4, NTNG1, NTNG2), और अशेरिन (USH2A)
यह भी देखें
संदर्भ
- ↑ DOI 10.1007/s00441-009-0838-2
- ↑ Timpl R, Rohde H, Robey PG, Rennard SI, Foidart JM, Martin GR (October 1979). "लेमिनिन--बेसमेंट झिल्लियों से प्राप्त एक ग्लाइकोप्रोटीन". The Journal of Biological Chemistry. 254 (19): 9933–7. doi:10.1016/S0021-9258(19)83607-4. PMID 114518.
- ↑ Aumailley M, Bruckner-Tuderman L, Carter WG, Deutzmann R, Edgar D, Ekblom P, Engel J, Engvall E, Hohenester E, Jones JC, Kleinman HK, Marinkovich MP, Martin GR, Mayer U, Meneguzzi G, Miner JH, Miyazaki K, Patarroyo M, Paulsson M, Quaranta V, Sanes JR, Sasaki T, Sekiguchi K, Sorokin LM, Talts JF, Tryggvason K, Uitto J, Virtanen I, von der Mark K, Wewer UM, Yamada Y, Yurchenco PD (August 2005). "एक सरलीकृत लेमिनिन नामकरण". Matrix Biology. 24 (5): 326–32. doi:10.1016/j.matbio.2005.05.006. PMID 15979864.
- ↑ 4.0 4.1 M. A. Haralson; John R. Hassell (1995). Extracellular matrix: a practical approach. Ithaca, N.Y: IRL Press. ISBN 978-0-19-963220-6.
- ↑ 5.0 5.1 Yurchenco PD, Patton BL (2009). "बेसमेंट मेम्ब्रेन असेंबली के विकासात्मक और रोगजनक तंत्र". Current Pharmaceutical Design. 15 (12): 1277–94. doi:10.2174/138161209787846766. PMC 2978668. PMID 19355968.
- ↑ Colognato H, Yurchenco PD (June 2000). "Form and function: the laminin family of heterotrimers". Developmental Dynamics. 218 (2): 213–34. doi:10.1002/(SICI)1097-0177(200006)218:2<213::AID-DVDY1>3.0.CO;2-R. PMID 10842354.
- ↑ Royce, Peter M., ed. (2002). Connective tissue and its heritable disorders: molecular, genetic, and medical aspects (2nd ed.). New York: Wiley-Liss. p. 306. ISBN 9780471251859.
- ↑ Kühn, Klaus (1997). "Extracellular matrix constituents as integrin ligands". In Elbe, Johannes A. (ed.). इंटीग्रिन-लिगैंड इंटरैक्शन. New York: Chapman & Hall. p. 50. ISBN 9780412138614.
- ↑ Smith J, Ockleford CD (January 1994). "Laser scanning confocal examination and comparison of nidogen (entactin) with laminin in term human amniochorion". Placenta. 15 (1): 95–106. doi:10.1016/S0143-4004(05)80240-1. PMID 8208674.
- ↑ Ockleford C, Bright N, Hubbard A, D'Lacey C, Smith J, Gardiner L, Sheikh T, Albentosa M, Turtle K (October 1993). "Micro-trabeculae, macro-plaques or mini-basement membranes in human term fetal membranes?". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 342 (1300): 121–36. doi:10.1098/rstb.1993.0142. PMID 7904354.
- ↑ Beck et al., 1999.[specify]
- ↑ Ichikawa N, Kasai S, Suzuki N, Nishi N, Oishi S, Fujii N, Kadoya Y, Hatori K, Mizuno Y, Nomizu M, Arikawa-Hirasawa E (April 2005). "Identification of neurite outgrowth active sites on the laminin alpha4 chain G domain". Biochemistry. 44 (15): 5755–62. doi:10.1021/bi0476228. PMID 15823034.
- ↑ Beckmann G, Hanke J, Bork P, Reich JG (February 1998). "Merging extracellular domains: fold prediction for laminin G-like and amino-terminal thrombospondin-like modules based on homology to pentraxins". Journal of Molecular Biology. 275 (5): 725–30. doi:10.1006/jmbi.1997.1510. PMID 9480764.
- ↑ Nieuwenhuis, B.; Haenzi, B.; Andrews, M. R.; Verhaagen, J.; Fawcett, J. W. (2018). "इंटीग्रिन तंत्रिका तंत्र की चोट के बाद एक्सोनल पुनर्जनन को बढ़ावा देता है". Biological Reviews. 93 (3): 1339–1362. doi:10.1111/brv.12398. PMC 6055631. PMID 29446228.
- ↑ Hall TE, Bryson-Richardson RJ, Berger S, Jacoby AS, Cole NJ, Hollway GE, Berger J, Currie PD (April 2007). "The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy". Proceedings of the National Academy of Sciences of the United States of America. 104 (17): 7092–7. Bibcode:2007PNAS..104.7092H. doi:10.1073/pnas.0700942104. PMC 1855385. PMID 17438294.
- ↑ Petz M, Them N, Huber H, Beug H, Mikulits W (January 2012). "ला घातक उपकला से मेसेनकाइमल संक्रमण के दौरान लैमिनिन बी1 के आईआरईएस-मध्यस्थ अनुवाद को बढ़ाता है". Nucleic Acids Research. 40 (1): 290–302. doi:10.1093/nar/gkr717. PMC 3245933. PMID 21896617.
- ↑ Wondimu Z, Gorfu G, Kawataki T, Smirnov S, Yurchenco P, Tryggvason K, Patarroyo M (March 2006). "Characterization of commercial laminin preparations from human placenta in comparison to recombinant laminins 2 (alpha2beta1gamma1), 8 (alpha4beta1gamma1), 10 (alpha5beta1gamma1)". Matrix Biology. 25 (2): 89–93. doi:10.1016/j.matbio.2005.10.001. PMID 16289578.
- ↑ Kortesmaa, Jarkko; Yurchenco, Peter; Tryggvason, Karl (19 May 2000). "Recombinant Laminin-8 (α4β1γ1)". Journal of Biological Chemistry. 275 (20): 14853–14859. doi:10.1074/jbc.275.20.14853. PMID 10809728.
- ↑ Miyazaki T, Futaki S, Hasegawa K, Kawasaki M, Sanzen N, Hayashi M, Kawase E, Sekiguchi K, Nakatsuji N, Suemori H (October 2008). "पुनः संयोजक मानव लैमिनिन आइसोफॉर्म मानव भ्रूण स्टेम कोशिकाओं के अविभाजित विकास का समर्थन कर सकते हैं". Biochemical and Biophysical Research Communications. 375 (1): 27–32. doi:10.1016/j.bbrc.2008.07.111. PMID 18675790.
- ↑ Domogatskaya A, Rodin S, Boutaud A, Tryggvason K (November 2008). "Laminin-511 but not -332, -111, or -411 enables mouse embryonic stem cell self-renewal in vitro". Stem Cells. 26 (11): 2800–9. doi:10.1634/stemcells.2007-0389. PMID 18757303.
- ↑ Rodin S, Domogatskaya A, Ström S, Hansson EM, Chien KR, Inzunza J, Hovatta O, Tryggvason K (June 2010). "Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511". Nature Biotechnology. 28 (6): 611–5. doi:10.1038/nbt.1620. hdl:10616/40259. PMID 20512123. S2CID 10801152.
- ↑ Sasaki M, Kleinman HK, Huber H, Deutzmann R, Yamada Y (November 1988). "लैमिनिन, एक मल्टीडोमेन प्रोटीन। ए श्रृंखला में बेसमेंट झिल्ली प्रोटीयोग्लाइकन और लेमिनिन बी श्रृंखला के साथ एक अद्वितीय गोलाकार डोमेन और समरूपता है।". The Journal of Biological Chemistry. 263 (32): 16536–44. doi:10.1016/S0021-9258(18)37424-6. PMID 3182802.
- ↑ 23.0 23.1 23.2 Stetefeld J, Mayer U, Timpl R, Huber R (April 1996). "निडोजेन बाइंडिंग साइट को आश्रय देने वाली लैमिनिन गामा1 श्रृंखला के लगातार तीन लैमिनिन-प्रकार के एपिडर्मल विकास कारक-जैसे (एलई) मॉड्यूल की क्रिस्टल संरचना". Journal of Molecular Biology. 257 (3): 644–57. doi:10.1006/jmbi.1996.0191. PMID 8648630.
- ↑ 24.0 24.1 24.2 Baumgartner R, Czisch M, Mayer U, Pöschl E, Huber R, Timpl R, Holak TA (April 1996). "समाधान में लैमिनिन गामा1 श्रृंखला के निडोजेन बाइंडिंग एलई मॉड्यूल की संरचना". Journal of Molecular Biology. 257 (3): 658–68. doi:10.1006/jmbi.1996.0192. PMID 8648631.
- ↑ Mayer U, Pöschl E, Gerecke DR, Wagman DW, Burgeson RE, Timpl R (May 1995). "Low nidogen affinity of laminin-5 can be attributed to two serine residues in EGF-like motif gamma 2III4". FEBS Letters. 365 (2–3): 129–32. doi:10.1016/0014-5793(95)00438-F. PMID 7781764. S2CID 21559588.
- ↑ Beck K, Hunter I, Engel J (February 1990). "Structure and function of laminin: anatomy of a multidomain glycoprotein". FASEB Journal. 4 (2): 148–60. doi:10.1096/fasebj.4.2.2404817. PMID 2404817.
- ↑ 27.0 27.1 Yurchenco PD, Cheng YS (August 1993). "लैमिनिन में स्व-संयोजन और कैल्शियम-बाध्यकारी साइटें। एक तीन-हाथ वाला इंटरेक्शन मॉडल". The Journal of Biological Chemistry. 268 (23): 17286–99. doi:10.1016/S0021-9258(19)85334-6. PMID 8349613.
- ↑ "लैमिनिन जी डोमेन". InterPro. European Bioinformatics Institute. Retrieved 22 February 2016.
- ↑ Tisi D, Talts JF, Timpl R, Hohenester E (April 2000). "Structure of the C-terminal laminin G-like domain pair of the laminin alpha2 chain harbouring binding sites for alpha-dystroglycan and heparin". The EMBO Journal. 19 (7): 1432–40. doi:10.1093/emboj/19.7.1432. PMC 310212. PMID 10747011.
- ↑ Xu H, Wu XR, Wewer UM, Engvall E (November 1994). "Murine muscular dystrophy caused by a mutation in the laminin alpha 2 (Lama2) gene". Nature Genetics. 8 (3): 297–302. doi:10.1038/ng1194-297. PMID 7874173. S2CID 21549628.
बाहरी संबंध
- The Laminin Protein
- Laminin at the US National Library of Medicine Medical Subject Headings (MeSH)
- Overview of all the structural information available in the PDB for UniProt: P19137 (Laminin subunit alpha-1) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: P24043 (Laminin subunit alpha-2) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: O15230 (Laminin subunit alpha-5) at the PDBe-KB.
- "How I learned to love laminin". YouTube. Imperial College London. April 13, 2011. (lecture by Professor Erhard Hoheneseter)
