डेंड्रोटॉक्सिन
डेंड्रोटॉक्सिन मांबा सांप (डेंड्रोस्पिस) द्वारा उत्पादित प्रीसानेप्टिक (अंतर्ग्रथनपूर्व) न्यूरोटोक्सिन का एक वर्ग है जो न्यूरॉन्स में वोल्टेज-गेटेड पोटेशियम चैनलों के विशेष उपप्रकारों को अवरुद्ध करता है, जिससे न्यूरोमस्कुलर जंक्शनों पर एसिट्लोक्लिन की निस्तार बढ़ जाती है। पोटेशियम चैनलों के लिए उनकी उच्च शक्ति और चयनात्मकता के कारण, डेंड्रोटॉक्सिन इन आयन चैनल प्रोटीनों की संरचना और कार्य का अध्ययन करने के लिए औषधीय उपकरण के रूप में अत्यंत उपयोगी प्रमाणित हुए हैं।
तंत्रिका तंत्र में कार्यात्मक प्रभाव
डेंड्रोटॉक्सिन को न्यूरोनल ऊतक में वोल्टेज-गेटेड पोटेशियम (K+) चैनलों के विशेष उपप्रकारों को अवरुद्ध करने के लिए दिखाया गया है। तंत्रिका तंत्र में, वोल्टेज-गेटेड K+ चैनल आराम करने वाली झिल्ली क्षमता को नियंत्रित करके नसों और मांसपेशियों की उत्तेजना को नियंत्रित करते हैं। ऐक्शन पोटेंशिअल के दौरान झिल्ली का पुनर्ध्रुवीकरण। डेंड्रोटॉक्सिन को मोटर न्यूरॉन्स[1] के रणवीर के नोड्स को बांधने और इन पोटेशियम चैनलों की गतिविधि को अवरुद्ध करने के लिए दिखाया गया है। इस तरह, डेंड्रोटॉक्सिन एक्शन पोटेंशिअल की अवधि को बढ़ाते हैं और न्यूरोमस्कुलर जंक्शन पर एसिटाइलकोलाइन रिलीज को बढ़ाते हैं, जिसके परिणामस्वरूप मांसपेशियों की हाइपरेन्क्विटिबिलिटी और ऐंठन के लक्षण हो सकते हैं।
डेंड्रोटॉक्सिन संरचना
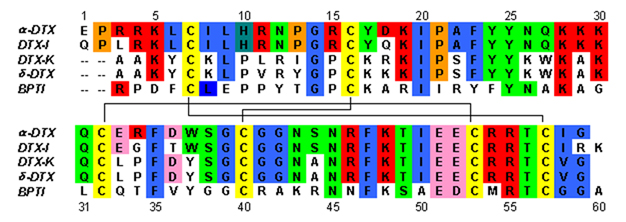
डेंड्रोटॉक्सिन ~ 7kDa प्रोटीन होते हैं जिनमें लगभग 57-60 अमीनो एसिड की एकल पेप्टाइड श्रृंखला होती है।अल्फा-डेंड्रोटॉक्सिन के कई होमोलॉग्स को अलग कर दिया गया है, सभी में थोड़ा अलग अनुक्रम है। हालाँकि, इन प्रोटीनों की आणविक संरचना और तह संरचना सभी समान हैं। डेंड्रोटॉक्सिन में पेप्टाइड के N- टर्मिनस के पास एक बहुत ही कम 310-हेलिक्स होता है, जबकि सी-टर्मिनस के पास दो मोड़ अल्फा-हेलिक्स होता है। दो-फंसे एंटीपैरल β-शीट आणविक संरचना के मध्य भाग पर कब्जा कर लेता है। ये दो β-स्ट्रैंड एक विकृत β-टर्न क्षेत्र[2] से जुड़े हुए हैं जो प्रोटीन की बाध्यकारी गतिविधि के लिए महत्वपूर्ण माना जाता है। सभी डेंड्रोटॉक्सिन तीन डाइसल्फ़ाइड पुलों द्वारा क्रॉस-लिंक्ड हैं, जो प्रोटीन में स्थिरता जोड़ते हैं और इसकी संरचनात्मक संरचना में बहुत योगदान करते हैं। इन डाइसल्फ़ाइड बॉन्ड बनाने वाले सिस्टीन अवशेषों को डेंड्रोटॉक्सिन परिवार के सभी सदस्यों के बीच संरक्षित किया गया है, और वे C7-C57, C16-C40, और C32-C53 (अल्फा-डेंड्रोटॉक्सिन के अनुसार क्रमांकन) पर स्थित हैं।
डेंड्रोटॉक्सिन संरचनात्मक रूप से गोजातीय अग्नाशय ट्रिप्सिन अवरोधक (बीपीटीआई) सहित कुनिट्ज डोमेन-प्रकार सेरीन प्रोटीज अवरोधकों के समरूप हैं। अल्फा-डेंड्रोटॉक्सिन और बीपीटीआई को 35% अनुक्रम पहचान के साथ-साथ समान डाइसल्फ़ाइड बॉन्ड दिखाया गया है। इन दो प्रोटीनों के बीच संरचनात्मक समरूपता के बावजूद, डेंड्रोटॉक्सिन बीपीटीआई जैसी किसी भी मापने योग्य निरोधात्मक प्रोटीज गतिविधि को प्रदर्शित नहीं करते हैं। गतिविधि का यह नुकसान प्रमुख अमीनो एसिड अवशेषों की अनुपस्थिति के परिणामस्वरूप प्रतीत होता है जो संरचनात्मक अंतर पैदा करते हैं जो बीपीटीआई में देखी गई प्रोटीज गतिविधि के लिए आवश्यक प्रमुख इंटरैक्शन में बाधा डालते हैं।
डेंड्रोटॉक्सिन मूल प्रोटीन होते हैं जो तटस्थ पीएच में मौजूद होने पर शुद्ध धनात्मक आवेश करते हैं। डेंड्रोटॉक्सिन के धनात्मक रूप से आवेश किए गए अधिकांश अमीनो एसिड अवशेष संरचना के निचले हिस्से में स्थित होते हैं, जो प्रोटीन के एक तरफ धनायनित डोमेन बनाते हैं। प्रोटीन के तीन प्राथमिक क्षेत्रों में केंद्रित लाइसिन (Lys) और आर्जिनिन (Arg) अवशेषों से धनात्मक आवेश परिणाम: N-टर्मिनस (Arg3, Arg4, Lys5) के पास, C-टर्मिनस (Arg54, Arg55) के पास और पर संकीर्ण β-मोड़ क्षेत्र (Lys28, Lys29, Lys30)।[3] ऐसा माना जाता है कि ये धनात्मक रूप से आवेश किए गए अवशेष डेंड्रोटॉक्सिन बाध्यकारी गतिविधि में एक महत्वपूर्ण भूमिका निभा सकते हैं, क्योंकि वे पोटेशियम चैनलों के छिद्र में आयनिक साइटों (ऋणात्मक रूप से आवेश अमीनो एसिड) के साथ संभावित बातचीत कर सकते हैं।
जैविक गतिविधि
औषध विज्ञान (फार्माकोलॉजी)
एकल डेंड्रोटॉक्सिन अणु अपने निरोधात्मक प्रभाव को लागू करने के लिए पोटेशियम चैनल के साथ विपरीत रूप से जुड़ता है। यह प्रस्तावित है कि डेंड्रोटॉक्सिन के धनायनित डोमेन में धनात्मक रूप से आवेश किए गए अमीनो एसिड अवशेषों और आयन चैनल छिद्र में ऋणात्मक रूप से आवेश किए गए अवशेषों के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन द्वारा इस इंटरैक्शन की मध्यस्थता की जाती है। माना जाता है कि पोटेशियम चैनल, अन्य कटियन-चयनात्मक चैनलों के समान, ऋणात्मक आवेशों का एक बादल है जो चैनल छिद्र के उद्घाटन से पहले होता है जो पोटेशियम आयनों को पारगम्य मार्ग के माध्यम से संचालित करने में मदद करता है। यह सामान्यतः माना जाता है (हालांकि प्रमाणित नहीं हुआ) कि एक डेंड्रोटॉक्सिन अणु चैनल की बाह्य सतह के पास आयनिक साइटों से बंधते हैं और शारीरिक रूप से छिद्रों को बंद कर देते हैं, जिससे आयन प्रवाहकत्त्व को रोका जा सकता है। हालाँकि, इमरेडी और मैककिनोन[4] प्रस्तावित किया है कि डेल्टा-डेंड्रोटॉक्सिन में उनके लक्ष्य प्रोटीन पर एक ऑफ-सेंटर बाध्यकारी साइट हो सकती है, और चैनल की संरचना को बदलकर चैनल को रोक सकता है, बजाय भौतिक रूप से ताकना को अवरुद्ध कर सकता है।
जैविक रूप से महत्वपूर्ण अवशेष
कई अध्ययनों ने यह पहचानने का प्रयास किया है कि डेंड्रोटॉक्सिन की गतिविधि को उनके पोटेशियम चैनल लक्ष्यों के लिए बाध्य करने के लिए कौन से अमीनो एसिड अवशेष महत्वपूर्ण हैं। हार्वे एट अल[5] धनात्मक रूप से आवेशित अवशेषों की पहचान करने के लिए अवशेष-विशिष्ट संशोधनों का उपयोग किया जो डेंड्रोटॉक्सिन- I की अवरुद्ध गतिविधि के लिए महत्वपूर्ण थे। उन्होंने बताया कि एन-टर्मिनल क्षेत्र के पास Lys5 के एसिटिलेशन और बीटा-टर्न क्षेत्र में Lys29 के कारण DTX-I बाइंडिंग एफिनिटी में काफी कमी आई है। इसी तरह के परिणाम डेंड्रोटॉक्सिन-के के साथ साइट-निर्देशित उत्परिवर्तन का उपयोग करके धनात्मक रूप से आवेश किए गए लाइसिन और आर्गिनिन अवशेषों को तटस्थ अलैनिन में बदलने के लिए दिखाए गए हैं। इन परिणामों ने, कई अन्य लोगों के साथ, फंसाया है कि एन-टर्मिनल आधे में धनात्मक रूप से आवेश किए गए लाइसिन, विशेष रूप से 3 में Lys510-हेलिक्स, उनके पोटेशियम चैनल लक्ष्यों के लिए डेंड्रोटॉक्सिन बाइंडिंग में बहुत महत्वपूर्ण भूमिका निभाते हैं। β-टर्न क्षेत्र में लाइसिन अवशेषों ने अधिक जटिल परिणाम प्रदान किए हैं, कुछ डेंड्रोटॉक्सिन होमोलॉग्स में जैविक रूप से महत्वपूर्ण प्रतीत होते हैं और दूसरों के लिए आवश्यक नहीं हैं। इसके अलावा, पूरे लाइसिन ट्रिपलेट (K28-K29-K30) का अल्फा-डीटीएक्स में अला-अला-ग्लाई में उत्परिवर्तन के परिणामस्वरूप जैविक गतिविधि में बहुत कम परिवर्तन हुआ है।
एक सामान्य सहमति है कि एन-टर्मिनस (अल्फा-डीटीएक्स में Lys5) के पास संरक्षित लाइसिन अवशेष सभी डेंड्रोटॉक्सिन की जैविक गतिविधि के लिए महत्वपूर्ण है, जबकि अतिरिक्त अवशेष, जैसे कि बीटा-टर्न क्षेत्र में, एक भूमिका निभा सकते हैं। डेंड्रोटॉक्सिन विशिष्टता में व्यक्तिगत विषाक्त पदार्थों की बातचीत को उनके व्यक्तिगत लक्ष्य स्थलों पर मध्यस्थता करके। यह न केवल वोल्टेज-गेटेड K+ चैनलों के विभिन्न उपप्रकारों के लिए कुछ डेंड्रोटॉक्सिन की कठोर विशिष्टता को समझाने में मदद करता है, बल्कि सामान्य K+ चैनलों के लिए डेंड्रोटॉक्सिन की शक्ति में अंतर को भी बताता है। उदाहरण के लिए, वांग एट अल।[6] दिखाया गया है कि KV1.1 के साथ डेंड्रोटॉक्सिन-के की बातचीत एन-टर्मिनस और β-टर्न क्षेत्र दोनों में इसके लाइसिन अवशेषों द्वारा मध्यस्थता की जाती है, जबकि अल्फा-डेंड्रोटॉक्सिन अपने लक्ष्य के साथ केवल एन-टर्मिनस के माध्यम से बातचीत करता है। यह कम विस्तृत इंटरएक्टिव डोमेन यह समझाने में मदद कर सकता है कि क्यों अल्फा-डेंड्रोटॉक्सिन कम भेदभावपूर्ण है जबकि डेंड्रोटॉक्सिन-के KV1.1 के लिए सख्ती से चयनात्मक है।
अनुसंधान में उपयोग
कशेरुकी न्यूरॉन्स के पोटेशियम चैनल उच्च स्तर की विविधता प्रदर्शित करते हैं जो न्यूरॉन्स को पोटेशियम चैनल उपइकाइयों के विभिन्न संयोजनों की अभिव्यक्ति द्वारा उनके विद्युत संकेतन गुणों को ठीक से ट्यून करने की अनुमति देता है। इसके अलावा, क्योंकि वे जैविक झिल्लियों में आयनिक प्रवाह को नियंत्रित करते हैं, वे विभिन्न सेल प्रकारों के सेलुलर विनियमन और सिग्नल ट्रांसडक्शन के कई पहलुओं में महत्वपूर्ण हैं। इसलिए, वोल्टेज-गेटेड पोटेशियम चैनल सांप, बिच्छू, समुद्री एनीमोन और शंकु घोंघे जैसे जीवों से शक्तिशाली जैविक विषाक्त पदार्थों की एक विस्तृत श्रृंखला के लिए लक्ष्य हैं। इस प्रकार, विष शुद्धिकरण ने पेप्टाइड विषाक्त पदार्थों जैसे डेंड्रोटॉक्सिन को अलग कर दिया है, जो पोटेशियम चैनलों के अध्ययन के लिए उपयोगी औषधीय उपकरण बन गए हैं। पोटेशियम चैनलों के विभिन्न उपप्रकारों के लिए उनकी शक्ति और चयनात्मकता के कारण, डेंड्रोटॉक्सिन इन प्रोटीनों के संरचनात्मक और कार्यात्मक अध्ययन के लिए आणविक जांच के रूप में उपयोगी हो गए हैं। यह अलग-अलग चैनल प्रकारों द्वारा निभाई गई भूमिकाओं की हमारी समझ को बेहतर बनाने में मदद कर सकता है, साथ ही इन विविध प्रकार के चैनल के औषधीय वर्गीकरण में सहायता कर सकता है।[7] इसके अलावा, रेडिओलेबेल्ड डेंड्रोटॉक्सिन की उपलब्धता नए पोटेशियम चैनल विषाक्त पदार्थों की खोज में अन्य स्रोतों की स्क्रीनिंग के लिए एक उपकरण प्रदान करती है, जैसे समुद्री एनेमोन्स में पोटेशियम चैनल विषाक्त पदार्थों के कलिकलुडीन वर्ग। अंत में, डेंड्रोटॉक्सिन द्वारा प्रदान की गई संरचनात्मक जानकारी चिकित्सीय यौगिकों के संश्लेषण के लिए सुराग प्रदान कर सकती है जो पोटेशियम चैनलों के विशेष वर्गों को लक्षित कर सकती हैं। डेंड्रोटॉक्सिन I का उपयोग K+ चैनल प्रोटीन को शुद्ध करने और उसकी विशेषता बताने में मदद करने के लिए किया गया है जिससे यह विभिन्न बाध्यकारी परख और क्रोमैटोग्राफी तकनीकों के माध्यम से जुड़ता है।[8]
संदर्भ
- ↑ Gasparini S, Danse J-M, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, C.L. de Medeiros C, Rowan EG, Harvey AL, and Me’nez A (1998). Delineation of the Functional Site of alpha-dendrotoxin: The functional topographies of dendrotoxins are different but share a conserved core with those of other KV1 potassium channel-blocking toxins. Journal of Biological Chemistry 273:25393-25403
- ↑ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Structural Basis for the Biological Activity of Dendrotoxin-I, a Potent Potassium Channel Blocker. Biopolymers 54:44-57
- ↑ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Molecular Structure, Conformational Analysis, and Structure-Activity Studies of Dendrotoxin and Its Homologues Using Molecular Mechanics and Molecular Dynamics Techniques. Journal of Medicinal Chemistry. 39:2141-2155
- ↑ Imredy JP, and MacKinnon R (2000). Energetic and Structural Interactions between delta-Dendrotoxin and a Voltage-gated Potassium Channel. Journal of Molecular Biology 296:1283-1294
- ↑ Harvey AL, Rowan EG, Vatanpour H, Engstrom A, Westerlund B, Karlsson E (1997). Changes to biological activity following acetylation of dendrotoxin I from Dendroaspis polylepis (black mamba). ' 35:1263-1273
- ↑ Wang FC, Bell N, Reid P, Smith LA, McIntosh P, Robertson B, and Dolly JO (1999). Identification of residues in dendrotoxin K responsible for its discrimination between neuronal K+ channels containing KV1.1 and 1.2 alpha subunits. European Journal of Biochemistry 263:222-229
- ↑ Yoshida S and Matsumoto S (2005). Effects of alpha-dendrotoxin on K+ currents and action potentials in tetrodotoxin-resistant adult rat trigeminal ganglion neurons. Journal of Pharmacology and Experimental Therapeutics 314:437-445
- ↑ Rehm, H.; Lazdunski, M. (1988-07-01). "Purification and subunit structure of a putative K+-channel protein identified by its binding properties for dendrotoxin I." Proceedings of the National Academy of Sciences (in English). 85 (13): 4919–4923. Bibcode:1988PNAS...85.4919R. doi:10.1073/pnas.85.13.4919. ISSN 0027-8424. PMC 80549. PMID 2455300.
बाहरी संबंध
- dendrotoxin at the US National Library of Medicine Medical Subject Headings (MeSH)