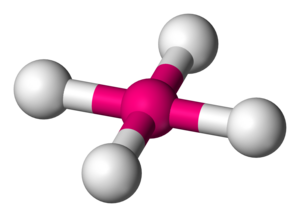
स्क्वायर प्लानर आणविक ज्यामिति
| स्क्वायर प्लानर आणविक ज्यामिति | |
|---|---|
 | |
| Examples | XeF4, [[Potassium tetrachloroplatinate|PtCl2− 4]] |
| Point group | D4h |
| Coordination number | 4 |
| Bond angle(s) | 90° |
| μ (Polarity) | 0 |

रसायन विज्ञान में स्क्वायर प्लानर आण्विक ज्यामिति स्टीरियोकेमिस्ट्री (परमाणुओं की स्थानिक व्यवस्था) का वर्णन करती है जिसे कुछ रासायनिक यौगिकों द्वारा अपनाया जाता है। जैसा कि नाम से पता चलता है, इस ज्यामिति के अणुओं में उनके परमाणु कोनों पर स्थित होते हैं।
उदाहरण
कई यौगिक इस ज्यामिति को अपनाते हैं, संक्रमण धातु परिसरों के लिए विशेष रूप से कई उदाहरण हैं। नोबल गैस यौगिक क्सीनन टेट्राफ्लोराइड | XeF4वीएसईपीआर सिद्धांत द्वारा भविष्यवाणी के अनुसार इस संरचना को अपनाता है। डी के साथ संक्रमण धातु परिसरों के लिए ज्यामिति प्रचलित है8 कॉन्फ़िगरेशन, जिसमें Rh(I), Ir(I), Pd(II), Pt(II), और Au(III) शामिल हैं। उल्लेखनीय उदाहरणों में एंटीकैंसर ड्रग्स सिस्प्लैटिन [PtCl2(एनएच3)2] और कार्बोप्लैटिन कई सजातीय उत्प्रेरक अपनी स्थिर अवस्था में वर्ग समतलीय होते हैं, जैसे कि विल्किंसन उत्प्रेरक और क्रैबट्री उत्प्रेरक। अन्य उदाहरणों में वास्का का कॉम्प्लेक्स और ज़ीस का नमक शामिल हैं। कुछ लिगेंड (जैसे पॉरफाइरिन) इस ज्यामिति को स्थिर करते हैं।
डी-ऑर्बिटल्स का विभाजन
स्क्वायर प्लानर के लिए एक सामान्य डी-कक्षीय विभाजन आरेख (डी4h) संक्रमण धातु परिसरों को सामान्य ऑक्टाहेड्रल आणविक ज्यामिति | ऑक्टाहेड्रल (ओh) विभाजन आरेख, जिसमें dz2 और डीx2−y2 ऑर्बिटल्स पतित हैं और डी के पतित सेट की तुलना में ऊर्जा में अधिक हैंxy, डीxz और डीyz ऑर्बिटल्स। जब दो अक्षीय लिगैंड्स को एक स्क्वायर प्लानर ज्योमेट्री उत्पन्न करने के लिए हटा दिया जाता है, तो dz2 ऑर्बिटल ऊर्जा में कम संचालित होता है क्योंकि जेड-अक्ष पर लिगेंड के साथ इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अब मौजूद नहीं है। हालाँकि, विशुद्ध रूप से σ-दान करने वाले लिगेंड्स के लिए dz2 d की तुलना में कक्षीय अभी भी ऊर्जा में अधिक हैxy, डीxz और डीyz d के टोरस्र्स के आकार के लोब के कारण ऑर्बिटल्सz2 कक्षीय। यह x- और y-अक्ष पर इलेक्ट्रॉन घनत्व रखता है और इसलिए भरे हुए लिगैंड ऑर्बिटल्स के साथ इंटरैक्ट करता है। डीxy, डीxz और डीyz ऑर्बिटल्स को आम तौर पर अध: पतन के रूप में प्रस्तुत किया जाता है, लेकिन उन्हें बिंदु समूह डी के इरेड्यूसबल प्रतिनिधित्व के संबंध में दो अलग-अलग ऊर्जा स्तरों में विभाजित करना पड़ता है।4h. उनका सापेक्ष क्रम विशेष परिसर की प्रकृति पर निर्भर करता है। इसके अलावा, ऑक्टाहेड्रल आणविक ज्यामिति के विपरीत, डी-ऑर्बिटल्स का विभाजन π-दान करने वाले लिगेंड द्वारा बाधित होता है। स्क्वायर प्लानर मामले में दृढ़ता से π-दान करने वाले लिगेंड डी का कारण बन सकते हैंxz और डीyz ऑर्बिटल्स d की तुलना में ऊर्जा में अधिक होने के लिएz2 कक्षीय, जबकि अष्टफलकीय स्थिति में π-दान करने वाले लिगेंड केवल d-कक्षक विपाटन के परिमाण को प्रभावित करते हैं और कक्षकों के सापेक्ष क्रम को संरक्षित किया जाता है।[1]
यह भी देखें
- एक्सई विधि
- आणविक ज्यामिति
संदर्भ
- ↑ Börgel, Jonas; Campbell, Michael G.; Ritter, Tobias (2016-01-12). "Transition Metal d-Orbital Splitting Diagrams: An Updated Educational Resource for Square Planar Transition Metal Complexes". Journal of Chemical Education. 93 (1): 118–121. Bibcode:2016JChEd..93..118B. doi:10.1021/acs.jchemed.5b00542. ISSN 0021-9584.
बाहरी संबंध
- 3D Chem – Chemistry, Structures, and 3D Molecules
- IUMSC – Indiana University Molecular Structure Center
- Interactive molecular examples for point groups
- [1] – Coordination numbers and complex ions
