हिस्टोन डीएसेटाइलेज
| Histone deacetylase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
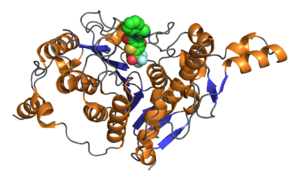 Catalytic domain of human histone deacetylase 4 with bound inhibitor. PDB rendering based on 2vqj.[1] | |||||||||
| Identifiers | |||||||||
| EC no. | 3.5.1.98 | ||||||||
| CAS no. | 9076-57-7 | ||||||||
| Databases | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / QuickGO | ||||||||
| |||||||||
| हिस्टोन डीएसेटाइलेज | |
|---|---|
| Identifiers | |
| Symbol | ? |
हिस्टोन डीएसेटाइलिस (EC 3.5.1.98 एंजाइम का एक वर्ग है जो एक हिस्टोन पर सिग्मा-एन एसिटाइल लाइसिन एमीनो अम्ल से एसिटाइल समूह (ओ=सी-सीएच3) को हटा देते हैं जिससे हिस्टोन डीएनए को अधिक कसकर लपेटने की अनुमति देता है।Cite error: Closing </ref> missing for <ref> tag
उच्च यूकेरियोट्स में एचडीएसी की कक्षाएं
एचडीएसी, खमीर मूल एंजाइमों और डोमेन संगठन के अनुक्रम समरूपता के आधार पर चार वर्गों में वर्गीकृत हैं। [2]
एचडीएसी में जिंक होता है और इसे जेडएन(जिंक) के रूप में जाना जाता है। [3] वे एक शास्त्रीय आर्गिनेज की सुविधा देते हैं और संरचनात्मक तथा यांत्रिक रूप से सिर्टुइनस से अलग होते हैं जो एक रॉसमैन फोल्ड में बदल जाते आश्रितह निकोटिनामाइड एडेनिन डाइन्यूक्लियोटाइड एनएडी आश्रित हैं। [4]
उपप्रकार
एचडीएसी प्रोटीन को कार्य और डीएनए को समानता के आधार पर चार वर्गों बांटा गया है। कक्षा एक, दो और चार को शास्त्रीय एचडीएसी माना जाता है जिनकी गतिविधियाँ ट्राइकोस्टैटिन ए (टीएसए) द्वारा बाधित होती हैं और उनमें जिंक पर निर्भर सक्रिय साइट होती है जबकि कक्षा तीन में एंजाइम एनएडी का एक परिवार है। जिन्हें प्रोटीन सिरूइन कहा जाता है और यह टीएसए से प्रभावित नहीं होते हैं।[5] खमीर में इन तीन समूहों के समरूप नाम पाए जाते हैं कम पोटेशियम (एचडीएरपीडी तीन) से मेल खाती है हिस्टोन डीएसेटाइलेज (एचडीए एक) कक्षा दो के अनुरूप और मूक सूचना नियामक कक्षा तीन के अनुरूप होता है कक्षा चार में केवल एक आइसोफॉर्म (एचडीएसी ग्यारह) होता है जो आरपीडी तीन या एचडीए एक खमीर एंजाइमों के साथ अत्यधिक सजातीय नहीं होता है।[6] इसलिए एचडीएसी ग्यारह को अपनी कक्षा में आसान किया गया है। कक्षा तीन के एंजाइमों को एक अलग प्रकार का एंजाइम माना जाता है और उनकी क्रिया का एक अलग तंत्र होता है ये एंजाइम एनएडी हैं जबकि अन्य वर्गों में एचडीएसी को जेडएन(जिंक) की आवश्यकता होती है यह एक सहकारक के रूप में पाया जाता है।[7]
विकास
एचडीएसी एस विकास के दौरान संरक्षित हैं सभी यूकेरियोट्स तथा आर्किया में ऑर्थोलॉग दिखाते हैं। कशेरुकियों पौधों और आर्थ्रोपोड्स सहित सभी ऊपरी यूकेरियोट्स में प्रति वर्ग एचडीएसी होता है जबकि अधिकांश कशेरुकी मछली की हड्डी के अपवाद के साथ ग्यारह कैनोनिकल एचडीएसी एस ले जाते हैं जिनमें एचडीएसी दो की कमी होती है लेकिन एचडीएसी ग्यारह की एक प्रति दिखाई देती है जिसे एचडीएसी बारह कहा जाता है। पौधे जानवरों की तुलना के अतिरिक्त एचडीएसी ले जाते हैं जो कि इन सीसाइल जीवों द्वारा जटिल ट्रांसक्रिप्शनल विनियम को पूरा करने के लिए होता है। एचडीएसी एस पैतृक एसिटाइल-बाइंडिंग डोमेन से व्युत्पन्न प्रतीत होते हैं क्योंकि एचडीएसी होमोलॉग जीवाणु में एसीटोन यूटिलाइजेशन प्रोटीन (एसीयूसी) प्रोटीन के रूप में पाए जाते हैं।[8] प्रोटीन परिवार के 226 सदस्यों का टोपोलॉजिकल फाइलोजेनेटिक ट्री द्वारा प्रतिनिधित्व करता है।[8]
उपकोशिकीय वितरण
कक्षा एक एचडीएसी के भीतर एक, दो और तीन नाभिक पाए जाते हैं जबकि एचडीएसी आठ में नाभिक और साइटोप्लाज्म दोनों पाए जाते हैं और ये झिल्ली से जुड़े भी होते हैं। क्लास दो एचडीएसी (एचडीएसी चार ,पांच , छ:,सात, नौ और दस) अलग-अलग संकेतों के आधार पर न्यूक्लियस के अंदर और बाहर शटल करने में सक्षम हैं।[9][10] एचडीएसी छ: एक साइटोप्लाज्मिक सूक्ष्म से जुड़ा एंजाइम है। एचडीएसी छ: ट्यूबुलिन, एचएसपी नब्बे और कोर्टेक्टिन को डिसेटाइलेट करता है यह प्रोटीन के साथ कॉम्प्लेक्स बनाता है और विभिन्न जैविक प्रक्रियाओं में सम्मिलित होता है।[11]
समारोह
हिस्टोन संशोधन
यह लाइसिन और आर्गनीन अमीनो अम्ल पर एकत्र अमीन समूहों के कारण हिस्टोन सकारात्मक रूप से चार्ज होती है। ये सकारात्मक चार्ज हिस्टोन को डीएनए बैकबोन पर नकारात्मक रूप से चार्ज किए गए फॉस्फेट समूहों के साथ बातचीत करने और बाँधने में मदद करते हैं। एसिटिलेशन, जो सामान्य रूप से एक कोशिका में होता है हिस्टोन पर धनात्मक आवेशों को अमीन्स एमाइडस में बदलकर हटा देता है और हिस्टोन की डीएनए से जुड़ने की क्षमता को कम कर देता है। यह बाइंडिंग क्रोमेटिन के विस्तार की अनुमति होती है जिससे जेनेटिक प्रतिलेखन (आनुवांशिकी) हो सकता है। हिस्टोन डीएसेटाइलिस उन एसिटाइल समूहों को हटाते हैं हिस्टोन सकारात्मक चार्ज को बढ़ाते हैं तथा हिस्टोन और डीएनए बैकबोन के बीच उच्च-संबंध को बढ़ाते हैं। तथा डीएनए बाइंडिंग डीएनए संरचना को संघनित करती है जो प्रतिलेखन को रोकती है।
हिस्टोन डीएसेटाइलेज़ जीवित प्रणाली के भीतर मार्गों की एक श्रृंखला में सम्मिलित है। जीन और जीनोम (केईजीजी) के क्योटो एनसाइक्लोपीडिया के अनुसार
- पर्यावरण सूचना सन्धि खाता चेतावनी मार्ग
- ठीक करना ,ऊतक ऊतक वृद्धि और मृत्यु तंत्रिका चक्र
- मानव रोग कैंसर; क्रोनिक मिलॉइड ल्यूकेमिया

हिस्टोन एसिटिलेशन जीन अभिव्यक्ति के नियमन में महत्वपूर्ण भूमिका निभाता है। हाइपरसेटिलेटेड क्रोमैटिन ट्रांसक्रिप्शनल रूप से सक्रिय है और हाइपोसेटिलेटेड क्रोमैटिन चूहों पर किए गए एक अध्ययन में पाया गया कि एचडीएसी एक की अनुपस्थिति में चूहा जीन के एक विशिष्ट उपसमुच्चय (7प्रतिशत) को विनियमित किया गया था।[12] उनके अध्ययन में एचडीएसी एक और एचडीएसी दो के बीच एक नियामक क्रॉसस्टॉक भी पाया गया और एक ट्रांसक्रिप्शनल कोएक्टिवेटर के रूप में एचडीएसी एक के लिए एक उपन्यास समारोह का सुझाव दिया। एचडीएसी एक अभिव्यक्ति सिजोफ्रेनिया के प्रीफ्रंटकॉर्टेक्स में बढ़ी हुई पाई गई [13] जीएडी सरसठ की अभिव्यक्ति के साथ नकारात्मक रूप से सहसंबद्ध है।
न्यूरॉनस में हिस्टोन संशोधन
न्यूरॉन्स तंत्रिका तंत्र के भीतर विद्युत रूप से उत्तेजनीय कोशिकाएं हैं और तंत्रिका सर्किट में एक साथ व्यवस्थित होते हैं।[14] संस्कृति में समुद्री घोड़ा न्यूरॉन्स गतिविधि हिस्टोन डीएसेटाइलेज एचडीएसी चार के परमाणु का कारण बनने के लिए पर्याप्त था। सिनैप्टिक एनएमडीए रिसेप्टरस के माध्यम से कैल्शियम प्रवाह की उत्तेजना के बाद एक और हिस्टोन डीएसेटाइलेज एचडीएसी पांच को कोशिका द्रव्य में बदल दिया गया था।[15]कल्चर में चूहे के अग्रमस्तिष्क न्यूरॉन्स के कोशिका केंद्रक में पाए जाने वाले चार हजार चार सौ सात प्रोटीन में से, न्यूरॉन्स के सक्रियण के बाद न्यूक्लियोसाइटोप्लास्मिक शट्लिंग या प्रोटीन जैवसंश्लेषण या प्रोटीन के प्रोटियोलिसिस के कारण दो हजार आठ सौ साठ परमाणु एकाग्रता में बदल गए।[16] न्यूरोनल उत्तेजना के बाद सभी प्रोटीनों में एचडीएसी चार में नाभिक से बाहर निकलने के कारण सबसे बड़ी एकाग्रता में कमी आई थी।
एचडीएसी में कमी से हिस्टोन टेल्स पर हिस्टोन एसिटिलिकेशन और डीसेटिलेशन की अधिक उपस्थिति होगी। हिस्टोन एसिटिलेशन जीन के सक्रिय प्रतिलेखन से जुड़ा हुआ है,[17] एक हिस्टोन डीएसेटाविज्ञान कमी से जीन प्रतिलेखन (जीव विज्ञान) को बनाए रखने या बढ़ाने से एपिजेनेटिक्स प्रभाव कम होगा। न्यूरॉन सक्रियण के बाद एचडीएसी चार में बड़ी कमी न्यूरोनल समारोह पर समान रूप से बड़ा प्रभाव डाल सकती है।
गैर-हिस्टोन प्रभाव
हिस्टोन और क्रोमैटिन संरचना को संशोधित करके जीन प्रतिलेखन को विनियमित करने के बाद में एचडीएसी को पूरी तरह से मानना एक गलती है जबकि यह प्रोटीन के कार्य, गतिविधि और स्थिरता को पोस्ट-ट्रांसलेशनल संशोधनों द्वारा नियंत्रित किया जा सकता है। प्रोटीन फास्फारिलीकरण व्यापक रूप से अध्ययन और समझा जाने वाला संशोधन है जिसमें कुछ अमीनो अम्ल अवशेषों को प्रोटीन किनेज की क्रिया द्वारा फास्फोराइलेट किया जाता है या फास्फेटेजों की क्रिया द्वारा डिफॉस्फोराइलेट किया जाता है। लाइसिन अवशेषों का एसिटिलेशन एक समान तंत्र के रूप में उभर रहा है जिसमें गैर-हिस्टोन प्रोटीन एसिटाइलिस और डीएसेटाइलिस द्वारा कार्य किया जाता है।[18] इस संदर्भ में एचडीएसी को विभिन्न प्रकार के गैर-हिस्टोन प्रोटीनों के साथ बातचीत करने के लिए पाया जा रहा है इनमें से कुछ प्रतिलेखन कारक हैं और ट्रांसक्रिप्शन कोरग्युलेटर सह-नियामक हैं। जो इस प्रकार हैं-
- एचडीएसी छ: एग्रेसोम्स से जुड़ा है। मिसफोल्डेड प्रोटीन समुच्चय को सर्वव्यापकता द्वारा टैग किया जाता है और डायनेन मोटर्स द्वारा साइटोप्लाज्म से माइक्रोट्यूब्यूल नेटवर्क के माध्यम से एक ऑर्गेनेल को एग्रेसिव कहा जाता है। एचडीएसी छ: पॉलीयूबिक्विटिनेटेड मिसफोल्डेड प्रोटीन और डायनेइन मोटर्स से लिंक को बांधता है जिससे मिसफोल्ड किए गए प्रोटीन के विनाश के लिए चैपरोन और प्रोटीसोम में भौतिक रूप से ले जाया जा सकता है।[19] एचडीएसी छ: एसएसपी नब्बे समारोह का महत्वपूर्ण नियामक है और इसका अवरोधक चयापचय संबंधी विकारों के इलाज के लिए प्रस्तावित है।[20]
- पीटीईएन (जीन) फॉस्फॉइनोसिटोल और एकेटी/पीआई3 किनेज पाथवे के माध्यम से सेल सिग्नलिंग में सम्मिलित एक महत्वपूर्ण फॉस्फेट है। फॉस्फोराइलेशन, सर्वव्यापकता, ऑक्सीकरण और एसिटिलीकरण के एसिटाइलट्रांसफेरेम नियंत्रण के अधीन है। हिस्टोन एसिटाइलट्रांसफेरेज द्वारा पीटीईएन का एसिटिलेशन इसकी गतिविधि को दबा सकता है इसके विपरीत, एसआईआरटीएक डीएसेटाइलेज द्वारा पीटीईएन का डीसेटाइलेशन और एचडीएसी एक द्वारा इसकी गतिविधि को उत्तेजित कर सकता है।[21][22]
- एपीई एक (एपीईएक्स) डीएनए की मरम्मत एक्टिविटी और ऑक्सीडेटिव तनाव से जुड़ी ट्रांसक्रिप्शनल रेगुलेटरी एक्टिविटी दोनों को रखने वाला एक मल्टीफंक्शनल प्रोटीन है। यह कक्षा एचडीएसी एस के साथ स्थिर रूप से जुड़ा हुआ है और डीसेटाइलेट किया गया है। एसिटिलेशन डीएनए मरम्मत गतिविधि को प्रभावित नहीं करती है, लेकिन यह इसकी ट्रांसक्रिप्शनल गतिविधि को नियंत्रित करती है जैसे कि पीटीईएन प्रमोटर से जुड़ने की क्षमता और पैराथाएरॉएड हार्मोन जीन का ट्रांसक्रिप्शन आरंभ किया जाता है।[23][24]
- एनएफ केबी एक प्रतिलेखन कारक और प्रभावकारक अणु है जो कोशिका तनाव के जवाब में सम्मिलित है जिसमें एसिटिलिकेशन द्वारा और एचडीएसी तीन और एचडीएसी छ: के माध्यम से डीसेटाइलेशन को नियंत्रित किया जाता है।[25]
ये एचडीएसी के लिए लगातार उभरती गैर-हिस्टोन, गैर-क्रोमैटिन भूमिकाओं के कुछ उदाहरण हैं।
न्यूरोडीजेनेरेटिव रोग
जीन एन्कोडिंग एफयूएस (जीन) एन्यूरोडीजेनेरेटिवक आरएनए/डीएनए बाध्यकारी प्रोटीन विरासत में मिला उत्परिवर्तन पेशीशोषी पार्श्व काठिन्य (एएलएस) से यथोचित रूप से जुड़ा हुआ है।[26] एफयूएस की डीएनए (स्वाभाविक रूप से होने वाली) प्रतिक्रिया में एक महत्वपूर्ण भूमिका निभाता है जिसमें हिस्टोन डीएसेटाइलेज के साथ इसका सीधा संपर्क है। एएलएस उत्परिवर्ती एफयूएस प्रोटीन डीएनए प्रतिक्रिया और सजातीय पुनर्संयोजन डीएनए मरम्मत में दोषपूर्ण हैं और एचडीएसी एक के साथ कम महत्वपूर्ण दिखाते हैं।[26]
गतिभंग रक्त वाहिनी विस्तार एटीएम सेरीन/थ्रेओनीन किनेज में उत्परिवर्तन के कारण होता है। वाइल्ड-टाइप एटीएम क्रोमैटिन रीमॉडेलिंग और एपिजेनेटिक्स में नियोजित एक प्रोटीन किनेज को एनकोड करता है जो डीएनए की मरम्मत के लिए आवश्यक होता है। डीएनए डबल-स्ट्रैंड ब्रेक की मरम्मत।[27] एटम म्यूटेशन के कारण न्यूरॉन्स परमाणु हिस्टोन डीएसेटाइलेज जमा करते हैं, जिसके परिणामस्वरूप हिस्टोन डीसेटाइलेशन और परिवर्तित न्यूरोनल जीन अभिव्यक्ति में वृद्धि होती है जो गतिभंग-टेलैंगिएक्टेसिया के स्नायविक अध: पतन विशेषताओं में योगदान देता है।[28]
एचडीएसी अवरोधक
हिस्टोन डीएसेटाइलेज़ इनहिबिटर्स (एचडीआई) का मनोरोग और न्यूरोलॉजी में मूड स्टेबलाइजर्स और एंटी-एपिलेप्टिक्स के रूप में एक लंबा इतिहास है उदाहरण वैल्प्रोइक एसिड इन्हीं दिनों में एचडीआई का न्यूरोडीजेनेरेटिव रोग के उपचार के रूप में अध्ययन किया जा रहा है।[29][30][31] कैंसर चिकित्सा के लिए एचडीआई विकसित करने का प्रयास किया गया है।[32][33] वोरिनोस्टैट (एसएएचए) त्वचीय टी सेल लिंफोमा (सीटीसीएल) वाले रोगियों में त्वचीय अभिव्यक्तियों के उपचार के लिए 2006 में अनुमोदित खाद्य और औषधि प्रशासन था जो पिछले उपचारों में विफल रहे हैं। सीटीसीएल के रोगियों के लिए 2009 में एक दूसरे एचडीआई, इस्टोडैक्स (भाग जाओ) को मंजूरी दी गई थी। सटीक तंत्र जिसके द्वारा यौगिक काम कर सकते हैं, अस्पष्ट हैं, लेकिन एपिजेनेटिक रास्ते प्रस्तावित हैं।[34] इसके अलावा, एक नैदानिक परीक्षण संक्रमित व्यक्तियों में एचआईवी के अव्यक्त पूल पर वैल्प्रोइक एसिड के प्रभावों का अध्ययन कर रहा है।[35] एचडीआई की वर्तमान में साइटोटोक्सिक कीमोथेरेपी या विकिरण चिकित्सा के लिए रसायन संवेदक के रूप में या इन विट्रो तालमेल के आधार पर डीएनए मेथिलिकरण अवरोधकों के सहयोग से जांच की जा रही है।[36] आइसोफॉर्म चुनिंदा एचडीआई विकसित किए गए हैं जो व्यक्तिगत एचडीएसी आइसोफॉर्म की भूमिका को स्पष्ट करने में सहायता कर सकते हैं।[37][38][39][40] एचडीएसी अवरोधकों का गैर-हिस्टोन प्रोटीन पर प्रभाव पड़ता है जो एसिटिलेशन से संबंधित हैं। एचडीआई इन अणुओं के एसिटिलीकरण की डिग्री को बदल सकते हैं और इसलिए, उनकी गतिविधि को बढ़ा या दबा सकते हैं। गैर-हिस्टोन प्रोटीन पर काम करने वाले एचडीएसी पर ऊपर दिए गए चार उदाहरणों के लिए (फ़ंक्शन देखें), उनमें से प्रत्येक उदाहरण में एचडीएसी अवरोधक ट्राइकोस्टैटिन ए | ट्राइकोस्टैटिन ए (टीएसए) प्रभाव को अवरुद्ध करता है। एचडीआई को कई ट्रांसक्रिप्शन कारकों की गतिविधि को बदलने के लिए दिखाया गया है जिसमें न्यूक्लियर रिसेप्टर कोएक्टीवेटर 3, एम वाई बी(जीन), ई2एफ1, ईकेएलएफ, एफईएन1, जीएटीए, एचएनएफ4 ,एचएसपी90, केयू, एनएफकेबी, पीसीएनए, सम्मिलित हैं। रेटिनोब्लास्टोमा प्रोटीन।[41][42]कीटोन निकाय बीटा-हाइड्रॉक्सीब्यूट्रिक एसिड | बीटा-हाइड्रॉक्सीब्यूटाइरेट चूहों में हिस्टोन डीएसेटाइलस निषेध द्वारा जीन की अभिव्यक्ति को बढ़ाने के लिए दिखाया गया है।[43]हिस्टोन डीएसेटाइलेज कुछ वायरस की विलंबता को नियंत्रित कर सकते हैं, जिसके परिणामस्वरूप पुनर्सक्रियन होता है।[44] उदाहरण के लिए एक अव्यक्त मानव हर्पीसवायरस -6 संक्रमण के साथ।
हिस्टोन डीएसेटाइलस इनहिबिटर्स ने कुछ प्लास्मोडियम प्रजातियों और चरणों के खिलाफ गतिविधि दिखाई है जो संकेत दे सकते हैं कि उनमें मलेरिया के उपचार की क्षमता है। जो कि कक्षा एचडीएसी एस का डाउनस्ट्रीम लक्ष्य है।[45]
यह भी देखें
- हिस्टोन एसिटाइलट्रांसफेरेज|हिस्टोन एसिटाइलट्रांसफेरेज (एचएटी)
- हिस्टोन डीएसेटाइल अवरोधक
- हिस्टोन मिथाइलट्रांसफेरेज़|हिस्टोन मिथाइलट्रांसफेरेज (एचएमटी)
- हिस्टोन-संशोधित एंजाइम|हिस्टोन-संशोधित एंजाइम
- आधारभूत संरचना द्वारा पोलीमरेज़ नियंत्रण
- ↑ Bottomley MJ, Lo Surdo P, Di Giovine P, Cirillo A, Scarpelli R, Ferrigno F, et al. (September 2008). "Structural and functional analysis of the human HDAC4 catalytic domain reveals a regulatory structural zinc-binding domain". The Journal of Biological Chemistry. 283 (39): 26694–26704. doi:10.1074/jbc.M803514200. PMC 3258910. PMID 18614528.
- ↑ Dokmanovic M, Clarke C, Marks PA (October 2007). "Histone deacetylase inhibitors: overview and perspectives". Molecular Cancer Research. 5 (10): 981–989. doi:10.1158/1541-7786.MCR-07-0324. PMID 17951399.
- ↑ Marks PA, Xu WS (July 2009). "Histone deacetylase inhibitors: Potential in cancer therapy". Journal of Cellular Biochemistry. 107 (4): 600–608. doi:10.1002/jcb.22185. PMC 2766855. PMID 19459166.
- ↑ Bürger M, Chory J (2018). "Structural and chemical biology of deacetylases for carbohydrates, proteins, small molecules and histones". Communications Biology. 1: 217. doi:10.1038/s42003-018-0214-4. PMC 6281622. PMID 30534609.
- ↑ Imai S, Armstrong CM, Kaeberlein M, Guarente L (February 2000). "Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase". Nature. 403 (6771): 795–800. Bibcode:2000Natur.403..795I. doi:10.1038/35001622. PMID 10693811. S2CID 2967911.
- ↑ Yang XJ, Seto E (March 2008). "The Rpd3/Hda1 family of lysine deacetylases: from bacteria and yeast to mice and men". Nature Reviews. Molecular Cell Biology. 9 (3): 206–218. doi:10.1038/nrm2346. PMC 2667380. PMID 18292778.
- ↑ Barneda-Zahonero B, Parra M (December 2012). "Histone deacetylases and cancer". Molecular Oncology. 6 (6): 579–589. doi:10.1016/j.molonc.2012.07.003. PMC 5528343. PMID 22963873.
- ↑ 8.0 8.1 Cite error: Invalid
<ref>tag; no text was provided for refs namedMilazzo_2020 - ↑ de Ruijter AJ, van Gennip AH, Caron HN, Kemp S, van Kuilenburg AB (March 2003). "Histone deacetylases (HDACs): characterization of the classical HDAC family". The Biochemical Journal. 370 (Pt 3): 737–749. doi:10.1042/BJ20021321. PMC 1223209. PMID 12429021.
- ↑ Longworth MS, Laimins LA (July 2006). "Histone deacetylase 3 localizes to the plasma membrane and is a substrate of Src". Oncogene. 25 (32): 4495–4500. doi:10.1038/sj.onc.1209473. PMID 16532030.
- ↑ Valenzuela-Fernández A, Cabrero JR, Serrador JM, Sánchez-Madrid F (June 2008). "HDAC6: a key regulator of cytoskeleton, cell migration and cell-cell interactions". Trends in Cell Biology. 18 (6): 291–297. doi:10.1016/j.tcb.2008.04.003. PMID 18472263.
- ↑ Zupkovitz G, Tischler J, Posch M, Sadzak I, Ramsauer K, Egger G, et al. (November 2006). "Negative and positive regulation of gene expression by mouse histone deacetylase 1". Molecular and Cellular Biology. 26 (21): 7913–7928. doi:10.1128/MCB.01220-06. PMC 1636735. PMID 16940178.
- ↑ Sharma RP, Grayson DR, Gavin DP (January 2008). "Histone deactylase 1 expression is increased in the prefrontal cortex of schizophrenia subjects: analysis of the National Brain Databank microarray collection". Schizophrenia Research. 98 (1–3): 111–117. doi:10.1016/j.schres.2007.09.020. PMC 2254186. PMID 17961987.
- ↑ Walker AS, Raliski BK, Nguyen DV, Zhang P, Sanders K, Karbasi K, Miller EW (2021). "Imaging Voltage in Complete Neuronal Networks Within Patterned Microislands Reveals Preferential Wiring of Excitatory Hippocampal Neurons". Front Neurosci. 15: 643868. doi:10.3389/fnins.2021.643868. PMC 8155642. PMID 34054406.
- ↑ Chawla S, Vanhoutte P, Arnold FJ, Huang CL, Bading H (April 2003). "Neuronal activity-dependent nucleocytoplasmic shuttling of HDAC4 and HDAC5". J Neurochem. 85 (1): 151–9. doi:10.1046/j.1471-4159.2003.01648.x. PMID 12641737.
- ↑ Herbst WA, Deng W, Wohlschlegel JA, Achiro JM, Martin KC (December 2021). "Neuronal activity regulates the nuclear proteome to promote activity-dependent transcription". J Cell Biol. 220 (12). doi:10.1083/jcb.202103087. PMC 8504181. PMID 34617965.
- ↑ Martin BJ, Brind'Amour J, Kuzmin A, Jensen KN, Liu ZC, Lorincz M, Howe LJ (January 2021). "Transcription shapes genome-wide histone acetylation patterns". Nat Commun. 12 (1): 210. doi:10.1038/s41467-020-20543-z. PMC 7801501. PMID 33431884.
- ↑ Glozak MA, Sengupta N, Zhang X, Seto E (December 2005). "Acetylation and deacetylation of non-histone proteins". Gene. 363: 15–23. doi:10.1016/j.gene.2005.09.010. PMID 16289629.
- ↑ Rodriguez-Gonzalez A, Lin T, Ikeda AK, Simms-Waldrip T, Fu C, Sakamoto KM (April 2008). "Role of the aggresome pathway in cancer: targeting histone deacetylase 6-dependent protein degradation". Cancer Research. 68 (8): 2557–2560. doi:10.1158/0008-5472.CAN-07-5989. PMID 18413721.
- ↑ Mahla RS (July 2012). "Comment on: Winkler et al. Histone deacetylase 6 (HDAC6) is an essential modifier of glucocorticoid-induced hepatic gluconeogenesis. Diabetes 2012;61:513-523". Diabetes. 61 (7): e10, author reply e11. doi:10.2337/db12-0323. PMC 3379673. PMID 22723278.
- ↑ Ikenoue T, Inoki K, Zhao B, Guan KL (September 2008). "PTEN acetylation modulates its interaction with PDZ domain". Cancer Research. 68 (17): 6908–6912. doi:10.1158/0008-5472.CAN-08-1107. PMID 18757404.
- ↑ Yao XH, Nyomba BL (June 2008). "Hepatic insulin resistance induced by prenatal alcohol exposure is associated with reduced PTEN and TRB3 acetylation in adult rat offspring". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 294 (6): R1797–R1806. doi:10.1152/ajpregu.00804.2007. PMID 18385463.
- ↑ Bhakat KK, Izumi T, Yang SH, Hazra TK, Mitra S (December 2003). "Role of acetylated human AP-endonuclease (APE1/Ref-1) in regulation of the parathyroid hormone gene". The EMBO Journal. 22 (23): 6299–6309. doi:10.1093/emboj/cdg595. PMC 291836. PMID 14633989.
- ↑ Fantini D, Vascotto C, Deganuto M, Bivi N, Gustincich S, Marcon G, et al. (January 2008). "APE1/Ref-1 regulates PTEN expression mediated by Egr-1". Free Radical Research. 42 (1): 20–29. doi:10.1080/10715760701765616. PMC 2677450. PMID 18324520.
- ↑ Hasselgren PO (December 2007). "Ubiquitination, phosphorylation, and acetylation--triple threat in muscle wasting". Journal of Cellular Physiology. 213 (3): 679–689. doi:10.1002/jcp.21190. PMID 17657723.
- ↑ 26.0 26.1 Wang WY, Pan L, Su SC, Quinn EJ, Sasaki M, Jimenez JC, et al. (October 2013). "Interaction of FUS and HDAC1 regulates DNA damage response and repair in neurons". Nature Neuroscience. 16 (10): 1383–1391. doi:10.1038/nn.3514. PMC 5564396. PMID 24036913.
- ↑ Berger ND, Stanley FK, Moore S, Goodarzi AA (October 2017). "ATM-dependent pathways of chromatin remodelling and oxidative DNA damage responses". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 372 (1731). doi:10.1098/rstb.2016.0283. PMC 5577461. PMID 28847820.
- ↑ Li J, Chen J, Ricupero CL, Hart RP, Schwartz MS, Kusnecov A, Herrup K (May 2012). "Nuclear accumulation of HDAC4 in ATM deficiency promotes neurodegeneration in ataxia telangiectasia". Nature Medicine. 18 (5): 783–790. doi:10.1038/nm.2709. PMC 3378917. PMID 22466704.
- ↑ Hahnen E, Hauke J, Tränkle C, Eyüpoglu IY, Wirth B, Blümcke I (February 2008). "Histone deacetylase inhibitors: possible implications for neurodegenerative disorders". Expert Opinion on Investigational Drugs. 17 (2): 169–184. doi:10.1517/13543784.17.2.169. PMID 18230051. S2CID 14344174.
- ↑ "Scientists 'reverse' memory loss". BBC News. 2007-04-29. Retrieved 2007-07-08.
- ↑ Geurs S, Clarisse D, Baele F, Franceus J, Desmet T, De Bosscher K, D'hooghe M (May 2022). "Identification of mercaptoacetamide-based HDAC6 inhibitors via a lean inhibitor strategy: screening, synthesis, and biological evaluation". Chemical Communications. 58 (42): 6239–6242. doi:10.1039/D2CC01550A. PMID 35510683.
- ↑ Mwakwari SC, Patil V, Guerrant W, Oyelere AK (2010). "Macrocyclic histone deacetylase inhibitors". Current Topics in Medicinal Chemistry. 10 (14): 1423–1440. doi:10.2174/156802610792232079. PMC 3144151. PMID 20536416.
- ↑ Miller TA, Witter DJ, Belvedere S (November 2003). "Histone deacetylase inhibitors". Journal of Medicinal Chemistry. 46 (24): 5097–5116. doi:10.1021/jm0303094. PMID 14613312.
- ↑ Monneret C (April 2007). "Histone deacetylase inhibitors for epigenetic therapy of cancer". Anti-Cancer Drugs. 18 (4): 363–370. doi:10.1097/CAD.0b013e328012a5db. PMID 17351388. S2CID 39017666.
- ↑ Depletion of Latent HIV in CD4 Cells - Full Text View - ClinicalTrials.gov
- ↑ Batty N, Malouf GG, Issa JP (August 2009). "Histone deacetylase inhibitors as anti-neoplastic agents". Cancer Letters. 280 (2): 192–200. doi:10.1016/j.canlet.2009.03.013. PMID 19345475.
- ↑ Patil V, Sodji QH, Kornacki JR, Mrksich M, Oyelere AK (May 2013). "3-Hydroxypyridin-2-thione as novel zinc binding group for selective histone deacetylase inhibition". Journal of Medicinal Chemistry. 56 (9): 3492–3506. doi:10.1021/jm301769u. PMC 3657749. PMID 23547652.
- ↑ Mwakwari SC, Guerrant W, Patil V, Khan SI, Tekwani BL, Gurard-Levin ZA, et al. (August 2010). "Non-peptide macrocyclic histone deacetylase inhibitors derived from tricyclic ketolide skeleton". Journal of Medicinal Chemistry. 53 (16): 6100–6111. doi:10.1021/jm100507q. PMC 2924451. PMID 20669972.
- ↑ Butler KV, Kalin J, Brochier C, Vistoli G, Langley B, Kozikowski AP (August 2010). "Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A". Journal of the American Chemical Society. 132 (31): 10842–10846. doi:10.1021/ja102758v. PMC 2916045. PMID 20614936.
- ↑ Geurs S, Clarisse D, Baele F, Franceus J, Desmet T, De Bosscher K, D'hooghe M (May 2022). "Identification of mercaptoacetamide-based HDAC6 inhibitors via a lean inhibitor strategy: screening, synthesis, and biological evaluation". Chemical Communications. 58 (42): 6239–6242. doi:10.1039/D2CC01550A. PMID 35510683.
- ↑ Drummond DC, Noble CO, Kirpotin DB, Guo Z, Scott GK, Benz CC (2005). "Clinical development of histone deacetylase inhibitors as anticancer agents". Annual Review of Pharmacology and Toxicology. 45: 495–528. doi:10.1146/annurev.pharmtox.45.120403.095825. PMID 15822187.
- ↑ Yang XJ, Seto E (August 2007). "HATs and HDACs: from structure, function and regulation to novel strategies for therapy and prevention". Oncogene. 26 (37): 5310–5318. doi:10.1038/sj.onc.1210599. PMID 17694074.
- ↑ Shimazu T, Hirschey MD, Newman J, He W, Shirakawa K, Le Moan N, et al. (January 2013). "Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor". Science. 339 (6116): 211–214. Bibcode:2013Sci...339..211S. doi:10.1126/science.1227166. PMC 3735349. PMID 23223453.
- ↑ Arbuckle JH, Medveczky PG (August 2011). "The molecular biology of human herpesvirus-6 latency and telomere integration". Microbes and Infection. 13 (8–9): 731–741. doi:10.1016/j.micinf.2011.03.006. PMC 3130849. PMID 21458587.
- ↑ Beus M, Rajić Z, Maysinger D, Mlinarić Z, Antunović M, Marijanović I, et al. (August 2018). "SAHAquines, Novel Hybrids Based on SAHA and Primaquine Motifs, as Potential Cytostatic and Antiplasmodial Agents". ChemistryOpen. 7 (8): 624–638. doi:10.1002/open.201800117. PMC 6104433. PMID 30151334.
बाहरी संबंध
- Histone+deacetylase at the US National Library of Medicine Medical Subject Headings (MeSH)
- Animation at Merck
