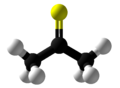
थायोसिटोन
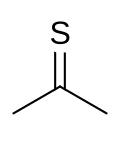
| |||
|
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
Propane-2-thione[1] | |||
| Systematic IUPAC name
Thiopropan-2-one | |||
Other names
| |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
PubChem CID
|
|||
| |||
| |||
| Properties | |||
| C3H6S | |||
| Molar mass | 74.14 g·mol−1 | ||
| Appearance | Orange to brown liquid | ||
| Odor | Putrid and intensely foul | ||
| Melting point | −55°C(218.15k/-67°F)[2] | ||
| Boiling point | 70°C(343.15k/158°F)[2] | ||
| Hazards | |||
| Occupational safety and health (OHS/OSH): | |||
Main hazards
|
Odor, skin irritant | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
थायोएसीटोन एक ऑर्गनोसल्फर यौगिक है जो थायोकेटोन् नामक -थियोन समूह से संबंधित है, जिसका रासायनिक सूत्र (CH3)2CS है। यह एक अस्थिर नारंगी या भूरे रंग का पदार्थ है जिसे केवल कम तापमान पर ही अलग किया जा सकता है।[3] -20 डिग्री सेल्सियस (−4 डिग्री फारेनहाइट) से ऊपर, थायोएसीटोन आसानी से एक बहुलक और एक त्रितय, ट्राइथियोएसीटोन में परिवर्तित हो जाता है।[4] इसमें एक अत्यंत शक्तिशाली, अप्रिय गंध है, और इसे मनुष्य द्वारा ज्ञात सबसे खराब गंध वाले रसायनों में से एक माना जाता है।
थायोएसीटोन पहली बार 1889 में बाउमन और फ्रॉम द्वारा ट्राइथियोएसीटोन के उनके संश्लेषण में साधारण अशुद्धता के रूप में प्राप्त किया गया था।[2]
तैयारी
थायोएसीटोन सामान्यतया चक्रीय ट्राईमर ट्रिथियोएसीटोन, [(CH3)2CS]3 को दरार के रूप में बदलकर प्राप्त किया जाता है। एलिल आइसोप्रोपिल सल्फाइड के पायरोलिसिस द्वारा या लुईस अम्ल की उपस्थिति में हाइड्रोजन सल्फाइड के साथ एसीटोन की अभिक्रिया करके ट्रिमर तैयार किया जाता है।[5][6] थिओन देने के लिए ट्रिमर 500–600 °C (932–1,112 °F) पर फट जाता है।[3][7][2]
बहुलकीकरण
इसके ऑक्सीजन समधर्मी एसीटोन के विपरीत, जो आसानी से बहुलकीकृत नहीं होता है, थायोएसीटोन अनायास बहुत कम तापमान पर भी बहुलकीकृत हो जाता है, और ईथर या एथिलीन ऑक्साइड में शुद्ध होकर घुल जाता है, जिससे एक सफेद ठोस उत्पन्न करता है जो एक रैखिक बहुलक का एक भिन्न मिश्रण होता है। जैसे ···–[C(CH
3)
2–S–]
n–···और चक्रीय ट्रिमर ट्राइथियोएसीटोन। इस उत्पाद का अवरक्त अवशोषण मुख्य रूप से 2950, 2900, 1440, 1150, 1360,और 1375 सेमी-1 पर जेमिनल मिथाइल युग्म के कारण होता है, और 1085 और 643 सेमी-1 पर C-S बंध के कारण होता है। 1H एनएमआर स्पेक्ट्रा x = 8.1 पर एकल चोटी दर्शाता है।[2]
बहुलक का औसत आणविक भार 2000 से 14000 तक भिन्न होता है, जो कि तैयार की गयी विधि, तापमान और थियोएनोल टॉटोमर की उपस्थिति पर निर्भर करता है। बहुलक लगभग 70 डिग्री सेल्सियस से 125 डिग्री सेल्सियस की सीमा में पिघलता है। बहुलकीकरण को मुक्त कणों और प्रकाश द्वारा बढ़ावा दिया जाता है।[2]
थायोएसीटोन (ट्रिथियोएसीटोन) का चक्रीय ट्रिमर कमरे के तापमान के पास 24 डिग्री सेल्सियस (75 डिग्री फारेनहाइट) के गलनांक बिंदु के साथ एक सफेद या रंगहीन यौगिक है। इसमें एक अप्रिय गंध भी होती है।[4]
गंध
थायोएसीटोन में तीव्र दुर्गंध होती है। कई कम आणविक भार वाले ऑर्गोसल्फर यौगिकों की तरह,इसकी गंध तीव्र है और अत्यधिक तनु होने पर भी इसका पता लगाया जा सकता है।[8]1889 में, जर्मन शहर फ्रीबर्ग में रसायन को आसवित करने के प्रयास के बाद गंध के कारण प्रयोगशाला के चारों ओर 0.75 किलोमीटर (0.47 मील) के दायरे में उल्टी, मतली और बेहोशी के मामले सामने आए।[9] 1890 के एक प्रतिवेदन में, लीड् में व्हाइटहॉल साबुन कार्य के ब्रिटिश रसायनज्ञों ने कहा कि ऐसा प्रतीत होता है कि यह तनुकरण गंध को और अधिक बुरा बना देता है और गंध को "भयभीत" के रूप में वर्णित करता है।[10]थायोएसीटोन को इसकी बेहद दुर्गंधयुक्त गंध और लोगों को बेहोश करने, उल्टी करने और लंबी दूरी पर पता लगाने की क्षमता के कारण एक खतरनाक रसायन माना जाता है।
1967 में, Esso के शोधकर्ताओं ने ब्रिटेन के ऑक्सफोर्ड के दक्षिण में एक प्रयोगशाला में ट्राइथियोसेटोन में दरार पैदा करने के प्रयोग को दोहराया। उन्होंने अपना अनुभव इस प्रकार बताया::
हाल ही में हमने पाया कि हमारी सबसे बड़ी उम्मीदों से परे एक गंध की समस्या है। प्रारंभिक प्रयोगों के समय, अवशेषों की एक बोतल से एक प्रभावशाली प्रदर्शन कूद गया, और यद्यपि इसे एक बार में बदल दिया गया, जिसके परिणामस्वरूप दो सौ गज [180 मीटर] दूर एक इमारत में काम करने वाले सहकर्मियों से मतली और बीमारी की तत्काल शिकायत हुई। हमारे दो औषधि विक्रेता जिन्होंने ट्राइथियोएसीटोन की सूक्ष्म मात्रा के टूटने की जांच करने के अतिरिक्त और कुछ नहीं किया था, उन्होंने स्वयं को एक रेस्तरां में शत्रुतापूर्ण घूरने की वस्तु पाया और एक वेटर स्त्री द्वारा अपने आस-पास के क्षेत्र को दुर्गन्ध से छिड़काव करने का अपमान सहा। गंधों ने कमजोर पड़ने के अपेक्षित प्रभावों को खारिज कर दिया क्योंकि प्रयोगशाला में श्रमिकों को गंध असहनीय नहीं लगी ... और वास्तव में उन्होंने जिम्मेदारी से इनकार किया क्योंकि वे बंद निकाय में काम कर रहे थे।अन्यथा उन्हें समझाने के लिए, उन्हें अन्य पर्यवेक्षकों के साथ प्रयोगशाला के चारों ओर, एक चौथाई मील [0.40 किमी] तक की दूरी पर फैलाया गया था, और एसीटोन जेम-डाइथियोल या कच्चे ट्राइथियोएसीटोन क्रिस्टलीकरण से मूल शराब की एक बूंद को एक धूआं अलमारी में रखी घड़ी के समीप गिलास पर रखा गया था। इसमें गंध सेकंडों में नीचे की ओर पायी गयी थी।
यह भी देखें
- थियोबेंजोफेनोन, एक थायोकेटोन जिसे ठोस के रूप में पृथक किया जा सकता है
- ब्रोमोऐसीटोन
- क्लोरोऐसीटोन
- फ्लोरोऐसीटोन
- आयोडोऐसीटोन
संदर्भ
- ↑ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 739. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 William H. Sharkey (1979): "Polymerization through the carbon-sulfur double bond". Polymerization, series Advances in Polymer Science, volume 17, pages 73–103. doi:10.1007/3-540-07111-3_2
- ↑ 3.0 3.1 V.C.E. Burnop; K.G. Latham (1967). "पॉलीथियोसेटोन पॉलिमर". Polymer. 8: 589–607. doi:10.1016/0032-3861(67)90069-9.
- ↑ 4.0 4.1 R.D. Lipscomb; W.H. Sharkey (1970). "थायोसिटोन का लक्षण वर्णन और पोलीमराइज़ेशन". Journal of Polymer Science Part A: Polymer Chemistry. 8 (8): 2187–2196. Bibcode:1970JPoSA...8.2187L. doi:10.1002/pol.1970.150080826.
- ↑ Bailey, William J.; Chu, Hilda (1965). "पॉलीथियोसेटोन का संश्लेषण". ACS Polymer Preprints. 6: 145–155.
- ↑ Bohme, Horst; Pfeifer, Hans; Schneider, Erich (1942). "डिमेरिक थायोकेटोन्स". Berichte der Deutschen Chemischen Gesellschaft. 75B (7): 900–909. doi:10.1002/cber.19420750722. Note: This early report mistakes the trimer for the monomer
- ↑ Kroto, H.W.; Landsberg, B.M.; Suffolk, R.J.; Vodden, A. (1974). "The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone, (CH3)2CS". Chemical Physics Letters. 29 (2): 265–269. Bibcode:1974CPL....29..265K. doi:10.1016/0009-2614(74)85029-3. ISSN 0009-2614.
- ↑ Derek Lowe (June 11, 2009). "Things I Won't Work With: Thioacetone". In The Pipeline.
- ↑ E. Baumann & E. Fromm (1889). "कीटोन्स के थियो डेरिवेटिव पर". Berichte der Deutschen Chemischen Gesellschaft. 22 (2): 2592–2599. doi:10.1002/cber.188902202151.
- ↑ केमिकल न्यूज एंड जर्नल ऑफ इंडस्ट्रियल साइंस. Chemical news office. 1890. p. 219.
बाहरी संबंध
- Thioacetone, NIST
- Trithioacetone, Aldrich