मरकरी (आई) सल्फेट

| |
| |
| Names | |
|---|---|
| IUPAC name
Mercury(I) sulfate
| |
| Other names
Mercurous sulfate
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
| EC Number |
|
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| Hg2SO4 | |
| Molar mass | 497.24 g/mol |
| Appearance | whitish-yellow crystals |
| Density | 7.56 g/cm3 |
| 0.051 g/100 mL (25 °C) 0.09 g/100 mL (100 °C) | |
Solubility product (Ksp)
|
6.5×10−7[1] |
| Solubility | soluble in dilute nitric acid, Insoluble in water, Soluble in hot sulfuric acid. |
| −123.0·10−6 cm3/mol | |
| Structure | |
| monoclinic | |
| Thermochemistry | |
Heat capacity (C)
|
132 J·mol−1·K−1[2] |
Std molar
entropy (S⦵298) |
200.7 J·mol−1·K−1 |
Std enthalpy of
formation (ΔfH⦵298) |
-743.1 kJ·mol−1 |
| Related compounds | |
Other anions
|
Mercury(I) fluoride Mercury(I) chloride Mercury(I) bromide Mercury(I) iodide |
Other cations
|
Mercury(II) sulfate Cadmium sulfate Thallium(I) sulfate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
मरकरी (आई) सल्फेट, जिसे सामान्यतः मरक्यूरस सल्फेट (यूके) या मरक्यूरस सल्फेट (यूएस) कहा जाता है, एक रासायनिक यौगिक Hg2SO4होता है। [3] मरकरी (आई) सल्फेट एक धात्विक यौगिक होता है जो सफेद, हल्के पीले या बेज रंग का पाउडर होता है।[4] यह सल्फ्यूरिक अम्ल का एक धात्विक नमक होता है जो दोनों हाइड्रोजन परमाणुओं को पारा (आई) के साथ प्रतिस्थापित करके निर्मित होता है। यह अत्यधिक विषैला होता है; यदि यह साँस के द्वारा शरीर में प्रवेश कर जाए, निगल लिया जाए या त्वचा द्वारा अवशोषित कर लिया जाए तो यह घातक हो सकता है।
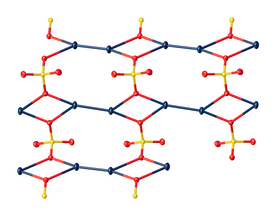
संरचना
क्रिस्टल में, मर्क्यूरियस सल्फेट न्यूनाधिक 2.50 Å की Hg-Hg दूरी के साथ Hg22+ केंद्र से बना होता है। SO42− आयन 2.23 से 2.93 Å तक लंबे और छोटे दोनों Hg-O बांड निर्मित करते हैं।[5]
छोटे Hg-O बांड पर ध्यान केंद्रित करते हुए, Hg - Hg - O बांड कोण 165°±1° होता है।[6][7]
तैयारी
मरकरी (आई) सल्फेट निर्मित करने की एक विधि मरकरी (आई) नाइट्रेट के अम्लीय घोल को 1 से 6 सल्फ्यूरिक अम्ल घोल के साथ मिश्रित किया जाता है:[8][9]
- Hg2(NO3)2 + H2SO4 → Hg2SO4 + 2 HNO3
इसे पारा (तत्व) की अधिकता को सांद्र सल्फ्यूरिक अम्ल के साथ प्रतिक्रिया करके भी निर्मित किया जा सकता है जो निम्न प्रकार है:[8]
- 2 Hg + 2 H2SO4 → Hg2SO4 + 2 H2O + SO2
विद्युतरासायनिक कोशिकाओं में उपयोग
मरकरी (आई) सल्फेट का उपयोग इलेक्ट्रोकेमिकल सेल कोशिकाओं में किया जाता है।[10][11][12] इसे सर्वप्रथम 1872 में लैटिमर क्लार्क द्वारा इलेक्ट्रोकेमिकल कोशिकाओं में प्रस्तुत किया गया था,[13] यह तब वैकल्पिक रूप से था 1911 में जॉर्ज ऑगस्टस ह्यूलेट द्वारा निर्मित की गई वेस्टन कोशिकाओं में उपयोग किया गया था।[13]यह सिल्वर सल्फेट के साथ 100 डिग्री सेल्सियस से ऊपर उच्च तापमान पर एक अच्छा इलेक्ट्रोड पाया जाता है।[14]
मरकरी (आई) सल्फेट को उच्च तापमान पर विघटित होते पाया जाता है। अपघटन प्रक्रिया एंडोथर्मिक होती है, और यह 335°C और 500°C के मध्य होती है।
मरकरी (आई) सल्फेट में अद्वितीय गुण होते हैं जो मानक कोशिकाओं को संभव बनाते हैं। इसकी घुलनशीलता अत्यधिक कम होती है (न्यूनाधिक एक ग्राम प्रति लीटर); कैथोड प्रणाली से प्रसार अत्यधिक नहीं होता है और यह पारा इलेक्ट्रोड पर एक बड़ी क्षमता देने के लिए पर्याप्त होते है।[15]
संदर्भ
- ↑ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (in English) (99 ed.). CRC Press. pp. 5–189. ISBN 978-1138561632.
- ↑ Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, FL: CRC Press, pp. 5–19, ISBN 0-8493-0594-2
- ↑ Intermediate Inorganic Chemistry by J. W. Mellor, published by Longmans, Green and Company, London, 1941, page 388
- ↑ "Mercurous Sulfate | 7783-36-0".
- ↑ Matthias Weil, Michael Puchberger, Enrique J. Baran (2004). "Preparation and Characterization of Dimercury(I)Monofluorophosphate(V), Hg2PO3F: Crystal Structure, Thermal Behavior, Vibrational Spectra, and Solid-State 31P and 19F NMR Spectra". Inorg. Chem. 43 (26): 8330–8335. doi:10.1021/ic048741e. PMID 15606179.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Dorm, E. (1969). "पारा (I) यौगिकों पर संरचनात्मक अध्ययन। VI. मरकरी (आई) सल्फेट और सेलेनेट की क्रिस्टल संरचना". Acta Chemica Scandinavica. 23: 1607–15. doi:10.3891/acta.chem.scand.23-1607.
- ↑ Weil, Matthias (2014). "Crystal structure of Hg2SO4– a redetermination". Acta Crystallographica Section E. 70 (9): i44. doi:10.1107/S1600536814011155. PMC 4186147. PMID 25309168.
- ↑ 8.0 8.1 Google Books result, accessed 11 December 2010
- ↑ Mercurous Sulphate, cadmium sulphate, and the cadmium cell. by Hulett G. A. The physical review.1907. p.19.
- ↑ "Influence of Microstucture on the Charge Storage Properties of Chemically Synthesized Manganese Dioxide" by Mathieu Toupin, Thiery Brousse, and Daniel Belanger. Chem. Mater. 2002, 14, 3945–3952
- ↑ "Electromotive Force Studies of Cell, CdxHgy | CdSO4,(m) I Hg2SO4, Hg, in Dioxane-Water Media" by Somesh Chakrabarti and Sukumar Aditya. Journal of Chemical and Engineering Data, Vol.17, No. 1, 1972
- ↑ "Characterization of Lithium Sulfate as an Unsymmetrical-Valence Salt Bridge for the Minimization of Liquid Junction Potentials in Aqueous – Organic Solvent Mixtures" by Cristiana L. Faverio, Patrizia R. Mussini, and Torquato Mussini. Anal. Chem. 1998, 70, 2589–2595
- ↑ 13.0 13.1 "George Augustus Hulett: from Liquid Crystals to Standard Cell" by John T. Stock. Bull. Hist. Chem. Volume 25, Number 2, 2000, p.91-98
- ↑ Lietzke, M. H.; Stoughton, R. W. (November 1953). "The Behavior of the Silver—Silver Sulfate and the Mercury—Mercurous Sulfate Electrodes at High Temperatures 1". Journal of the American Chemical Society. 75 (21): 5226–5227. doi:10.1021/ja01117a024.(subscription required)
- ↑ "Sulphates of Mercury and Standard Cells." by Elliott, R. B. and Hulett, G. A. The Journal of Physical Chemistry 36.7 (1932): 2083–2086.