आयन ट्रांसपोर्टर: Difference between revisions
mNo edit summary |
mNo edit summary |
||
| Line 32: | Line 32: | ||
=== माध्यमिक ट्रांसपोर्टर === | === माध्यमिक ट्रांसपोर्टर === | ||
फाइल:सोडियम ग्लूकोज सिम्पॉर्टर ऑल इन वन.पीडीएफ|थंब|233x233पीएक्स|ना+ ग्लू सिंपोर्टर | फाइल:सोडियम ग्लूकोज सिम्पॉर्टर ऑल इन वन.पीडीएफ|थंब|233x233पीएक्स|ना+ ग्लू सिंपोर्टर | ||
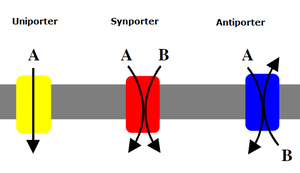
[[File:Porters.PNG|thumb|235x235 पीएक्स]]द्वितीयक ट्रांसपोर्टर भी आयनों (या छोटे अणुओं) को सघनता प्रवणता के विरुद्ध परिवहन करते हैं - कम सांद्रता से उच्च सांद्रता तक - लेकिन प्राथमिक ट्रांसपोर्टरों के विपरीत जो सांद्रता प्रवणता बनाने के लिए ATP का उपयोग करते हैं, द्वितीयक ट्रांसपोर्टर प्राथमिक ट्रांसपोर्टरों द्वारा बनाई गई सांद्रता प्रवणता से संभावित ऊर्जा का उपयोग | [[File:Porters.PNG|thumb|235x235 पीएक्स]]द्वितीयक ट्रांसपोर्टर भी आयनों (या छोटे अणुओं) को सघनता प्रवणता के विरुद्ध परिवहन करते हैं - कम सांद्रता से उच्च सांद्रता तक - लेकिन प्राथमिक ट्रांसपोर्टरों के विपरीत जो सांद्रता प्रवणता बनाने के लिए ATP का उपयोग करते हैं, द्वितीयक ट्रांसपोर्टर प्राथमिक ट्रांसपोर्टरों द्वारा बनाई गई सांद्रता प्रवणता से संभावित ऊर्जा का उपयोग आयनों का परिवहन के लिए करते हैं।<sup>[6]</sup> उदाहरण के लिए, छोटी आंत और किडनी में पाए जाने वाले सोडियम पर निर्भर ग्लूकोज ट्रांसपोर्टर कोशिका में ग्लूकोज ले जाने में मदद करने के लिए सोडियम पोटेशियम पंप (जैसा कि ऊपर बताया गया है) द्वारा सेल में बनाए गए सोडियम ग्रेडिएंट का उपयोग करते हैं।<ref name="pmid5867548">{{cite journal | vauthors = Crane RK, Forstner G, Eichholz A | title = Studies on the mechanism of the intestinal absorption of sugars. X. An effect of Na+ concentration on the apparent Michaelis constants for intestinal sugar transport, in vitro | journal = Biochimica et Biophysica Acta | volume = 109 | issue = 2 | pages = 467–77 | date = November 1965 | pmid = 5867548 | doi = 10.1016/0926-6585(65)90172-x }}</ref> ऐसा तब होता है जब सोडियम अपनी सघनता प्रवणता को नीचे प्रवाहित करता है जो ग्लूकोज को उसकी सघनता प्रवणता को वापस कोशिका में धकेलने के लिए पर्याप्त ऊर्जा प्रदान करता है। यह छोटी आंत और किडनी में ग्लूकोज खोने से रोकने के लिए महत्वपूर्ण है। सोडियम-ग्लूकोज सिम्पॉर्टर जैसे संकेतक एक आयन को उसकी सघनता प्रवणता के साथ परिवहन करते हैं, और वे एक ही दिशा में एक दूसरे अणु के परिवहन को जोड़ते हैं।<sup>[13]</sup> [[एंटीपोर्टर्स]] एक अणु की सांद्रता प्रवणता का उपयोग अपनी सांद्रता प्रवणता को ऊपर ले जाने के लिए भी करते हैं लेकिन युग्मित अणु को विपरीत दिशा में ले जाया जाता है।<sup>[6]</sup> | ||
== विनियमन == | == विनियमन == | ||
आयन ट्रांसपोर्टरों को विभिन्न तरीकों से नियंत्रित किया जा सकता है जैसे फास्फोराइलेशन, एलोस्टेरिक अवरोध या सक्रियण, और आयन सांद्रता के प्रति संवेदनशीलता। [[फॉस्फेट]] समूह | आयन ट्रांसपोर्टरों को विभिन्न तरीकों से नियंत्रित किया जा सकता है जैसे फास्फोराइलेशन, एलोस्टेरिक अवरोध या सक्रियण, और आयन सांद्रता के प्रति संवेदनशीलता। [[फॉस्फेट]] समूह को जोड़ने के लिए प्रोटीन किनेसेस का उपयोग करना या प्रोटीन को डीफॉस्फोराइलेट करने के लिए फॉस्फेटेज ट्रांसपोर्टर की गतिविधि को बदल सकते हैं।<ref>{{cite journal | vauthors = Marshall WS, Watters KD, Hovdestad LR, Cozzi RR, Katoh F | title = CFTR Cl- channel functional regulation by phosphorylation of focal adhesion kinase at tyrosine 407 in osmosensitive ion transporting mitochondria rich cells of euryhaline killifish | journal = The Journal of Experimental Biology | volume = 212 | issue = Pt 15 | pages = 2365–77 | date = August 2009 | pmid = 19617429 | pmc = 2712415 | doi = 10.1242/jeb.030015 }}</ref> फॉस्फेट समूह के जुड़ने से प्रोटीन सक्रिय होता है या बाधित होता है, यह विशिष्ट प्रोटीन पर निर्भर करता है। एलोस्टेरिक निषेध के साथ, नियामक लिगैंड नियामक साइट में बंध सकता है और या तो ट्रांसपोर्टर को बाधित या सक्रिय कर सकता है। आयन ट्रांसपोर्टरों को समाधान में आयन की सांद्रता (जरूरी नहीं कि आयन इसे स्थानांतरित करता है) द्वारा नियंत्रित किया जा सकता है। उदाहरण के लिए, इलेक्ट्रॉन परिवहन श्रृंखला उदाहरण के लिए विलयन में H<sup>+</sup> आयनों (pH) की उपस्थिति द्वारा नियंत्रित होती हैं| <ref name=":0" /> | ||
Revision as of 09:51, 6 March 2023
जीव विज्ञान में, एक ट्रांसपोर्टर एक ट्रांसमेम्ब्रेन प्रोटीन होता है जो कई अलग-अलग जैविक कार्यों को पूरा करने के लिए एक जैविक झिल्ली के पार आयनों (या अन्य छोटे अणुओं) को स्थानांतरित करता है, जिसमें कोशिकाुलर संचार, होमोस्टैसिस को बनाए रखना, ऊर्जा उत्पादन आदि शामिल हैं।[1] पंप, यूनिपोर्टर्स, एंटीपोर्टर्स और सिम्पोर्टर्स सहित विभिन्न प्रकार के ट्रांसपोर्टर हैं। सक्रिय ट्रांसपोर्टर या आयन पंप ट्रांसपोर्टर होते हैं जो एडेनोसाइन ट्राइफॉस्फेट (ATP), सूरज की रोशनी, और अन्य रेडॉक्स प्रतिक्रियाओं सहित विभिन्न स्रोतों से ऊर्जा को संभावित ऊर्जा में आयन को अपनी सांद्रता ढाल में पंप करके परिवर्तित करते हैं।Cite error: Closing </ref> missing for <ref> tag इस संभावित ऊर्जा का उपयोग द्वितीयक ट्रांसपोर्टरों द्वारा किया जा सकता है, जिसमें आयन वाहक और आयन चैनल शामिल हैं, ATP संश्लेषण जैसी महत्वपूर्ण कोशिकाुलर प्रक्रियाओं को चलाने के लिए।[3]
यह पृष्ठ मुख्य रूप से आयन ट्रांसपोर्टरों पर केंद्रित है जो पंप के रूप में कार्य करते हैं, लेकिन ट्रांसपोर्टर अणुओं को सुगम प्रसार के माध्यम से स्थानांतरित करने के लिए भी कार्य कर सकते हैं। सुविधाजनक प्रसार के लिए ATP की आवश्यकता नहीं होती है और अणुओं को अनुमति देता है, जो इन प्रोटीन ट्रांसपोर्टरों के माध्यम से अपने सांद्रता ढाल को फैलाने के लिए झिल्ली (निष्क्रिय प्रसार) में जल्दी से फैलाने में असमर्थ हैं।[4]
उचित कोशिका फ़ंक्शन के लिए आयन ट्रांसपोर्टर आवश्यक हैं और इस प्रकार वे कोशिका द्वारा अत्यधिक विनियमित होते हैं और विभिन्न तरीकों का उपयोग करके शोधकर्ताओं द्वारा अध्ययन किया जाता है। कोशिका विनियमों और अनुसंधान विधियों के कुछ उदाहरण दिए जाएंगे।
फ़ाइल: चित्र 2.jimmyjohnslaser2.pdf|thumb|543x543px
वर्गीकरण और असंबद्धता
आयन ट्रांसपोर्टरों को झिल्ली परिवहन प्रोटीन के आयन ट्रांसपोर्टर सुपरफैमिली के रूप में वर्गीकृत किया जाता है जिसमें ट्रांसपोर्टरों के 12 परिवार होते हैं।[2] ये परिवार परिवहन वर्गीकरण (TC) प्रणाली का हिस्सा हैं, जिसका उपयोग इंटरनेशनल यूनियन ऑफ बायोकैमिस्ट्री एंड मॉलिक्यूलर बायोलॉजी (IUBMB) द्वारा किया जाता है और इन्हें ट्रांसपोर्ट किए जा रहे सबस्ट्रेट्स, परिवहन तंत्र, उपयोग किए जाने वाले ऊर्जा स्रोत और विशेषताओं के अनुसार समूहीकृत किया जाता है। प्रत्येक प्रोटीन को बनाने वाले डीएनए अनुक्रमों की तुलना करके भी। सबसे महत्वपूर्ण एकीकृत कारक सब्सट्रेट की आवेशित प्रकृति है जो एक आयन के परिवहन को इंगित करता है न कि एक तटस्थ प्रजाति को।[2]आयन ट्रांसपोर्टर आयन चैनलों से काफी भिन्न होते हैं। चैनल छिद्र होते हैं जो झिल्ली के माध्यम से चलते हैं, जबकि ट्रांसपोर्ट प्रोटीन होते हैं जिन्हें बदलने के लिए आकार बदलना चाहिए कि यह झिल्ली के किस तरफ खुला है, इस वजह से ट्रांसपोर्टर चैनलों की तुलना में गतिमान अणुओं में बहुत धीमे होते हैं।
एक इलेक्ट्रोकेमिकल ढाल या सांद्रता ढाल दो अलग-अलग क्षेत्रों में एक रासायनिक अणु या आयन की सांद्रता में अंतर है।[3]संतुलन पर दोनों क्षेत्रों में आयन की सांद्रता समान होगी, इसलिए यदि सांद्रता में अंतर है तो आयन सांद्रता प्रवणता या उच्च सांद्रता से कम सांद्रता की ओर बहने की कोशिश करेंगे। आयन चैनल विशिष्ट आयनों को अनुमति देता है जो कोशिका झिल्ली के दोनों तरफ सांद्रता को बराबर करते हुए, उनकी सांद्रता प्रवणता को प्रवाहित करने के लिए चैनल में फिट होंगे। आयन चैनल और आयन ट्रांसपोर्टर इसे सुगम प्रसार के माध्यम से पूरा करते हैं जो एक प्रकार का निष्क्रिय परिवहन है। हालांकि, केवल आयन ट्रांसपोर्टर भी सक्रिय परिवहन कर सकते हैं, जिसमें आयनों को उनके सांद्रता ढाल के खिलाफ चलना शामिल है।[4] ATP जैसे ऊर्जा स्रोतों का उपयोग करते हुए, आयन ट्रांसपोर्टर आयनों को उनकी सांद्रता प्रवणता के खिलाफ स्थानांतरित करने में सक्षम होते हैं, जो तब माध्यमिक ट्रांसपोर्टरों या अन्य प्रोटीनों द्वारा ऊर्जा के स्रोत के रूप में उपयोग किया जा सकता है।[3]
ऊर्जा स्रोत
प्राथमिक ट्रांसपोर्टर
प्राथमिक ट्रांसपोर्टर कोशिकाओं की झिल्ली के आर-पार Na+, K+, और Ca2+ जैसे आयनों के परिवहन के लिए ऊर्जा का उपयोग करते हैं और सांद्रण प्रवणता बना सकते हैं।[3] यह परिवहन ATP को ऊर्जा स्रोत के रूप में उपयोग कर सकता है या इसका उपयोग पौधों में इलेक्ट्रॉन परिवहन श्रृंखला जैसे तरीकों से ATP उत्पन्न करने के लिए किया जा सकता है।[4][3]
सक्रिय ट्रांसपोर्टर
ट्रांसपोर्टर जो ATP का उपयोग करते हैं, ATP में ऊर्जा को सांद्रता ढाल के रूप में संभावित ऊर्जा में परिवर्तित करते हैं। वे आयन को कम सांद्रता से उच्च सांद्रता तक ले जाने के लिए ATP का उपयोग करते हैं। ATP का उपयोग करने वाले प्रोटीन के उदाहरण P-प्रकार के ATPases हैं जो फास्फारिलीकरण द्वारा Na+, K+, और Ca2+ आयनों को स्थानांतरित करते हैं, A-प्रकार ATPases जो आयनों को स्थानांतरित करते हैं, और ABC-बाध्यकारी कैसेट ट्रांसपोर्टर(ATP बाइंडिंग कैसेट ट्रांसपोर्टर) जो अणुओं के एक व्यापक सेट को ट्रांसपोर्ट करते हैं।[3]P-टाइप ATPase के उदाहरणों में Na+/K+-ATPase शामिल हैं |[4][5][6] जिसे जानूस किनसे-2(Janus Kinase-2) द्वारा नियंत्रित किया जाता है[7] साथ ही प्लाज्मा झिल्ली Ca2+ ATPase जो ADP और ATP सांद्रता के प्रति संवेदनशीलता प्रदर्शित करता है[8] P ग्लाइकोप्रोटीन मानव शरीर में ABC ट्रांसपोर्ट बाइंडिंग प्रोटीन का एक उदाहरण है।
ATP उत्पादक ट्रांसपोर्टर
ATP उत्पादक ट्रांसपोर्टर ATP यूटिलाइजिंग ट्रांसपोर्टर के विपरीत दिशा में चलते हैं। ये प्रोटीन आयनों को उच्च से निम्न सांद्रता में ढाल के साथ ले जाते हैं लेकिन इस प्रक्रिया में ATP का निर्माण होता है। ATP उत्पन्न करने के लिए सांद्रता ढाल के रूप में संभावित ऊर्जा का उपयोग किया जाता है।[3]जानवरों में, यह ATP संश्लेषण माइटोकॉन्ड्रिया में F-प्रकार ATPase का उपयोग करके होता है जिसे अन्यथा एटीपी सिंथेज़ के रूप में जाना जाता है।यह प्रक्रिया ऑक्सीडेटिव फास्फारिलीकरण नामक प्रक्रिया में इलेक्ट्रॉन परिवहन श्रृंखला का उपयोग करती है।[9][10] V-प्रकार ATPase, F-प्रकार ATPase के विपरीत कार्य करता है और इसका उपयोग पौधों में प्रोटॉन ग्रेडिएंट बनाने के लिए ATP को हाइड्रोलाइज़ करने के लिए किया जाता है। इसके उदाहरण लाइसोसोम हैं जो क्लोरोप्लास्ट में प्रकाश संश्लेषण की प्रक्रिया के दौरान V-प्रकार ATPase का उपयोग करते हुए पुटिकाओं या पौधों की रसधानियों को अम्लीकृत करते हैं।[4]इस प्रक्रिया को पीएच जैसे विभिन्न तरीकों से नियंत्रित किया जा सकता है।[11]
माध्यमिक ट्रांसपोर्टर
फाइल:सोडियम ग्लूकोज सिम्पॉर्टर ऑल इन वन.पीडीएफ|थंब|233x233पीएक्स|ना+ ग्लू सिंपोर्टर
द्वितीयक ट्रांसपोर्टर भी आयनों (या छोटे अणुओं) को सघनता प्रवणता के विरुद्ध परिवहन करते हैं - कम सांद्रता से उच्च सांद्रता तक - लेकिन प्राथमिक ट्रांसपोर्टरों के विपरीत जो सांद्रता प्रवणता बनाने के लिए ATP का उपयोग करते हैं, द्वितीयक ट्रांसपोर्टर प्राथमिक ट्रांसपोर्टरों द्वारा बनाई गई सांद्रता प्रवणता से संभावित ऊर्जा का उपयोग आयनों का परिवहन के लिए करते हैं।[6] उदाहरण के लिए, छोटी आंत और किडनी में पाए जाने वाले सोडियम पर निर्भर ग्लूकोज ट्रांसपोर्टर कोशिका में ग्लूकोज ले जाने में मदद करने के लिए सोडियम पोटेशियम पंप (जैसा कि ऊपर बताया गया है) द्वारा सेल में बनाए गए सोडियम ग्रेडिएंट का उपयोग करते हैं।[12] ऐसा तब होता है जब सोडियम अपनी सघनता प्रवणता को नीचे प्रवाहित करता है जो ग्लूकोज को उसकी सघनता प्रवणता को वापस कोशिका में धकेलने के लिए पर्याप्त ऊर्जा प्रदान करता है। यह छोटी आंत और किडनी में ग्लूकोज खोने से रोकने के लिए महत्वपूर्ण है। सोडियम-ग्लूकोज सिम्पॉर्टर जैसे संकेतक एक आयन को उसकी सघनता प्रवणता के साथ परिवहन करते हैं, और वे एक ही दिशा में एक दूसरे अणु के परिवहन को जोड़ते हैं।[13] एंटीपोर्टर्स एक अणु की सांद्रता प्रवणता का उपयोग अपनी सांद्रता प्रवणता को ऊपर ले जाने के लिए भी करते हैं लेकिन युग्मित अणु को विपरीत दिशा में ले जाया जाता है।[6]
विनियमन
आयन ट्रांसपोर्टरों को विभिन्न तरीकों से नियंत्रित किया जा सकता है जैसे फास्फोराइलेशन, एलोस्टेरिक अवरोध या सक्रियण, और आयन सांद्रता के प्रति संवेदनशीलता। फॉस्फेट समूह को जोड़ने के लिए प्रोटीन किनेसेस का उपयोग करना या प्रोटीन को डीफॉस्फोराइलेट करने के लिए फॉस्फेटेज ट्रांसपोर्टर की गतिविधि को बदल सकते हैं।[13] फॉस्फेट समूह के जुड़ने से प्रोटीन सक्रिय होता है या बाधित होता है, यह विशिष्ट प्रोटीन पर निर्भर करता है। एलोस्टेरिक निषेध के साथ, नियामक लिगैंड नियामक साइट में बंध सकता है और या तो ट्रांसपोर्टर को बाधित या सक्रिय कर सकता है। आयन ट्रांसपोर्टरों को समाधान में आयन की सांद्रता (जरूरी नहीं कि आयन इसे स्थानांतरित करता है) द्वारा नियंत्रित किया जा सकता है। उदाहरण के लिए, इलेक्ट्रॉन परिवहन श्रृंखला उदाहरण के लिए विलयन में H+ आयनों (pH) की उपस्थिति द्वारा नियंत्रित होती हैं| [3]
आयन ट्रांसपोर्टरों का अध्ययन करने की तकनीक
पैच दबाना
एक पैच क्लैंप एक इलेक्ट्रोफिजियोलॉजी तकनीक है जो कोशिकाओं में चैनलों और ट्रांसपोर्टरों का अध्ययन करने के लिए उपयोग की जाती है जो उनके माध्यम से चलती है। चैनलों और ट्रांसपोर्टरों के अस्तित्व में आने से पहले इस तकनीक को हॉजकिन और हक्सले द्वारा सिद्ध किया गया था।[9][14] पैच क्लैम्पिंग विरासत पर इसके ज़बरदस्त काम के अलावा जारी है और आमतौर पर शोधकर्ताओं द्वारा अभी भी आयन ट्रांसपोर्टरों का अध्ययन करने के लिए उपयोग किया जाता है और पर्यावरण और लिगेंड ट्रांसपोर्टर के कार्य को कैसे प्रभावित करते हैं।[1][15]
एक्स-रे क्रिस्टलोग्राफी | एक्स-रे क्रिस्टलोग्राफी
एक्स-रे क्रिस्टलोग्राफी एक अविश्वसनीय उपकरण है जो प्रोटीन की संरचना को देखने की अनुमति देता है, हालांकि, यह केवल एक प्रोटीन संरचना का एक स्नैपशॉट है। ट्रांसपोर्ट प्रोटीन की संरचना शोधकर्ताओं को यह समझने की अनुमति देती है कि कैसे और क्या ट्रांसपोर्टर झिल्ली के पार अणुओं को स्थानांतरित करने के लिए करता है।[16][17]
फोटोब्लीचिंग के बाद फ्लोरेसेंस रिकवरी
फोटोब्लीचिंग (एफआरएपी) के बाद प्रतिदीप्ति एक झिल्ली में लिपिड या प्रोटीन के प्रसार को ट्रैक करने के लिए इस्तेमाल की जाने वाली तकनीक है। इस तकनीक का उपयोग कोशिका में ट्रांसपोर्टरों की गतिशीलता और कोशिका झिल्ली में लिपिड डोमेन और लिपिड राफ्ट के साथ इसकी बातचीत को बेहतर ढंग से समझने के लिए किया जाता है।
पहले अनुनाद ऊर्जा हस्तांतरण
फ़ॉर्स्टर अनुनाद ऊर्जा हस्तांतरण (FRET) एक ऐसी तकनीक है जो प्रतिदीप्ति का उपयोग करके ट्रैक करती है कि दो प्रोटीन एक दूसरे के कितने करीब हैं। इसका उपयोग ट्रांसपोर्टरों के अध्ययन में यह देखने के लिए किया गया है कि वे अन्य कोशिकाुलर प्रोटीन के साथ कैसे बातचीत करते हैं।[1]
आयन ट्रांसपोर्टरों की तालिका
यह भी देखें
- सक्रिय ट्रांसपोर्ट
- आयन परिवहन संख्या
- आयन ट्रांसपोर्टर सुपरफैमिली
- झिल्ली परिवहन प्रोटीन
- ट्रांसपोर्ट प्रोटीन
संदर्भ
- ↑ 1.0 1.1 1.2 Maffeo C, Bhattacharya S, Yoo J, Wells D, Aksimentiev A (December 2012). "Modeling and simulation of ion channels". Chemical Reviews. 112 (12): 6250–84. doi:10.1021/cr3002609. PMC 3633640. PMID 23035940.
- ↑ 2.0 2.1 Prakash S, Cooper G, Singhi S, Saier MH (December 2003). "The ion transporter superfamily". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1618 (1): 79–92. doi:10.1016/j.bbamem.2003.10.010. PMID 14643936.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 Voet D, Voet VG, Pratt CW (2016-02-29). Fundamentals of biochemistry : life at the molecular level. ISBN 9781118918401. OCLC 910538334.
- ↑ 4.0 4.1 4.2 4.3 Scheer BT (2014-01-01). "Ion transport". AccessScience. doi:10.1036/1097-8542.352000.
- ↑ Morth JP, Pedersen BP, Buch-Pedersen MJ, Andersen JP, Vilsen B, Palmgren MG, Nissen P (January 2011). "A structural overview of the plasma membrane Na+,K+-ATPase and H+-ATPase ion pumps". Nature Reviews. Molecular Cell Biology. 12 (1): 60–70. doi:10.1038/nrm3031. PMID 21179061. S2CID 9734181.
- ↑ Takeuchi A, Reyes N, Artigas P, Gadsby DC (November 2009). "Visualizing the mapped ion pathway through the Na,K-ATPase pump". Channels. 3 (6): 383–6. doi:10.4161/chan.3.6.9775. PMC 2889157. PMID 19806033.
- ↑ Hosseinzadeh Z, Luo D, Sopjani M, Bhavsar SK, Lang F (April 2014). "Down-regulation of the epithelial Na⁺ channel ENaC by Janus kinase 2". The Journal of Membrane Biology. 247 (4): 331–8. doi:10.1007/s00232-014-9636-1. PMID 24562791. S2CID 16015149.
- ↑ Haumann J, Dash RK, Stowe DF, Boelens AD, Beard DA, Camara AK (August 2010). "Mitochondrial free [Ca2+] increases during ATP/ADP antiport and ADP phosphorylation: exploration of mechanisms". Biophysical Journal. 99 (4): 997–1006. Bibcode:2010BpJ....99..997H. doi:10.1016/j.bpj.2010.04.069. PMC 2920628. PMID 20712982.
- ↑ 9.0 9.1 Prebble JN (September 2010). "The discovery of oxidative phosphorylation: a conceptual off-shoot from the study of glycolysis". Studies in History and Philosophy of Biological and Biomedical Sciences. 41 (3): 253–62. doi:10.1016/j.shpsc.2010.07.014. PMID 20934646.
- ↑ Cite error: Invalid
<ref>tag; no text was provided for refs namedPurves_2001 - ↑ Tikhonov AN (October 2013). "pH-dependent regulation of electron transport and ATP synthesis in chloroplasts". Photosynthesis Research. 116 (2–3): 511–34. doi:10.1007/s11120-013-9845-y. PMID 23695653. S2CID 12903551.
- ↑ Crane RK, Forstner G, Eichholz A (November 1965). "Studies on the mechanism of the intestinal absorption of sugars. X. An effect of Na+ concentration on the apparent Michaelis constants for intestinal sugar transport, in vitro". Biochimica et Biophysica Acta. 109 (2): 467–77. doi:10.1016/0926-6585(65)90172-x. PMID 5867548.
- ↑ Marshall WS, Watters KD, Hovdestad LR, Cozzi RR, Katoh F (August 2009). "CFTR Cl- channel functional regulation by phosphorylation of focal adhesion kinase at tyrosine 407 in osmosensitive ion transporting mitochondria rich cells of euryhaline killifish". The Journal of Experimental Biology. 212 (Pt 15): 2365–77. doi:10.1242/jeb.030015. PMC 2712415. PMID 19617429.
- ↑ Vandenberg JI, Waxman SG (June 2012). "Hodgkin and Huxley and the basis for electrical signalling: a remarkable legacy still going strong". The Journal of Physiology. 590 (11): 2569–70. doi:10.1113/jphysiol.2012.233411. PMC 3424715. PMID 22787169.
- ↑ Swant J, Goodwin JS, North A, Ali AA, Gamble-George J, Chirwa S, Khoshbouei H (December 2011). "α-Synuclein stimulates a dopamine transporter-dependent chloride current and modulates the activity of the transporter". The Journal of Biological Chemistry. 286 (51): 43933–43. doi:10.1074/jbc.M111.241232. PMC 3243541. PMID 21990355.
- ↑ Morth JP, Pedersen BP, Toustrup-Jensen MS, Sørensen TL, Petersen J, Andersen JP, et al. (December 2007). "Crystal structure of the sodium-potassium pump". Nature. 450 (7172): 1043–9. Bibcode:2007Natur.450.1043M. doi:10.1038/nature06419. PMID 18075585. S2CID 4344526.
- ↑ Shinoda T, Ogawa H, Cornelius F, Toyoshima C (May 2009). "Crystal structure of the sodium-potassium pump at 2.4 A resolution". Nature. 459 (7245): 446–50. Bibcode:2009Natur.459..446S. doi:10.1038/nature07939. PMID 19458722. S2CID 205216514.
बाहरी संबंध
- Ion+pumps at the US National Library of Medicine Medical Subject Headings (MeSH) D12.776.157.530.450; D12.776.543.585.450
- The Transporter substrate database (TSdb)