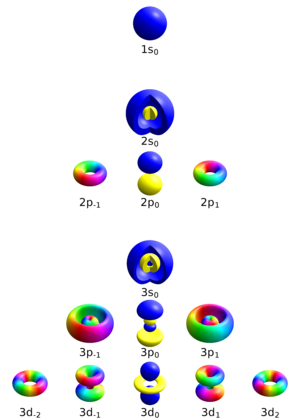सांख्यिक अंक: Difference between revisions
No edit summary |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 251: | Line 251: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 27/03/2023]] | [[Category:Created On 27/03/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 09:12, 2 May 2023
| के बारे में लेखों की एक श्रृंखला का हिस्सा |
| क्वांटम यांत्रिकी |
|---|
क्वांटम यांत्रिकी और रसायन विज्ञान में, क्वांटम संख्याएं क्वांटम प्रणाली की गतिशीलता में संरक्षित मात्रा के मूल्यों का वर्णन करती हैं। क्वांटम संख्याएँ ऑपरेटर (क्वांटम यांत्रिकी) के आइगेनमानों के अनुरूप होती हैं जो हैमिल्टनियन (क्वांटम यांत्रिकी) के साथ आवागमन करती हैं - ऐसी मात्राएँ जिन्हें प्रणाली की ऊर्जा के रूप में एक ही समय में सटीकता के साथ जाना जा सकता है और उनके संबंधित आइगेनस्पेस। एक साथ, एक क्वांटम प्रणाली के सभी क्वांटम नंबरों का एक विनिर्देश पूरी तरह से प्रणाली की एक आधार (रैखिक बीजगणित) स्थिति की विशेषता है, और सैद्धांतिक रूप से क्वांटम यांत्रिकी में एक साथ माप हो सकता है।
क्वांटम यांत्रिकी का एक महत्वपूर्ण पहलू ब्याज की कई अवलोकनीय मात्राओं का परिमाणीकरण (भौतिकी) है। विशेष रूप से, यह क्वांटम संख्या की ओर जाता है जो असतत गणित या अर्ध-पूर्णांक में मान लेता है; हालांकि वे कुछ मामलों में अनंत तक पहुंच सकते थे। यह क्वांटम यांत्रिकी को चिरसम्मत यांत्रिकी से अलग करता है, जहां द्रव्यमान, आवेश या संवेग जैसे प्रणाली को चिह्नित करने वाले मान, सभी निरंतर श्रेणी में होते हैं। क्वांटम संख्याएँ प्रायः विशेष रूप से परमाणुओं में इलेक्ट्रॉनों के ऊर्जा स्तर का वर्णन करती हैं, लेकिन अन्य संभावनाओं में कोणीय गति, स्पिन (भौतिकी), आदि सम्मिलित हैं। एक महत्वपूर्ण समूह फ्लेवर (कण भौतिकी) है - आंतरिक समरूपता क्वांटम संख्या जो एक कण के प्रकार और उसके निर्धारण मौलिक बलों के माध्यम से अन्य कणों के साथ पारस्परिक प्रभाव बनता है। किसी भी क्वांटम प्रणाली में एक या अधिक क्वांटम संख्याएँ हो सकती हैं; इस प्रकार सभी संभावित क्वांटम संख्याओं को सूचीबद्ध करना कठिन है।
किसी दिए गए प्रणालीके लिए आवश्यक क्वांटम संख्या
क्वांटम संख्याओं का मिलान एक प्रणाली से दूसरी प्रणाली में भिन्न होता है और इसका कोई सार्वभौमिक उत्तर नहीं है। इसलिए प्रत्येक प्रणाली का विश्लेषण करने के लिए इन मापदंडों को पाया जाना चाहिए। एक परिमाणित प्रणाली के लिए कम से कम एक क्वांटम संख्या की आवश्यकता होती है। किसी भी क्वांटम प्रणाली की गतिशीलता (अर्थात समय विकास) एक ऑपरेटर की राशि द्वारा हैमिल्टनियन (क्वांटम यांत्रिकी) के रूप में वर्णित है, H प्रणाली की ऊर्जा के अनुरूप प्रणाली की एक क्वांटम संख्या है; यानी, हैमिल्टनियन के eigenvalues में से एक है। प्रत्येक रैखिक स्वतंत्रता ऑपरेटर के लिए एक क्वांटम संख्या भी होती है O हेमिल्टनियन के साथ वह कम्युनिटी। कम्यूटिंग वेधशालाओं (सीएससीओ) का एक पूरा सेट जो हैमिल्टनियन के साथ यात्रा करता है, प्रणालीको उसके सभी क्वांटम नंबरों के साथ चित्रित करता है। क्वांटम संख्या और सीएससीओ के ऑपरेटरों के बीच एक-से-एक संबंध है, प्रत्येक क्वांटम संख्या के साथ इसके संबंधित ऑपरेटर के एक eigenvalues लेते हैं। अलग-अलग बेसिस (रैखिक बीजगणित) के परिणामस्वरूप जो मनमाने ढंग से आने वाले ऑपरेटरों का एक पूरा सेट बनाने के लिए चुना जा सकता है, अलग-अलग स्थितियों में एक ही प्रणाली के विवरण के लिए क्वांटम संख्याओं के विभिन्न सेटों का उपयोग किया जा सकता है।
परमाणु में इलेक्ट्रॉन
चार क्वांटम संख्याएँ परमाणु में एक इलेक्ट्रॉन का पूरी तरह से वर्णन कर सकती हैं:
- मुख्य क्वांटम संख्या (n)
- अज़ीमुथल क्वांटम संख्या (ℓ)
- चुंबकीय क्वांटम संख्या (mℓ)
- स्पिन क्वांटम संख्या (ms)
स्पिन-ऑर्बिट इंटरेक्शन, स्पिन-ऑर्बिटल इंटरैक्शन, हालांकि, इन नंबरों से संबंधित है। इस प्रकार, प्रणालीका पूरा विवरण कम क्वांटम संख्याओं के साथ दिया जा सकता है, यदि इन आधार वैक्टरों के लिए ऑर्थोगोनल विकल्प बनाए जाते हैं।
विशिष्टता
एक प्रणाली में विभिन्न इलेक्ट्रॉनों की अलग-अलग क्वांटम संख्याएँ होंगी। उदाहरण के लिए, उच्चतम व्याप्त कक्षीय इलेक्ट्रॉन, वास्तविक विभेदक इलेक्ट्रॉन (अर्थात वह इलेक्ट्रॉन जो पिछले तत्व से एक तत्व को अलग करता है), या औफबाऊ सिद्धांत # मैडेलुंग ऊर्जा आदेश नियम के अनुसार विभेदक इलेक्ट्रॉन। लेण्टेनियुम में, एक और उदाहरण के रूप में, सम्मिलित इलेक्ट्रॉन 6s में हैं; 5डी; और 4f कक्षक, क्रमशः। इस मामले में प्रमुख क्वांटम संख्याएँ 6, 5 और 4 हैं।
सामान्य शब्दावली
यहाँ प्रयुक्त मॉडल चार क्वांटम संख्याओं का उपयोग करते हुए इलेक्ट्रॉनों का वर्णन करता है, n, ℓ, mℓ, ms, जो की नीचे दिया गया है। परमाणु कण अवस्था (जैसे प्रोटॉन और न्यूट्रॉन) के प्राचीन विवरण में यह सामान्य नामकरण भी है। आण्विक कक्षाओं के क्वांटम विवरण के लिए अन्य क्वांटम संख्याओं की आवश्यकता होती है, क्योंकि हैमिल्टनियन (क्वांटम यांत्रिकी) और इसकी समरूपता अलग-अलग होती है।
प्रिंसिपल क्वांटम नंबर
मुख्य क्वांटम संख्या एक इलेक्ट्रॉन शेल इलेक्ट्रॉन शेल, या ऊर्जा स्तर का वर्णन करती है। का मान है n 1 से लेकर उस परमाणु के सबसे बाहरी इलेक्ट्रॉन वाले शेल तक होता है, अर्थात[1]
- n = 1, 2, ...
उदाहरण के लिए, सीज़ियम (Cs) में, सबसे बाहरी वैलेंस (रसायन विज्ञान) इलेक्ट्रॉन ऊर्जा स्तर 6 के शेल में होता है, इसलिए सीज़ियम में एक इलेक्ट्रॉन हो सकता है n मान 1 से 6 तक।
टाइम-इंडिपेंडेंट पोटेंशियल में कणों के लिए (देखें श्रोडिंगर इक्वेशन टाइम इंडिपेंडेंट|श्रोडिंगर इक्वेशन), यह भी लेबल करता है n हेमिल्टनियन का वां आइगेनवेल्यू (H), यानी ऊर्जा E, कोणीय संवेग के कारण योगदान के साथ (शब्द सम्मिलित है J2) छोड़ दिया। तो यह संख्या केवल इलेक्ट्रॉन और नाभिक के बीच की दूरी पर निर्भर करती है (अर्थात, रेडियल निर्देशांक r). से औसत दूरी बढ़ जाती है n. इसलिए अलग-अलग प्रिंसिपल क्वांटम नंबर वाले क्वांटम स्टेट्स को अलग-अलग शेल से संबंधित कहा जाता है।
अज़ीमुथल क्वांटम संख्या
अज़ीमुथल क्वांटम संख्या, जिसे कोणीय संवेग क्वांटम संख्या या कक्षीय क्वांटम संख्या के रूप में भी जाना जाता है, इलेक्ट्रॉन शेल#उपकोशों (सबशेल्स) का वर्णन करता है, और संबंध के माध्यम से कक्षीय कोणीय गति का परिमाण देता है।
- L2 = ħ2 ℓ (ℓ + 1)
रसायन विज्ञान और स्पेक्ट्रोस्कोपी में, ℓ = 0 को s कक्षीय कहा जाता है, ℓ = 1, p कक्षीय, ℓ = 2, d कक्षीय, और ℓ = 3, f कक्षीय।
का मान है ℓ 0 से लेकर n − 1, तो पहला p कक्षीय (ℓ = 1) दूसरे इलेक्ट्रॉन शेल में प्रकट होता है (n = 2), पहला d कक्षीय (ℓ = 2) तीसरे शेल में प्रकट होता है (n = 3), और इसी तरह:[2]
- ℓ = 0, 1, 2,..., n − 1
में प्रांरम्भ होने वाली क्वांटम संख्या n = 3,ℓ = 0, एक परमाणु के तीसरे इलेक्ट्रॉन शेल के s कक्षीय में इलेक्ट्रॉन का वर्णन करता है। रसायन विज्ञान में, यह क्वांटम संख्या बहुत महत्वपूर्ण है, क्योंकि यह एक परमाणु कक्षीय के आकार को निर्दिष्ट करती है और रासायनिक बंधनों और बंधन कोणों को दृढ़ता से प्रभावित करती है। अज़ीमुथल क्वांटम संख्या एक कक्षीय में मौजूद कोणीय नोड्स की संख्या को भी निरूपित कर सकती है। उदाहरण के लिए, p ऑर्बिटल्स के लिए, ℓ = 1 और इस प्रकार p ऑर्बिटल में कोणीय नोड्स की मात्रा 1 है।
कक्षीय का आकार अज़ीमुथल क्वांटम संख्या द्वारा भी दिया जाता है।
चुंबकीय क्वांटम संख्या
चुंबकीय क्वांटम संख्या उस उपधारा के भीतर विशिष्ट परमाणु कक्षीय (या बादल) का वर्णन करती है, और एक निर्दिष्ट अक्ष के साथ कक्षीय कोणीय गति का प्रक्षेपण करती है:
- Lz = mℓ ħ
के मान mℓ से रेंज −ℓ को ℓ, पूर्णांक अंतराल के साथ।[3]
एस उपधारा (ℓ = 0) में केवल एक कक्षीय होता है, और इसलिए {{math|mℓ}एक s कक्षीय में एक इलेक्ट्रॉन का } हमेशा 0 होगा। p उपकोश (ℓ = 1) में तीन ऑर्बिटल्स होते हैं (कुछ प्रणालियों में, तीन डम्बल के आकार के बादलों के रूप में चित्रित), इसलिए {{mvar|mℓ} एक p कक्षीय में एक इलेक्ट्रॉन का } -1, 0, या 1 होगा। d उपकोश (ℓ = 2) में पाँच ऑर्बिटल्स होते हैं mℓ -2, -1, 0, 1 और 2 के मान।
स्पिन क्वांटम संख्या
स्पिन क्वांटम संख्या प्रत्येक कक्षीय के भीतर इलेक्ट्रॉन के आंतरिक स्पिन कोणीय गति का वर्णन करती है और कोणीय गति ऑपरेटर # स्पिन कोणीय गति का प्रक्षेपण देती है S निर्दिष्ट अक्ष के साथ:
- Sz = ms ħ.
सामान्य तौर पर, के मान ms से रेंज −s को s, कहाँ s स्पिन क्वांटम संख्या है, जो कण के आंतरिक स्पिन कोणीय गति से जुड़ी है:[4]
- ms = −s, −s + 1, −s + 2, ..., s − 2, s − 1, s.
एक इलेक्ट्रॉन में स्पिन संख्या होती है s = 1/2, फलस्वरूप ms ± होगा1/2, स्पिन अप और स्पिन डाउन स्टेट्स का जिक्र करते हुए। पाउली अपवर्जन सिद्धांत के कारण किसी भी व्यक्तिगत कक्षीय में प्रत्येक इलेक्ट्रॉन की अलग-अलग क्वांटम संख्याएँ होनी चाहिए, इसलिए एक कक्षीय में कभी भी दो से अधिक इलेक्ट्रॉन नहीं होते हैं।
नियम
नियम के लिए कोई सार्वभौमिक निश्चित मान नहीं हैं mℓ और ms. बल्कि, mℓ और ms मान मनमानी हैं। इन स्थिरांकों के लिए विकल्पों पर एकमात्र प्रतिबंध यह है कि गणना या विवरण के एक विशेष सेट के भीतर उपयोग किए जाने वाले नामकरण योजनाबद्ध को सुसंगत होना चाहिए (उदाहरण के लिए एक पी ऑर्बिटल में पहले इलेक्ट्रॉन द्वारा कब्जा किए गए कक्षीय को इस रूप में वर्णित किया जा सकता है) mℓ = −1 या mℓ = 0 या mℓ = 1, लेकिन mℓ उस कक्षीय में अगले अयुग्मित इलेक्ट्रॉन का मान भिन्न होना चाहिए; फिर भी, mℓ फिर से अन्य कक्षकों में इलेक्ट्रॉनों को सौंपा जा सकता है mℓ = −1 या mℓ = 0 या mℓ = 1).
इन नियमों का सारांश इस प्रकार है:
नाम प्रतीकl अर्थ मूल्यों की श्रृंखला मूल्य उदाहरण मुख्य क्वांटम संख्या n शेल 1 ≤ n n = 1, 2, 3, … अज़ीमुथल क्वांटम संख्या (कोणीय गति) ℓ सबशेल (एस ऑर्बिटल को 0 के रूप में सूचीबद्ध किया गया है, पी ऑर्बिटल को 1 आदि के रूप में सूचीबद्ध किया गया है) 0 ≤ ℓ ≤ n − 1 के लिए n = 3:
ℓ = 0, 1, 2 (s, p, d)सबशेल (एस ऑर्बिटल को 0 के रूप में सूचीबद्ध किया गया है, पी ऑर्बिटल को 1 आदि के रूप में सूचीबद्ध किया गया है) mℓ कक्षीय (कक्षीय अभिविन्यास) −ℓ ≤ mℓ ≤ ℓ के लिए ℓ = 2:
mℓ = −2, −1, 0, 1, 2स्पिन क्वांटम संख्या ms इलेक्ट्रॉन का चक्रण (−1/2 = स्पिन डाउन", 1/2= "स्पिन अप") −s ≤ ms ≤ s एक इलेक्ट्रॉन के लिए s = 1/2,
इसलिए ms = −1/2, +1/2
उदाहरण: कार्बन (C) परमाणु के सबसे बाहरी वैलेंस (रसायन विज्ञान) इलेक्ट्रॉनोंको संदर्भित करने के लिए उपयोग की जाने वाली क्वांटम संख्याएँ, जो 2p परमाणु कक्षीय में स्थित हैं, हैं; n = 2 (दूसरा इलेक्ट्रॉन शेल), ℓ = 1 (p कक्षीय इलेक्ट्रॉन कोश#उपकोश), mℓ = 1, 0, −1, ms = 1/2 (समानांतर स्पिन)।
स्पेक्ट्रोस्कोपी के परिणामों ने संकेत दिया कि अधिकतम दो इलेक्ट्रॉन एक कक्षीय पर कब्जा कर सकते हैं। हालांकि, हुंड के नियमों के अनुसार, दो इलेक्ट्रॉनों में कभी भी समान सटीक क्वांटम स्थिति नहीं हो सकती है और न ही क्वांटम संख्याओं का एक ही सेट हो सकता है, जो पाउली अपवर्जन सिद्धांत को संबोधित करता है। एक चौथा क्वांटम नंबर, जो दो संभावित मूल्यों के साथ स्पिन का प्रतिनिधित्व करता है, संघर्ष को हल करने के लिए एक तदर्थ धारणा के रूप में जोड़ा गया था; इस धारणा को बाद में सापेक्षवादी क्वांटम यांत्रिकी और प्रसिद्ध स्टर्न-गेरलाच प्रयोग के परिणामों से विस्तार से समझाया जाएगा।
पृष्ठभूमि
क्वांटम यांत्रिकी के पूरे इतिहास में कई अलग-अलग मॉडल प्रस्तावित किए गए हैं, लेकिन नामकरण की सबसे प्रमुख प्रणाली फ्रेडरिक डॉग, रॉबर्ट एस. मुल्लिकेन के हंड-मुल्लिकेन आणविक कक्षीय सिद्धांत और इरविन श्रोडिंगर | श्रोडिंगर, जॉन सी. स्लेटर के योगदान से उत्पन्न हुई है। और जॉन लेनार्ड-जोन्स। नामकरण की इस प्रणाली में नील्स बोह्र ऊर्जा स्तर, हंड-मुल्लिकेन कक्षीय सिद्धांत, और स्पेक्ट्रोस्कोपी और हुंड के नियमों के आधार पर इलेक्ट्रॉन स्पिन पर अवलोकन सम्मिलित थे।[5]
कुल कोणीय संवेग संख्या
कण का कुल कोणीय संवेग
जब कोई स्पिन-ऑर्बिट इंटरेक्शन को ध्यान में रखता है, तो L और S ऑपरेटर अब हैमिल्टनियन (क्वांटम यांत्रिकी) के साथ क्रमविनिमेयता नहीं रखते हैं, और उनके आइगेनवेल्यू समय के साथ बदलते हैं। इस प्रकार क्वांटम संख्याओं का एक और सेट इस्तेमाल किया जाना चाहिए। इस सेट में सम्मिलित है[6][7]
- कुल कोणीय गति क्वांटम संख्या :
- j = |ℓ ± s|
जो संबंध के माध्यम से कुल कोणीय संवेग देता है
- J2 = ħ2 j (j + 1)
- एक निर्दिष्ट अक्ष के साथ कुल कोणीय गति का प्रक्षेपण" :
- mj = −j, −j + 1, −j + 2, ..., j − 2, j − 1, j
उपरोक्त के अनुरूप और संतुष्ट करता है
- mj = mℓ + ms and |mℓ + ms| ≤ j
- समानता
प्रतिबिंब के तहत यह eigenvalue है : उन राज्यों के लिए सकारात्मक (+1) जो सम ℓ से आए हैं और नकारात्मक (-1) उन राज्यों के लिए हैं जो विषम ℓ से आए हैं । पूर्व को सम समता के रूप में भी जाना जाता है और बाद वाले को विषम समता के रूप में जाना जाता है , और इसके द्वारा दिया जाता है
- P = (−1)ℓ
उदाहरण के लिए, निम्नलिखित 8 अवस्थाओं पर विचार करें, जो उनकी क्वांटम संख्या द्वारा परिभाषित हैं:
n ℓ mℓ ms ℓ + s ℓ − s mℓ + ms (1) 2 1 1 +1/2 3/2 1/23/2 (2) 2 1 1 −1/2 3/2 1/2 1/2 (3) 2 1 0 +1/2 3/2 1/2 1/2 (4) 2 1 0 −1/2 3/2 1/2 −1/2 (5) 2 1 −1 +1/2 3/2 1/2 −1/2 (6) 2 1 −1 −1/2 3/2 1/2−3/2 (7) 2 0 0 +1/2 1/2 −1/2 1/2 (8) 2 0 0 −1/2 1/2 −1/2 −1/2
प्रणाली में क्वांटम राज्यों को इन 8 राज्यों के रैखिक संयोजन के रूप में वर्णित किया जा सकता है। हालाँकि, स्पिन-ऑर्बिट इंटरैक्शन की उपस्थिति में, यदि कोई 8 राज्यों द्वारा एक ही प्रणाली का वर्णन करना चाहता है जो हैमिल्टनियन (क्वांटम यांत्रिकी) के आइजन्वेक्टर हैं (अर्थात प्रत्येक एक ऐसे राज्य का प्रतिनिधित्व करता है जो समय के साथ दूसरों के साथ मिश्रण नहीं करता है), हमें चाहिए निम्नलिखित 8 राज्यों पर विचार करें:
j mj समता 3/2 3/2 ओड ऊपर दशा (1) से आ रहा है 3/2 1/2 ओड उपरोक्त दशा (2) और (3) से आ रहा है 3/2 −1/2 ओड उपरोक्त दशा (4) और (5) से आ रहे हैं 3/2 −3/2 ओड ऊपर दशा (6) से आ रहा है 1/2 1/2 ओड उपरोक्त दशा (2) और (3) से आ रहा है 1/2 −1/2 ओड उपरोक्त दशा (4) और (5) से आ रहे हैं 1/2 1/2 इवन ऊपर दशा (7) से आ रहा है 1/2 −1/2 इवन ऊपर दशा (8) से आ रहा है
परमाणु कोणीय गति क्वांटम संख्या
परमाणु नाभिक में, प्रोटॉन और न्यूट्रॉन (न्यूक्लियॉन) की पूरी असेंबली में प्रत्येक न्यूक्लियॉन के कोणीय संवेग के कारण परिणामी कोणीय संवेग होता है, जिसे आमतौर पर निरूपित किया जाता है। I. यदि न्यूट्रॉन का कुल कोणीय संवेग है jn = ℓ + s और एक प्रोटॉन के लिए है jp = ℓ + s (जहाँ s प्रोटॉन और न्यूट्रॉन के लिए होता है 1/2 फिर से (नोट देखें), फिर 'परमाणु कोणीय गति क्वांटम संख्या' I द्वारा दिए गए हैं:
- I = |jn − jp|, |jn − jp| + 1, |jn − jp| + 2, ..., (jn + jp) − 2, (jn + jp) − 1, (jn + jp)
नोट: परमाणु (और परमाणु) राज्यों के कक्षीय कोणीय संवेग सभी ħ के पूर्णांक गुणक हैं जबकि न्यूट्रॉन और प्रोटॉन के आंतरिक कोणीय संवेग अर्ध-पूर्णांक गुणक हैं। यह तुरंत स्पष्ट होना चाहिए कि न्यूक्लियंस के आंतरिक स्पिन का संयोजन उनकी कक्षीय गति के साथ हमेशा कुल स्पिन के लिए आधा-पूर्णांक मान देगा, I, किसी भी सम-एक नाभिक के लिए किसी भी विषम-ए नाभिक और पूर्णांक मानों का।
संख्या के साथ समानता I का उपयोग परमाणु कोणीय गति वाले राज्यों को लेबल करने के लिए किया जाता है, हाइड्रोजन (H), कार्बन (C), और सोडियम (Na) के कुछ समस्थानिकों के उदाहरण हैं;[8]
1
1HI = (1/2)+ 9
6CI = (3/2)− 20
11NaI = 2+ 2
1HI = 1+ 10
6CI = 0+ 21
11NaI = (3/2)+ 3
1HI = (1/2)+ 11
6CI = (3/2)− 22
11NaI = 3+ 12
6CI = 0+ 23
11NaI = (3/2)+ 13
6CI = (1/2)− 24
11NaI = 4+ 14
6CI = 0+ 25
11NaI = (5/2)+ 15
6CI = (1/2)+ 26
11NaI = 3+
में असामान्य उतार-चढ़ाव का कारण I, केवल एक न्यूक्लियॉन के अंतर से भी, प्रोटॉन और न्यूट्रॉन की विषम और सम संख्या के कारण होते हैं - न्यूक्लियॉन के जोड़े में शून्य का कुल कोणीय संवेग होता है (बिल्कुल ऑर्बिटल्स में इलेक्ट्रॉनों की तरह), एक विषम या सम संख्या में अयुग्मित न्यूक्लियॉन छोड़ते हैं। . कार्बनिक रसायन में एनएमआर स्पेक्ट्रोस्कोपी के संचालन के लिए परमाणु स्पिन की संपत्ति एक महत्वपूर्ण कारक है,[7]और परमाणु चिकित्सा में एमआरआई,[8]बाहरी चुंबकीय क्षेत्र के साथ बातचीत करने वाले परमाणु चुंबकीय क्षण के कारण।
प्राथमिक कण
प्राथमिक कणों में कई क्वांटम संख्याएँ होती हैं जिन्हें आमतौर पर उनके लिए आंतरिक कहा जाता है। हालांकि, यह समझा जाना चाहिए कि प्राथमिक कण कण भौतिकी के मानक मॉडल की क्वांटम अवस्थाएँ हैं, और इसलिए इन कणों की क्वांटम संख्याएँ इस मॉडल के हैमिल्टनियन (क्वांटम यांत्रिकी) से वही संबंध रखती हैं जो बोह्र की क्वांटम संख्याएँ हैं। परमाणु अपने हैमिल्टनियन (क्वांटम यांत्रिकी) को करता है। दूसरे शब्दों में, प्रत्येक क्वांटम संख्या समस्या की समरूपता को दर्शाती है। अंतरिक्ष समय और विकट: आंतरिक समरूपता के बीच अंतर करने के लिए क्वांटम क्षेत्र सिद्धांत में यह अधिक उपयोगी है।
स्पेसटाइम समरूपता से संबंधित विशिष्ट क्वांटम संख्याएं स्पिन (भौतिकी) (घूर्णी समरूपता से संबंधित), समता (भौतिकी), सी-समता और टी समता (स्पेसटाइम के पॉइनकेयर समरूपता से संबंधित) हैं। विशिष्ट आंतरिक समरूपता लेप्टान संख्या और बेरिऑन संख्या या विद्युत आवेश हैं। (इस तरह की क्वांटम संख्याओं की पूरी सूची के लिए स्वाद (कण भौतिकी) पर लेख देखें।)
गुणक क्वांटम संख्या
अधिकांश संरक्षित क्वांटम संख्याएँ योगात्मक होती हैं, इसलिए एक प्राथमिक कण प्रतिक्रिया में, प्रतिक्रिया के पहले और बाद में क्वांटम संख्याओं का योग समान होना चाहिए। हालाँकि, कुछ, जिन्हें आमतौर पर समता (भौतिकी) कहा जाता है, गुणक होते हैं; यानी, उनका उत्पाद संरक्षित है। सभी गुणात्मक क्वांटम संख्याएँ एक समरूपता (जैसे समता) से संबंधित होती हैं जिसमें समरूपता परिवर्तन को दो बार लागू करना कुछ भी नहीं करने के बराबर होता है (इनवोल्यूशन (गणित))।
यह भी देखें
टिप्पणियाँ
संदर्भ
- ↑ Beiser, A. (1987). आधुनिक भौतिकी की अवधारणाएँ (4th ed.). McGraw-Hill (International). ISBN 0-07-100144-1.[page needed]
- ↑ Atkins, P. W. (1977). Molecular Quantum Mechanics Parts I and II: An Introduction to Quantum Chemistry. Vol. 1. Oxford University Press. ISBN 0-19-855129-0.[page needed]
- ↑ Eisberg & Resnick 1985.
- ↑ Peleg, Y.; Pnini, R.; Zaarur, E.; Hecht, E. (2010). क्वांटम यांत्रिकी. Schuam's Outlines (2nd ed.). McGraw Hill (USA). ISBN 978-0-07-162358-2.[page needed]
- ↑ Chemistry, Matter, and the Universe, R.E. Dickerson, I. Geis, W.A. Benjamin Inc. (USA), 1976, ISBN 0-19-855148-7
- ↑ Atkins, P. W. (1977). Molecular Quantum Mechanics Parts I and II: An Introduction to Quantum Chemistry. Vol. 1. Oxford University Press. ISBN 0-19-855129-0.[page needed]
- ↑ 7.0 7.1 Atkins, P. W. (1977). Molecular Quantum Mechanics Part III: An Introduction to Quantum Chemistry. Vol. 2. Oxford University Press.[ISBN missing][page needed]
- ↑ 8.0 8.1 Krane, K. S. (1988). परिचयात्मक परमाणु भौतिकी. John Wiley & Sons. ISBN 978-0-471-80553-3.[page needed]
अग्रिम पठन
- Dirac, Paul A. M. (1982). Principles of quantum mechanics. Oxford University Press. ISBN 0-19-852011-5.
- Griffiths, David J. (2004). Introduction to Quantum Mechanics (2nd ed.). Prentice Hall. ISBN 0-13-805326-X.
- Halzen, Francis & Martin, Alan D. (1984). QUARKS AND LEPTONS: An Introductory Course in Modern Particle Physics. John Wiley & Sons. ISBN 0-471-88741-2.
- Eisberg, Robert Martin; Resnick, Robert (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles (2nd ed.). John Wiley & Sons. ISBN 978-0-471-87373-0 – via Internet Archive.