ट्राइकैल्शियम फॉस्फेट: Difference between revisions
| Line 80: | Line 80: | ||
''कैल्शियम फॉस्फेट'' कई सामग्रियों को संदर्भित करता है जिसमें [[orthophosphate|ऑर्थोफोस्फेट्स]] ({{chem|PO|4|3−}}), [[मेटाफॉस्फेट]] या [[पाइरोफॉस्फेट]] के साथ कैल्शियम आयनों (Ca<sup>2+</sup>) से मिलकर कई सामग्रियों को संदर्भित करता है ({{chem|P|2|O|7|4−}}) और कभी-कभी ऑक्साइड और [[हीड्राकसीड]] आयन। विशेष रूप से, सामान्य खनिज [[एपेटाइट]] का सूत्र Ca होता है<sub>5</sub>(बाद<sub>4</sub>)<sub>3</sub>एक्स, जहां एक्स [[फ्लोराइड]], [[क्लोराइड]], हाइड्रोक्साइड, या मिश्रण है; यदि अतिरिक्त आयन मुख्य रूप से हाइड्रॉक्साइड है तो यह हाइड्रॉक्सीपैटाइट है। बाजार में उपलब्ध ट्राइकैल्शियम फॉस्फेट का अधिकांश भाग वास्तव में हाइड्रॉक्सीपैटाइट का चूर्ण होता है। | ''कैल्शियम फॉस्फेट'' कई सामग्रियों को संदर्भित करता है जिसमें [[orthophosphate|ऑर्थोफोस्फेट्स]] ({{chem|PO|4|3−}}), [[मेटाफॉस्फेट]] या [[पाइरोफॉस्फेट]] के साथ कैल्शियम आयनों (Ca<sup>2+</sup>) से मिलकर कई सामग्रियों को संदर्भित करता है ({{chem|P|2|O|7|4−}}) और कभी-कभी ऑक्साइड और [[हीड्राकसीड]] आयन। विशेष रूप से, सामान्य खनिज [[एपेटाइट]] का सूत्र Ca होता है<sub>5</sub>(बाद<sub>4</sub>)<sub>3</sub>एक्स, जहां एक्स [[फ्लोराइड]], [[क्लोराइड]], हाइड्रोक्साइड, या मिश्रण है; यदि अतिरिक्त आयन मुख्य रूप से हाइड्रॉक्साइड है तो यह हाइड्रॉक्सीपैटाइट है। बाजार में उपलब्ध ट्राइकैल्शियम फॉस्फेट का अधिकांश भाग वास्तव में हाइड्रॉक्सीपैटाइट का चूर्ण होता है। | ||
== | == निर्मिति करना == | ||
फॉस्फोरिक एसिड और | ट्राईकैल्शियम फॉस्फेट का व्यावसायिक रूप से हाइड्रॉक्सीपैटाइट को फॉस्फोरिक एसिड और आशमित चूना के साथ उपचार करके उत्पादित किया जाता है।<ref name=Ullmann/> | ||
इसे सीधे जलीय घोल से अवक्षेपित नहीं किया जा सकता है। आमतौर पर दोहरे अपघटन प्रतिक्रियाओं को नियोजित किया जाता है, जिसमें घुलनशील फॉस्फेट और कैल्शियम लवण शामिल होते हैं, उदा। (एनएच<sub>4</sub>)<sub>2</sub>एचपीओ<sub>4</sub> + सीए (नहीं)<sub>3</sub>)<sub>2</sub>.<ref name="Destainville">{{cite journal |title=एपेटिटिक ट्राईकैल्शियम फॉस्फेट का संश्लेषण, लक्षण वर्णन और तापीय व्यवहार|authors=Destainville, A., Champion, E., Bernache-Assollant, D., Laborde, E. |doi=10.1016/S0254-0584(02)00466-2 |date=2003 |volume=80 |issue=1 |pages=269–277 |journal=Materials Chemistry and Physics }}</ref> सावधानीपूर्वक नियंत्रित पीएच स्थितियों के तहत किया जाता है। अवक्षेप या तो अनाकार ट्राईकैल्शियम फॉस्फेट, एटीसीपी, या कैल्शियम की कमी वाले हाइड्रॉक्सीपैटाइट, सीडीएचए, सीए होगा<sub>9</sub>(एचपीओ<sub>4</sub>)(बाद<sub>4</sub>)<sub>5</sub>(ओएच), (नोट सीडीएचए को कभी-कभी एपेटिटिक कैल्शियम ट्राइफॉस्फेट कहा जाता है)।<ref name="Destainville" /><ref name="Bioactive">{{cite book |last1=Rey, C. |last2=Combes, C. |last3=Drouet, C.|last4=Grossin, D.|year= 2011 |chapter= 1.111 – Bioactive Ceramics: Physical Chemistry |editor1-last=Ducheyne |editor1-first=Paul |title=व्यापक बायोमटेरियल्स|volume=1 |publisher=Elsevier |publication-date=2011 |pages=187–281 |doi=10.1016/B978-0-08-055294-1.00178-1 |isbn=978-0-08-055294-1 }}</ref><ref name ="Dorozhkin2012">{{cite journal |title= अनाकार कैल्शियम (ऑर्थो) फॉस्फेट|authors= Dorozhkin, Sergey V. |doi=10.1016/j.actbio.2010.06.031 |pmid= 20609395 |date=December 2012|volume=6|issue=12|pages= 4457–4475 |journal=Acta Biomaterialia }}</ref> अवक्षेप को शांत करके क्रिस्टलीय ट्राइकैल्शियम फॉस्फेट प्राप्त किया जा सकता है। β-सीए<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub> आम तौर पर बनता है, α-Ca का उत्पादन करने के लिए उच्च तापमान की आवश्यकता होती है<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub>. | इसे सीधे जलीय घोल से अवक्षेपित नहीं किया जा सकता है। आमतौर पर दोहरे अपघटन प्रतिक्रियाओं को नियोजित किया जाता है, जिसमें घुलनशील फॉस्फेट और कैल्शियम लवण शामिल होते हैं, उदा। (एनएच<sub>4</sub>)<sub>2</sub>एचपीओ<sub>4</sub> + सीए (नहीं)<sub>3</sub>)<sub>2</sub>.<ref name="Destainville">{{cite journal |title=एपेटिटिक ट्राईकैल्शियम फॉस्फेट का संश्लेषण, लक्षण वर्णन और तापीय व्यवहार|authors=Destainville, A., Champion, E., Bernache-Assollant, D., Laborde, E. |doi=10.1016/S0254-0584(02)00466-2 |date=2003 |volume=80 |issue=1 |pages=269–277 |journal=Materials Chemistry and Physics }}</ref> सावधानीपूर्वक नियंत्रित पीएच स्थितियों के तहत किया जाता है। अवक्षेप या तो अनाकार ट्राईकैल्शियम फॉस्फेट, एटीसीपी, या कैल्शियम की कमी वाले हाइड्रॉक्सीपैटाइट, सीडीएचए, सीए होगा<sub>9</sub>(एचपीओ<sub>4</sub>)(बाद<sub>4</sub>)<sub>5</sub>(ओएच), (नोट सीडीएचए को कभी-कभी एपेटिटिक कैल्शियम ट्राइफॉस्फेट कहा जाता है)।<ref name="Destainville" /><ref name="Bioactive">{{cite book |last1=Rey, C. |last2=Combes, C. |last3=Drouet, C.|last4=Grossin, D.|year= 2011 |chapter= 1.111 – Bioactive Ceramics: Physical Chemistry |editor1-last=Ducheyne |editor1-first=Paul |title=व्यापक बायोमटेरियल्स|volume=1 |publisher=Elsevier |publication-date=2011 |pages=187–281 |doi=10.1016/B978-0-08-055294-1.00178-1 |isbn=978-0-08-055294-1 }}</ref><ref name ="Dorozhkin2012">{{cite journal |title= अनाकार कैल्शियम (ऑर्थो) फॉस्फेट|authors= Dorozhkin, Sergey V. |doi=10.1016/j.actbio.2010.06.031 |pmid= 20609395 |date=December 2012|volume=6|issue=12|pages= 4457–4475 |journal=Acta Biomaterialia }}</ref> अवक्षेप को शांत करके क्रिस्टलीय ट्राइकैल्शियम फॉस्फेट प्राप्त किया जा सकता है। β-सीए<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub> आम तौर पर बनता है, α-Ca का उत्पादन करने के लिए उच्च तापमान की आवश्यकता होती है<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub>. | ||
गीली प्रक्रिया का एक विकल्प कैल्शियम पाइरोफॉस्फेट और कैल्शियम कार्बोनेट के मिश्रण को गर्म करना है:<ref name="Bioactive"/>:काको<sub>3</sub> + पसंद है<sub>2</sub>P<sub>2</sub>O<sub>7</sub> → पसंद है<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub> + सीओ<sub>2</sub> | गीली प्रक्रिया का एक विकल्प कैल्शियम पाइरोफॉस्फेट और कैल्शियम कार्बोनेट के मिश्रण को गर्म करना है:<ref name="Bioactive"/>:काको<sub>3</sub> + पसंद है<sub>2</sub>P<sub>2</sub>O<sub>7</sub> → पसंद है<sub>3</sub>(बाद<sub>4</sub>)<sub>2</sub> + सीओ<sub>2</sub> | ||
== β-, α- और α'- Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> बहुरूपियों की संरचना == | |||
ट्राइकैल्शियम फॉस्फेट में तीन मान्यता प्राप्त बहुरूपताएं हैं, रॉमबोहेड्रल β रूप (ऊपर दिखाया गया है) और दो उच्च तापमान रूप, मोनोक्लिनिक α और हेक्सागोनल α′। β-ट्राईकैल्शियम फॉस्फेट का क्रिस्टलोग्राफिक घनत्व 3.066 ग्राम सेमी<sup>−3</sup> है, जबकि उच्च तापमान के रूप कम घने होते हैं, α-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.866 ग्राम सेमी<sup>−3</sup> और α'-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.702 ग्राम सेमी<sup>−3</sup> होता है। सभी रूपों में जटिल संरचनाएं होती हैं जिनमें ऑक्सीजन के माध्यम से कैल्शियम आयनों से जुड़े टेट्राहेड्रल फॉस्फेट केंद्र होते हैं।<ref>{{cite journal|title=Crystal structure analysis of β-tricalcium phosphate Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> by neutron powder diffraction|author1=Yashima, M.|author2=Sakai, A.|author3=Kamiyama, T.|author4=Hoshikawa, A.|journal=RNAl of Solid State Chemistry|year=2003|volume=175|issue=2|pages=272–277|doi=10.1016/S0022-4596(03)00279-2|bibcode=2003JSSCh.175..272Y}}</ref> उच्च तापमान रूपों में से प्रत्येक में दो प्रकार के स्तंभ होते हैं, एक में केवल कैल्शियम आयन होते हैं और दूसरे में कैल्शियम और फॉस्फेट दोनों होते हैं।<ref name="Carrodeguas2011">{{cite journal |title=α-Tricalcium phosphate: Synthesis, properties and biomedical applications |author1=Carrodeguas, R.G. |author2=De Aza, S. |doi=10.1016/j.actbio.2011.06.019 |pmid=21712105 |volume=7 |issue=10 |year=2011 |pages=3536–3546 |journal=Acta Biomaterialia }}</ref> | |||
बीटा और अल्फा फॉर्म के बीच रासायनिक और जैविक गुणों में अंतर हैं, α फॉर्म अधिक घुलनशील और बायोडिग्रेडेबल है। दोनों रूप व्यावसायिक रूप से उपलब्ध हैं और चिकित्सा और दंत चिकित्सा अनुप्रयोगों में उपयोग किए जाने वाले योगों में सम्मलित होते हैं।<ref name="Carrodeguas2011" /> | |||
बीटा और अल्फा फॉर्म के बीच रासायनिक और जैविक गुणों में अंतर हैं, α फॉर्म अधिक घुलनशील और बायोडिग्रेडेबल है। दोनों रूप व्यावसायिक रूप से उपलब्ध हैं और चिकित्सा और दंत चिकित्सा अनुप्रयोगों में उपयोग किए जाने वाले योगों में | |||
== घटना == | == घटना == | ||
[[कैल्शियम फॉस्फेट]] हड्डी के मुख्य दहन उत्पादों में से एक है ([[हड्डी की राख|अस्थि भस्म]] देखें)। कैल्शियम फॉस्फेट भी सामान्यतः खनिज चट्टान जैसे [[अकार्बनिक]] स्रोतों से प्राप्त होता है।<ref>Yacoubou, Jeanne, MS. [http://www.vrg.org/ingredients/index.php Vegetarian Journal's Guide To Food Ingredients] "Guide to Food Ingredients". The Vegetarian Resource Group, n.d. Web. 14 Sept. 2012.</ref> ट्रिकैल्शियम फॉस्फेट स्वाभाविक रूप से कई रूपों में होता है, जिनमें निम्न सम्मलित हैं: | [[कैल्शियम फॉस्फेट]] हड्डी के मुख्य दहन उत्पादों में से एक है ([[हड्डी की राख|अस्थि भस्म]] देखें)। कैल्शियम फॉस्फेट भी सामान्यतः खनिज चट्टान जैसे [[अकार्बनिक]] स्रोतों से प्राप्त होता है।<ref>Yacoubou, Jeanne, MS. [http://www.vrg.org/ingredients/index.php Vegetarian Journal's Guide To Food Ingredients] "Guide to Food Ingredients". The Vegetarian Resource Group, n.d. Web. 14 Sept. 2012.</ref> ट्रिकैल्शियम फॉस्फेट स्वाभाविक रूप से कई रूपों में होता है, जिनमें निम्न सम्मलित हैं: | ||
* [[मोरक्को]], [[इजराइल]], फिलीपींस, [[मिस्र]] और [[कोला प्रायद्वीप]] ([[रूस]]) में चट्टान के रूप में और कुछ अन्य देशों में कम मात्रा में उपलब्ध होते है। प्राकृतिक रूप पूरी तरह से शुद्ध नहीं होते है, और रेत और चूने जैसे कुछ अन्य घटक होते हैं जो संरचना को बदल सकते हैं। अधिकांश कैल्शियम फॉस्फेट चट्टानों में P<sub>2</sub>O<sub>5</sub> की मात्रा वजन के हिसाब से 30% से 40% P<sub>2</sub>O<sub>5</sub> होती है। | * [[मोरक्को]], [[इजराइल]], फिलीपींस, [[मिस्र]] और [[कोला प्रायद्वीप]] ([[रूस]]) में चट्टान के रूप में और कुछ अन्य देशों में कम मात्रा में उपलब्ध होते है। प्राकृतिक रूप पूरी तरह से शुद्ध नहीं होते है, और रेत और चूने जैसे कुछ अन्य घटक होते हैं जो संरचना को बदल सकते हैं। अधिकांश कैल्शियम फॉस्फेट चट्टानों में P<sub>2</sub>O<sub>5</sub> की मात्रा वजन के हिसाब से 30% से 40% P<sub>2</sub>O<sub>5</sub> होती है। | ||
* कशेरुकी जंतुओं के कंकालों और दांतों में | * कशेरुकी जंतुओं के कंकालों और दांतों में | ||
* | *गाय के दूध में। | ||
== बाइफैसिक ट्राइकैल्शियम फॉस्फेट, बीसीपी == | == बाइफैसिक ट्राइकैल्शियम फॉस्फेट, बीसीपी == | ||
बाइफैसिक ट्राईकैल्शियम फॉस्फेट, बीसीपी, को मूल रूप से ट्राइकैल्शियम फॉस्फेट के रूप में रिपोर्ट किया गया था, किन्तु एक्स-रे विवर्तन तकनीकों ने दिखाया कि सामग्री दो चरणों, हाइड्रॉक्सीपैटाइट (HA)) और β-ट्राइकल कैल्शियम फॉस्फेट का एक अंतरंग मिश्रण होती है ।<ref name="Bioceramicschap17">{{cite book |last1=Daculsi|first1=G.|last2= Legeros|first2=R. |year=2008 |chapter=17 – Tricalcium phosphate/hydroxyapatite biphasic ceramics |editor1-last=Kokubo |editor1-first= Tadashi |title=बायोसेरामिक्स और उनके नैदानिक अनुप्रयोग|publisher=Woodhead Publishing |pages=395–423 |doi=10.1533/9781845694227.2.395 |isbn=978-1-84569-204-9 }}</ref> यह एक चीनी मिट्टी होती है।<ref name="Salinas2013">{{Cite journal |last1= Salinas|first1= Antonio J.|last2=Vallet-Regi|first2=Maria|year=2013 |title=Bioactive ceramics: from bone grafts to tissue engineering |journal= RSC Advances |volume=3 |issue=28 |pages=11116–11131 |doi=10.1039/C3RA00166K |bibcode= 2013RSCAd...311116S}}</ref> | बाइफैसिक ट्राईकैल्शियम फॉस्फेट, बीसीपी, को मूल रूप से ट्राइकैल्शियम फॉस्फेट के रूप में रिपोर्ट किया गया था, किन्तु एक्स-रे विवर्तन तकनीकों ने दिखाया कि सामग्री दो चरणों, हाइड्रॉक्सीपैटाइट (HA)) और β-ट्राइकल कैल्शियम फॉस्फेट का एक अंतरंग मिश्रण होती है ।<ref name="Bioceramicschap17">{{cite book |last1=Daculsi|first1=G.|last2= Legeros|first2=R. |year=2008 |chapter=17 – Tricalcium phosphate/hydroxyapatite biphasic ceramics |editor1-last=Kokubo |editor1-first= Tadashi |title=बायोसेरामिक्स और उनके नैदानिक अनुप्रयोग|publisher=Woodhead Publishing |pages=395–423 |doi=10.1533/9781845694227.2.395 |isbn=978-1-84569-204-9 }}</ref> यह एक चीनी मिट्टी होती है।<ref name="Salinas2013">{{Cite journal |last1= Salinas|first1= Antonio J.|last2=Vallet-Regi|first2=Maria|year=2013 |title=Bioactive ceramics: from bone grafts to tissue engineering |journal= RSC Advances |volume=3 |issue=28 |pages=11116–11131 |doi=10.1039/C3RA00166K |bibcode= 2013RSCAd...311116S}}</ref> निर्मिति करने कैल्शियम की कमी वाले एपेटाइट्स <ref name="Bioactive" /> के अपरिवर्तनीय अपघटन के कारण सिंटरिंग सम्मलित होते है, जिसे वैकल्पिक रूप से अरससमीकरणमितीय एपेटाइट्स या मूल कैल्शियम फॉस्फेट कहा जाता है,<ref name="Elliot">{{cite book |last1=Elliott|first1=J.C. |year= 1994 |chapter=3 – Hydroxyapatite and Nonstoichiometric Apatites|title=अकार्बनिक रसायन विज्ञान में अध्ययन|volume=18 |publisher=Elsevier |pages=111–189 |doi=10.1016/B978-0-444-81582-8.50008-0 |isbn=9780444815828 }}</ref> एक उदाहरण है:<ref name="ValletRegi2011">{{cite journal |title= कैल्शियम की कमी वाले एपेटाइट का संश्लेषण और लक्षण वर्णन|authors=Vallet-Regí, M.;Rodríguez-Lorenzo, L.M. |doi=10.1016/S0167-2738(97)00213-0 |date=November 1997 |volume=101–103, Part 2 |pages=1279–1285 |journal=Solid State Ionics }}</ref> | ||
:Ca<sub>10−''δ''</sub>(PO<sub>4</sub>)<sub>6−''δ''</sub>(HPO<sub>4</sub>)<sub>''δ''</sub>(OH)<sub>2−''δ''</sub> → (1−''δ'') Ca<sub>10</sub>(PO<sub>4</sub>)<sub>6</sub>(OH)<sub>2</sub> + 3''δ'' Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> | :Ca<sub>10−''δ''</sub>(PO<sub>4</sub>)<sub>6−''δ''</sub>(HPO<sub>4</sub>)<sub>''δ''</sub>(OH)<sub>2−''δ''</sub> → (1−''δ'') Ca<sub>10</sub>(PO<sub>4</sub>)<sub>6</sub>(OH)<sub>2</sub> + 3''δ'' Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub> | ||
β-TCP में अशुद्धियाँ हो सकती हैं, उदाहरण के लिए कैल्शियम पाइरोफॉस्फेट, CaP<sub>2</sub>O<sub>7</sub> और एपेटाइट। β-TCP बायोरेसोरेबल होता है। BCP के बायोडिग्रेडेशन में HA-क्रिस्टल के उन्मूलन के बाद β-TCP चरण का तेजी से विघटन सम्मलित हुए है। β-टीसीपी शारीरिक | β-TCP में अशुद्धियाँ हो सकती हैं, उदाहरण के लिए कैल्शियम पाइरोफॉस्फेट, CaP<sub>2</sub>O<sub>7</sub> और एपेटाइट। β-TCP बायोरेसोरेबल होता है। BCP के बायोडिग्रेडेशन में HA-क्रिस्टल के उन्मूलन के बाद β-TCP चरण का तेजी से विघटन सम्मलित हुए है। β-टीसीपी शारीरिक pH स्तर पर शरीर के तरल पदार्थों में घुलता नहीं है, विघटन के लिए अम्लीय pH उत्पन्न करने वाली कोशिका सक्रियता, की आवश्यकता होती है। <ref name="Bioactive" /> | ||
== उपयोग करता है == | == उपयोग करता है == | ||
Revision as of 15:53, 28 May 2023
| |
| |
| Names | |
|---|---|
| IUPAC name
Calcium phosphate
| |
| Other names
Tribasic calcium phosphate, tricalcium bis(phosphate)
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| Ca3(PO4)2 | |
| Molar mass | 310.18 |
| Appearance | White amorphous powder |
| Density | 3.14 g/cm3[1] |
| Melting point | 1,670 °C (3,040 °F; 1,940 K)[1] |
| 1.2 mg/kg[1] | |
Solubility product (Ksp)
|
2.07×10−33[2] |
| Thermochemistry | |
Std enthalpy of
formation (ΔfH⦵298) |
−4126 kJ/mol (α-form)[3] |
| Pharmacology | |
| A12AA01 (WHO) | |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Flash point | Non-flammable |
| Related compounds | |
Other anions
|
Calcium pyrophosphate |
Other cations
|
Trimagnesium phosphate Trisodium phosphate Tripotassium phosphate |
Related compounds
|
Monocalcium phosphate Dicalcium phosphate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
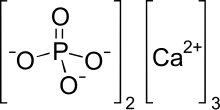
ट्राइकैल्शियम फॉस्फेट (कभी-कभी संक्षिप्त शीर्षक टीसीपी), जिसे समान्यतः कैल्शियम फॉस्फेट के रूप में जाना जाता है, रासायनिक सूत्र Ca3(PO4)2 के साथ फॉस्फोरिक एसिड का कैल्शियम साल्ट (रसायन विज्ञान) होता है। इसे ट्राइबेसिक कैल्शियम फॉस्फेट और बोन फॉस्फेट ऑफ लाइम (बीपीएल) के रूप में भी जाना जाता है। यह कम घुलनशीलता का एक सफेद ठोस पदार्थ होता है। ट्राईकैल्शियम फॉस्फेट के अधिकांश व्यावसायिक नमूने वास्तव में हाइड्रॉक्सियापटाइट हैं।[4]
यह तीन क्रिस्टलीय बहुरूपों α, α', और β के रूप में सम्मलित होता है। α और α' की स्थिति उच्च तापमान पर स्थिर होते हैं।
नामकरण
कैल्शियम फॉस्फेट कई सामग्रियों को संदर्भित करता है जिसमें ऑर्थोफोस्फेट्स (PO3−
4), मेटाफॉस्फेट या पाइरोफॉस्फेट के साथ कैल्शियम आयनों (Ca2+) से मिलकर कई सामग्रियों को संदर्भित करता है (P
2O4−
7) और कभी-कभी ऑक्साइड और हीड्राकसीड आयन। विशेष रूप से, सामान्य खनिज एपेटाइट का सूत्र Ca होता है5(बाद4)3एक्स, जहां एक्स फ्लोराइड, क्लोराइड, हाइड्रोक्साइड, या मिश्रण है; यदि अतिरिक्त आयन मुख्य रूप से हाइड्रॉक्साइड है तो यह हाइड्रॉक्सीपैटाइट है। बाजार में उपलब्ध ट्राइकैल्शियम फॉस्फेट का अधिकांश भाग वास्तव में हाइड्रॉक्सीपैटाइट का चूर्ण होता है।
निर्मिति करना
ट्राईकैल्शियम फॉस्फेट का व्यावसायिक रूप से हाइड्रॉक्सीपैटाइट को फॉस्फोरिक एसिड और आशमित चूना के साथ उपचार करके उत्पादित किया जाता है।[4]
इसे सीधे जलीय घोल से अवक्षेपित नहीं किया जा सकता है। आमतौर पर दोहरे अपघटन प्रतिक्रियाओं को नियोजित किया जाता है, जिसमें घुलनशील फॉस्फेट और कैल्शियम लवण शामिल होते हैं, उदा। (एनएच4)2एचपीओ4 + सीए (नहीं)3)2.[5] सावधानीपूर्वक नियंत्रित पीएच स्थितियों के तहत किया जाता है। अवक्षेप या तो अनाकार ट्राईकैल्शियम फॉस्फेट, एटीसीपी, या कैल्शियम की कमी वाले हाइड्रॉक्सीपैटाइट, सीडीएचए, सीए होगा9(एचपीओ4)(बाद4)5(ओएच), (नोट सीडीएचए को कभी-कभी एपेटिटिक कैल्शियम ट्राइफॉस्फेट कहा जाता है)।[5][6][7] अवक्षेप को शांत करके क्रिस्टलीय ट्राइकैल्शियम फॉस्फेट प्राप्त किया जा सकता है। β-सीए3(बाद4)2 आम तौर पर बनता है, α-Ca का उत्पादन करने के लिए उच्च तापमान की आवश्यकता होती है3(बाद4)2.
गीली प्रक्रिया का एक विकल्प कैल्शियम पाइरोफॉस्फेट और कैल्शियम कार्बोनेट के मिश्रण को गर्म करना है:[6]:काको3 + पसंद है2P2O7 → पसंद है3(बाद4)2 + सीओ2
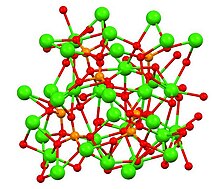
β-, α- और α'- Ca3(PO4)2 बहुरूपियों की संरचना
ट्राइकैल्शियम फॉस्फेट में तीन मान्यता प्राप्त बहुरूपताएं हैं, रॉमबोहेड्रल β रूप (ऊपर दिखाया गया है) और दो उच्च तापमान रूप, मोनोक्लिनिक α और हेक्सागोनल α′। β-ट्राईकैल्शियम फॉस्फेट का क्रिस्टलोग्राफिक घनत्व 3.066 ग्राम सेमी−3 है, जबकि उच्च तापमान के रूप कम घने होते हैं, α-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.866 ग्राम सेमी−3 और α'-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.702 ग्राम सेमी−3 होता है। सभी रूपों में जटिल संरचनाएं होती हैं जिनमें ऑक्सीजन के माध्यम से कैल्शियम आयनों से जुड़े टेट्राहेड्रल फॉस्फेट केंद्र होते हैं।[8] उच्च तापमान रूपों में से प्रत्येक में दो प्रकार के स्तंभ होते हैं, एक में केवल कैल्शियम आयन होते हैं और दूसरे में कैल्शियम और फॉस्फेट दोनों होते हैं।[9]
बीटा और अल्फा फॉर्म के बीच रासायनिक और जैविक गुणों में अंतर हैं, α फॉर्म अधिक घुलनशील और बायोडिग्रेडेबल है। दोनों रूप व्यावसायिक रूप से उपलब्ध हैं और चिकित्सा और दंत चिकित्सा अनुप्रयोगों में उपयोग किए जाने वाले योगों में सम्मलित होते हैं।[9]
घटना
कैल्शियम फॉस्फेट हड्डी के मुख्य दहन उत्पादों में से एक है (अस्थि भस्म देखें)। कैल्शियम फॉस्फेट भी सामान्यतः खनिज चट्टान जैसे अकार्बनिक स्रोतों से प्राप्त होता है।[10] ट्रिकैल्शियम फॉस्फेट स्वाभाविक रूप से कई रूपों में होता है, जिनमें निम्न सम्मलित हैं:
- मोरक्को, इजराइल, फिलीपींस, मिस्र और कोला प्रायद्वीप (रूस) में चट्टान के रूप में और कुछ अन्य देशों में कम मात्रा में उपलब्ध होते है। प्राकृतिक रूप पूरी तरह से शुद्ध नहीं होते है, और रेत और चूने जैसे कुछ अन्य घटक होते हैं जो संरचना को बदल सकते हैं। अधिकांश कैल्शियम फॉस्फेट चट्टानों में P2O5 की मात्रा वजन के हिसाब से 30% से 40% P2O5 होती है।
- कशेरुकी जंतुओं के कंकालों और दांतों में
- गाय के दूध में।
बाइफैसिक ट्राइकैल्शियम फॉस्फेट, बीसीपी
बाइफैसिक ट्राईकैल्शियम फॉस्फेट, बीसीपी, को मूल रूप से ट्राइकैल्शियम फॉस्फेट के रूप में रिपोर्ट किया गया था, किन्तु एक्स-रे विवर्तन तकनीकों ने दिखाया कि सामग्री दो चरणों, हाइड्रॉक्सीपैटाइट (HA)) और β-ट्राइकल कैल्शियम फॉस्फेट का एक अंतरंग मिश्रण होती है ।[11] यह एक चीनी मिट्टी होती है।[12] निर्मिति करने कैल्शियम की कमी वाले एपेटाइट्स [6] के अपरिवर्तनीय अपघटन के कारण सिंटरिंग सम्मलित होते है, जिसे वैकल्पिक रूप से अरससमीकरणमितीय एपेटाइट्स या मूल कैल्शियम फॉस्फेट कहा जाता है,[13] एक उदाहरण है:[14]
- Ca10−δ(PO4)6−δ(HPO4)δ(OH)2−δ → (1−δ) Ca10(PO4)6(OH)2 + 3δ Ca3(PO4)2
β-TCP में अशुद्धियाँ हो सकती हैं, उदाहरण के लिए कैल्शियम पाइरोफॉस्फेट, CaP2O7 और एपेटाइट। β-TCP बायोरेसोरेबल होता है। BCP के बायोडिग्रेडेशन में HA-क्रिस्टल के उन्मूलन के बाद β-TCP चरण का तेजी से विघटन सम्मलित हुए है। β-टीसीपी शारीरिक pH स्तर पर शरीर के तरल पदार्थों में घुलता नहीं है, विघटन के लिए अम्लीय pH उत्पन्न करने वाली कोशिका सक्रियता, की आवश्यकता होती है। [6]
उपयोग करता है
खाद्य योज्य
ट्राइकैल्शियम फॉस्फेट पाउडर मसालों में एक पिण्डन निरोधक कारक के रूप में प्रयोग किया जाता है, उदा। टेबल साल्ट को जमने से रोकने के लिए कैल्शियम फॉस्फेट को यूरोपीय खाद्य योज्य संख्या E341 सौंपी गई है।
स्वास्थ्य और सौंदर्य उत्पाद
यह शिशु पाउडर, एंटासिड और टूथपेस्ट में भी पाया जाता है।[4]
बायोमेडिकल
इसका उपयोग पोषण पूरक के रूप में भी किया जाता है[15] और गाय के दूध में स्वाभाविक रूप से होता है,[citation needed] चूँकि पूरक के लिए सबसे आम और किफायती रूप हैं कैल्शियम कार्बोनेट (जिसे भोजन के साथ लिया जाना चाहिए) और कैल्शियम साइट्रेट (जिसे भोजन के बिना लिया जा सकता है)।[16] विभिन्न कैल्शियम लवणों की विभिन्न जैवउपलब्धता के बारे में कुछ तर्क वितर्क होता रहा है।
जब स्वप्रतिरोपण अस्थि निरोपण व्यवहार्य या संभव नहीं होता है तो इसका उपयोग हड्डी के दोषों की मरम्मत के लिए ऊतक प्रतिस्थापन के रूप में किया जा सकता है।[17][18][19] इसे अकेले या जैवनिम्नीकरणीय, पुनः अवशोषित करने योग्य बहुलक जैसे पॉलीग्लाइकोलिक एसिड के संयोजन में उपयोग किया जा सकता है।[20] इसे अस्थि निरोपण के लिए ऑटोलॉगस सामग्री के साथ भी जोड़ा जा सकता है।[21][22]
हड्डी में स्थानीय औषधि वितरण के लिए छिद्रित बीटा-ट्राईकैल्शियम फॉस्फेट स्कैफोल्ड को औषधि वाहक तंत्र के रूप में नियोजित किया जाता है।[23]
प्राकृतिक घटना
ट्यूइट (खनिज), ट्राइकैल्शियम ऑर्थोफोस्फेट (V) का एक प्राकृतिक रेखीय , कुछ उल्कापिंडों का एक दुर्लभ घटक होते है। इसका गठन आघात कायांतरण से संबंधित होता है।[24]
संदर्भ
- ↑ 1.0 1.1 1.2 Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). Boca Raton, FL: CRC Press. p. 4.54. ISBN 9781498754293.
- ↑ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (in English) (99 ed.). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ↑ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ↑ 4.0 4.1 4.2 Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2012). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ↑ 5.0 5.1 Destainville, A., Champion, E., Bernache-Assollant, D., Laborde, E. (2003). "एपेटिटिक ट्राईकैल्शियम फॉस्फेट का संश्लेषण, लक्षण वर्णन और तापीय व्यवहार". Materials Chemistry and Physics. 80 (1): 269–277. doi:10.1016/S0254-0584(02)00466-2.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ 6.0 6.1 6.2 6.3 Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (2011). "1.111 – Bioactive Ceramics: Physical Chemistry". In Ducheyne, Paul (ed.). व्यापक बायोमटेरियल्स. Vol. 1. Elsevier. pp. 187–281. doi:10.1016/B978-0-08-055294-1.00178-1. ISBN 978-0-08-055294-1.
- ↑ Dorozhkin, Sergey V. (December 2012). "अनाकार कैल्शियम (ऑर्थो) फॉस्फेट". Acta Biomaterialia. 6 (12): 4457–4475. doi:10.1016/j.actbio.2010.06.031. PMID 20609395.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Yashima, M.; Sakai, A.; Kamiyama, T.; Hoshikawa, A. (2003). "Crystal structure analysis of β-tricalcium phosphate Ca3(PO4)2 by neutron powder diffraction". RNAl of Solid State Chemistry. 175 (2): 272–277. Bibcode:2003JSSCh.175..272Y. doi:10.1016/S0022-4596(03)00279-2.
- ↑ 9.0 9.1 Carrodeguas, R.G.; De Aza, S. (2011). "α-Tricalcium phosphate: Synthesis, properties and biomedical applications". Acta Biomaterialia. 7 (10): 3536–3546. doi:10.1016/j.actbio.2011.06.019. PMID 21712105.
- ↑ Yacoubou, Jeanne, MS. Vegetarian Journal's Guide To Food Ingredients "Guide to Food Ingredients". The Vegetarian Resource Group, n.d. Web. 14 Sept. 2012.
- ↑ Daculsi, G.; Legeros, R. (2008). "17 – Tricalcium phosphate/hydroxyapatite biphasic ceramics". In Kokubo, Tadashi (ed.). बायोसेरामिक्स और उनके नैदानिक अनुप्रयोग. Woodhead Publishing. pp. 395–423. doi:10.1533/9781845694227.2.395. ISBN 978-1-84569-204-9.
{{cite book}}: zero width space character in|title=at position 31 (help) - ↑ Salinas, Antonio J.; Vallet-Regi, Maria (2013). "Bioactive ceramics: from bone grafts to tissue engineering". RSC Advances. 3 (28): 11116–11131. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ↑ Elliott, J.C. (1994). "3 – Hydroxyapatite and Nonstoichiometric Apatites". अकार्बनिक रसायन विज्ञान में अध्ययन. Vol. 18. Elsevier. pp. 111–189. doi:10.1016/B978-0-444-81582-8.50008-0. ISBN 9780444815828.
- ↑ Vallet-Regí, M.;Rodríguez-Lorenzo, L.M. (November 1997). "कैल्शियम की कमी वाले एपेटाइट का संश्लेषण और लक्षण वर्णन". Solid State Ionics. 101–103, Part 2: 1279–1285. doi:10.1016/S0167-2738(97)00213-0.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Bonjour JP, Carrie AL, Ferrari S, Clavien H, Slosman D, Theintz G, Rizzoli R (March 1997). "Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial". J. Clin. Invest. 99 (6): 1287–1294. doi:10.1172/JCI119287. PMC 507944. PMID 9077538.
- ↑ Straub DA (June 2007). "Calcium supplementation in clinical practice: a review of forms, doses, and indications". Nutr Clin Pract. 22 (3): 286–296. doi:10.1177/0115426507022003286. PMID 17507729.
- ↑ Paderni S, Terzi S, Amendola L (September 2009). "ऑस्टियोकंडक्टिव बोन सब्स्टीट्यूट के साथ प्रमुख अस्थि दोष उपचार". Musculoskelet Surg. 93 (2): 89–96. doi:10.1007/s12306-009-0028-0. PMID 19711008. S2CID 33413039.
- ↑ Moore DC, Chapman MW, Manske D (1987). "लंबी हड्डी के डायफिसियल दोषों को ग्राफ्ट करने में उपयोग के लिए एक द्विध्रुवीय कैल्शियम फॉस्फेट सिरेमिक का मूल्यांकन". Journal of Orthopaedic Research. 5 (3): 356–365. doi:10.1002/jor.1100050307. PMID 3040949. S2CID 41579389.
- ↑ Lange TA, Zerwekh JE, Peek RD, Mooney V, Harrison BH (1986). "बड़े रद्दी दोषों में दानेदार ट्राईकैल्शियम फॉस्फेट". Annals of Clinical and Laboratory Science. 16 (6): 467–472. PMID 3541772.
- ↑ Cao H, Kuboyama N (September 2009). "A biodegradable porous composite scaffold of PGA/β-TCP for bone tissue engineering". Bone. 46 (2): 386–395. doi:10.1016/j.bone.2009.09.031. PMID 19800045.
- ↑ Erbe EM, Marx JG, Clineff TD, Bellincampi LD (October 2001). "Potential of an ultraporous β-tricalcium phosphate synthetic cancellous bone void filler and bone marrow aspirate composite graft". European Spine Journal. 10 Suppl. 2 (Suppl 2): S141–S146. doi:10.1007/s005860100287. PMC 3611552. PMID 11716011.
- ↑ Bansal S, Chauhan V, Sharma S, Maheshwari R, Juyal A, Raghuvanshi S (July 2009). "हाइड्रॉक्सीपैटाइट और बीटा-ट्राइकल कैल्शियम फॉस्फेट का मूल्यांकन अस्थि मज्जा एस्पिरेट के साथ मिश्रित पोस्टेरोलेंटल स्पाइनल फ्यूजन के लिए एक हड्डी ग्राफ्ट विकल्प के रूप में". Indian Journal of Orthopaedics. 43 (3): 234–239. doi:10.4103/0019-5413.49387. PMC 2762171. PMID 19838344.
- ↑ Kundu, B; Lemos A; Soundrapandian C; Sen PS; Datta S; Ferreira JMF; Basu D (2010). "Development of porous HAp and β-TCP scaffolds by starch consolidation with foaming method and drug-chitosan bilayered scaffold based drug delivery system". J. Mater. Sci. Mater. Med. 21 (11): 2955–2969. doi:10.1007/s10856-010-4127-0. PMID 20644982. S2CID 6483779.
- ↑ Tuite. Mindat.org
