रासायनिक सूत्र
| एल्युमिनियम सल्फेट का रासायनिक सूत्र। एल्युमिनियम सल्फेट हेक्साडेकाहाइड्रेट का सूत्र है Al2(SO4)3 · 16H2O. |
| Structural formula for butane. Examples of other chemical formulae for butane are the empirical formula C2H5, the molecular formula C4H10 and the condensed (or semi-structural) formula CH3CH2CH2CH3. |
रसायन विज्ञान में, रासायनिक सूत्र परमाणुओं के रासायनिक अनुपात के बारे में जानकारी प्रस्तुत करने का एक तरीका है जो रासायनिक तत्व प्रतीकों, संख्याओं, और कभी -कभी अन्य प्रतीकों, जैसे कि कोष्ठक, डैश, कोष्ठक, अल्पविराम, प्लस (+) और माइनस (-) संकेतों का उपयोग करके एक विशेष रासायनिक यौगिक या अणु का गठन करते हैं। ये प्रतीकों की एकल टाइपोग्राफिक लाइन तक सीमित हैं, जिसमें सब्सक्रिप्ट और सुपरस्क्रिप्ट शामिल हो सकते हैं। रासायनिक सूत्र एक रासायनिक नामकरण नहीं है, और इसमें कोई शब्द नहीं है। यद्यपि रासायनिक सूत्र कुछ सरल रासायनिक संरचनाओं को लागू कर सकता है, यह एक पूर्ण रासायनिक संरचनात्मक सूत्र के समान नहीं है। रासायनिक सूत्र पूरी तरह से अणुओं और रासायनिक पदार्थों में से केवल सबसे सरल की संरचना को निर्दिष्ट कर सकते हैं, और आमतौर पर रासायनिक नामों और संरचनात्मक सूत्रों की तुलना में सीमित होते हैं।
रासायनिक सूत्रों के सबसे सरल प्रकारों को अनुभवजन्य सूत्र कहा जाता है, जो प्रत्येक प्रकार के परमाणुओं के संख्यात्मक अनुपात को इंगित करने वाले अक्षरों और संख्याओं का उपयोग करते हैं। आणविक सूत्र अणु में प्रत्येक प्रकार के परमाणु की संख्या मात्र को इंगित करते हैं, संरचना के बारे में कोई जानकारी नहीं देते हैं। उदाहरण के लिए, शर्करा के लिए अनुभवजन्य सूत्र CH2O (कार्बन और ऑक्सीजन तुलना में दो गुने हाइड्रोजन परमाणु) है, जबकि इसका आणविक सूत्र C6H12O6 (12 हाइड्रोजन परमाणु, 6 कार्बन और ऑक्सीजन परमाणु) है।
कभी-कभी रासायनिक सूत्र संघनित सूत्र (या संघनित आणविक सूत्र, कभी-कभी एक अर्ध-संरचनात्मक सूत्र कहा जाता है) के रूप में लिखे जाने से जटिल होता है, जो उन विशेष तरीकों के बारे में अतिरिक्त जानकारी देता है जिनमें परमाणु या तो सहसंयोजक, आयनिक, या इन प्रकारों के विभिन्न संयोजन रासायनिक बंधनों से बंधे होते हैं। यह संभव है यदि प्रासंगिक बंधन एक आयाम में दिखाना आसान है। उदाहरण के लिए इथेनॉल का संघनित आणविक/रासायनिक सूत्र, CH3−CH2−OH या CH3CH2OH है। हालांकि, यहां तक कि एक संघनित रासायनिक सूत्र आवश्यक रूप से परमाणुओं के बीच जटिल संबंध संबंधों को दिखाने की क्षमता में सीमित है, विशेष रूप से जब परमाणु, चार या अधिक अलग-अलग प्रतिस्थापन से बंधे होते हैं।
चूंकि रासायनिक सूत्र को रासायनिक तत्व प्रतीक ों की एकल पंक्ति के रूप में व्यक्त किया जाना चाहिए, यह अक्सर सही संरचनात्मक सूत्र के रूप में जानकारीपूर्ण नहीं दे सकता है, जो रासायनिक यौगिकों में परमाणुओं के बीच स्थानिक संबंध का एक चित्रमय वर्णन है (उदाहरण के लिए दाईं ओर चित्र देखें , ब्यूटेन के लिए संरचनात्मक और रासायनिक सूत्र)। संरचनात्मक जटिलता के कारणों के लिए, एकल संघनित रासायनिक सूत्र (या अर्ध-संरचनात्मक सूत्र) विभिन्न अणुओं के अनुरूप हो सकता है, जिसे समावयव के रूप में जाना जाता है। उदाहरण के लिए, ग्लूकोज अपने आणविक सूत्र C6H12O6 को फ्रुक्टोज, गैलेक्टोज और मैननोज सहित कई अन्य शर्करा के साथ साझा करता है। रैखिक समतुल्य रासायनिक नाम मौजूद हैं जो विशिष्ट रूप से किसी भी जटिल संरचनात्मक सूत्र (रासायनिक नामकरण देखें) को निर्दिष्ट कर सकते हैं, लेकिन ऐसे नामों को कई शब्दों (शब्दों) का उपयोग करना चाहिए, बजाय सरल तत्व प्रतीकों, संख्याओं और सरल टाइपोग्राफिक प्रतीकों के लिए जो एक रासायनिक सूत्र को परिभाषित करते हैं।
रासायनिक प्रतिक्रियाओं और अन्य रासायनिक परिवर्तनों का वर्णन करने के लिए रासायनिक समीकरण ों में रासायनिक सूत्रों का उपयोग किया जा सकता है, जैसे कि आयनिक यौगिकों का विलयन बनाना। हालांकि, जैसा कि उल्लेख किया गया है, रासायनिक सूत्रों में परमाणुओं के बीच रासायनिक संबंधों को दिखाने के लिए संरचनात्मक सूत्रों की पूरी शक्ति नहीं है, वे रासायनिक प्रतिक्रियाओं में परमाणुओं की संख्या और विद्युत आवेशों की संख्या पर नज़र रखने के लिए पर्याप्त हैं, इस प्रकार रासायनिक समीकरणों को संतुलित करना ताकि इन समीकरणों का उपयोग परमाणुओं के संरक्षण, और विद्युत आवेश के संरक्षण से जुड़े रासायनिक समस्याओं में किया जा सके।
संक्षिप्त विवरण
रासायनिक सूत्र अपने रासायनिक प्रतीक द्वारा प्रत्येक घटक रासायनिक तत्व की पहचान करता है और प्रत्येक तत्व के परमाणुओं की आनुपातिक संख्या को इंगित करता है। अनुभवजन्य सूत्रों में, ये अनुपात प्रमुख तत्व के साथ शुरू होते हैं और फिर यौगिक में अन्य तत्वों के परमाणुओं की संख्या, अनुपात द्वारा प्रमुख तत्व को निर्धारित करते हैं। आणविक यौगिकों के लिए, इन अनुपात संख्याओं को पूरे संख्या के रूप में व्यक्त किया जा सकता है। उदाहरण के लिए, इथेनॉल का अनुभवजन्य सूत्र C2H6O लिखा जा सकता है क्योंकि इथेनॉल के अणुओं में दो कार्बन परमाणु, छह हाइड्रोजन परमाणु और एक ऑक्सीजन परमाणु होते हैं। हालांकि, कुछ प्रकार के आयनिक यौगिकों को पूरी तरह से संपूर्ण संख्या अनुभवजन्य सूत्रों के साथ नहीं लिखा जा सकता है। एक उदाहरण बोरॉन कार्बाइड है, जिसका सूत्र CBn एक चर अपूर्ण संख्या अनुपात है जहाँ n, 4 के ऊपर 6.5 से अधिक हो सकता है।
जब सूत्र के रासायनिक यौगिक में सरल अणु होते हैं, तो रासायनिक सूत्र अक्सर अणु की संरचना का सुझाव देने के तरीके नियोजित करते हैं। इस प्रकार के सूत्रों को विभिन्न रूप से आणविक सूत्र और संघनित सूत्र के रूप में जाना जाता है। आणविक सूत्र अणु में परमाणुओं की संख्या को दर्शाता है, जैसा कि ग्लूकोज के लिए आणविक सूत्र C6H12O6 है, बजाय कि ग्लूकोज के अनुभवजन्य सूत्र CH2O। हालांकि, बहुत सरल पदार्थों को छोड़कर आणविक रासायनिक सूत्र में संरचनात्मक जानकारी की कमी होती है, और वे अस्पष्ट होते हैं।
सरल अणुओं के लिए, संघनित (या अर्ध-संरचनात्मक) सूत्र एक प्रकार का रासायनिक सूत्र है जो पूरी तरह से सही संरचनात्मक सूत्र हो सकता है। उदाहरण के लिए, इथेनॉल को संघनित रासायनिक सूत्र CH3CH2OH द्वारा दर्शाया जा सकता है, और डाइमिथाइल ईथर को संघनित सूत्र CH3OCH3 द्वारा। इन दो अणुओं का अनुभवजन्य और आणविक सूत्र (C2H6O) है, लेकिन दिखाए गए संघनित सूत्रों द्वारा विभेदित किया जा सकता है, जो इन सरल कार्बनिक यौगिकों की पूर्ण संरचना का प्रतिनिधित्व करने के लिए पर्याप्त हैं।
संघनित रासायनिक सूत्रों का उपयोग आयनिक यौगिक ों का प्रतिनिधित्व करने के लिए भी किया जा सकता है जो असतत अणुओं के रूप में मौजूद नहीं हैं, लेकिन फिर भी उनके भीतर सहसंयोजक बाध्य समूह होते हैं। ये बहुपरमाणुक आयन परमाणुओं के समूह हैं जो सहसंयोजक रूप से एक साथ बंधे होते हैं और जिनपर समग्र आयनिक चार्ज होता है, जैसे कि सल्फेट [SO4]2- आयन। यौगिक में प्रत्येक बहुपरमाणुक आयन को अलग-अलग समूहों को चित्रित करने के लिए व्यक्तिगत रूप से लिखा जाता है। उदाहरण के लिए, यौगिक डाइक्लोरिन हेक्सॉक्साइड का अनुभवजन्य सूत्र ClO3 है, और आणविक सूत्र Cl2O6, लेकिन तरल या ठोस रूपों में, यह यौगिक अधिक सही ढंग से एक आयनिक संघनित सूत्र [ClO2]+[ClO4]− द्वारा दिखाया गया है जो दिखाता है कि इस यौगिक में [ClO2]+ और [ClO4]− आयन शामिल हैं। ऐसे मामलों में, संघनित सूत्र को केवल प्रत्येक आयनिक प्रजातियों में से कम से कम एक दिखाने के लिए पर्याप्त जटिल होना चाहिए।
यहां वर्णित रासायनिक सूत्र कहीं अधिक जटिल रासायनिक व्यवस्थित नामों से अलग हैं जो रासायनिक नामकरण के विभिन्न प्रणालियों में उपयोग किए जाते हैं।उदाहरण के लिए, ग्लूकोज के लिए एक व्यवस्थित नाम (2R, 3S, 4R, 5R) -2,3,4,5,6-पेंटाहाइड्रोक्सीहेक्सनल है। इस नाम की व्याख्या, इसके पीछे के नियमों द्वारा की गई, पूरी तरह से ग्लूकोज के संरचनात्मक सूत्र को निर्दिष्ट करता है, लेकिन नाम एक रासायनिक सूत्र नहीं है जैसा कि आमतौर पर समझा जाता है, और ऐसे पद और शब्दों का उपयोग करता है जो रासायनिक सूत्रों में उपयोग नहीं किए गए। इस तरह के नाम, बुनियादी सूत्रों के विपरीत, रेखांकन के बिना पूर्ण संरचनात्मक सूत्रों का प्रतिनिधित्व करने में सक्षम हो सकते हैं।
प्रकार
अनुभवजन्य सूत्र
रसायन विज्ञान में, किसी रसायन का अनुभवजन्य सूत्र यौगिक में तत्वों के प्रत्येक प्रकार के परमाणु या अनुपात के सापेक्ष संख्या की एक सरल अभिव्यक्ति है।अनुभवजन्य सूत्र आयनिक यौगिकों के लिए मानक हैं, जैसे CaCl2, और बृहदणु के लिए, जैसे SiO2। अनुभवजन्य सूत्र आइसोमेरिज्म, संरचना या परमाणुओं की पूर्ण संख्या का कोई संदर्भ नहीं देता है। अनुभवजन्य शब्द तत्व विश्लेषण की प्रक्रिया को संदर्भित करता है, तत्व द्वारा शुद्ध रासायनिक पदार्थ के सापेक्ष प्रतिशत संरचना को निर्धारित करने के लिए उपयोग की जाने वाली विश्लेषणात्मक रसायन विज्ञान की एक तकनीक।
उदाहरण के लिए, हेक्सेन का आणविक सूत्र C6H14 है, और (इसके आइसोमर्स में से एक के लिए, n-हेक्सेन) संरचनात्मक सूत्र CH3CH2CH2CH2CH2CH3, इसका मतलब यह है कि इसमें 6 कार्बन परमाणुओं और 14 हाइड्रोजन परमाणुओं की श्रृंखला संरचना है। हालांकि, हेक्सेन के लिए अनुभवजन्य सूत्र C3H7 है। इसी तरह हाइड्रोजन पेरोक्साइड के लिए अनुभवजन्य सूत्र H2O2, जो सामान्य रूप से HO है, और घटक तत्वों के 1: 1 अनुपात को व्यक्त करता है। फॉर्मलाडिहाइड और सिरका अम्ल का एक ही अनुभवजन्य सूत्र CH2O होता है। यह फॉर्मलाडेहाइड के लिए वास्तविक रासायनिक सूत्र है, लेकिन सिरका अम्ल में परमाणुओं की संख्या दोगुनी होती है।
आणविक सूत्र
आणविक सूत्र एक आणविक पदार्थ के अणु में प्रत्येक प्रकार के परमाणु की सरल संख्या को इंगित करते हैं। वे अणुओं के लिए अनुभवजन्य सूत्र के समान हैं जिनमें केवल एक विशेष प्रकार का एक परमाणु होता है, लेकिन अन्यथा बड़ी संख्या हो सकती है।अंतर का एक उदाहरण ग्लूकोज के लिए अनुभवजन्य सूत्र CH2O (अनुपात 1: 2: 1) है, जबकि इसका आणविक सूत्र C6H12O6 (परमाणुओं की संख्या 6: 12: 6) है। पानी के लिए, दोनों सूत्र H2O हैं। आणविक सूत्र अपने अनुभवजन्य सूत्र की तुलना में अणु के बारे में अधिक जानकारी प्रदान करता है, लेकिन स्थापित करना अधिक कठिन है।
आणविक सूत्र, अणु में तत्वों की संख्या को दर्शाता है, और यह निर्धारित करता है कि यह एक द्विआधारी यौगिक, टर्नरी यौगिक, चतुर्धातुक यौगिक है, या इससे भी अधिक तत्व हैं।
संरचनात्मक सूत्र
अणु के मात्रात्मक विवरण के अलावा, संरचनात्मक सूत्र[lower-alpha 1] यह भी अंकित करता है कि परमाणुओं को कैसे व्यवस्थित किया जाता है, और परमाणुओं के बीच रासायनिक बंधनों को दिखाता है। आणविक संरचना के विभिन्न पहलुओं पर केंद्रित कई प्रकार के संरचनात्मक सूत्र हैं।
दो आरेख, दो अणु दिखाते हैं जो एक दूसरे के संरचनात्मक आइसोमर ्स हैं, क्योंकि वे दोनों के एक ही आणविक सूत्र C4H10 हैं, लेकिन उनके पास अलग -अलग संरचनात्मक सूत्र हैं जैसा कि दिखाया गया है।
संघनित सूत्र
अणु की कनेक्टिविटी अक्सर इसके भौतिक और रासायनिक गुणों और व्यवहार पर एक मजबूत प्रभाव डालती है। एक ही प्रकार के परमाणुओं (यानी आइसोमर्स की एक जोड़ी) के समान संख्या से बने दो अणु के रासायनिक और/या भौतिक गुण पूरी तरह से अलग हो सकते हैं यदि परमाणु अलग-अलग या विभिन्न पदों में जुड़े होते हैं। ऐसे मामलों में, संरचनात्मक सूत्र उपयोगी है, क्योंकि यह दिखाता है कि कौन से परमाणु दूसरों से से बंधे हैं। कनेक्टिविटी से, अनुमानित आणविक ज्यामिति को समझाना अक्सर संभव होता है।
एक संघनित (या अर्ध-संरचनात्मक) सूत्र एक साधारण रासायनिक पदार्थ में रासायनिक बंधन के प्रकार और स्थानिक व्यवस्था का प्रतिनिधित्व कर सकता है, हालांकि यह जरूरी नहीं कि आइसोमर्स या जटिल संरचनाओं को निर्दिष्ट करता है।उदाहरण के लिए, एटैन में दो कार्बन परमाणु होते हैं, जो एक-दूसरे के लिए एकल-बंधु होते हैं, प्रत्येक कार्बन परमाणु में तीन हाइड्रोजन परमाणु होते हैं।इसके रासायनिक सूत्र को प्रस्तुत किया जा सकता है CH3CH3।ईथीलीन में कार्बन परमाणुओं के बीच एक दोहरा बंधन होता है (और इस प्रकार प्रत्येक कार्बन में केवल दो हाइड्रोजेन होते हैं), इसलिए रासायनिक सूत्र लिखा जा सकता है: CH2CH2, और तथ्य यह है कि कार्बन के बीच एक दोहरा बंधन है निहित है क्योंकि कार्बन में चार की वैधता है।हालांकि, एक अधिक स्पष्ट तरीका लिखना है H2C=CH2 या आमतौर पर कम H2C::CH2।दो पंक्तियों (या दो जोड़े डॉट्स) से संकेत मिलता है कि एक डबल बॉन्ड परमाणुओं को उनके दोनों ओर जोड़ता है।
एक ट्रिपल बॉन्ड को तीन लाइनों के साथ व्यक्त किया जा सकता है (HC≡CH) या तीन जोड़े डॉट्स (HC:::CH), और यदि अस्पष्टता हो सकती है, तो एक एकल बॉन्ड को इंगित करने के लिए एक एकल लाइन या डॉट्स का उपयोग किया जा सकता है।
कई कार्यात्मक समूह ों वाले अणु जो समान हैं, उन्हें कोष्ठक में दोहराए गए समूह को संलग्न करके व्यक्त किया जा सकता है। उदाहरण के लिए, आइसोब्यूटेन (CH3)3CH लिखा जा सकता है। यह संघनित संरचनात्मक सूत्र अन्य अणुओं से एक अलग कनेक्टिविटी बताता है जो एक ही अनुपात (आइसोमर्स) में एक जैसे परमाणुओं का उपयोग करके बनाया जा सकता है। सूत्र (CH3)3CH तात्पर्य, एक हाइड्रोजन परमाणु और तीन मिथाइल समूह ों (CH3) से जुड़ा एक केंद्रीय कार्बन परमाणु है। प्रत्येक तत्व के परमाणुओं की समान संख्या (10 हाइड्रोजेन और 4 कार्बन, या C4H10) का उपयोग एक सीधी श्रृंखला अणु बनाने के लिए किया जा सकता है, n-ब्यूटेन: CH3CH2CH2CH3।
संयोजन के नियम
किसी भी रासायनिक यौगिक में, तत्व हमेशा एक दूसरे के साथ एक ही अनुपात में संयोजित होते हैं। यह निरंतर रचना का नियम है।
निरंतर रचना का नियम कहता है कि, किसी विशेष रासायनिक यौगिक में, उस यौगिक के सभी नमूने समान अनुपात या अनुपात में समान तत्वों से बने होंगे।उदाहरण के लिए, किसी भी पानी का अणु हमेशा दो हाइड्रोजन परमाणुओं और एक ऑक्सीजन परमाणु से 2: 1 अनुपात में बना होता है। यदि हम पानी के अणु में ऑक्सीजन और हाइड्रोजन के सापेक्ष द्रव्यमान को देखते हैं, तो हम पाते हैं कि पानी के अणु के द्रव्यमान का 94% ऑक्सीजन जिम्मेदार है और शेष 6% हाइड्रोजन। यह द्रव्यमान अनुपात किसी भी पानी के अणु के लिए समान होगा।[2]
रासायनिक सूत्रों की सीमाओं के जवाब में रासायनिक नाम
एल्केन, जिसे ब्यूट-2-इन कहते हैं, के दो आइसोमर्स हैं, जिसका रासायनिक सूत्र CH3CH=CHCH3 पहचान नहीं करता है। दो मिथाइल समूहों की सापेक्ष स्थिति को अतिरिक्त संकेतन द्वारा इंगित किया जाना चाहिए कि क्या मिथाइल समूह डबल बॉन्ड (cis या Z) के एक ही तरफ या एक दूसरे से विपरीत पक्षों पर हैं (ट्रांस या E)।[3]
जैसा कि ऊपर उल्लेख किया गया है, कई जटिल कार्बनिक और अकार्बनिक यौगिकों के पूर्ण संरचनात्मक सूत्रों का प्रतिनिधित्व करने के लिए, रासायनिक नामकरण की आवश्यकता हो सकती है जो सरल संघनित सूत्रों में ऊपर उपयोग किए गए उपलब्ध संसाधनों से परे अच्छी तरह से चला जाता है। उदाहरणों के लिए कार्बनिक रसायन विज्ञान का IUPAC नामकरण और अकार्बनिक रसायन विज्ञान के IUPAC नामकरण देखें। इसके अलावा, अंतर्राष्ट्रीय रासायनिक पहचानकर्ता (InChl) जैसे रैखिक नामकरण प्रणाली कंप्यूटर को एक संरचनात्मक सूत्र का निर्माण करने की अनुमति देती है, और सरलीकृत आणविक-इनपुट लाइन-एंट्री सिस्टम (SMILES) अधिक मानव-पठनीय ASCII इनपुट की अनुमति देता है। हालांकि, ये सभी नामकरण प्रणाली रासायनिक सूत्रों के मानकों से परे हैं, और तकनीकी रूप से रासायनिक नामकरण प्रणाली हैं, न कि सूत्र प्रणाली।[citation needed]
संघनित सूत्रों में बहुलक
संघनित रासायनिक सूत्रों में बहुलक के लिए, कोष्ठक को दोहराने वाली इकाई के चारों ओर रखा जाता है। उदाहरण के लिए, हाइड्रोकार्बन अणु जिसे CH3(CH2)50CH3 द्वारा वर्णित किया गया है, पचास दोहराए जाने वाली इकाइयों के साथ एक अणु है। यदि दोहराए जाने वाली इकाइयों की संख्या अज्ञात या परिवर्तनशील है, तो अक्षर n का उपयोग इस सूत्र को इंगित करने के लिए किया जा सकता है: CH3(CH2)nCH3।
संघनित सूत्रों में आयन
आयनों के लिए, विशेष परमाणु पर चार्ज को दाहिने हाथ के सुपरस्क्रिप्ट के साथ निरूपित किया जा सकता है। उदाहरण के लिए, Na+, या Cu2+। आवेशित अणु या परमाणुक आयनों पर कुल चार्ज भी इस तरह से दिखाया जा सकता है, जैसे कि हाइड्रोनियम के लिए, H3O+, या सल्फेट, SO2−4। ध्यान दें कि + और - क्रमशः +1 और -1 के स्थान पर उपयोग किए जाते हैं।
अधिक जटिल आयनों के लिए, कोष्ठक [ ] का उपयोग अक्सर आयनिक सूत्र को संलग्न करने के लिए किया जाता है, जैसा कि [B12H12]2−, जो कि [[सीज़ियम डोडेकाबोरेट |सीज़ियम डोडेकाबोरेट, Cs2[B12H12]]] जैसे यौगिकों में पाया जाता है। कोष्ठक ( ) को एक दोहराव इकाई को इंगित करने के लिए कोष्ठक के अंदर नेस्टेड किया जा सकता है, जैसा कि हेक्सममिनकोबाल्ट(iii)क्लोराइड, [Co(NH3)6]3+Cl−3 में है। यहां (NH3)6 इंगित करता है कि आयन में कोबाल्ट के लिए बंधुआ, छह अमीन समूह (NH3) हैं, और कोष्ठक [ ] आयन के पूरे सूत्र को चार्ज +3 के साथ संलग्न करता है।[further explanation needed]
यह कड़ाई से वैकल्पिक है; रासायनिक सूत्र आयनीकरण की जानकारी के साथ या उसके बिना मान्य है, और हेक्सामिनकोबाल्ट(III)क्लोराइड, [Co(NH3)6]3+Cl−3 या [Co(NH3)6]Cl3 के रूप में लिखा जा सकता है। पैरेंथेसेस की तरह कोष्ठक, रसायन विज्ञान में वैसा ही व्यवहार करते हैं जैसा कि वे गणित में करते हैं, एक साथ समूहन करना – वे विशेष रूप से केवल आयनीकरण परिस्तिथि के लिए नियोजित नहीं हैं। बाद के मामले में, कोष्ठक 6 समूहों को एक ही आकार के सभी आकार को इंगित करते हैं, जो आकार 1 (कोबाल्ट परमाणु) के दूसरे समूह से बंधे होते हैं, और फिर एक समूह के रूप में पूरे बंडल को 3 क्लोरीन परमाणुओं से बंधा होता है। पूर्व मामले में, यह स्पष्ट है कि क्लोरीन को जोड़ने वाला बॉन्ड सहसंयोजक बंधन के बजाय आयनिक बंध है।
समस्थानिक
यद्यपि समस्थानिक पारंपरिक रसायन विज्ञान की तुलना में परमाणु रसायन विज्ञान या स्थिर समस्थानिक रसायन विज्ञान के लिए अधिक प्रासंगिक हैं, विभिन्न समस्थानिक को रासायनिक सूत्र में एक उपसर्ग ऊपर की ओर लिखा हुआ ,के साथ इंगित किया जा सकता है। उदाहरण के लिए, रेडियोधर्मी फॉस्फोरस -32, [32PO4]3- युक्त फॉस्फेट आयन है। साथ ही स्थिर समस्थानिक अनुपात से जुड़े एक अध्ययन में अणु, 18O16O शामिल हो सकता है।
परमाणु संख्या को इंगित करने के लिए बाएं हाथ की सदस्यता को कभी-कभी अनावश्यक रूप से उपयोग किया जाता है। उदाहरण के लिए, 8O2 डाइऑक्सिजन के लिए, और 16
8O
2 डाइऑक्सिजन की सबसे प्रचुर मात्रा में समस्थानिक प्रजातियों के लिए। परमाणु प्रतिक्रियाओं के लिए समीकरण लिखते समय यह सुविधाजनक है, ताकि चार्ज के संतुलन को अधिक स्पष्ट रूप से दिखाया जा सके।
फंसे हुए परमाणु
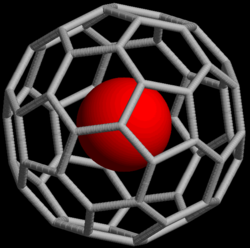
@ प्रतीक (संकेत पर ) एक परमाणु या अणु को इंगित करता है जो एक पिंजरे के अंदर फंस गया है, लेकिन रासायनिक रूप से इसके लिए बाध्य नहीं है। उदाहरण के लिए, एक परमाणु (एम) के साथ बाकमिंस्टरफुलरीन (C60) बस MC60 के रूप में प्रतिनिधित्व किया जाएगा, भले ही एम रासायनिक संबंध के बिना या बाहर फुलरीन के अंदर हो, कार्बन परमाणुओं में से बंधा हो। @ प्रतीक का उपयोग करते हुए, इसे M@C60 निरूपित किया जाएगा यदि एम कार्बन नेटवर्क के अंदर था। एक गैर-फुलरीन उदाहरण [As@Ni12As20]3− है, एक आयन जिसमें एक आर्सेनिक (As) परमाणु अन्य 32 परमाणुओं द्वारा गठित पिंजरे में फंस जाता है।
फुलरीन पिंजरों ( एंडोहेड्रल फुलरीन ) की खोज के साथ, यह संकेतन 1991 में प्रस्तावित किया गया था[4] जो उदाहरण के लिए La (लेण्टेनियुम) जैसे परमाणुओं को[[लेण्टेनियुम | La@C60 या La@C82]] बनाने के लिए फंसा सकता है। प्रतीक की पसंद को लेखकों द्वारा संक्षिप्त, आसानी से मुद्रित और इलेक्ट्रॉनिक रूप से प्रेषित होने के रूप में समझाया गया (एटी साइन एएससीआईआई में शामिल है, जो कि अधिकांश आधुनिक करैक्टर एन्कोडिंग स्कीम्स पर आधारित हैं), और दृश्य पहलू एक एंडोहेड्रल फुलरीन की संरचना का सुझाव देते हैं।
गैर-स्टोइकोमेट्रिक रासायनिक सूत्र
रासायनिक सूत्र अक्सर प्रत्येक तत्व के लिए पूर्णांक का उपयोग करते हैं। हालांकि, यौगिकों का एक वर्ग है, जिसे गैर-स्टोइकोमेट्रिक यौगिक कहा जाता है, जिसका प्रतिनिधित्व छोटे पूर्णांक द्वारा नहीं किया जा सकता है। इस तरह के सूत्र को दशमलव अंश ों का उपयोग करके लिखा जा सकता है, जैसे Fe0.95O, या इसमें एक पत्र द्वारा दर्शाया गया एक चर भाग शामिल हो सकता है, जैसा कि Fe1-xO, जहां x आम तौर पर 1 से बहुत कम है।
कार्बनिक यौगिकों के लिए सामान्य रूप
यौगिकों की एक श्रृंखला के लिए उपयोग किया जाने वाला एक रासायनिक सूत्र जो एक निरंतर इकाई द्वारा एक दूसरे से भिन्न होता है, उसे एक सामान्य सूत्र कहा जाता है। यह रासायनिक सूत्रों की एक समरूप श्रृंखला उत्पन्न करता है। उदाहरण के लिए, एल्कोहल को सूत्र CnH2n + 1OH द्वारा दर्शाया जा सकता है। 1 ≤ n ≤ 3 के लिए होमोलॉग मेथनॉल, इथेनॉल, प्रोपेनोल दे रहा है।
हिल प्रणाली
हिल प्रणाली (या हिल अंकन) अनुभवजन्य रासायनिक सूत्र, आणविक रासायनिक सूत्र और संघनित सूत्र के घटकों को लिखने की एक प्रणाली है जैसे कि एक अणु में कार्बन परमाणुओं की संख्या पहले इंगित की जाती है, उसके बाद हाइड्रोजन परमाणुओं की संख्या, और उसके बाद अन्य सभी रासायनिक तत्वों की संख्या, रासायनिक प्रतीकों के वर्णानुक्रम में।। जब सूत्र में कोई कार्बन नहीं होता है, तो हाइड्रोजन सहित सभी तत्व वर्णानुक्रम में सूचीबद्ध होते हैं।
इन नियमों के अनुसार सूत्र में मौजूद प्रत्येक तत्व के परमाणुओं की संख्या के अनुसार सूत्रों को छांटकर, पहले के तत्वों या संख्याओं में अंतर के साथ किसी भी बाद के तत्व या संख्या & mdash में अंतर से अधिक महत्वपूर्ण माना जा रहा है; जैसे कि लेक्सिकोग्राफिकल ऑर्डर में पाठ के तार को छांटना; हिल सिस्टम ऑर्डर के रूप में जाना जाने वाला रासायनिक सूत्रों को टकराना संभव है।
हिल सिस्टम को पहली बार 1900 में संयुक्त राज्य अमेरिका के पेटेंट और ट्रेडमार्क कार्यालय के एडविन ए हिल द्वारा प्रकाशित किया गया था।[5] यह यौगिकों की सूचियों को सॉर्ट करने के लिए रासायनिक डेटाबेस और प्रिंटेड इंडेक्स में सबसे अधिक इस्तेमाल की जाने वाली प्रणाली है।[6]
हिल सिस्टम ऑर्डर में सूत्रों की एक सूची को वर्णानुक्रम में व्यवस्थित किया जाता है, जैसा कि ऊपर, एकल-पत्र तत्वों के साथ दो-अक्षर के प्रतीकों से पहले आते हैं जब प्रतीक एक ही अक्षर के साथ शुरू होते हैं (इसलिए B, Be से पहले आता है, जो Br से पहले आता है)।[6]
निम्नलिखित उदाहरण सूत्र हिल सिस्टम का उपयोग करके लिखे गए हैं, और हिल ऑर्डर में सूचीबद्ध हैं:
- Brl
- BrClH2Si
- CCl4
- CH3I
- C2H5Br
- H2O4S
यह भी देखें
- रासायनिक सूत्रों का शब्दकोश
- सूत्र इकाई
- परमाणु संकेतन
- आवर्त सारणी
- कंकाल सूत्र
- सरलीकृत आणविक-इनपुट लाइन-प्रवेश प्रणाली
टिप्पणियाँ
संदर्भ
- ↑ Denise DeCooman (2022-04-08). "What are Chemical Formulas and How are They Used?". Study.com. sec. Chemical Formula Examples. Archived from the original on 2022-06-23.
- ↑ "निरंतर रचना नियम". Everything Math and Science. SIYAVULA. Retrieved 31 March 2016.
 This material is available under a Creative Commons Attribution-Share Alike 3.0 license.
This material is available under a Creative Commons Attribution-Share Alike 3.0 license.
- ↑ Burrows, Andrew. (2013-03-21). रसायन विज्ञान: अकार्बनिक, कार्बनिक और भौतिक रसायन विज्ञान का परिचय (Second ed.). Oxford. ISBN 978-0-19-969185-2. OCLC 818450212.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Chai, Yan; Guo, Ting; Jin, Changming; Haufler, Robert E.; Chibante, L. P. Felipe; Fure, Jan; Wang, Lihong; Alford, J. Michael; Smalley, Richard E. (1991). "फुलरीनस wlth धातुओं के अंदर". Journal of Physical Chemistry. 95 (20): 7564–7568. doi:10.1021/j100173a002.
- ↑ Edwin A. Hill (1900). "रासायनिक साहित्य को अनुक्रमित करने की एक प्रणाली पर;अमेरिकी पेटेंट कार्यालय के वर्गीकरण प्रभाग द्वारा अपनाया गया". J. Am. Chem. Soc. 22 (8): 478–494. doi:10.1021/ja02046a005. hdl:2027/uiug.30112063986233.
- ↑ 6.0 6.1 Wiggins, Gary. (1991). Chemical Information Sources. New York: McGraw Hill. p. 120.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). "3". General chemistry: principles and modern applications (8th ed.). Upper Saddle River, N.J: Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
बाहरी संबंध
 Media related to रासायनिक सूत्र at Wikimedia Commons
Media related to रासायनिक सूत्र at Wikimedia Commons- Hill notation example, from the University of Massachusetts Lowell libraries, including how to sort into Hill system order
- Molecular formula calculation applying Hill notation. The library calculating Hill notation is available on npm.