ट्राइकैल्शियम फॉस्फेट: Difference between revisions
m (added Category:Vigyan Ready using HotCat) |
|||
| Line 129: | Line 129: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 18/05/2023]] | [[Category:Created On 18/05/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 10:59, 2 June 2023
| |
| |
| Names | |
|---|---|
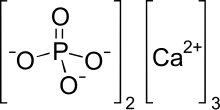
| IUPAC name
Calcium phosphate
| |
| Other names
Tribasic calcium phosphate, tricalcium bis(phosphate)
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| Ca3(PO4)2 | |
| Molar mass | 310.18 |
| Appearance | White amorphous powder |
| Density | 3.14 g/cm3[1] |
| Melting point | 1,670 °C (3,040 °F; 1,940 K)[1] |
| 1.2 mg/kg[1] | |
Solubility product (Ksp)
|
2.07×10−33[2] |
| Thermochemistry | |
Std enthalpy of
formation (ΔfH⦵298) |
−4126 kJ/mol (α-form)[3] |
| Pharmacology | |
| A12AA01 (WHO) | |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Flash point | Non-flammable |
| Related compounds | |
Other anions
|
Calcium pyrophosphate |
Other cations
|
Trimagnesium phosphate Trisodium phosphate Tripotassium phosphate |
Related compounds
|
Monocalcium phosphate Dicalcium phosphate |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
ट्राइकैल्शियम फॉस्फेट (कभी-कभी संक्षिप्त टीसीपी), जिसे समान्यतः कैल्शियम फॉस्फेट के रूप में जाना जाता है, रासायनिक सूत्र Ca3(PO4)2 के साथ फास्फोरिक अम्ल का कैल्शियम साल्ट होता है। इसे ट्राइबेसिक कैल्शियम फॉस्फेट और चूने का अस्थिफॉस्फेट (बीपीएल) के रूप में भी जाना जाता है। यह कम घुलनशीलता का सफेद ठोस पदार्थ होता है। "ट्राईकैल्शियम फॉस्फेट" के अधिकांश व्यावसायिक नमूने वास्तव में हाइड्रॉक्सियापटाइट होते हैं।[4]
यह तीन क्रिस्टलीय बहुरूपों α, α', और β के रूप में सम्मलित होते है। α और α' की स्थिति उच्च तापमान पर स्थिर होते हैं।
पारिभाषिक शब्दावली
कैल्शियम फॉस्फेट ऑर्थोफोस्फेट्स (PO3−
4), के साथ कैल्शियम आयनों (Ca2+) से मिलकर कई सामग्रियों को संदर्भित करता है मेटाफॉस्फेट या पाइरोफॉस्फेट (P
2O4−
7) और कभी-कभी ऑक्साइड और हीड्राकसीड आयन कों विशेष रूप से, सामान्य खनिज एपेटाइट का सूत्र Ca5(PO4)3X, होता है, जहां X F, Cl, OH या एक मिश्रण होता है; यदि अतिरिक्त आयन मुख्य रूप से हाइड्रॉक्साइड है तो यह हाइड्रॉक्सीपैटाइट होता है। बाजार में उपलब्ध अधिकांश "ट्राईकैल्शियम फॉस्फेट" वास्तव में पाउडर हाइड्रॉक्सीपैटाइट होते है।
निर्मिति करना
ट्राईकैल्शियम फॉस्फेट का व्यावसायिक रूप से हाइड्रॉक्सीपैटाइट को फॉस्फोरिक अम्ल और आशमित चूना के साथ उपचारण करके उत्पादित किया जाता है।[4]
इसे सीधे जलीय घोल से अवक्षेपित नहीं किया जा सकता है। सामान्यतः दोहरे अपघटन प्रतिक्रियाओं को नियोजित किया जाता है, जिसमें घुलनशील फॉस्फेट और कैल्शियम लवण सम्मलित होते है, उदा। (NH4)2HPO4 + Ca(NO3)2[5] सावधानीपूर्वक नियंत्रित pH स्थितियों के तहत किया जाता है। अवक्षेप या तो "अक्रिस्टलीय ट्राइकैल्शियम फॉस्फेट", एटीसीपी, या कैल्शियम की कमी वाले हाइड्रॉक्सीपैटाइट, सीडीएचए, Ca9(HPO4)(PO4)5(OH), होगे (नोट सीडीएचए को कभी-कभी एपेटिटिक कैल्शियम ट्राइफॉस्फेट कहा जाता है)।[5][6][7] अनपेक्षित को निस्तापन करके क्रिस्टलीय ट्राइकैल्शियम फॉस्फेट प्राप्त किया जा सकता है। β-Ca3(PO4)2 सामान्यतः बनता है, α-Ca3(PO4)2 के उत्पादन के लिए उच्च तापमान की आवश्यकता होती है।
आर्द्र प्रक्रिया का एक विकल्प कैल्शियम पाइरोफॉस्फेट और कैल्शियम कार्बोनेट के मिश्रण को गर्म करता है:[6]:
CaCO3 + Ca2P2O7 → Ca3(PO4)2 + CO2
β-, α- और α'- Ca3(PO4)2 बहुरूपियों की संरचना
ट्राइकैल्शियम फॉस्फेट में तीन मान्यता प्राप्त बहुरूपताएं होती हैं, रॉमबोहेड्रल β रूप (ऊपर दिखाया गया है) और दो उच्च तापमान रूप, मोनोक्लिनिक α और हेक्सागोनल α′। β-ट्राईकैल्शियम फॉस्फेट का क्रिस्टलोग्राफिक घनत्व 3.066 ग्राम सेमी−3 है, जबकि उच्च तापमान के रूप कम घने होते हैं, α-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.866 ग्राम सेमी−3 और α'-ट्राईकैल्शियम फॉस्फेट का घनत्व 2.702 ग्राम सेमी−3 होता है। सभी रूपों में जटिल संरचनाएं होती हैं जिनमें ऑक्सीजन के माध्यम से कैल्शियम आयनों से जुड़े टेट्राहेड्रल फॉस्फेट केन्द्र बिन्दु होते हैं।[8] उच्च तापमान रूपों में प्रत्येक में दो प्रकार के खण्ड होते हैं, एक में केवल कैल्शियम आयन होते हैं और दूसरे में कैल्शियम और फॉस्फेट दोनों होते हैं।[9]
बीटा और अल्फा रूप के बीच रासायनिक और जैविक गुणों में अंतर होता हैं, α फॉर्म अधिक घुलनशील और जैवनिम्नीकरणीय होते है। दोनों विधि व्यावसायिक रूप से उपलब्ध हैं और चिकित्सा और दंत चिकित्सा अनुप्रयोगों में उपयोग किए जाने वाले योगों में सम्मलित होती हैं।[9]
घटना
कैल्शियम फॉस्फेट हड्डी के मुख्य दहन उत्पादों में से एक है (अस्थि भस्म देखें)। कैल्शियम फॉस्फेट भी सामान्यतः खनिज चट्टान जैसे अकार्बनिक स्रोतों से प्राप्त होता है।[10] ट्रिकैल्शियम फॉस्फेट स्वाभाविक रूप से कई रूपों में होता है, जिनमें निम्न सम्मलित हैं:
- मोरक्को, इजराइल, फिलीपींस, मिस्र और कोला प्रायद्वीप (रूस) में चट्टान के रूप में और कुछ अन्य देशों में कम मात्रा में उपलब्ध होते है। प्राकृतिक रूप से पूरी तरह से शुद्ध नहीं होते है, रेत और चूने जैसे कुछ अन्य घटक होते हैं जो संरचना को बदल सकते हैं। अधिकांश कैल्शियम फॉस्फेट चट्टानों में P2O5 की मात्रा वजन के हिसाब से 30% से 40% P2O5 होती है।
- कशेरुकी जंतुओं के कंकालों और दांतों में
- दूध में।
बाइफैसिक ट्राइकैल्शियम फॉस्फेट, बीसीपी
बाइफैसिक ट्राईकैल्शियम फॉस्फेट, बीसीपी, को मूल रूप से ट्राइकैल्शियम फॉस्फेट के रूप में सूचित किया गया था, किन्तु एक्स-रे विवर्तन तकनीकों ने दिखाया कि सामग्री दो चरणों, हाइड्रॉक्सीपैटाइट (HA)) और β-ट्राइकल कैल्शियम फॉस्फेट का अंतरंग मिश्रण थी।[11] यह एक चीनी मिट्टी होती है।[12] जों निर्मिति करने में कैल्शियम की कमी वाले एपेटाइट्स[6] के अपरिवर्तनीय अपघटन के कारण सिंटरिंग सम्मलित होते है, जिसे वैकल्पिक रूप से गैर-स्टोइकोमेट्रिक एपेटाइट्स या मूल कैल्शियम फॉस्फेट कहा जाता है,[13] एक उदाहरण है:[14]
- Ca10−δ(PO4)6−δ(HPO4)δ(OH)2−δ → (1−δ) Ca10(PO4)6(OH)2 + 3δ Ca3(PO4)2
β-TCP में अशुद्धियाँ हो सकती हैं, उदाहरण के लिए कैल्शियम पाइरोफॉस्फेट, CaP2O7 और एपेटाइट। β-TCP बायोरेसोरेबल होता है। बीसीपी के जैव-निम्नीकरण में HA-क्रिस्टल उन्मूलन के बाद β-TCP चरण का तेजी से विघटन सम्मलित है। β-टीसीपी शारीरिक pH स्तर पर शरीर के तरल पदार्थों में घुलता नहीं है, विघटन के लिए अम्लीय pH उत्पन्न करने वाली कोशिका सक्रियता, की आवश्यकता होती है। [6]
उपयोग
खाद्य योज्य
ट्राइकैल्शियम फॉस्फेट पाउडर मसालों मेंमें एक एंटीकेकिंग घटक के रूप में प्रयोग किया जाता है, उदा। टेबल साल्ट को जमने से रोकने के लिए कैल्शियम फॉस्फेट को यूरोपीय खाद्य योज्य संख्या E341 सौंपी गई है।
स्वास्थ्य और सौंदर्य उत्पाद
यह शिशु पाउडर, एंटासिड और टूथपेस्ट में भी पाया जाता है।[4]
बायोमेडिकल
इसका उपयोग पोषण पूरक संपूरण के रूप में भी किया जाता है[15] और गाय के दूध में स्वाभाविक रूप से होता है,[citation needed] चूँकि संपूरण के लिए सबसे किफायती रूप हैं कैल्शियम कार्बोनेट (जिसे भोजन के साथ लिया जाना चाहिए) और कैल्शियम साइट्रेट (जिसे भोजन के बिना लिया जा सकता है)।[16] विभिन्न कैल्शियम लवणों की विभिन्न जैवउपलब्धता के बारे में कुछ तर्क वितर्क होता रहा है।
जब स्वप्रतिरोपण अस्थि निरोपण व्यवहार्य या संभव नहीं होता है तो इसका उपयोग हड्डी के दोषों की मरम्मत के लिए ऊतक प्रतिस्थापन के रूप में किया जा सकता है।[17][18][19] इसे अकेले या जैवनिम्नीकरणीय, पुनः अवशोषित करने योग्य बहुलक जैसे पॉलीग्लाइकोलिक एसिड के संयोजन में उपयोग किया जा सकता है।[20] इसे अस्थि निरोपण के लिए ऑटोलॉगस सामग्री के साथ भी जोड़ा जा सकता है।[21][22]
हड्डी में स्थानीय औषधि वितरण के लिए छिद्रित बीटा-ट्राईकैल्शियम फॉस्फेट स्कैफोल्ड को औषधि वाहक तंत्र के रूप में नियोजित किया जाता है।[23]
प्राकृतिक घटना
ट्यूइट (खनिज), ट्राइकैल्शियम ऑर्थोफोस्फेट (V) का एक प्राकृतिक रेखीय , कुछ उल्कापिंडों का एक दुर्लभ घटक होते है। इसका गठन आघात कायांतरण से संबंधित होता है।[24]
संदर्भ
- ↑ 1.0 1.1 1.2 Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). Boca Raton, FL: CRC Press. p. 4.54. ISBN 9781498754293.
- ↑ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (in English) (99 ed.). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ↑ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ↑ 4.0 4.1 4.2 Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2012). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ↑ 5.0 5.1 Destainville, A., Champion, E., Bernache-Assollant, D., Laborde, E. (2003). "एपेटिटिक ट्राईकैल्शियम फॉस्फेट का संश्लेषण, लक्षण वर्णन और तापीय व्यवहार". Materials Chemistry and Physics. 80 (1): 269–277. doi:10.1016/S0254-0584(02)00466-2.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ 6.0 6.1 6.2 6.3 Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (2011). "1.111 – Bioactive Ceramics: Physical Chemistry". In Ducheyne, Paul (ed.). व्यापक बायोमटेरियल्स. Vol. 1. Elsevier. pp. 187–281. doi:10.1016/B978-0-08-055294-1.00178-1. ISBN 978-0-08-055294-1.
- ↑ Dorozhkin, Sergey V. (December 2012). "अनाकार कैल्शियम (ऑर्थो) फॉस्फेट". Acta Biomaterialia. 6 (12): 4457–4475. doi:10.1016/j.actbio.2010.06.031. PMID 20609395.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Yashima, M.; Sakai, A.; Kamiyama, T.; Hoshikawa, A. (2003). "Crystal structure analysis of β-tricalcium phosphate Ca3(PO4)2 by neutron powder diffraction". RNAl of Solid State Chemistry. 175 (2): 272–277. Bibcode:2003JSSCh.175..272Y. doi:10.1016/S0022-4596(03)00279-2.
- ↑ 9.0 9.1 Carrodeguas, R.G.; De Aza, S. (2011). "α-Tricalcium phosphate: Synthesis, properties and biomedical applications". Acta Biomaterialia. 7 (10): 3536–3546. doi:10.1016/j.actbio.2011.06.019. PMID 21712105.
- ↑ Yacoubou, Jeanne, MS. Vegetarian Journal's Guide To Food Ingredients "Guide to Food Ingredients". The Vegetarian Resource Group, n.d. Web. 14 Sept. 2012.
- ↑ Daculsi, G.; Legeros, R. (2008). "17 – Tricalcium phosphate/hydroxyapatite biphasic ceramics". In Kokubo, Tadashi (ed.). बायोसेरामिक्स और उनके नैदानिक अनुप्रयोग. Woodhead Publishing. pp. 395–423. doi:10.1533/9781845694227.2.395. ISBN 978-1-84569-204-9.
{{cite book}}: zero width space character in|title=at position 31 (help) - ↑ Salinas, Antonio J.; Vallet-Regi, Maria (2013). "Bioactive ceramics: from bone grafts to tissue engineering". RSC Advances. 3 (28): 11116–11131. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ↑ Elliott, J.C. (1994). "3 – Hydroxyapatite and Nonstoichiometric Apatites". अकार्बनिक रसायन विज्ञान में अध्ययन. Vol. 18. Elsevier. pp. 111–189. doi:10.1016/B978-0-444-81582-8.50008-0. ISBN 9780444815828.
- ↑ Vallet-Regí, M.;Rodríguez-Lorenzo, L.M. (November 1997). "कैल्शियम की कमी वाले एपेटाइट का संश्लेषण और लक्षण वर्णन". Solid State Ionics. 101–103, Part 2: 1279–1285. doi:10.1016/S0167-2738(97)00213-0.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ↑ Bonjour JP, Carrie AL, Ferrari S, Clavien H, Slosman D, Theintz G, Rizzoli R (March 1997). "Calcium-enriched foods and bone mass growth in prepubertal girls: a randomized, double-blind, placebo-controlled trial". J. Clin. Invest. 99 (6): 1287–1294. doi:10.1172/JCI119287. PMC 507944. PMID 9077538.
- ↑ Straub DA (June 2007). "Calcium supplementation in clinical practice: a review of forms, doses, and indications". Nutr Clin Pract. 22 (3): 286–296. doi:10.1177/0115426507022003286. PMID 17507729.
- ↑ Paderni S, Terzi S, Amendola L (September 2009). "ऑस्टियोकंडक्टिव बोन सब्स्टीट्यूट के साथ प्रमुख अस्थि दोष उपचार". Musculoskelet Surg. 93 (2): 89–96. doi:10.1007/s12306-009-0028-0. PMID 19711008. S2CID 33413039.
- ↑ Moore DC, Chapman MW, Manske D (1987). "लंबी हड्डी के डायफिसियल दोषों को ग्राफ्ट करने में उपयोग के लिए एक द्विध्रुवीय कैल्शियम फॉस्फेट सिरेमिक का मूल्यांकन". Journal of Orthopaedic Research. 5 (3): 356–365. doi:10.1002/jor.1100050307. PMID 3040949. S2CID 41579389.
- ↑ Lange TA, Zerwekh JE, Peek RD, Mooney V, Harrison BH (1986). "बड़े रद्दी दोषों में दानेदार ट्राईकैल्शियम फॉस्फेट". Annals of Clinical and Laboratory Science. 16 (6): 467–472. PMID 3541772.
- ↑ Cao H, Kuboyama N (September 2009). "A biodegradable porous composite scaffold of PGA/β-TCP for bone tissue engineering". Bone. 46 (2): 386–395. doi:10.1016/j.bone.2009.09.031. PMID 19800045.
- ↑ Erbe EM, Marx JG, Clineff TD, Bellincampi LD (October 2001). "Potential of an ultraporous β-tricalcium phosphate synthetic cancellous bone void filler and bone marrow aspirate composite graft". European Spine Journal. 10 Suppl. 2 (Suppl 2): S141–S146. doi:10.1007/s005860100287. PMC 3611552. PMID 11716011.
- ↑ Bansal S, Chauhan V, Sharma S, Maheshwari R, Juyal A, Raghuvanshi S (July 2009). "हाइड्रॉक्सीपैटाइट और बीटा-ट्राइकल कैल्शियम फॉस्फेट का मूल्यांकन अस्थि मज्जा एस्पिरेट के साथ मिश्रित पोस्टेरोलेंटल स्पाइनल फ्यूजन के लिए एक हड्डी ग्राफ्ट विकल्प के रूप में". Indian Journal of Orthopaedics. 43 (3): 234–239. doi:10.4103/0019-5413.49387. PMC 2762171. PMID 19838344.
- ↑ Kundu, B; Lemos A; Soundrapandian C; Sen PS; Datta S; Ferreira JMF; Basu D (2010). "Development of porous HAp and β-TCP scaffolds by starch consolidation with foaming method and drug-chitosan bilayered scaffold based drug delivery system". J. Mater. Sci. Mater. Med. 21 (11): 2955–2969. doi:10.1007/s10856-010-4127-0. PMID 20644982. S2CID 6483779.
- ↑ Tuite. Mindat.org
