संक्रमण धातु हाइड्राइड: Difference between revisions
No edit summary |
|||
| Line 5: | Line 5: | ||
=== बाइनरी मेटल हाइड्राइड === | === बाइनरी मेटल हाइड्राइड === | ||
कई संक्रमण धातुएं हाइड्रोजन के साथ यौगिक बनाती हैं, जिन्हें बाइनरी हाइड्राइड कहा जाता है: बाइनरी क्योंकि इन यौगिकों में केवल दो तत्व होते हैं, और हाइड्राइड, क्योंकि [[हाइड्रोजनिक]] लिगैंड को हाइड्रिडिक (H-- जैसा) अक्षर माना जाता है। ये यौगिक सभी विलायक में हमेशा अघुलनशील होते हैं, जो उनकी बहुलक संरचनाओं को दर्शाते हैं। ये साधारणतयः धातु जैसी विद्युत चालकता प्रदर्शित करते हैं। इनमें कई [[अरससमीकरणमितीय (नॉनस्टोइकोमेट्रिक)]] यौगिक हैं। विद्युत धनात्मकता धातु ([[ टाइटेनियम | टाइटेनियम]] (Ti), Zr, Hf, [[ जस्ता |जस्ता]] (Zn)) और कुछ अन्य धातुएँ [[रससमीकरणमिति (स्टोइकोमेट्री)]] MH या कभी-कभी MH2 (M = Ti, Zr, Hf, V, Zn) के साथ हाइड्राइड बनाती हैं। सबसे अच्छा अध्ययन पैलेडियम के द्विआधारी हाइड्राइड हैं, जो | कई संक्रमण धातुएं हाइड्रोजन के साथ यौगिक बनाती हैं, जिन्हें बाइनरी हाइड्राइड कहा जाता है: बाइनरी क्योंकि इन यौगिकों में केवल दो तत्व होते हैं, और हाइड्राइड, क्योंकि [[हाइड्रोजनिक]] लिगैंड को हाइड्रिडिक (H-- जैसा) अक्षर माना जाता है। ये यौगिक सभी विलायक में हमेशा अघुलनशील होते हैं, जो उनकी बहुलक संरचनाओं को दर्शाते हैं। ये साधारणतयः धातु जैसी विद्युत चालकता प्रदर्शित करते हैं। इनमें कई [[अरससमीकरणमितीय (नॉनस्टोइकोमेट्रिक)]] यौगिक हैं। विद्युत धनात्मकता धातु ([[ टाइटेनियम | टाइटेनियम]] (Ti), Zr, Hf, [[ जस्ता |जस्ता]] (Zn)) और कुछ अन्य धातुएँ [[रससमीकरणमिति (स्टोइकोमेट्री)]] MH या कभी-कभी MH2 (M = Ti, Zr, Hf, V, Zn) के साथ हाइड्राइड बनाती हैं। सबसे अच्छा अध्ययन पैलेडियम के द्विआधारी हाइड्राइड हैं, जो साधारणतयः एक सीमित मोनोहाइड्राइड बनाता है। वास्तव में, हाइड्रोजन गैस पीडी विंडो के माध्यम से पीडीएच की मध्यस्थता के माध्यम से फैलती है।<ref>{{Greenwood&Earnshaw2nd}}</ref> | ||
[[File:AX9E0-3D-balls.png|thumb|की संरचना {{chem|ReH|9|2-}} नमक में आयन पोटेशियम नॉनहाइड्रिडोरहेनेट | K<sub>2</sub>रह<sub>9</sub>.<ref>{{cite journal |first1= S. C. |last1= Abrahams |first2= A. P. |last2= Ginsberg |first3= K. |last3= Knox |title= संक्रमण धातु-हाइड्रोजन यौगिक। द्वितीय. पोटेशियम रेनियम हाइड्राइड की क्रिस्टल और आणविक संरचना, K<sub>2</sub>ReH<sub>9</sub>|journal= Inorg. Chem. |year= 1964 |volume= 3 |issue= 4 |pages= 558–567 |doi= 10.1021/ic50014a026}}</ref>]] | [[File:AX9E0-3D-balls.png|thumb|की संरचना {{chem|ReH|9|2-}} नमक में आयन पोटेशियम नॉनहाइड्रिडोरहेनेट | K<sub>2</sub>रह<sub>9</sub>.<ref>{{cite journal |first1= S. C. |last1= Abrahams |first2= A. P. |last2= Ginsberg |first3= K. |last3= Knox |title= संक्रमण धातु-हाइड्रोजन यौगिक। द्वितीय. पोटेशियम रेनियम हाइड्राइड की क्रिस्टल और आणविक संरचना, K<sub>2</sub>ReH<sub>9</sub>|journal= Inorg. Chem. |year= 1964 |volume= 3 |issue= 4 |pages= 558–567 |doi= 10.1021/ic50014a026}}</ref>]] | ||
=== टर्नरी धातु हाइड्राइड === | === टर्नरी धातु हाइड्राइड === | ||
टर्नरी मेटल हाइड्राइड्स का सूत्र AxMHn होता है, जहाँ A+ एक क्षार या क्षारीय पृथ्वी धातु धनायन है, उदाहरण के लिए K<sup>+</sup> और Mg<sup>2+</sup>। एक प्रसिद्ध उदाहरण K<sub>2</sub>ReH<sub>9</sub> है, एक नमक जिसमें दो K+ आयन और ReH92− आयन होते हैं। अन्य होमोलेप्टिक धातु हाइड्राइड में Mg<sub>2</sub>FeH<sub>6</sub> और Mg<sub>2</sub>NiH<sub>4</sub> में आयन | टर्नरी मेटल हाइड्राइड्स का सूत्र AxMHn होता है, जहाँ A+ एक क्षार या क्षारीय पृथ्वी धातु धनायन है, उदाहरण के लिए K<sup>+</sup> और Mg<sup>2+</sup>। एक प्रसिद्ध उदाहरण K<sub>2</sub>ReH<sub>9</sub> है, एक नमक जिसमें दो K+ आयन और ReH92− आयन होते हैं। अन्य होमोलेप्टिक धातु हाइड्राइड में Mg<sub>2</sub>FeH<sub>6</sub> और Mg<sub>2</sub>NiH<sub>4</sub> में आयन सम्मलित हैं। इनमें से कुछ आयनिक पॉलीहाइड्राइड [[ 18-इलेक्ट्रॉन नियम |18-इलेक्ट्रॉन नियम]] को संतुष्ट करते हैं, कई नहीं। उनकी उच्च जाली ऊर्जा के कारण, ये लवण साधारणतयः किसी भी विलायक में घुलनशील नहीं होते हैं, एक प्रसिद्ध अपवाद K<sub>2</sub>ReH<sub>9</sub> है।<ref>{{cite journal | last1 = King | first1 = R.B. | year = 2000 | title = होमोलेप्टिक संक्रमण धातु हाइड्राइड आयनों में संरचना और बंधन| journal = Coordination Chemistry Reviews | volume = 200–202 | pages = 813–829 | doi = 10.1016/S0010-8545(00)00263-0}}</ref> | ||
===समन्वय परिसरों=== | ===समन्वय परिसरों=== | ||
संक्रमण धातुओं के सबसे प्रचलित हाइड्राइड [[ धातु परिसर |धातु परिसर]] हैं जिसमें हाइड्राइड के अलावा अन्य लिगेंड का मिश्रण होता है। कोलिगैंड्स की रेंज बड़ी है। लगभग सभी धातुएं ऐसे | संक्रमण धातुओं के सबसे प्रचलित हाइड्राइड [[ धातु परिसर |धातु परिसर]] हैं जिसमें हाइड्राइड के अलावा अन्य लिगेंड का मिश्रण होता है। कोलिगैंड्स की रेंज बड़ी है। लगभग सभी धातुएं ऐसे व्युत्पन्न बनाती हैं। मुख्य अपवादों में देर से धातुएं चांदी, सोना, [[ कैडमियम हाइड्राइड |कैडमियम हाइड्राइड]] और [[ पारा हाइड्राइड ]] सम्मलित हैं, जो प्रत्यक्ष एम-एच बंध के साथ कुछ या अस्थिर परिसरों का निर्माण करते हैं। औद्योगिक रूप से उपयोगी हाइड्राइड के उदाहरण हैं HCo(CO)<sub>4</sub> and HRh(CO)(PPh<sub>3</sub>)<sub>3</sub>, जो [[ हाइड्रोफॉर्माइलेशन |हाइड्रोफॉर्माइलेशन]] के लिए [[उत्प्रेरक]] हैं। | ||
:[[Image:HFeCl dppe 2.svg|thumb|left|क्लोरोबिस (dppe) आयरन हाइड्राइड | HFeCl (dppe)<sub>2</sub>सबसे सुलभ संक्रमण धातु हाइड्राइड में से एक है।]]संक्रमण धातुओं के पहले आणविक हाइड्राइड की सूचना पहली बार 1930 के दशक में [[ वाल्टर हाइबर |वाल्टर हाइबर]] और सहकर्मियों द्वारा दी गई थी। उन्होंने H<sub>2</sub>Fe(CO)<sub>4</sub> और HCo(CO)<sub>4</sub> का वर्णन किया, कई वर्षों के अंतराल के बाद हाइड्रोफॉर्माइलेशन में एचसीओ (सीओ) 4 की नियत भूमिका पर जर्मन युद्ध दस्तावेजों की | :[[Image:HFeCl dppe 2.svg|thumb|left|क्लोरोबिस (dppe) आयरन हाइड्राइड | HFeCl (dppe)<sub>2</sub>सबसे सुलभ संक्रमण धातु हाइड्राइड में से एक है।]]संक्रमण धातुओं के पहले आणविक हाइड्राइड की सूचना पहली बार 1930 के दशक में [[ वाल्टर हाइबर |वाल्टर हाइबर]] और सहकर्मियों द्वारा दी गई थी। उन्होंने H<sub>2</sub>Fe(CO)<sub>4</sub> और HCo(CO)<sub>4</sub> का वर्णन किया, कई वर्षों के अंतराल के बाद हाइड्रोफॉर्माइलेशन में एचसीओ (सीओ) 4 की नियत भूमिका पर जर्मन युद्ध दस्तावेजों की मुक्ति के बाद, 1950 के दशक के मध्य में ऑर्गोमेटेलिक रसायन शास्त्र में तीन प्रमुख समूहों द्वारा कई नए हाइड्राइड्स की सूचना दी गई: HRe(C<sub>5</sub>H<sub>5</sub>)<sub>2</sub> [[ जेफ्री विल्किंसन |जेफ्री विल्किंसन]], HMo(C<sub>5</sub>H<sub>5</sub>)(CO)<sub>3</sub> by E. O. Fischer, and HPtCl(PEt<sub>3</sub>)<sub>2</sub> by [[ जोसेफ चट्टो ]]<ref name="Kaesz">{{Cite journal | ||
| doi = 10.1021/cr60277a003 | | doi = 10.1021/cr60277a003 | ||
| volume = 72 | | volume = 72 | ||
| Line 25: | Line 25: | ||
=== क्लस्टर हाइड्राइड === | === क्लस्टर हाइड्राइड === | ||
हाइड्रिडो समन्वय परिसरों की तरह, कई समूहों में टर्मिनल (एक एम-एच बंधन से बंधे) हाइड्राइड लिगैंड होते हैं। हाइड्राइड लिगेंड्स धातुओं के जोड़े को भी समतल कर सकते हैं, जैसा कि [HW2(CO)10]- द्वारा दर्शाया गया है। क्लस्टर H2Os3(CO)10 में टर्मिनल और डबल ब्रिजिंग हाइड्राइड लिगैंड दोनों हैं। हाइड्राइड्स [Ag<sub>3</sub>{(PPh<sub>2</sub>)<sub>2</sub>CH<sub>2</sub>}<sub>3</sub>(μ<sub>3</sub>-H)(μ<sub>3</sub>-Cl)]BF<sub>4</sub> के रूप में क्लस्टर के त्रिकोणीय फलक को भी फैला सकते हैं।<ref>{{Cite journal|title = सिल्वर हाइड्राइड कॉम्प्लेक्स का संश्लेषण, संरचना और गैस-चरण प्रतिक्रियाशीलता [Ag3{(PPh2)2CH2}3(μ3-H)(μ3-Cl)]BF4|journal = Angewandte Chemie|date = 2013-08-05|issn = 1521-3757|pages = 8549–8552|volume = 125|issue = 32|doi = 10.1002/ange.201302436|language = en|first1 = Athanasios|last1 = Zavras|first2 = George N.|last2 = Khairallah|first3 = Timothy U.|last3 = Connell|first4 = Jonathan M.|last4 = White|first5 = Alison J.|last5 = Edwards|first6 = Paul S.|last6 = Donnelly|first7 = Richard A. J.|last7 = O'Hair}}</ref> क्लस्टर [Co6H(CO)15]- में, हाइड्राइड "इंटरस्टिशियल" है, जो Co<sub>6</sub> ऑक्टाहेड्रोन के केंद्र में स्थित है। क्लस्टर हाइड्राइड्स के लिए | हाइड्रिडो समन्वय परिसरों की तरह, कई समूहों में टर्मिनल (एक एम-एच बंधन से बंधे) हाइड्राइड लिगैंड होते हैं। हाइड्राइड लिगेंड्स धातुओं के जोड़े को भी समतल कर सकते हैं, जैसा कि [HW2(CO)10]- द्वारा दर्शाया गया है। क्लस्टर H2Os3(CO)10 में टर्मिनल और डबल ब्रिजिंग हाइड्राइड लिगैंड दोनों हैं। हाइड्राइड्स [Ag<sub>3</sub>{(PPh<sub>2</sub>)<sub>2</sub>CH<sub>2</sub>}<sub>3</sub>(μ<sub>3</sub>-H)(μ<sub>3</sub>-Cl)]BF<sub>4</sub> के रूप में क्लस्टर के त्रिकोणीय फलक को भी फैला सकते हैं।<ref>{{Cite journal|title = सिल्वर हाइड्राइड कॉम्प्लेक्स का संश्लेषण, संरचना और गैस-चरण प्रतिक्रियाशीलता [Ag3{(PPh2)2CH2}3(μ3-H)(μ3-Cl)]BF4|journal = Angewandte Chemie|date = 2013-08-05|issn = 1521-3757|pages = 8549–8552|volume = 125|issue = 32|doi = 10.1002/ange.201302436|language = en|first1 = Athanasios|last1 = Zavras|first2 = George N.|last2 = Khairallah|first3 = Timothy U.|last3 = Connell|first4 = Jonathan M.|last4 = White|first5 = Alison J.|last5 = Edwards|first6 = Paul S.|last6 = Donnelly|first7 = Richard A. J.|last7 = O'Hair}}</ref> क्लस्टर [Co6H(CO)15]- में, हाइड्राइड "इंटरस्टिशियल" है, जो Co<sub>6</sub> ऑक्टाहेड्रोन के केंद्र में स्थित है। क्लस्टर हाइड्राइड्स के लिए यह कार्य चुनौतीपूर्ण हो सकता है जैसा कि स्ट्राइकर के अभिकर्मक [Cu<sub>6</sub>(PPh<sub>3</sub>)<sub>6</sub>H<sub>6</sub>] पर अध्ययन द्वारा दिखाया गया है।<ref>{{Cite journal|title = स्ट्राइकर के अभिकर्मक में हाइड्राइड्स की विशेषता: [HCu{P(C6H5)3}]6|journal = Inorganic Chemistry|date = 2014-03-17|issn = 0020-1669|pages = 2963–2967|volume = 53|issue = 6|doi = 10.1021/ic402736t|pmid = 24571368|first1 = Elliot L.|last1 = Bennett|first2 = Patrick J.|last2 = Murphy|first3 = Silvia|last3 = Imberti|first4 = Stewart F.|last4 = Parker|doi-access = free}}</ref> | ||
== संश्लेषण == | == संश्लेषण == | ||
| Line 31: | Line 31: | ||
न्यूक्लियोफिलिक मुख्य समूह हाइड्राइड कई संक्रमण धातु हैलाइडों और धनायनों को संबंधित हाइड्राइड में परिवर्तित करते हैं: | न्यूक्लियोफिलिक मुख्य समूह हाइड्राइड कई संक्रमण धातु हैलाइडों और धनायनों को संबंधित हाइड्राइड में परिवर्तित करते हैं: | ||
:ML<sub>n</sub>X + LiBHEt<sub>3</sub> → HML<sub>n</sub> + BEt<sub>3</sub> + LiX | :ML<sub>n</sub>X + LiBHEt<sub>3</sub> → HML<sub>n</sub> + BEt<sub>3</sub> + LiX | ||
ये रूपांतरण मेटाथिसिस प्रतिक्रियाएं हैं, और उत्पाद की हाइड्रिकता | ये रूपांतरण मेटाथिसिस प्रतिक्रियाएं हैं, और उत्पाद की हाइड्रिकता साधारणतयः हाइड्राइड दाता की तुलना में कम होती है। पारस्परिक (और अपेक्षाकृत सस्ते) हाइड्राइड दाता अभिकर्मकों में [[ सोडियम बोरोहाइड्राइड |सोडियम बोरोहाइड्राइड]] और [[ लिथियम एल्यूमीनियम हाइड्राइड | लिथियम एल्यूमीनियम हाइड्राइड]] सम्मलित हैं। प्रयोगशाला में, [[ लिथियम ट्राइथाइलबोरोहाइड्राइड |लिथियम ट्राइथाइलबोरोहाइड्राइड]] और [[रेड-अल]] जैसे "मिश्रित हाइड्राइड्स" द्वारा साधारणतयः अधिक नियंत्रण का प्रस्ताव किया जाती है। क्षार धातु हाइड्राइड जैसे [[ सोडियम हाइड्राइड | सोडियम हाइड्राइड]], साधारणतयः उपयोगी अभिकर्मक नहीं होते हैं। | ||
=== उन्मूलन प्रतिक्रियाएं === | === उन्मूलन प्रतिक्रियाएं === | ||
[[ बीटा-हाइड्राइड उन्मूलन |बीटा-हाइड्राइड उन्मूलन]] और अल्फा-हाइड्राइड उन्मूलन ऐसी प्रक्रियाएं हैं जो हाइड्राइड्स को वहन करती हैं। सजातीय पोलीमराइजेशन में पूर्व एक सामान्य समाप्ति | [[ बीटा-हाइड्राइड उन्मूलन |बीटा-हाइड्राइड उन्मूलन]] और अल्फा-हाइड्राइड उन्मूलन ऐसी प्रक्रियाएं हैं जो हाइड्राइड्स को वहन करती हैं। सजातीय पोलीमराइजेशन में पूर्व एक सामान्य समाप्ति मार्ग पर यह कुछ संक्रमण धातु हाइड्राइड परिसरों को [[ ऑर्गेनोलिथियम |ऑर्गेनोलिथियम]] और [[ ग्रिग्नार्ड अभिकर्मक | ग्रिग्नार्ड अभिकर्मक]] से संश्लेषित करने की भी अनुमति देता है: | ||
ML<sub>n</sub>X + LiC<sub>4</sub>H<sub>9</sub> → C<sub>4</sub>H<sub>9</sub>ML<sub>n</sub> + LiX | ML<sub>n</sub>X + LiC<sub>4</sub>H<sub>9</sub> → C<sub>4</sub>H<sub>9</sub>ML<sub>n</sub> + LiX | ||
| Line 40: | Line 40: | ||
C<sub>4</sub>H<sub>9</sub>ML<sub>n</sub> → HML<sub>n</sub> + H<sub>2</sub>C=CHC<sub>2</sub>H<sub>5</sub> | C<sub>4</sub>H<sub>9</sub>ML<sub>n</sub> → HML<sub>n</sub> + H<sub>2</sub>C=CHC<sub>2</sub>H<sub>5</sub> | ||
=== [[ ऑक्सीडेटिव जोड़ |ऑक्सीडेटिव परिवर्धन]] === | === [[ ऑक्सीडेटिव जोड़ |ऑक्सीडेटिव परिवर्धन]] === | ||
निम्न संयोजकता संक्रमण धातु केंद्र में डाइहाइड्रोजन का ऑक्सीडेटिव योग हाइड्रोजनीकरण का सामान्य | निम्न संयोजकता संक्रमण धातु केंद्र में डाइहाइड्रोजन का ऑक्सीडेटिव योग हाइड्रोजनीकरण का सामान्य स्वरूप है। एक उत्कृष्ट उदाहरण में वास्का का परिसर सम्मलित है:<ref>Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. {{ISBN|1-891389-53-X}}</ref> | ||
Ir<sup>I</sup>Cl(CO)(PPh<sub>3</sub>)<sub>2</sub> + H<sub>2</sub> ⇌ H<sub>2</sub>Ir<sup>III</sup>Cl(CO)(PPh<sub>3</sub>)<sub>2</sub> | Ir<sup>I</sup>Cl(CO)(PPh<sub>3</sub>)<sub>2</sub> + H<sub>2</sub> ⇌ H<sub>2</sub>Ir<sup>III</sup>Cl(CO)(PPh<sub>3</sub>)<sub>2</sub> | ||
| Line 51: | Line 51: | ||
कुछ धातु हाइड्राइड तब बनते हैं जब एक धातु परिसर को आधार की उपस्थिति में हाइड्रोजन के साथ व्यवहार किया जाता है। प्रतिक्रिया में धातु की ऑक्सीकरण अवस्था में कोई परिवर्तन नहीं होता है और इसे H2 को हाइड्राइड में विभाजित करने के रूप में देखा जा सकता है जो धातु को बांधता है और प्रोटॉन जो आधार से बंधता है। | कुछ धातु हाइड्राइड तब बनते हैं जब एक धातु परिसर को आधार की उपस्थिति में हाइड्रोजन के साथ व्यवहार किया जाता है। प्रतिक्रिया में धातु की ऑक्सीकरण अवस्था में कोई परिवर्तन नहीं होता है और इसे H2 को हाइड्राइड में विभाजित करने के रूप में देखा जा सकता है जो धातु को बांधता है और प्रोटॉन जो आधार से बंधता है। | ||
:ML<sub>n</sub><sup>x+</sup> + base + H<sub>2</sub> ⇌ HML<sub>n</sub><sup>(x-1)+</sup> + Hbase<sup>+</sup> | :ML<sub>n</sub><sup>x+</sup> + base + H<sub>2</sub> ⇌ HML<sub>n</sub><sup>(x-1)+</sup> + Hbase<sup>+</sup> | ||
इस तरह की प्रतिक्रिया को डायहाइड्रोजन परिसरों की मध्यस्थता को | इस तरह की प्रतिक्रिया को डायहाइड्रोजन परिसरों की मध्यस्थता को सम्मलित करने के लिए माना जाता है। [[द्वि-कार्यात्मक उत्प्रेरक]] इस प्रकार H<sub>2</sub> को सक्रिय करते हैं। | ||
[[Image:Cp2MoH2.png|thumb|128px|NaBH . का उपयोग करके [[ मोलिब्डोसिन डाइहाइड्राइड ]] का उत्पादन किया जाता है<sub>4</sub> हाइड्राइड स्रोत के रूप में]] | [[Image:Cp2MoH2.png|thumb|128px|NaBH . का उपयोग करके [[ मोलिब्डोसिन डाइहाइड्राइड ]] का उत्पादन किया जाता है<sub>4</sub> हाइड्राइड स्रोत के रूप में]] | ||
| Line 99: | Line 99: | ||
फॉस्फीन लिगैंड द्वारा CO के प्रतिस्थापन पर मान <6 kJ/mol से बदल जाते हैं। | फॉस्फीन लिगैंड द्वारा CO के प्रतिस्थापन पर मान <6 kJ/mol से बदल जाते हैं। | ||
एम-एच | एम-एच बंध सैद्धांतिक रूप से एक प्रोटॉन, हाइड्रोजन रेडिकल या हाइड्राइड का उत्पादन करने के लिए तैयार हो सकता है।<ref>{{cite journal | last1 = Rakowski DuBois | first1 = M. | last2 = DuBois | first2 = D. L. | year = 2009 | title = H<sub>2</sub> उत्पादन और ऑक्सीकरण के लिए आण्विक उत्प्रेरक के डिजाइन में पहले और दूसरे समन्वय क्षेत्रों की भूमिकाएं| journal = Chem. Soc. Rev. | volume = 38 | issue = 1| pages = 62–72 | doi = 10.1039/b801197b | pmid = 19088965 | url = https://zenodo.org/record/1229994}}</ref> | ||
:: HML<sub>n</sub> ⇌ ML<sub>n</sub><sup>−</sup> + H<sup>+</sup> | :: HML<sub>n</sub> ⇌ ML<sub>n</sub><sup>−</sup> + H<sup>+</sup> | ||
:: HML<sub>n</sub> ⇌ ML<sub>n</sub> + H | :: HML<sub>n</sub> ⇌ ML<sub>n</sub> + H | ||
:: HML<sub>n</sub> ⇌ ML<sub>n</sub><sup>+</sup> + H<sup>−</sup> | :: HML<sub>n</sub> ⇌ ML<sub>n</sub><sup>+</sup> + H<sup>−</sup> | ||
चूंकि ये गुण परस्पर जुड़े हुए हैं, वे अन्योन्याश्रित नहीं हैं। एक धातु हाइड्राइड ऊष्मागतिकी के रूप से एक कमजोर एसिड और एक कमजोर एच-दाता हो सकता है; यह एक श्रेणी में मजबूत भी हो सकता है लेकिन दूसरे में नहीं या दोनों में मजबूत, एक हाइड्राइड की H<sup>−</sup> शक्ति को इसकी हाइड्राइड दाता क्षमता या हाइड्रिकिटी के रूप में भी जाना जाता है, हाइड्राइड की लुईस आधार शक्ति से मेल खाती है। सभी हाइड्राइड शक्तिशाली लुईस | चूंकि ये गुण परस्पर जुड़े हुए हैं, वे अन्योन्याश्रित नहीं हैं। एक धातु हाइड्राइड ऊष्मागतिकी के रूप से एक कमजोर एसिड और एक कमजोर एच-दाता हो सकता है; यह एक श्रेणी में मजबूत भी हो सकता है लेकिन दूसरे में नहीं या दोनों में मजबूत, एक हाइड्राइड की H<sup>−</sup> शक्ति को इसकी हाइड्राइड दाता क्षमता या हाइड्रिकिटी के रूप में भी जाना जाता है, हाइड्राइड की लुईस आधार शक्ति से मेल खाती है। सभी हाइड्राइड शक्तिशाली लुईस क्षार नहीं होते हैं। हाइड्राइड की आधार शक्ति प्रोटॉन के pK<sub>a</sub> के बराबर भिन्न होती है। इस हाइड्रिसिटी को धातु के परिसर और एक ज्ञात पीकेए के साथ आधार के बीच हेटेरोलाइटिक क्लीजिंग हाइड्रोजन द्वारा मापा जा सकता है, फिर परिणामी संतुलन को मापता है। यह मानता है कि हाइड्राइड हाइड्रोजन को सुधारने के लिए हेटेरोलाइटिक या समरूप रूप से स्वयं के साथ प्रतिक्रिया नहीं करता है। यदि होमोलिटिक एम-एच बॉन्ड होमोलिटिक M-H बॉन्ड के आधे से भी कम मूल्य का है, तो एक परिसर स्वयं के साथ प्रतिक्रिया करेगा। भले ही होमोलिटिक बंध की शक्ति उस सीमा से ऊपर हो, फिर भी मौलिक परिसर प्रतिक्रिया के लिए अतिसंवेदनशील होता है। | ||
:2 HML<sub>n</sub><sup>z</sup> ⇌ 2 ML<sub>n</sub><sup>z</sup> + H<sub>2</sub> | :2 HML<sub>n</sub><sup>z</sup> ⇌ 2 ML<sub>n</sub><sup>z</sup> + H<sub>2</sub> | ||
जब एक साथ एक मजबूत एसिड और एक मजबूत हाइड्राइड होता है तो एक जटिल खुद के साथ विषम रूप से प्रतिक्रिया करेगा। इस रूपांतरण के परिणामस्वरूप दो इलेक्ट्रॉनों द्वारा भिन्न ऑक्सीकरण | जब एक साथ एक मजबूत एसिड और एक मजबूत हाइड्राइड होता है तो एक जटिल खुद के साथ विषम रूप से प्रतिक्रिया करेगा। इस रूपांतरण के परिणामस्वरूप दो इलेक्ट्रॉनों द्वारा भिन्न ऑक्सीकरण स्थिति के साथ परिसरों की एक जोड़ी का उत्पादन होता है। आगे [[विद्युत रासायनिक प्रतिक्रियाएं]] संभव हैं। | ||
:2HML<sub>n</sub><sup>z</sup> ⇌ ML<sub>n</sub><sup>z+1</sup> + ML<sub>n</sub><sup>z-1</sup> + H<sub>2</sub> | :2HML<sub>n</sub><sup>z</sup> ⇌ ML<sub>n</sub><sup>z+1</sup> + ML<sub>n</sub><sup>z-1</sup> + H<sub>2</sub> | ||
| Line 119: | Line 119: | ||
लुईस एसिड के लिए हाइड्राइड लिगैंड के लिए आत्मीयता को इसकी संकरता (हाइड्रिसिटी) कहा जाता है: | लुईस एसिड के लिए हाइड्राइड लिगैंड के लिए आत्मीयता को इसकी संकरता (हाइड्रिसिटी) कहा जाता है: | ||
:ML<sub>n</sub>H<sup>n−</sup> ⇌ ML<sub>n</sub><sup>(n+1)−</sup> + H<sup>−</sup> | :ML<sub>n</sub>H<sup>n−</sup> ⇌ ML<sub>n</sub><sup>(n+1)−</sup> + H<sup>−</sup> | ||
चूँकि हाइड्राइड विलयन में स्थायी ऋणायन के रूप में | चूँकि हाइड्राइड विलयन में स्थायी ऋणायन के रूप में सम्मलित नहीं होता है, इस संतुलन स्थिरांक (और इससे जुड़ी मुक्त ऊर्जा) की गणना मापने योग्य संतुलन से की जाती है। संदर्भ बिंदु एक प्रोटॉन की हाइड्रिसिटी है, जो एसीटोनिट्राइल घोल में −76 kcal mol<sup>−1</sup> पर परिकलित किया जाता है:<ref>{{cite journal |doi=10.1021/ar00029a010|title=इलेक्ट्रोड क्षमता और थर्मोकेमिकल चक्र से समाधान में बांड ऊर्जा। एक सरलीकृत और सामान्य दृष्टिकोण|year=1993|last1=Wayner|first1=Danial D. M.|last2=Parker|first2=Vernon D.|journal=Accounts of Chemical Research|volume=26|issue=5|pages=287–294}}</ref> | ||
:H<sup>+</sup> + H<sup>−</sup> <sup></sup>⇌ H<sub>2</sub> ΔG<sub>298</sub> = −76 kcal mol<sup>−1</sup> | :H<sup>+</sup> + H<sup>−</sup> <sup></sup>⇌ H<sub>2</sub> ΔG<sub>298</sub> = −76 kcal mol<sup>−1</sup> | ||
एक प्रोटॉन के सापेक्ष, अधिकांश धनायन H− के लिए कम आत्मीयता प्रदर्शित करते हैं। कुछ उदाहरणों में | एक प्रोटॉन के सापेक्ष, अधिकांश धनायन H− के लिए कम आत्मीयता प्रदर्शित करते हैं। कुछ उदाहरणों में सम्मलित हैं: | ||
:: [Ni(dppe)<sub>2</sub>]<sup>2+</sup> + H<sup>−</sup> ⇌ [HNi(dppe)<sub>2</sub>]<sup>+</sup> ΔG<sub>298</sub> = −63 kcal mol<sup>−1</sup> | :: [Ni(dppe)<sub>2</sub>]<sup>2+</sup> + H<sup>−</sup> ⇌ [HNi(dppe)<sub>2</sub>]<sup>+</sup> ΔG<sub>298</sub> = −63 kcal mol<sup>−1</sup> | ||
:: [Ni(dmpe)<sub>2</sub>]<sup>2+</sup> + H<sup>−</sup> ⇌ [HNi(dmpe)<sub>2</sub>]<sup>+</sup> ΔG<sub>298</sub> = −50.7 kcal mol<sup>−1</sup> | :: [Ni(dmpe)<sub>2</sub>]<sup>2+</sup> + H<sup>−</sup> ⇌ [HNi(dmpe)<sub>2</sub>]<sup>+</sup> ΔG<sub>298</sub> = −50.7 kcal mol<sup>−1</sup> | ||
| Line 128: | Line 128: | ||
:: ये आंकड़े बताते हैं कि [HPt(dmpe)<sub>2</sub>]<sup>+</sup> एक मजबूत हाइड्राइड डोनर होगा, जो [Pt(dmpe)<sub>2</sub>]<sup>2+</sup> की अपेक्षाकृत उच्च स्थिरता को दर्शाता है।<ref>M Tilset "Organometallic Electrochemistry: Thermodynamics of Metal–Ligand Bonding" in Comprehensive Organometallic Chemistry III, Eds [[Robert H. Crabtree|Crabtree, R. H.]]; [[Michael Mingos|Mingos, D. M. P.]] 2007 Elsevier. {{ISBN|9780080445915}}</ref> | :: ये आंकड़े बताते हैं कि [HPt(dmpe)<sub>2</sub>]<sup>+</sup> एक मजबूत हाइड्राइड डोनर होगा, जो [Pt(dmpe)<sub>2</sub>]<sup>2+</sup> की अपेक्षाकृत उच्च स्थिरता को दर्शाता है।<ref>M Tilset "Organometallic Electrochemistry: Thermodynamics of Metal–Ligand Bonding" in Comprehensive Organometallic Chemistry III, Eds [[Robert H. Crabtree|Crabtree, R. H.]]; [[Michael Mingos|Mingos, D. M. P.]] 2007 Elsevier. {{ISBN|9780080445915}}</ref> | ||
==गतिकी और तंत्र== | ==गतिकी और तंत्र== | ||
धातु परिसरों में और उनके बीच प्रोटॉन-स्थानांतरण की दर | धातु परिसरों में और उनके बीच प्रोटॉन-स्थानांतरण की दर साधारणतयः धीमी होती है।<ref>{{Cite book | ||
| publisher = Wiley | | publisher = Wiley | ||
| isbn = 978-0-470-16643-7 | | isbn = 978-0-470-16643-7 | ||
| Line 142: | Line 142: | ||
==संरचना और संबंध == | ==संरचना और संबंध == | ||
धातु हाइड्राइड की संरचनाओं का निर्धारण चुनौतीपूर्ण हो सकता है क्योंकि हाइड्राइड लिगेंड्स एक्स-रे को अच्छी तरह से नहीं बिखेरते हैं, विशेष रूप से संलग्न धातु की तुलना में। परिणामस्वरूप एम-एच दूरियों को | धातु हाइड्राइड की संरचनाओं का निर्धारण चुनौतीपूर्ण हो सकता है क्योंकि हाइड्राइड लिगेंड्स एक्स-रे को अच्छी तरह से नहीं बिखेरते हैं, विशेष रूप से संलग्न धातु की तुलना में। परिणामस्वरूप एम-एच दूरियों को साधारणतयः कम करके आंका जाता है, खासकर शुरुआती अध्ययनों में। साधारणतयः एक स्पष्ट समन्वय स्थल पर एक लिगैंड की अनुपस्थिति से एक हाइड्राइड लिगैंड की उपस्थिति का अनुमान लगाया गया था। पारस्परिक रूप से, धातु हाइड्राइड की संरचनाओं को न्यूट्रॉन विवर्तन द्वारा संबोधित किया गया था क्योंकि हाइड्रोजन न्यूट्रॉन को दृढ़ता से बिखेरता है।<ref>{{cite journal|author1=Bau, R. |author2=Drabnis, M. H.|title=न्यूट्रॉन विवर्तन द्वारा निर्धारित संक्रमण धातु हाइड्राइड की संरचनाएं|journal=Inorganica Chimica Acta|year=1997|volume=259|issue=1–2|pages=27–50|doi=10.1016/S0020-1693(97)89125-6}}</ref> | ||
टर्मिनल हाइड्राइड वाले धातु परिसर | टर्मिनल हाइड्राइड वाले धातु परिसर साधारण हैं। द्वि- और बहु-नाभिकीय यौगिकों में, हाइड्राइड साधारणतयः [[ ब्रिजिंग लिगैंड |ब्रिजिंग लिगैंड]] होते हैं। इन ब्रिजिंग हाइड्राइड्स में से कई ऑलिगोमेरिक हैं, जैसे स्ट्राइकर का अभिकर्मक।<ref>{{Cite journal | ||
| doi = 10.1016/S0040-4039(02)02609-6 | | doi = 10.1016/S0040-4039(02)02609-6 | ||
| volume = 44 | | volume = 44 | ||
| Line 180: | Line 180: | ||
:डायहाइड्रोजन परिसर: M—H<sub>2</sub> | :डायहाइड्रोजन परिसर: M—H<sub>2</sub> | ||
== स्पेक्ट्रोस्कोपी == | == स्पेक्ट्रोस्कोपी == | ||
देर से संक्रमण धातु हाइड्राइड अपने [[ प्रोटॉन एनएमआर |प्रोटॉन एनएमआर]] स्पेक्ट्रा में विशेष रूप से अप-फील्ड परिवर्तन दिखाते हैं। एम-एच सिग्नल के लिए δ-5 और -25 के बीच इस सीमा के बाहर कई उदाहरणों के साथ प्रकट होना साधारण बात है लेकिन साधारणतयः सभी 0 पीपीएम से नीचे दिखाई देते हैं। बड़े परिवर्तन उत्तेजित अवस्थाओं के प्रभाव से और मजबूत स्पिन-ऑर्बिट युग्मन<ref>{{Cite journal | journal = Journal of Physical Chemistry A | year = 2011 | volume = 115 | issue = 22 | pages = 5654–5659 | last = Hrobarik | first = P. |author2=Hrobarikova, V. |author3=Meier, F. |author4=Repisky, M. |author5=Komorovsky, S. |author6= Kaupp, M. | title = ट्रांजिशन-मेटल हाइड्राइड कॉम्प्लेक्स में 1H NMR केमिकल शिफ्ट्स की रिलेटिविस्टिक फोर-कंपोनेंट DFT कैलकुलेशन: बकिंघम-स्टीफंस मॉडल से परे असामान्य हाई-फील्ड शिफ्ट्स| doi = 10.1021/jp202327z| pmid = 21591659 |bibcode=2011JPCA..115.5654H }}</ref> के कारण उत्पन्न होते हैं (इसके विपरीत, कार्बनिक यौगिकों के लिए <sup>1</sup>H NMR परिवर्तन साधारणतयः 12-1 की सीमा में होते हैं)। एक सीमा पर -50.5 की शिफ्ट के साथ 16e परिसर IrHCl<sub>2</sub>(PMe(''t''-Bu)<sub>2</sub>)<sub>2</sub> है। संकेत साधारणतयः अन्य लिगैंड्स, जैसे फॉस्फीन को [[ स्पिन-स्पिन युग्मन |स्पिन-स्पिन युग्मन]] प्रदर्शित करते हैं।<ref>J. W. Akitt in "Multinuclear NMR" Joan Mason (Editor), 1987, Plenum Press. {{ISBN|0-306-42153-4}}</ref> | |||
धातु हाइड्राइड 2000 | |||
धातु हाइड्राइड M-H के लिए 2000 cm<sup>−1</sup> के निकट IR बैंड ν<sub>M-H</sub> प्रदर्शित करते हैं, चूंकि तीव्रता परिवर्तनशील होती है।<ref name="Kaesz" /> इन संकेतों को ड्यूटेरियम लेबलिंग द्वारा पहचाना जा सकता है। | |||
==इतिहास== | ==इतिहास== | ||
1844 में [[ हाइपोफॉस्फोरस अम्ल ]] के साथ तांबे के लवण के उपचार के परिणामस्वरूप एक गैर-परिभाषित कॉपर हाइड्राइड का वर्णन किया गया था। बाद में यह पाया गया कि | 1844 में [[ हाइपोफॉस्फोरस अम्ल |हाइपोफॉस्फोरस अम्ल]] के साथ तांबे के लवण के उपचार के परिणामस्वरूप एक गैर-परिभाषित कॉपर हाइड्राइड का वर्णन किया गया था। बाद में यह पाया गया कि संक्रमण धातु लवण और ग्रिग्नार्ड अभिकर्मकों के मिश्रण द्वारा हाइड्रोजन गैस को अवशोषित किया गया था।<ref name="Chatt">{{cite journal|title=हाइड्राइड कॉम्प्लेक्स|author=[[Joseph Chatt]]|journal=Science|year=1968|volume=160|issue=3829|pages=723–729|doi=10.1126/science.160.3829.723|pmid=17784306|bibcode=1968Sci...160..723C|s2cid=22350909}}</ref> | ||
पहला अच्छी तरह से परिभाषित धातु हाइड्रिडो परिसर | |||
पहला अच्छी तरह से परिभाषित धातु हाइड्रिडो परिसर H<sub>2</sub>Fe(CO)<sub>4</sub> था, जो लोहे के कार्बोनिल आयन के निम्न तापमान प्रोटॉन द्वारा प्राप्त किया गया था। अगला रिपोर्ट किया गया हाइड्राइड परिसर (C<sub>5</sub>H<sub>5</sub>)<sub>2</sub>ReH था। बाद के परिसर को [[ एनएमआर स्पेक्ट्रोस्कोपी |एनएमआर स्पेक्ट्रोस्कोपी]] द्वारा विशेषता थी, जिसने धातु हाइड्राइड परिसरों के अध्ययन में इस तकनीक की उपयोगिता को प्रदर्शित किया।<ref name="Chatt" /> 1957 में, जोसेफ चैट, बर्नार्ड एल. शॉ और एल.ए. डंकनसन ने ट्रांस-पीटीएचसीएल PtHCl(PEt<sub>3</sub>)<sub>2</sub> को पहला गैर-ऑर्गेनोमेटेलिक हाइड्राइड (यानी, धातु-कार्बन बंधन की कमी) का वर्णन किया। लंबे समय से चली आ रही इस पूर्वाग्रह को दूर करते हुए कि धातु हाइड्राइड अस्थिर होंगे, इसे हवा में स्थिर दिखाया गया हैं।<ref>{{cite journal|authors=J. Chatt, L. A. Duncanson, B. L. Shaw|title=प्लेटिनम का एक वाष्पशील क्लोरोहाइड्राइड|journal=Proc. Chem. Soc.|year=1957|pages=329–368|doi=10.1039/PS9570000329}}</ref> | |||
== संदर्भ == | == संदर्भ == | ||
Revision as of 12:38, 11 November 2022
संक्रमण धातु हाइड्राइड रासायनिक यौगिक होते हैं जिनमें हाइड्रोजन से जुड़ा हुआ संक्रमण धातु होता है। अधिकांशतः संक्रमण धातुएं हाइड्राइड के परिसर से बनती हैं और कुछ विभिन्न उत्प्रेरण और सिंथेटिक प्रतिक्रियाओं में महत्वपूर्ण हैं। हाइड्राइड शब्द का प्रयोग शिथिल रूप से किया जाता है: उनमें से कुछ अम्लीय होते हैं (जैसे, आयरन टेट्राकार्बोनिल हाइड्राइड e.g., H2Fe(CO)4), जबकि कुछ अन्य हाइड्रिडिक होते हैं, जिनमें H− होता है-समान वर्ण (उदा., ZnH2).
धातु हाइड्राइड के वर्ग
बाइनरी मेटल हाइड्राइड
कई संक्रमण धातुएं हाइड्रोजन के साथ यौगिक बनाती हैं, जिन्हें बाइनरी हाइड्राइड कहा जाता है: बाइनरी क्योंकि इन यौगिकों में केवल दो तत्व होते हैं, और हाइड्राइड, क्योंकि हाइड्रोजनिक लिगैंड को हाइड्रिडिक (H-- जैसा) अक्षर माना जाता है। ये यौगिक सभी विलायक में हमेशा अघुलनशील होते हैं, जो उनकी बहुलक संरचनाओं को दर्शाते हैं। ये साधारणतयः धातु जैसी विद्युत चालकता प्रदर्शित करते हैं। इनमें कई अरससमीकरणमितीय (नॉनस्टोइकोमेट्रिक) यौगिक हैं। विद्युत धनात्मकता धातु ( टाइटेनियम (Ti), Zr, Hf, जस्ता (Zn)) और कुछ अन्य धातुएँ रससमीकरणमिति (स्टोइकोमेट्री) MH या कभी-कभी MH2 (M = Ti, Zr, Hf, V, Zn) के साथ हाइड्राइड बनाती हैं। सबसे अच्छा अध्ययन पैलेडियम के द्विआधारी हाइड्राइड हैं, जो साधारणतयः एक सीमित मोनोहाइड्राइड बनाता है। वास्तव में, हाइड्रोजन गैस पीडी विंडो के माध्यम से पीडीएच की मध्यस्थता के माध्यम से फैलती है।[1]
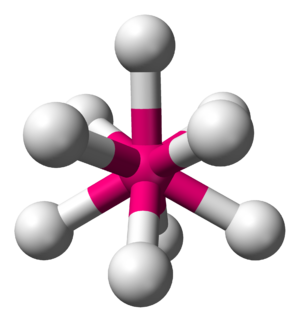
टर्नरी धातु हाइड्राइड
टर्नरी मेटल हाइड्राइड्स का सूत्र AxMHn होता है, जहाँ A+ एक क्षार या क्षारीय पृथ्वी धातु धनायन है, उदाहरण के लिए K+ और Mg2+। एक प्रसिद्ध उदाहरण K2ReH9 है, एक नमक जिसमें दो K+ आयन और ReH92− आयन होते हैं। अन्य होमोलेप्टिक धातु हाइड्राइड में Mg2FeH6 और Mg2NiH4 में आयन सम्मलित हैं। इनमें से कुछ आयनिक पॉलीहाइड्राइड 18-इलेक्ट्रॉन नियम को संतुष्ट करते हैं, कई नहीं। उनकी उच्च जाली ऊर्जा के कारण, ये लवण साधारणतयः किसी भी विलायक में घुलनशील नहीं होते हैं, एक प्रसिद्ध अपवाद K2ReH9 है।[3]
समन्वय परिसरों
संक्रमण धातुओं के सबसे प्रचलित हाइड्राइड धातु परिसर हैं जिसमें हाइड्राइड के अलावा अन्य लिगेंड का मिश्रण होता है। कोलिगैंड्स की रेंज बड़ी है। लगभग सभी धातुएं ऐसे व्युत्पन्न बनाती हैं। मुख्य अपवादों में देर से धातुएं चांदी, सोना, कैडमियम हाइड्राइड और पारा हाइड्राइड सम्मलित हैं, जो प्रत्यक्ष एम-एच बंध के साथ कुछ या अस्थिर परिसरों का निर्माण करते हैं। औद्योगिक रूप से उपयोगी हाइड्राइड के उदाहरण हैं HCo(CO)4 and HRh(CO)(PPh3)3, जो हाइड्रोफॉर्माइलेशन के लिए उत्प्रेरक हैं।
- संक्रमण धातुओं के पहले आणविक हाइड्राइड की सूचना पहली बार 1930 के दशक में वाल्टर हाइबर और सहकर्मियों द्वारा दी गई थी। उन्होंने H2Fe(CO)4 और HCo(CO)4 का वर्णन किया, कई वर्षों के अंतराल के बाद हाइड्रोफॉर्माइलेशन में एचसीओ (सीओ) 4 की नियत भूमिका पर जर्मन युद्ध दस्तावेजों की मुक्ति के बाद, 1950 के दशक के मध्य में ऑर्गोमेटेलिक रसायन शास्त्र में तीन प्रमुख समूहों द्वारा कई नए हाइड्राइड्स की सूचना दी गई: HRe(C5H5)2 जेफ्री विल्किंसन, HMo(C5H5)(CO)3 by E. O. Fischer, and HPtCl(PEt3)2 by जोसेफ चट्टो [4]। ऐसे हजारों यौगिक अब ज्ञात हैं।
क्लस्टर हाइड्राइड
हाइड्रिडो समन्वय परिसरों की तरह, कई समूहों में टर्मिनल (एक एम-एच बंधन से बंधे) हाइड्राइड लिगैंड होते हैं। हाइड्राइड लिगेंड्स धातुओं के जोड़े को भी समतल कर सकते हैं, जैसा कि [HW2(CO)10]- द्वारा दर्शाया गया है। क्लस्टर H2Os3(CO)10 में टर्मिनल और डबल ब्रिजिंग हाइड्राइड लिगैंड दोनों हैं। हाइड्राइड्स [Ag3{(PPh2)2CH2}3(μ3-H)(μ3-Cl)]BF4 के रूप में क्लस्टर के त्रिकोणीय फलक को भी फैला सकते हैं।[5] क्लस्टर [Co6H(CO)15]- में, हाइड्राइड "इंटरस्टिशियल" है, जो Co6 ऑक्टाहेड्रोन के केंद्र में स्थित है। क्लस्टर हाइड्राइड्स के लिए यह कार्य चुनौतीपूर्ण हो सकता है जैसा कि स्ट्राइकर के अभिकर्मक [Cu6(PPh3)6H6] पर अध्ययन द्वारा दिखाया गया है।[6]
संश्लेषण
हाइड्राइड स्थानांतरण
न्यूक्लियोफिलिक मुख्य समूह हाइड्राइड कई संक्रमण धातु हैलाइडों और धनायनों को संबंधित हाइड्राइड में परिवर्तित करते हैं:
- MLnX + LiBHEt3 → HMLn + BEt3 + LiX
ये रूपांतरण मेटाथिसिस प्रतिक्रियाएं हैं, और उत्पाद की हाइड्रिकता साधारणतयः हाइड्राइड दाता की तुलना में कम होती है। पारस्परिक (और अपेक्षाकृत सस्ते) हाइड्राइड दाता अभिकर्मकों में सोडियम बोरोहाइड्राइड और लिथियम एल्यूमीनियम हाइड्राइड सम्मलित हैं। प्रयोगशाला में, लिथियम ट्राइथाइलबोरोहाइड्राइड और रेड-अल जैसे "मिश्रित हाइड्राइड्स" द्वारा साधारणतयः अधिक नियंत्रण का प्रस्ताव किया जाती है। क्षार धातु हाइड्राइड जैसे सोडियम हाइड्राइड, साधारणतयः उपयोगी अभिकर्मक नहीं होते हैं।
उन्मूलन प्रतिक्रियाएं
बीटा-हाइड्राइड उन्मूलन और अल्फा-हाइड्राइड उन्मूलन ऐसी प्रक्रियाएं हैं जो हाइड्राइड्स को वहन करती हैं। सजातीय पोलीमराइजेशन में पूर्व एक सामान्य समाप्ति मार्ग पर यह कुछ संक्रमण धातु हाइड्राइड परिसरों को ऑर्गेनोलिथियम और ग्रिग्नार्ड अभिकर्मक से संश्लेषित करने की भी अनुमति देता है:
MLnX + LiC4H9 → C4H9MLn + LiX
C4H9MLn → HMLn + H2C=CHC2H5
ऑक्सीडेटिव परिवर्धन
निम्न संयोजकता संक्रमण धातु केंद्र में डाइहाइड्रोजन का ऑक्सीडेटिव योग हाइड्रोजनीकरण का सामान्य स्वरूप है। एक उत्कृष्ट उदाहरण में वास्का का परिसर सम्मलित है:[7]
IrICl(CO)(PPh3)2 + H2 ⇌ H2IrIIICl(CO)(PPh3)2
ऑक्सीडेटिव जोड़ भी डिमेटेलिक परिसर में हो सकता है, जैसे
- Co2(CO)8 + H2 ⇌ 2 HCo(CO)4
कई एसिड ऑक्सीडेटिव परिवर्धन में भाग लेते हैं, जैसा कि वास्का के परिसर में एचसीएल के अतिरिक्त द्वारा दिखाया गया है:
- IrICl(CO)(PPh3)2 + HCl → HIrIIICl2(CO)(PPh3)2
डायहाइड्रोजन का हेटेरोलाइटिक क्लेवाज
कुछ धातु हाइड्राइड तब बनते हैं जब एक धातु परिसर को आधार की उपस्थिति में हाइड्रोजन के साथ व्यवहार किया जाता है। प्रतिक्रिया में धातु की ऑक्सीकरण अवस्था में कोई परिवर्तन नहीं होता है और इसे H2 को हाइड्राइड में विभाजित करने के रूप में देखा जा सकता है जो धातु को बांधता है और प्रोटॉन जो आधार से बंधता है।
- MLnx+ + base + H2 ⇌ HMLn(x-1)+ + Hbase+
इस तरह की प्रतिक्रिया को डायहाइड्रोजन परिसरों की मध्यस्थता को सम्मलित करने के लिए माना जाता है। द्वि-कार्यात्मक उत्प्रेरक इस प्रकार H2 को सक्रिय करते हैं।
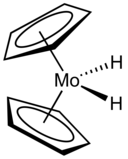
थर्मोडायनामिक विचार
| धातु हाइड्राइड परिसर | बीडीई (बीडीई) (केजे/मोल) | pKa |
|---|---|---|
| H-CpCr(CO)3 | 257 | 13.3 |
| H-CpMo(CO)3 | 290 | 13.9 |
| H-CpW(CO)3 | 303 | 16.1 |
| H-Mn(CO)5 | 285 | 14.1 |
| H-Re(CO)5 | 313 | 21.1 |
| H-FeH(CO)4 | 283 | 11.4 |
| H-CpFe(CO)2 | 239 | 19.4 |
| H-CpRu(CO)2 | 272 | 20.2 |
| H-Co(CO)4 | 278 | 8.3 |
फॉस्फीन लिगैंड द्वारा CO के प्रतिस्थापन पर मान <6 kJ/mol से बदल जाते हैं।
एम-एच बंध सैद्धांतिक रूप से एक प्रोटॉन, हाइड्रोजन रेडिकल या हाइड्राइड का उत्पादन करने के लिए तैयार हो सकता है।[9]
- HMLn ⇌ MLn− + H+
- HMLn ⇌ MLn + H
- HMLn ⇌ MLn+ + H−
चूंकि ये गुण परस्पर जुड़े हुए हैं, वे अन्योन्याश्रित नहीं हैं। एक धातु हाइड्राइड ऊष्मागतिकी के रूप से एक कमजोर एसिड और एक कमजोर एच-दाता हो सकता है; यह एक श्रेणी में मजबूत भी हो सकता है लेकिन दूसरे में नहीं या दोनों में मजबूत, एक हाइड्राइड की H− शक्ति को इसकी हाइड्राइड दाता क्षमता या हाइड्रिकिटी के रूप में भी जाना जाता है, हाइड्राइड की लुईस आधार शक्ति से मेल खाती है। सभी हाइड्राइड शक्तिशाली लुईस क्षार नहीं होते हैं। हाइड्राइड की आधार शक्ति प्रोटॉन के pKa के बराबर भिन्न होती है। इस हाइड्रिसिटी को धातु के परिसर और एक ज्ञात पीकेए के साथ आधार के बीच हेटेरोलाइटिक क्लीजिंग हाइड्रोजन द्वारा मापा जा सकता है, फिर परिणामी संतुलन को मापता है। यह मानता है कि हाइड्राइड हाइड्रोजन को सुधारने के लिए हेटेरोलाइटिक या समरूप रूप से स्वयं के साथ प्रतिक्रिया नहीं करता है। यदि होमोलिटिक एम-एच बॉन्ड होमोलिटिक M-H बॉन्ड के आधे से भी कम मूल्य का है, तो एक परिसर स्वयं के साथ प्रतिक्रिया करेगा। भले ही होमोलिटिक बंध की शक्ति उस सीमा से ऊपर हो, फिर भी मौलिक परिसर प्रतिक्रिया के लिए अतिसंवेदनशील होता है।
- 2 HMLnz ⇌ 2 MLnz + H2
जब एक साथ एक मजबूत एसिड और एक मजबूत हाइड्राइड होता है तो एक जटिल खुद के साथ विषम रूप से प्रतिक्रिया करेगा। इस रूपांतरण के परिणामस्वरूप दो इलेक्ट्रॉनों द्वारा भिन्न ऑक्सीकरण स्थिति के साथ परिसरों की एक जोड़ी का उत्पादन होता है। आगे विद्युत रासायनिक प्रतिक्रियाएं संभव हैं।
- 2HMLnz ⇌ MLnz+1 + MLnz-1 + H2
जैसा कि उल्लेख किया गया है कि कुछ परिसर एक आधार की उपस्थिति में डायहाइड्रोजन को विषम रूप से विभाजित करते हैं। इन परिसरों के एक हिस्से के परिणामस्वरूप हाइड्राइड परिसरों में इतना अम्लीय होता है कि आधार द्वारा दूसरी बार अवक्षेपित किया जा सकता है। इस स्थिति में प्रारंभिक परिसर को हाइड्रोजन और आधार के साथ दो इलेक्ट्रॉनों द्वारा कम किया जा सकता है। भले ही हाइड्राइड इतना अम्लीय न हो कि उसे अवक्षेपित किया जा सके जैसा कि ऊपर चर्चा की गई है, यह समग्र रूप से एक इलेक्ट्रॉन अपचयन के लिए स्वयं के साथ समरूप रूप से प्रतिक्रिया कर सकता है।
- दो अवक्षेपण: MLnz + H2 + 2Base ⇌ MLnz-2 + 2H+ क्षार
- होमोलिसिस के बाद अवक्षेपण: 2MLnz + H2 + 2base ⇌ 2MLnz-1 + 2H+ क्षार
संकरता (हाइड्रिसिटी)
लुईस एसिड के लिए हाइड्राइड लिगैंड के लिए आत्मीयता को इसकी संकरता (हाइड्रिसिटी) कहा जाता है:
- MLnHn− ⇌ MLn(n+1)− + H−
चूँकि हाइड्राइड विलयन में स्थायी ऋणायन के रूप में सम्मलित नहीं होता है, इस संतुलन स्थिरांक (और इससे जुड़ी मुक्त ऊर्जा) की गणना मापने योग्य संतुलन से की जाती है। संदर्भ बिंदु एक प्रोटॉन की हाइड्रिसिटी है, जो एसीटोनिट्राइल घोल में −76 kcal mol−1 पर परिकलित किया जाता है:[10]
- H+ + H− ⇌ H2 ΔG298 = −76 kcal mol−1
एक प्रोटॉन के सापेक्ष, अधिकांश धनायन H− के लिए कम आत्मीयता प्रदर्शित करते हैं। कुछ उदाहरणों में सम्मलित हैं:
- [Ni(dppe)2]2+ + H− ⇌ [HNi(dppe)2]+ ΔG298 = −63 kcal mol−1
- [Ni(dmpe)2]2+ + H− ⇌ [HNi(dmpe)2]+ ΔG298 = −50.7 kcal mol−1
- [Pt(dppe)2]2+ + H− ⇌ [HPt(dppe)2]+ ΔG298 = −53 kcal mol−1
- [Pt(dmpe)2]2+ + H− ⇌ [HPt(dmpe)2]+ ΔG298 = −42.6 kcal mol−1
- ये आंकड़े बताते हैं कि [HPt(dmpe)2]+ एक मजबूत हाइड्राइड डोनर होगा, जो [Pt(dmpe)2]2+ की अपेक्षाकृत उच्च स्थिरता को दर्शाता है।[11]
गतिकी और तंत्र
धातु परिसरों में और उनके बीच प्रोटॉन-स्थानांतरण की दर साधारणतयः धीमी होती है।[12] बोर्डवेल थर्मोडायनामिक चक्र के माध्यम से कई हाइड्राइड अध्ययन के लिए दुर्गम हैं। नतीजतन, दोनों प्रासंगिक थर्मोडायनामिक मापदंडों को स्पष्ट करने के लिए रासायनिक गतिकी अध्ययन कार्यरत हैं। साधारणतयः पहली पंक्ति संक्रमण धातुओं से प्राप्त हाइड्राइड सबसे तेज़ गतिज को प्रदर्शित करते हैं जिसके बाद दूसरी और तीसरी पंक्ति धातु परिसर होते हैं।
संरचना और संबंध
धातु हाइड्राइड की संरचनाओं का निर्धारण चुनौतीपूर्ण हो सकता है क्योंकि हाइड्राइड लिगेंड्स एक्स-रे को अच्छी तरह से नहीं बिखेरते हैं, विशेष रूप से संलग्न धातु की तुलना में। परिणामस्वरूप एम-एच दूरियों को साधारणतयः कम करके आंका जाता है, खासकर शुरुआती अध्ययनों में। साधारणतयः एक स्पष्ट समन्वय स्थल पर एक लिगैंड की अनुपस्थिति से एक हाइड्राइड लिगैंड की उपस्थिति का अनुमान लगाया गया था। पारस्परिक रूप से, धातु हाइड्राइड की संरचनाओं को न्यूट्रॉन विवर्तन द्वारा संबोधित किया गया था क्योंकि हाइड्रोजन न्यूट्रॉन को दृढ़ता से बिखेरता है।[13]
टर्मिनल हाइड्राइड वाले धातु परिसर साधारण हैं। द्वि- और बहु-नाभिकीय यौगिकों में, हाइड्राइड साधारणतयः ब्रिजिंग लिगैंड होते हैं। इन ब्रिजिंग हाइड्राइड्स में से कई ऑलिगोमेरिक हैं, जैसे स्ट्राइकर का अभिकर्मक।[14] [(Ph3P)CuH]6 और क्लस्टर जैसे [Rh6(PR3)6H12]2+।[15] अंतिम बॉन्डिंग मोटिफ गैर-पारस्परिक डायहाइड्राइड है जिसे सिग्मा बॉन्ड डाइहाइड्रोजन एडिक्ट्स या बस डायहाइड्रोजन परिसर के रूप में भी जाना जाता है। [W(PR3)2(CO)3(H2)] परिसर सामान्य रूप से एक गैर-पारस्परिक डाइहाइड्राइड और सिग्मा-बंध परिसर दोनों का पहला विशिष्ट उदाहरण था।[16][17] क्रिस्टल संरचनाओं में हाइड्राइड का पता लगाने के लिए एक्स-रे विवर्तन साधारणतयः अपर्याप्त होता है और इस प्रकार उनके स्थान को माना जाना चाहिए। क्रिस्टलोग्राफिक रूप से भारी परमाणु के पास एक हाइड्राइड का स्पष्ट रूप से पता लगाने के लिए न्यूट्रॉन विवर्तन की आवश्यकता होती है। गैर-पारस्परिक हाइड्राइड का भी विभिन्न प्रकार के परिवर्तनीय तापमान एनएमआर तकनीकों और एचडी युग्मन के साथ अध्ययन किया गया है।
- पारस्परिक टर्मिनल: M—H
- ब्रिजिंग लिगैंड: M—H—M
- डायहाइड्रोजन परिसर: M—H2
स्पेक्ट्रोस्कोपी
देर से संक्रमण धातु हाइड्राइड अपने प्रोटॉन एनएमआर स्पेक्ट्रा में विशेष रूप से अप-फील्ड परिवर्तन दिखाते हैं। एम-एच सिग्नल के लिए δ-5 और -25 के बीच इस सीमा के बाहर कई उदाहरणों के साथ प्रकट होना साधारण बात है लेकिन साधारणतयः सभी 0 पीपीएम से नीचे दिखाई देते हैं। बड़े परिवर्तन उत्तेजित अवस्थाओं के प्रभाव से और मजबूत स्पिन-ऑर्बिट युग्मन[18] के कारण उत्पन्न होते हैं (इसके विपरीत, कार्बनिक यौगिकों के लिए 1H NMR परिवर्तन साधारणतयः 12-1 की सीमा में होते हैं)। एक सीमा पर -50.5 की शिफ्ट के साथ 16e परिसर IrHCl2(PMe(t-Bu)2)2 है। संकेत साधारणतयः अन्य लिगैंड्स, जैसे फॉस्फीन को स्पिन-स्पिन युग्मन प्रदर्शित करते हैं।[19]
धातु हाइड्राइड M-H के लिए 2000 cm−1 के निकट IR बैंड νM-H प्रदर्शित करते हैं, चूंकि तीव्रता परिवर्तनशील होती है।[4] इन संकेतों को ड्यूटेरियम लेबलिंग द्वारा पहचाना जा सकता है।
इतिहास
1844 में हाइपोफॉस्फोरस अम्ल के साथ तांबे के लवण के उपचार के परिणामस्वरूप एक गैर-परिभाषित कॉपर हाइड्राइड का वर्णन किया गया था। बाद में यह पाया गया कि संक्रमण धातु लवण और ग्रिग्नार्ड अभिकर्मकों के मिश्रण द्वारा हाइड्रोजन गैस को अवशोषित किया गया था।[20]
पहला अच्छी तरह से परिभाषित धातु हाइड्रिडो परिसर H2Fe(CO)4 था, जो लोहे के कार्बोनिल आयन के निम्न तापमान प्रोटॉन द्वारा प्राप्त किया गया था। अगला रिपोर्ट किया गया हाइड्राइड परिसर (C5H5)2ReH था। बाद के परिसर को एनएमआर स्पेक्ट्रोस्कोपी द्वारा विशेषता थी, जिसने धातु हाइड्राइड परिसरों के अध्ययन में इस तकनीक की उपयोगिता को प्रदर्शित किया।[20] 1957 में, जोसेफ चैट, बर्नार्ड एल. शॉ और एल.ए. डंकनसन ने ट्रांस-पीटीएचसीएल PtHCl(PEt3)2 को पहला गैर-ऑर्गेनोमेटेलिक हाइड्राइड (यानी, धातु-कार्बन बंधन की कमी) का वर्णन किया। लंबे समय से चली आ रही इस पूर्वाग्रह को दूर करते हुए कि धातु हाइड्राइड अस्थिर होंगे, इसे हवा में स्थिर दिखाया गया हैं।[21]
संदर्भ
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Abrahams, S. C.; Ginsberg, A. P.; Knox, K. (1964). "संक्रमण धातु-हाइड्रोजन यौगिक। द्वितीय. पोटेशियम रेनियम हाइड्राइड की क्रिस्टल और आणविक संरचना, K2ReH9". Inorg. Chem. 3 (4): 558–567. doi:10.1021/ic50014a026.
- ↑ King, R.B. (2000). "होमोलेप्टिक संक्रमण धातु हाइड्राइड आयनों में संरचना और बंधन". Coordination Chemistry Reviews. 200–202: 813–829. doi:10.1016/S0010-8545(00)00263-0.
- ↑ 4.0 4.1 Kaesz, H. D.; R. B. Saillant (1972-06-01). "संक्रमण धातुओं के हाइड्राइड परिसरों". Chemical Reviews. 72 (3): 231–281. doi:10.1021/cr60277a003.
- ↑ Zavras, Athanasios; Khairallah, George N.; Connell, Timothy U.; White, Jonathan M.; Edwards, Alison J.; Donnelly, Paul S.; O'Hair, Richard A. J. (2013-08-05). "सिल्वर हाइड्राइड कॉम्प्लेक्स का संश्लेषण, संरचना और गैस-चरण प्रतिक्रियाशीलता [Ag3{(PPh2)2CH2}3(μ3-H)(μ3-Cl)]BF4". Angewandte Chemie (in English). 125 (32): 8549–8552. doi:10.1002/ange.201302436. ISSN 1521-3757.
- ↑ Bennett, Elliot L.; Murphy, Patrick J.; Imberti, Silvia; Parker, Stewart F. (2014-03-17). "स्ट्राइकर के अभिकर्मक में हाइड्राइड्स की विशेषता: [HCu{P(C6H5)3}]6". Inorganic Chemistry. 53 (6): 2963–2967. doi:10.1021/ic402736t. ISSN 0020-1669. PMID 24571368.
- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ↑ Tilset, M. (2007). "Organometallic Electrochemistry: Thermodynamics of Metal–Ligand Bonding". Comprehensive Organometallic Chemistry III. pp. 279–305. doi:10.1016/B0-08-045047-4/00012-1. ISBN 9780080450476.
- ↑ Rakowski DuBois, M.; DuBois, D. L. (2009). "H2 उत्पादन और ऑक्सीकरण के लिए आण्विक उत्प्रेरक के डिजाइन में पहले और दूसरे समन्वय क्षेत्रों की भूमिकाएं". Chem. Soc. Rev. 38 (1): 62–72. doi:10.1039/b801197b. PMID 19088965.
- ↑ Wayner, Danial D. M.; Parker, Vernon D. (1993). "इलेक्ट्रोड क्षमता और थर्मोकेमिकल चक्र से समाधान में बांड ऊर्जा। एक सरलीकृत और सामान्य दृष्टिकोण". Accounts of Chemical Research. 26 (5): 287–294. doi:10.1021/ar00029a010.
- ↑ M Tilset "Organometallic Electrochemistry: Thermodynamics of Metal–Ligand Bonding" in Comprehensive Organometallic Chemistry III, Eds Crabtree, R. H.; Mingos, D. M. P. 2007 Elsevier. ISBN 9780080445915
- ↑ K. W. Kramarz, J. R. Norton (2007). "Slow Proton-Transfer Reactions in Organometallic and Bioinorganic Chemistry". In Kenneth D. Karlin (ed.). अकार्बनिक रसायन विज्ञान में प्रगति. Vol. 42. Wiley. pp. 1–65. ISBN 978-0-470-16643-7.[permanent dead link]
- ↑ Bau, R.; Drabnis, M. H. (1997). "न्यूट्रॉन विवर्तन द्वारा निर्धारित संक्रमण धातु हाइड्राइड की संरचनाएं". Inorganica Chimica Acta. 259 (1–2): 27–50. doi:10.1016/S0020-1693(97)89125-6.
- ↑ Chiu, Pauline; Zhengning Li; Kelvin C.M. Fung (January 2003). "स्ट्राइकर के अभिकर्मक की एक समीचीन तैयारी". Tetrahedron Letters. 44 (3): 455–457. doi:10.1016/S0040-4039(02)02609-6. Retrieved 2009-04-17.
- ↑ Brayshaw, S.; Harrison, A.; McIndoe, J.; Marken, F.; Raithby, P.; Warren, J.; Weller, A. (2007). "हाई हाइड्राइड काउंट ऑक्टाहेड्रल रोडियम क्लस्टर्स की क्रमिक कमी [Rh6(PR3)6H12][BAr F4]2: Redox-Switchable Hydrogen Storage". J. Am. Chem. Soc. 129 (6): 1793–1804. doi:10.1021/ja066940m. PMID 17284009.
- ↑ Kubas, G. J.; R. R. Ryan; B. I. Swanson; P. J. Vergamini; H. J. Wasserman (1984-01-01). "पृथक आणविक हाइड्रोजन परिसरों के पहले उदाहरणों की विशेषता, एम (सीओ) 3 (पीआर 3) 2 (एच 2) (एम = मोलिब्डेनम या टंगस्टन; आर = साइ या आइसोप्रोपिल)। साइड-ऑन बंधुआ डाइहाइड्रोजन लिगैंड के लिए साक्ष्य". Journal of the American Chemical Society. 106 (2): 451–452. doi:10.1021/ja00314a049.
- ↑ Kubas, Gregory J. (2001-08-31). मेटल डाइहाइड्रोजन और -बॉन्ड कॉम्प्लेक्स - संरचना, सिद्धांत और प्रतिक्रियाशीलता (1 ed.). Springer. ISBN 978-0-306-46465-2.
- ↑ Hrobarik, P.; Hrobarikova, V.; Meier, F.; Repisky, M.; Komorovsky, S.; Kaupp, M. (2011). "ट्रांजिशन-मेटल हाइड्राइड कॉम्प्लेक्स में 1H NMR केमिकल शिफ्ट्स की रिलेटिविस्टिक फोर-कंपोनेंट DFT कैलकुलेशन: बकिंघम-स्टीफंस मॉडल से परे असामान्य हाई-फील्ड शिफ्ट्स". Journal of Physical Chemistry A. 115 (22): 5654–5659. Bibcode:2011JPCA..115.5654H. doi:10.1021/jp202327z. PMID 21591659.
- ↑ J. W. Akitt in "Multinuclear NMR" Joan Mason (Editor), 1987, Plenum Press. ISBN 0-306-42153-4
- ↑ 20.0 20.1 Joseph Chatt (1968). "हाइड्राइड कॉम्प्लेक्स". Science. 160 (3829): 723–729. Bibcode:1968Sci...160..723C. doi:10.1126/science.160.3829.723. PMID 17784306. S2CID 22350909.
- ↑ J. Chatt, L. A. Duncanson, B. L. Shaw (1957). "प्लेटिनम का एक वाष्पशील क्लोरोहाइड्राइड". Proc. Chem. Soc.: 329–368. doi:10.1039/PS9570000329.
{{cite journal}}: CS1 maint: uses authors parameter (link)
