टेंडेम मास स्पेक्ट्रोमेट्री: Difference between revisions
No edit summary |
No edit summary |
||
| (15 intermediate revisions by 6 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Type of mass spectrometry}} | {{Short description|Type of mass spectrometry}} | ||
{{Use dmy dates|date=March 2020}} | {{Use dmy dates|date=March 2020}} | ||
'''टेंडेम मास स्पेक्ट्रोमेट्री''', जिसे '''MS/MS''' या <math>MS^2</math> के रूप में भी जाना जाता है, [[वाद्य विश्लेषण]] में एक तकनीक है जहां दो या दो से अधिक [[मास स्पेक्ट्रोमेट्री]] को रासायनिक उदाहरण का विश्लेषण करने की उनकी क्षमताओं को बढ़ाने के लिए अतिरिक्त प्रतिक्रिया चरण का उपयोग करके एक साथ जोड़ा जाता है।<ref>{{GoldBookRef|title=tandem mass spectrometer|file=T06250}}</ref> टेंडेम MS का सामान्य उपयोग [[प्रोटीन]] और [[पेप्टाइड|पेप्टाइड्स]] जैसे जैव [[अणु]]ओं का विश्लेषण है। | |||
किसी दिए गए उदाहरण के अणु [[Index.php?title=आयनित|ईओणित]] होते हैं और पहला स्पेक्ट्रोमीटर (निर्दिष्ट MS1) इन [[आयनों|ईओणों]] को उनके मास-से-आवेश अनुपात (प्रायः m/z या m/Q के रूप में दिया जाता है) द्वारा अलग करता है। MS1 से आने वाले एक विशेष m/z-अनुपात के ईओणों का चयन किया जाता है और फिर उन्हें छोटे विखंडन वाले ईओणों जैसे टकराव-प्रेरित पृथक्करण, ईओण-अणु प्रतिक्रिया, या फोटोपृथक्करण में विभाजित किया जाता है फिर इन अंशों को दूसरे मास स्पेक्ट्रोमीटर (MS2) में डाला | किसी दिए गए उदाहरण के अणु [[Index.php?title=आयनित|ईओणित]] होते हैं और पहला स्पेक्ट्रोमीटर (निर्दिष्ट '''MS1''') इन [[आयनों|ईओणों]] को उनके मास-से-आवेश अनुपात (प्रायः m/z या m/Q के रूप में दिया जाता है) द्वारा अलग करता है। MS1 से आने वाले एक विशेष '''m/z'''-अनुपात के ईओणों का चयन किया जाता है और फिर उन्हें छोटे विखंडन वाले ईओणों जैसे टकराव-प्रेरित पृथक्करण, ईओण-अणु प्रतिक्रिया, या फोटोपृथक्करण में विभाजित किया जाता है फिर इन अंशों को दूसरे मास स्पेक्ट्रोमीटर ('''MS2''') में डाला जाता है, जो बदले में टुकड़ों को उनके '''m/z'''-अनुपात से अलग करता है और उनका पता लगाता है। विखंडन चरण नियमित मास स्पेक्ट्रोमीटर में बहुत समान '''m/z'''-अनुपात वाले ईओणों को पहचानना और अलग करना संभव बनाता है। | ||
== संरचना == | == संरचना == | ||
विशिष्ट | विशिष्ट टेंडेम मास स्पेक्ट्रोमेट्री उपकरण व्यवस्था में त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर (QqQ), बहु-[[Index.php?title=क्षेत्र मास स्पेक्ट्रोमीटर|क्षेत्र मास स्पेक्ट्रोमीटर]], चतुर्भुज ध्रुव-उड़ान का समय (Q-TOF), सांध्वनिक अंतरण ईओण द्विताणुत्वर | ||
प्रतिध्वनि मास स्पेक्ट्रोमीटर और संकर मास स्पेक्ट्रोमीटर सम्मिलित हैं। | |||
=== | === त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर === | ||
त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर मास निस्पंदन के रूप में पहले और तीसरे चतुर्भुज ध्रुव का उपयोग करते हैं। जब विश्लेषण दूसरे चतुर्भुज से गुजरते हैं, तो विखंडन गैस के साथ टकराव के माध्यम से आगे बढ़ता है। | |||
=== | === चतुर्भुज ध्रुव-उड़ान का समय (Q-TOF) === | ||
Q-TOF मास स्पेक्ट्रोमीटर TOF और चतुर्भुज ध्रुव उपकरणों को जोड़ता है, जो उत्पाद ईओणों के लिए उच्च मास सटीकता, सटीक मात्रा क्षमता और विखंडन प्रयोग प्रयोज्यता का कारण बनता है। यह मास स्पेक्ट्रोमेट्री का एक प्रयोग है जो ईओण विखंडन (m/z) अनुपात उड़ान माप के समय के माध्यम से निर्धारित किया जाता है। | |||
=== संकर मास स्पेक्ट्रोमीटर === | |||
संकर मास स्पेक्ट्रोमीटर में दो से अधिक मास विश्लेषक होते हैं। | |||
== उपकरण == | == उपकरण == | ||
[[Image:MS MS.png|thumb|right| | [[Image:MS MS.png|thumb|right|टेंडेम मास स्पेक्ट्रोमेट्री की योजनाबद्ध]]मास विश्लेषण पृथक्करण के कई चरणों को स्थान में अलग किए गए व्यक्तिगत मास स्पेक्ट्रोमीटर तत्वों के साथ या समय में अलग किए गए MS चरणों के साथ एकल मास स्पेक्ट्रोमीटर का उपयोग करके पूरा किया जा सकता है। स्थान में टेंडेम मास स्पेक्ट्रोमेट्री के लिए, विभिन्न तत्वों को प्रायः आशुलिपि में व्याख्या किया जाता है, जिससे उपयोग किए जाने वाले मास चयनकर्ता का प्रकार दिया जाता है। | ||
=== | === स्थान में टेंडेम === | ||
[[File:Triple quadripole.png|thumb|right| | [[File:Triple quadripole.png|thumb|right|त्रिपक्षीय चतुर्भुज ध्रुव डायग्राम; और स्थान में टेंडेम मास स्पेक्ट्रोमेट्री का उदाहरण]]स्थान में टेंडेम मास स्पेक्ट्रोमेट्री में, पृथक्करण तत्व भौतिक रूप से वियुक्त और अलग होते हैं, यद्यपि उच्च निर्वात बनाए रखने के लिए तत्वों के बीच एक भौतिक संबंध होता है। ये तत्व क्षेत्र, संचरण, चतुर्भुज ध्रुव, या उड़ान का समय हो सकते हैं। एकाधिक चतुष्कोणों का उपयोग करते समय, वे मास विश्लेषक और टकराव कक्ष दोनों के रूप में कार्य कर सकते हैं। | ||
मास विश्लेषक के लिए सामान्य संकेतन Q - | मास विश्लेषक के लिए सामान्य संकेतन Q - चतुर्भुज ध्रुव मास विश्लेषक है, q - [[ आकाशवाणी आवृति |आकाशवाणी आवृति]] टकराव चतुर्भुज ध्रुव, TOF - उड़ान समय. मास विश्लेषक, B - चुंबकीय क्षेत्र और E - विद्युत क्षेत्र है। विभिन्न संकर उपकरणों को इंगित संकेतन उदाहरण के लिए QqQ' - [[ट्रिपल क्वाड्रुपोल मास स्पेक्ट्रोमीटर|त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर]] हैं, ''QTOF'' - चतुर्भुज ध्रुव उड़ान समय. मास स्पेक्ट्रोमीटर (''QqTOF'' भी) हैं और BEBE - चार-क्षेत्र (रिवर्स ज्योमेट्री) मास स्पेक्ट्रोमीटर को जोड़ा जा सकता है। | ||
=== समय में | === समय में टेंडेम === | ||
[[File:LTQ Trap And Dynodes 2.jpg|thumb|right|250 px|ईओण ट्रैप मास स्पेक्ट्रोमीटर टाइम इंस्ट्रूमेंट में | [[File:LTQ Trap And Dynodes 2.jpg|thumb|right|250 px|ईओण ट्रैप मास स्पेक्ट्रोमीटर टाइम इंस्ट्रूमेंट में टेंडेममास स्पेक्ट्रोमेट्री का एक उदाहरण है।]]समय पर टेंडेम मास स्पेक्ट्रोमेट्री करने से, एक ही स्थान पर फंसे ईओणों के साथ पृथक्करण पूरा किया जाता है, जिसमें समय के साथ कई पृथक्करण चरण होते हैं। इस तरह के विश्लेषण के लिए [[चौगुना आयन जाल|चतुर्भुज ध्रुव]] [[फूरियर रूपांतरण आयन साइक्लोट्रॉन अनुनाद|ईओण]] जाल या [[फूरियर रूपांतरण आयन साइक्लोट्रॉन अनुनाद|फूरियर रूपांतरण ईओण द्विताणुत्वर अनुनाद]] (सांध्वनिक अंतरण ईओण साइक्लोट्रॉन रेज़ोनेंस)(FTICR) उपकरण का उपयोग किया जा सकता है।<ref>{{Cite journal | vauthors = Cody RB, Freiser BS |title=फूरियर-ट्रांसफॉर्म मास स्पेक्ट्रोमीटर में टक्कर-प्रेरित पृथक्करण|journal=International Journal of Mass Spectrometry and Ion Physics|volume=41|issue=3|pages=199–204|doi=10.1016/0020-7381(82)85035-3|bibcode=1982IJMSI..41..199C|year=1982}}</ref> प्रपाशन उपकरण विश्लेषण के कई चरण निष्पादित कर सकते हैं, जिसे कभी-कभी MS<sup>''n''</sup> (MS से N) कहा जाता है।<ref>{{Cite journal | vauthors = Cody RB, Burnier RC, Cassady CJ, Freiser BS |date=1982-11-01|title=फूरियर ट्रांसफॉर्म मास स्पेक्ट्रोमेट्री में लगातार टकराव-प्रेरित पृथक्करण|journal=Analytical Chemistry |volume=54 |issue=13 |pages=2225–2228 |doi=10.1021/ac00250a021}}</ref> प्रायः चरणों की संख्या, n इंगित नहीं की जाती है, लेकिन कभी-कभी मान निर्दिष्ट किया जाता है, उदाहरण के लिए MS<sup>3</sup> पृथक्करण के तीन चरणों को इंगित करता है। | ||
समय के साथ मिलकर MS उपकरण अगले वर्णित प्रणाली का उपयोग नहीं करते हैं, लेकिन सामान्यतः संपूर्ण स्पेक्ट्रम के पूर्ववर्ती ईओण अवलोकन करना और मूल ईओण अवलोकन करना से सम्पूर्ण जानकारी एकत्र करते हैं। प्रत्येक वाद्य विन्यास सामूहिक पहचान की एक अद्वितीय विधा का उपयोग करता है। | समय के साथ मिलकर MS उपकरण अगले वर्णित प्रणाली का उपयोग नहीं करते हैं, लेकिन सामान्यतः संपूर्ण स्पेक्ट्रम के पूर्ववर्ती ईओण अवलोकन करना और मूल ईओण अवलोकन करना से सम्पूर्ण जानकारी एकत्र करते हैं। प्रत्येक वाद्य विन्यास सामूहिक पहचान की एक अद्वितीय विधा का उपयोग करता है। | ||
===स्थान MS/MS प्रणाली में | ===स्थान MS/MS प्रणाली में टेंडेम === | ||
जब | जब टेंडेम MS स्थान बनावट के साथ निष्पादित किया जाता है, तो उपकरण को विभिन्न प्रकार में से एक में काम करना चाहिए। कई अलग-अलग टेंडेम MS/MS प्रायोगिक व्यवस्था हैं और प्रत्येक प्रकार के अपने अनुप्रयोग हैं और विभिन्न जानकारी प्रदान करते हैं। स्थान में टेंडेम MS दो उपकरण घटकों के युग्मन का उपयोग करता है जो समान मास स्पेक्ट्रम श्रेणी स्थान में उनके बीच नियंत्रित अंशांकन के साथ को मापते हैं, जबकि समय में टेंडेम MS में [[आयन जाल|ईओण जाल]] का उपयोग सम्मिलित होता है। | ||
MS/MS का उपयोग करते हुए चार मुख्य अवलोकन पूर्ववर्ती ईओण अवलोकन करना, उत्पाद ईओण अवलोकन करना, उदासीन क्षति अवलोकन करना और चयनित प्रतिक्रिया | MS/MS का उपयोग करते हुए चार मुख्य अवलोकन पूर्ववर्ती ईओण अवलोकन करना, उत्पाद ईओण अवलोकन करना, उदासीन क्षति अवलोकन करना और चयनित प्रतिक्रिया निरीक्षण का प्रयोग संभव हैं। | ||
पूर्ववर्ती ईओण अवलोकन करने के लिए, उत्पाद ईओण को दूसरे मास विश्लेषक में चुना जाता है, और पूर्ववर्ती मास को पहले मास विश्लेषक में अवलोकन किया जाता है। ध्यान दें कि पूर्ववर्ती ईओण<ref>{{GoldBookRef|title=precursor ion|file=P04807}}</ref> मूल ईओण <ref>{{GoldBookRef|title=parent ion|file=P04406}}</ref> और उत्पाद ईओण<ref>{{GoldBookRef|title=product ion|file= P04864}}</ref> पुत्री ईओण का पर्याय है;<ref>{{GoldBookRef|title=daughter ion|file= D01524}}</ref> यद्यपि इन मानवरूपी शब्दों के उपयोग को हतोत्साहित किया जाता है।<ref>{{Cite journal| last = Bursey | first = Maurice M. | year = 1991 | title = Comment to readers: Style and the lack of it | journal = Mass Spectrometry Reviews | volume = 10 | issue = 1 | pages = 1–2 | doi = 10.1002/mas.1280100102 | bibcode = 1991MSRv...10....1B}}</ref><ref>{{Cite journal| last = Adams | first = J. | year = 1992 | title = संपादक को| journal = Journal of the American Society for Mass Spectrometry | volume = 3 | page = 473 | doi = 10.1016/1044-0305(92)87078-D | issue = 4 | pmid = 24243061 | doi-access = free}}</ref> | पूर्ववर्ती ईओण अवलोकन करने के लिए, उत्पाद ईओण को दूसरे मास विश्लेषक में चुना जाता है, और पूर्ववर्ती मास को पहले मास विश्लेषक में अवलोकन किया जाता है। ध्यान दें कि पूर्ववर्ती ईओण<ref>{{GoldBookRef|title=precursor ion|file=P04807}}</ref> मूल ईओण <ref>{{GoldBookRef|title=parent ion|file=P04406}}</ref> और उत्पाद ईओण<ref>{{GoldBookRef|title=product ion|file= P04864}}</ref> पुत्री ईओण का पर्याय है;<ref>{{GoldBookRef|title=daughter ion|file= D01524}}</ref> यद्यपि इन मानवरूपी शब्दों के उपयोग को हतोत्साहित किया जाता है।<ref>{{Cite journal| last = Bursey | first = Maurice M. | year = 1991 | title = Comment to readers: Style and the lack of it | journal = Mass Spectrometry Reviews | volume = 10 | issue = 1 | pages = 1–2 | doi = 10.1002/mas.1280100102 | bibcode = 1991MSRv...10....1B}}</ref><ref>{{Cite journal| last = Adams | first = J. | year = 1992 | title = संपादक को| journal = Journal of the American Society for Mass Spectrometry | volume = 3 | page = 473 | doi = 10.1016/1044-0305(92)87078-D | issue = 4 | pmid = 24243061 | doi-access = free}}</ref> | ||
उत्पाद ईओण अवलोकन में, पहले चरण में एक पूर्ववर्ती ईओण का चयन किया जाता है, जिसे विखंडित करने की अनुमति दी जाती है और फिर सभी परिणामी मासों को दूसरे मास विश्लेषक में अवलोकन किया जाता है और दूसरे मास विश्लेषक के बाद स्थित संसूचक में पता लगाया जाता है। यह प्रयोग सामान्यतः | उत्पाद ईओण अवलोकन में, पहले चरण में एक पूर्ववर्ती ईओण का चयन किया जाता है, जिसे विखंडित करने की अनुमति दी जाती है और फिर सभी परिणामी मासों को दूसरे मास विश्लेषक में अवलोकन किया जाता है और दूसरे मास विश्लेषक के बाद स्थित संसूचक में पता लगाया जाता है। यह प्रयोग सामान्यतः टेंडेम MS द्वारा परिमाणीकरण के लिए उपयोग किए जाने वाले संक्रमणों की पहचान करने के लिए किया जाता है। | ||
उदासीन क्षति अवलोकन में, पहला मास विश्लेषक सभी मास का अवलोकन करता है। दूसरा मास विश्लेषक भी पहले मास विश्लेषक से एक समूह समायोजन पर अवलोकन करता | उदासीन क्षति अवलोकन में, पहला मास विश्लेषक सभी मास का अवलोकन करता है। दूसरा मास विश्लेषक भी पहले मास विश्लेषक से एक समूह समायोजन पर अवलोकन करता है।<ref>{{Cite journal| last1 = Louris | first1 = John N. | year = 1985 | title = हाइब्रिड मास स्पेक्ट्रोमीटर के साथ नए स्कैन मोड एक्सेस किए गए| journal = Analytical Chemistry | volume = 57 | pages = 2918–2924 | doi = 10.1021/ac00291a039 | last2 = Wright | first2 = Larry G. | last3 = Cooks | first3 = R. Graham. | last4 = Schoen | first4 = Alan E. | name-list-style = vanc | issue = 14}}</ref> लेकिन यह समायोजन एक उदासीन क्षति से मेल खाता है जो सामान्यतः यौगिकों के वर्ग के लिए लिए देखा जाता है। निरंतर-उदासीन-क्षति अवलोकन में, निर्दिष्ट सामान्य उदासीन के क्षति से गुजरने वाले सभी पूर्ववर्तीों की निरीक्षण की जाती है। इस जानकारी को प्राप्त करने के लिए, दोनों मास विश्लेषक को एक साथ अवलोकन किया जाता हैं, लेकिन मास समायोजन के साथ जो निर्दिष्ट उदासीन मास से संबंधित होता है। पूर्ववर्ती-ईओण अवलोकन के समान, यह तकनीक एक मिश्रण में निकट संबंधी यौगिकों के वर्ग की चयनात्मक पहचान में भी उपयोगी है। | ||
चयनित प्रतिक्रिया | चयनित प्रतिक्रिया निरीक्षण में, दोनों मास विश्लेषक एक चयनित मास समूह होते हैं। यह प्रणाली MS प्रयोगों के लिए चयनित ईओण निरीक्षण के अनुरूप है। एक चयनात्मक विश्लेषण प्रणाली, जो संवेदनशीलता को बढ़ा सकता है।<ref>{{Cite book| last1 = deHoffman | first1 = Edmond | last2 = Stroobant | first2 = Vincent | name-list-style = vanc | title = Mass Spectrometry: Principles and Applications | publisher = Wiley | year = 2003 | location = Toronto | page = 133 | isbn = 978-0-471-48566-7}}</ref> | ||
== विखंडन == | == विखंडन == | ||
{{Main| | {{Main|विखंडन रसायन शास्त्र}} | ||
मास स्पेक्ट्रोमेट्री को | |||
मास स्पेक्ट्रोमेट्री को टेंडेमित करने के लिए गैस-चरण ईओणों का विखंडन आवश्यक है जो मास विश्लेषण के विभिन्न चरणों के बीच होता है। ईओणों को खंडित करने के लिए कई विधियों का उपयोग किया जाता है और इनके परिणामस्वरूप विभिन्न प्रकार के विखंडन हो सकते हैं और इस प्रकार अणु की संरचना और संरचना के विषय में अलग-अलग जानकारी मिलती है। | |||
=== स्रोत में विखंडन === | === स्रोत में विखंडन === | ||
प्रायः | प्रायः ईओणीकरण प्रक्रिया इतनी तीव्र होती है कि परिणामी ईओणों को पर्याप्त [[आंतरिक ऊर्जा]] के साथ मास स्पेक्ट्रोमीटर के भीतर टुकड़े करने के लिए छोड़ दिया जाता है। यदि उत्पाद ईओण स्वतः-पृथक्करण से पहले मध्यम समय के लिए अपने अतिरिक्त-संतुलन अवस्था में बने रहते हैं, तो इस प्रक्रिया को [[मेटास्टेबल]] विखंडन कहा जाता है।<ref>{{GoldBookRef|file=T06451|title=transient (chemical) species}}</ref> नोक पौना विखंडन सामान्यतः [[Index.php?title=इलेक्ट्रोस्प्रे|इलेक्ट्रोस्प्रे ईओणीकरण]] आधारित उपकरणों पर नोक पौना क्षमता को बढ़ाकर स्रोत में विखंडन के उद्देश्यपूर्ण प्रेरण को संदर्भित करता है। यद्यपि स्रोत में विखंडन, विखंडन विश्लेषण के लिए अनुमति देता है, यह तकनीकी रूप से टेंडेम मास स्पेक्ट्रोमेट्री नहीं है जब तक कि स्वतः- पृथक्करण से पहले मेटास्टेबल ईओणों का बड़े पैमाने पर विश्लेषण चयन नहीं किया जाता है और परिणामी टुकड़ों पर विश्लेषण का दूसरा चरण नहीं किया जाता है। स्रोत में विखंडन का उपयोग उन्नत स्रोत विखंडन टिप्पणी तकनीक के उपयोग के माध्यम से टेंडेम मास स्पेक्ट्रोमेट्री के बदले में किया जा सकता है, जो विखंडन उत्पन्न करता है और सीधे मास स्पेक्ट्रोमेट्री डेटा से मेल खाता है।<ref>{{cite journal |last1=Domingo-Almenara |first1=Xavier |last2=Montenegro-Burke |first2=J. Rafael |last3=Guijas |first3=Carlos |last4=Majumder |first4=Erica L.-W. |last5=Benton |first5=H. Paul |last6=Siuzdak |first6=Gary |title=अलक्षित मेटाबोलॉमिक्स के लिए ऑटोनॉमस मेटलिन-गाइडेड इन-सोर्स फ्रैगमेंट एनोटेशन|journal=Analytical Chemistry |date=5 March 2019 |volume=91 |issue=5 |pages=3246–3253 |doi=10.1021/acs.analchem.8b03126|pmid=30681830 |pmc=6637741}}</ref>उन्नत स्रोत विखंडन टिप्पणी द्वारा देखे गए अंशों में पारंपरिक टुकड़ों की तुलना में उच्च संकेत तीव्रता होती है जो टेंडेम मास स्पेक्ट्रोमीटर की टकराव कोशिकाओं में क्षति का सामना करते हैं।<ref>{{cite journal |last1=Xue |first1=Jingchuan |last2=Domingo-Almenara |first2=Xavier |last3=Guijas |first3=Carlos |last4=Palermo |first4=Amelia |last5=Rinschen |first5=Markus M. |last6=Isbell |first6=John |last7=Benton |first7=H. Paul |last8=Siuzdak |first8=Gary |title=संवर्धित इन-सोर्स फ्रैग्मेंटेशन एनोटेशन उपन्यास डेटा स्वतंत्र अधिग्रहण और स्वायत्त METLIN आणविक पहचान को सक्षम करता है|journal=Analytical Chemistry |date=21 April 2020 |volume=92 |issue=8 |pages=6051–6059 |doi=10.1021/acs.analchem.0c00409|pmid=32242660|pmc=8966047 |s2cid=214768212 }}</ref> उन्नत स्रोत विखंडन टिप्पणी MS1 मास विश्लेषक जैसे उड़ान समय और एकल चतुर्भुज ध्रुव उपकरण पर विखंडन डेटा अधिकृत को सक्षम बनाता है। छद्म MS<sup>3</sup> -प्रकार के विखंडन के दो चरणों की अनुमति देने के लिए स्रोत में विखंडन का उपयोग प्रायः टेंडेम मास स्पेक्ट्रोमेट्री (डाक-स्रोत विखंडन के साथ) के अतिरिक्त किया जाता है।<ref>{{cite journal | vauthors = Körner R, Wilm M, Morand K, Schubert M, Mann M | title = नैनो इलेक्ट्रोस्प्रे को पेप्टाइड्स और प्रोटीन डाइजेस्ट के विश्लेषण के लिए क्वाड्रुपोल आयन ट्रैप के साथ जोड़ा गया| journal = Journal of the American Society for Mass Spectrometry | volume = 7 | issue = 2 | pages = 150–6 | date = February 1996 | pmid = 24203235 | doi = 10.1016/1044-0305(95)00626-5 | doi-access = free}}</ref> | ||
=== टकराव-प्रेरित पृथक्करण === | === टकराव-प्रेरित पृथक्करण === | ||
डाक-स्रोत विखंडन प्रायः मास स्पेक्ट्रोमेट्री प्रयोग में उपयोग किया जा रहा है। ऊर्जा को ईओणों में भी जोड़ा जा सकता है, जो सामान्यतः पहले कंपन, उदासीन परमाणुओं या अणुओं के साथ डाक-स्रोत टकराव के माध्यम से, विकिरण का अवशोषण, या गुणा आवेशित ईओण द्वारा एक इलेक्ट्रॉन के | डाक-स्रोत विखंडन प्रायः मास स्पेक्ट्रोमेट्री प्रयोग में उपयोग किया जा रहा है। ऊर्जा को ईओणों में भी जोड़ा जा सकता है, जो सामान्यतः पहले कंपन, उदासीन परमाणुओं या अणुओं के साथ डाक-स्रोत टकराव के माध्यम से, विकिरण का अवशोषण, या गुणा आवेशित ईओण द्वारा एक इलेक्ट्रॉन के हस्तांतरण के माध्यम से उत्तेजित होते हैं। टकराव-प्रेरित पृथक्करण (CID), जिसे संपार्श्विक रूप से सक्रिय पृथक्करण (CAD) भी कहा जाता है, गैस चरण में एक उदासीन परमाणु या अणु के साथ ईओण की टकराव और ईओण के बाद के पृथक्करण सम्मिलित हैं।<ref name="pmid16401509">{{cite book | vauthors = Wells JM, McLuckey SA | title = जैविक मास स्पेक्ट्रोमेट्री| chapter = Collision‐Induced Dissociation (CID) of Peptides and Proteins | volume = 402 | pages = 148–85 | year = 2005 | pmid = 16401509 | doi = 10.1016/S0076-6879(05)02005-7 | series = Methods in Enzymology | isbn = 9780121828073 }}</ref><ref name="pmid15481084">{{cite journal | vauthors = Sleno L, Volmer DA | title = अग्रानुक्रम द्रव्यमान स्पेक्ट्रोमेट्री के लिए आयन सक्रियण विधियाँ| journal = Journal of Mass Spectrometry | volume = 39 | issue = 10 | pages = 1091–112 | date = October 2004 | pmid = 15481084 | doi = 10.1002/jms.703 | bibcode = 2004JMSp...39.1091S }}</ref> उदाहरण के लिए विचार करें | ||
:<chem>{AB+} + M -> {A} + {B+} + M</chem> | :<chem>{AB+} + M -> {A} + {B+} + M</chem> | ||
जहाँ ईओण AB<sup>+</sup> उदासीन प्रजाति M से टकराता है और बाद में अलग हो जाता है। इस प्रक्रिया का विवरण [[टक्कर सिद्धांत|टकराव सिद्धांत]] द्वारा वर्णित है। विभिन्न वाद्य विन्यास के कारण, CID के दो मुख्य प्रकार संभव हैं: (i) बीम-प्रकार (जिसमें पूर्ववर्ती ईओण उड़ान | जहाँ ईओण AB<sup>+</sup> उदासीन प्रजाति M से टकराता है और बाद में अलग हो जाता है। इस प्रक्रिया का विवरण [[टक्कर सिद्धांत|टकराव सिद्धांत]] द्वारा वर्णित है। विभिन्न वाद्य विन्यास के कारण, CID के दो मुख्य प्रकार संभव हैं: (i) बीम-प्रकार (जिसमें पूर्ववर्ती ईओण उड़ान केसमय खंडित होते हैं)<ref>{{cite journal | vauthors = Xia Y, Liang X, McLuckey SA | title = आयन ट्रैप बनाम कम-ऊर्जा बीम-प्रकार की टक्कर-प्रेरित विखंडन प्रोटोनेटेड यूबिकिटिन आयनों का| journal = Analytical Chemistry | volume = 78 | issue = 4 | pages = 1218–27 | date = February 2006 | pmid = 16478115 | doi = 10.1021/ac051622b }}</ref> और (ii) ईओण जाल-प्रकार (जिसमें पूर्ववर्ती ईओण पहले फंस जाते हैं, और फिर खंडित हो जाते हैं)।<ref>{{Cite journal|last=March|first=Raymond E. | name-list-style = vanc |date=1997-04-01|title=क्वाड्रुपोल आयन ट्रैप मास स्पेक्ट्रोमेट्री का परिचय|journal=Journal of Mass Spectrometry |volume=32 |issue=4 |pages=351–369 |doi=10.1002/(sici)1096-9888(199704)32:4<351::aid-jms512>3.0.co;2-y |bibcode=1997JMSp...32..351M |s2cid=16506573 }}</ref><ref>{{cite journal | vauthors = Bantscheff M, Boesche M, Eberhard D, Matthieson T, Sweetman G, Kuster B | title = एलटीक्यू ऑर्बिट्रैप मास स्पेक्ट्रोमीटर पर मजबूत और संवेदनशील iTRAQ परिमाणीकरण| journal = Molecular & Cellular Proteomics | volume = 7 | issue = 9 | pages = 1702–13 | date = September 2008 | pmid = 18511480 | pmc = 2556025 | doi = 10.1074/mcp.M800029-MCP200}}</ref> | ||
CID विखंडन का एक तीसरा और नवीनतम प्रकार [[उच्च-ऊर्जा संपार्श्विक पृथक्करण]] (HCD) है। | CID विखंडन का एक तीसरा और नवीनतम प्रकार [[उच्च-ऊर्जा संपार्श्विक पृथक्करण]] (HCD) है। HCD एक CID तकनीक है जो [[orbitrap|ऑर्बिट्रप]] मास स्पेक्ट्रोमीटर के लिए विशिष्ट है जिसमें विखंडन ईओण ट्रैप के बाहर होता है,<ref name="pmid17721543">{{cite journal | vauthors = Olsen JV, Macek B, Lange O, Makarov A, Horning S, Mann M | title = पेप्टाइड संशोधन विश्लेषण के लिए उच्च-ऊर्जा सी-जाल पृथक्करण| journal = Nature Methods | volume = 4 | issue = 9 | pages = 709–12 | date = September 2007 | pmid = 17721543 | doi = 10.1038/nmeth1060 | s2cid = 2538231 }}</ref><ref>{{cite journal | vauthors = Senko MW, Remes PM, Canterbury JD, Mathur R, Song Q, Eliuk SM, Mullen C, Earley L, Hardman M, Blethrow JD, Bui H, Specht A, Lange O, Denisov E, Makarov A, Horning S, Zabrouskov V | title = Novel parallelized quadrupole/linear ion trap/Orbitrap tribrid mass spectrometer improving proteome coverage and peptide identification rates | language = EN | journal = Analytical Chemistry | volume = 85 | issue = 24 | pages = 11710–4 | date = December 2013 | pmid = 24251866 | doi = 10.1021/ac403115c }}</ref> यह HCD सेल में होता है (ईओण क्रम बहुपोल नाम के कुछ उपकरणों में)।<ref>{{cite journal | vauthors = Riley NM, Westphall MS, Coon JJ | title = सक्रिय आयन-इलेक्ट्रॉन स्थानांतरण पृथक्करण व्यापक टॉप-डाउन प्रोटीन विखंडन को सक्षम करता है| journal = Journal of Proteome Research | volume = 16 | issue = 7 | pages = 2653–2659 | date = July 2017 | pmid = 28608681 | pmc = 5555583 | doi = 10.1021/acs.jproteome.7b00249}}</ref> HCD एक जाल-प्रकार का विखंडन है जिसे बीम-प्रकार की विशेषताओं के लिए दिखाया गया है।<ref>{{cite journal | vauthors = Nagaraj N, D'Souza RC, Cox J, Olsen JV, Mann M | title = उच्च ऊर्जा संपार्श्विक पृथक्करण विखंडन के साथ बड़े पैमाने पर फॉस्फोप्रोटोमिक्स की व्यवहार्यता| language = EN | journal = Journal of Proteome Research | volume = 9 | issue = 12 | pages = 6786–94 | date = December 2010 | pmid = 20873877 | doi = 10.1021/pr100637q }}</ref><ref>{{cite journal | vauthors = Jora M, Burns AP, Ross RL, Lobue PA, Zhao R, Palumbo CM, Beal PA, Addepalli B, Limbach PA | title = उच्च-ऊर्जा कोलिशनल डिसोसिएशन मास स्पेक्ट्रोमेट्री (एचसीडी एमएस) द्वारा न्यूक्लियोसाइड संशोधनों के विभेदक स्थितीय आइसोमर्स| journal = Journal of the American Society for Mass Spectrometry | volume = 29 | issue = 8 | pages = 1745–1756 | date = August 2018 | pmid = 29949056 | pmc = 6062210 | doi = 10.1007/s13361-018-1999-6 | bibcode = 2018JASMS..29.1745J }}</ref> स्वतंत्र रूप से उपलब्ध बड़े पैमाने पर उच्च समाधान के टेंडेम मास स्पेक्ट्रोमेट्री डेटाबेस उपस्थिति हैं (उदाहरण के लिए प्रायोगिक CID MS / MS डेटा के साथ प्रत्येक 850,000 आणविक मानकों के साथ मेटलिन),<ref>{{Cite journal|title=Article Metrics - METLIN MS 2 molecular standards database: a broad chemical and biological resource {{!}} Nature Methods|url=https://www.nature.com/articles/s41592-020-0942-5/metrics|language=en|issn=1548-7105}}</ref> और सामान्यतः छोटे अणु पहचान की सुविधा के लिए उपयोग किया जाता है। | ||
===इलेक्ट्रॉन अधिकृत और स्थानांतरण विधियाँ === | ===इलेक्ट्रॉन अधिकृत और स्थानांतरण विधियाँ === | ||
| Line 60: | Line 62: | ||
====[[[[इलेक्ट्रॉन]]-अधिकृत पृथक्करण]] ==== | ====[[[[इलेक्ट्रॉन]]-अधिकृत पृथक्करण]] ==== | ||
यदि एक इलेक्ट्रॉन को बहु आवेशित धनात्मक ईओण में जोड़ा जाता है, तो | यदि एक इलेक्ट्रॉन को बहु आवेशित धनात्मक ईओण में जोड़ा जाता है, तो विधुत् की तीव्र प्रवाहित ऊर्जा मुक्त हो जाता है। एक मुक्त इलेक्ट्रॉन को जोड़ने को इलेक्ट्रॉन-अधिकृत पृथक्करण (ECD) कहा जाता है, [27] और इसे इसके द्वारा दर्शाया जाता है,<ref>{{cite journal | vauthors = Cooper HJ, Håkansson K, Marshall AG | title = जैव-आणविक विश्लेषण में इलेक्ट्रॉन कैप्चर पृथक्करण की भूमिका| journal = Mass Spectrometry Reviews | volume = 24 | issue = 2 | pages = 201–22 | year = 2005 | pmid = 15389856 | doi = 10.1002/mas.20014 | bibcode = 2005MSRv...24..201C }}</ref> | ||
:<math chem>[\ce M + n\ce H]^{n+} + \ce{e^- ->} \left[ [\ce M + (n-1)\ce H]^{(n-1)+} \right]^* \ce{-> fragments}</math> | :<math chem>[\ce M + n\ce H]^{n+} + \ce{e^- ->} \left[ [\ce M + (n-1)\ce H]^{(n-1)+} \right]^* \ce{-> fragments}</math> | ||
| Line 73: | Line 75: | ||
जहां A ईओण है।<ref>{{cite journal | vauthors = McLuckey SA, Stephenson JL | title = Ion/ion chemistry of high-mass multiply charged ions | journal = Mass Spectrometry Reviews | volume = 17 | issue = 6 | pages = 369–407 | year = 1998 | pmid = 10360331 | doi = 10.1002/(SICI)1098-2787(1998)17:6<369::AID-MAS1>3.0.CO;2-J | bibcode = 1998MSRv...17..369M | url = https://zenodo.org/record/1235512}}</ref> | जहां A ईओण है।<ref>{{cite journal | vauthors = McLuckey SA, Stephenson JL | title = Ion/ion chemistry of high-mass multiply charged ions | journal = Mass Spectrometry Reviews | volume = 17 | issue = 6 | pages = 369–407 | year = 1998 | pmid = 10360331 | doi = 10.1002/(SICI)1098-2787(1998)17:6<369::AID-MAS1>3.0.CO;2-J | bibcode = 1998MSRv...17..369M | url = https://zenodo.org/record/1235512}}</ref> | ||
ETD पेप्टाइड बैकबोन (c और z ईओणों) के साथ | ETD पेप्टाइड बैकबोन (c और z ईओणों) के साथ अव्यवस्थित ढंग से टूट जाता है जबकि पक्ष श्रृंखला और फास्फारिलीकरण जैसे संशोधनों संशोधन निरंतर रहते हैं तकनीक केवल उच्च आवेश वाले अवस्था ईओणों (z>2) के लिए अच्छी तरह से काम करती है, यद्यपि टकराव-प्रेरित पृथक्करण (CID) के सापेक्ष, ETD लंबे पेप्टाइड्स या यहां तक कि संपूर्ण प्रोटीन के विखंडन के लिए उपयोगी है। यह तकनीक को [[टॉप-डाउन प्रोटिओमिक्स]] के लिए महत्वपूर्ण बनाता है। ECD की तरह,ETD फास्फारिलीकरण जैसे संशोधनों के साथ पेप्टाइड्स के लिए प्रभावी है।<ref>{{cite journal | vauthors = Chi A, Huttenhower C, Geer LY, Coon JJ, Syka JE, Bai DL, Shabanowitz J, Burke DJ, Troyanskaya OG, Hunt DF | title = इलेक्ट्रॉन हस्तांतरण पृथक्करण (ETD) मास स्पेक्ट्रोमेट्री द्वारा Saccharomyces cerevisiae से प्रोटीन पर फॉस्फोराइलेशन साइटों का विश्लेषण| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 104 | issue = 7 | pages = 2193–8 | date = February 2007 | pmid = 17287358 | pmc = 1892997 | doi = 10.1073/pnas.0607084104 | bibcode = 2007PNAS..104.2193C| doi-access = free }}</ref> | ||
इलेक्ट्रॉन-स्थानांतरण और उच्च-ऊर्जा टकराव पृथक्करण ( | इलेक्ट्रॉन-स्थानांतरण और उच्च-ऊर्जा टकराव पृथक्करण (STHSD) ETD और HCD का एक संयोजन है जहाँ पेप्टाइड पूर्ववर्ती को प्रारम्भ में एक रैखिक ईओण ट्रैप में [[फ्लोरांथीन]] ईओणों के साथ ईओण / ईओण प्रतिक्रिया के अधीन किया जाता है, जो c- और z- ईओण उत्पन्न करता है।<ref name="pmid15210983" /><ref>{{cite journal | vauthors = Frese CK, Altelaar AF, van den Toorn H, Nolting D, Griep-Raming J, Heck AJ, Mohammed S | title = इलेक्ट्रॉन-हस्तांतरण और उच्च-ऊर्जा टक्कर पृथक्करण अग्रानुक्रम मास स्पेक्ट्रोमेट्री के संयोजन से दोहरे विखंडन द्वारा पूर्ण पेप्टाइड अनुक्रम कवरेज की ओर| journal = Analytical Chemistry | volume = 84 | issue = 22 | pages = 9668–73 | date = November 2012 | pmid = 23106539 | doi = 10.1021/ac3025366 }}</ref> दूसरे चरण में ऑर्बिट्रप विश्लेषक में अंतिम विश्लेषण से पहले B- और Y-ईओण उत्पन्न करने के लिए सभी ETD व्युत्पन्न ईओणों पर HCD सभी-ईओण विखंडन लागू किया जाता है।<ref name="pmid17721543" />यह विधि ईओण उत्पन्न करने के लिए दोहरे विखंडन को नियोजित करती है- और इस प्रकार पेप्टाइड अनुक्रमण और [[अनुवाद के बाद का संशोधन]] स्थानीयकरण के लिए डेटा-समृद्ध MS/MS स्पेक्ट्रा का उपयोग करती है।<ref>{{cite journal | vauthors = Frese CK, Zhou H, Taus T, Altelaar AF, Mechtler K, Heck AJ, Mohammed S | title = Unambiguous phosphosite localization using electron-transfer/higher-energy collision dissociation (EThcD) | journal = Journal of Proteome Research | volume = 12 | issue = 3 | pages = 1520–5 | date = March 2013 | pmid = 23347405 | pmc = 3588588 | doi = 10.1021/pr301130k}}</ref> | ||
==== नकारात्मक इलेक्ट्रॉन-हस्तांतरण पृथक्करण ==== | ==== नकारात्मक इलेक्ट्रॉन-हस्तांतरण पृथक्करण ==== | ||
विखंडन एक अवक्षेपित प्रजाति के साथ भी हो सकता है, जिसमें एक इलेक्ट्रॉन को एक नकारात्मक इलेक्ट्रॉन हस्तांतरण पृथक्करण (NETD) में प्रजातियों से एक धनायनित अभिकर्मक में स्थानांतरित किया जाता है:<ref>{{cite journal | vauthors = Coon JJ, Shabanowitz J, Hunt DF, Syka JE | title = पेप्टाइड आयनों का इलेक्ट्रॉन स्थानांतरण पृथक्करण| journal = Journal of the American Society for Mass Spectrometry | volume = 16 | issue = 6 | pages = 880–2 | date = June 2005 | pmid = 15907703 | doi = 10.1016/j.jasms.2005.01.015 | doi-access = free}}</ref> | विखंडन एक अवक्षेपित प्रजाति के साथ भी हो सकता है, जिसमें एक इलेक्ट्रॉन को एक नकारात्मक इलेक्ट्रॉन हस्तांतरण पृथक्करण (NETD) में प्रजातियों से एक धनायनित अभिकर्मक में स्थानांतरित किया जाता है:<ref>{{cite journal | vauthors = Coon JJ, Shabanowitz J, Hunt DF, Syka JE | title = पेप्टाइड आयनों का इलेक्ट्रॉन स्थानांतरण पृथक्करण| journal = Journal of the American Society for Mass Spectrometry | volume = 16 | issue = 6 | pages = 880–2 | date = June 2005 | pmid = 15907703 | doi = 10.1016/j.jasms.2005.01.015 | doi-access = free}}</ref> | ||
| Line 81: | Line 83: | ||
इस स्थानांतरण घटना के बाद, इलेक्ट्रॉन की कमी वाले ईओण आंतरिक पुनर्व्यवस्था और विखंडन (मास स्पेक्ट्रोमेट्री) से गुजरते हैं। NETD [[इलेक्ट्रॉन-अलगाव पृथक्करण]] (EDD) का ईओण/ईओण एनालॉग है। | इस स्थानांतरण घटना के बाद, इलेक्ट्रॉन की कमी वाले ईओण आंतरिक पुनर्व्यवस्था और विखंडन (मास स्पेक्ट्रोमेट्री) से गुजरते हैं। NETD [[इलेक्ट्रॉन-अलगाव पृथक्करण]] (EDD) का ईओण/ईओण एनालॉग है। | ||
NETD C<sub>α</sub>-C संबंध पर आधार के साथ पेप्टाइड और प्रोटीन को खंडित करने के साथ संगत है। परिणामी टुकड़े सामान्यतः | NETD C<sub>α</sub>-C संबंध पर आधार के साथ पेप्टाइड और प्रोटीन को खंडित करने के साथ संगत है। परिणामी टुकड़े सामान्यतः a- और x-प्रकार के उत्पाद आयन होते हैं। | ||
====इलेक्ट्रॉन-अनासक्ति पृथक्करण==== | ====इलेक्ट्रॉन-अनासक्ति पृथक्करण==== | ||
| Line 89: | Line 91: | ||
सकारात्मक रूप से चार्ज किए गए पेप्टाइड्स और धनायनित अभिकर्मकों के बीच प्रतिक्रिया,<ref>{{cite journal | vauthors = Chingin K, Makarov A, Denisov E, Rebrov O, Zubarev RA | title = उच्च-ऊर्जा वाले धनायनों के एक बीम के साथ सक्रिय रूप से चार्ज किए गए जैविक आयनों का विखंडन| journal = Analytical Chemistry | volume = 86 | issue = 1 | pages = 372–9 | date = January 2014 | pmid = 24236851| doi = 10.1021/ac403193k }}</ref> जिसे चार्ज ट्रांसफर पृथक्करण (सीटीडी) के रूप में भी जाना जाता है,<ref>{{cite journal | vauthors = Hoffmann WD, Jackson GP | title = किलोइलेक्ट्रॉनवोल्ट हीलियम केशन का उपयोग करके पेप्टाइड केशन का चार्ज ट्रांसफर डिसोसिएशन (CTD) मास स्पेक्ट्रोमेट्री| journal = Journal of the American Society for Mass Spectrometry | volume = 25 | issue = 11 | pages = 1939–43 | date = November 2014 | pmid = 25231159| doi = 10.1007/s13361-014-0989-6 | bibcode = 2014JASMS..25.1939H | s2cid = 1400057}}</ref>को हाल ही में कम-चार्ज स्थिति (1+ या 2+) पेप्टाइड्स के लिए एक वैकल्पिक उच्च-ऊर्जा विखंडन मार्ग के रूप में प्रदर्शित किया गया है। अभिकर्मक के रूप में हीलियम धनायनों का उपयोग करते हुए CTD का प्रस्तावित तंत्र है: | सकारात्मक रूप से चार्ज किए गए पेप्टाइड्स और धनायनित अभिकर्मकों के बीच प्रतिक्रिया,<ref>{{cite journal | vauthors = Chingin K, Makarov A, Denisov E, Rebrov O, Zubarev RA | title = उच्च-ऊर्जा वाले धनायनों के एक बीम के साथ सक्रिय रूप से चार्ज किए गए जैविक आयनों का विखंडन| journal = Analytical Chemistry | volume = 86 | issue = 1 | pages = 372–9 | date = January 2014 | pmid = 24236851| doi = 10.1021/ac403193k }}</ref> जिसे चार्ज ट्रांसफर पृथक्करण (सीटीडी) के रूप में भी जाना जाता है,<ref>{{cite journal | vauthors = Hoffmann WD, Jackson GP | title = किलोइलेक्ट्रॉनवोल्ट हीलियम केशन का उपयोग करके पेप्टाइड केशन का चार्ज ट्रांसफर डिसोसिएशन (CTD) मास स्पेक्ट्रोमेट्री| journal = Journal of the American Society for Mass Spectrometry | volume = 25 | issue = 11 | pages = 1939–43 | date = November 2014 | pmid = 25231159| doi = 10.1007/s13361-014-0989-6 | bibcode = 2014JASMS..25.1939H | s2cid = 1400057}}</ref>को हाल ही में कम-चार्ज स्थिति (1+ या 2+) पेप्टाइड्स के लिए एक वैकल्पिक उच्च-ऊर्जा विखंडन मार्ग के रूप में प्रदर्शित किया गया है। अभिकर्मक के रूप में हीलियम धनायनों का उपयोग करते हुए CTD का प्रस्तावित तंत्र है: | ||
:<math chem>\ce{{[{M}+H]^1+} + He+ ->} \left[ \ce{[{M}+H]^2+} \right]^* + \ce{He^0 -> fragments}</math> | :<math chem>\ce{{[{M}+H]^1+} + He+ ->} \left[ \ce{[{M}+H]^2+} \right]^* + \ce{He^0 -> fragments}</math> | ||
प्रारंभिक रिपोर्टें हैं कि CTD पेप्टाइड्स के बैकबोन C<sub>α</sub>-C बॉन्ड | प्रारंभिक रिपोर्टें हैं कि CTD पेप्टाइड्स के बैकबोन C<sub>α</sub>-C बॉन्ड अनुभेदन का कारण बनता है और a•- और x-प्रकार के उत्पाद आयन प्रदान करता है। | ||
=== फोटोपृथक्करण === | === फोटोपृथक्करण === | ||
| Line 96: | Line 98: | ||
:<chem>{AB+} + \mathit{h\nu} -> {A} + B+</chem> | :<chem>{AB+} + \mathit{h\nu} -> {A} + B+</chem> | ||
कहाँ <math>h\nu</math> ईओण द्वारा अवशोषित फोटॉन का प्रतिनिधित्व करता है। पराबैंगनी लेसरों का उपयोग किया जा सकता है, लेकिन जैव अणुओं के अत्यधिक विखंडन का कारण बन सकता है।<ref name="pmid16401510">{{cite book | vauthors = Morgan JW, Hettick JM, Russell DH | title = जैविक मास स्पेक्ट्रोमेट्री| chapter = Peptide Sequencing by MALDI 193‐nm Photodissociation TOF MS | volume = 402 | pages = 186–209 | year = 2005 | pmid = 16401510 | doi = 10.1016/S0076-6879(05)02006-9 | series = Methods in Enzymology | isbn = 9780121828073 }}</ref> | कहाँ <math>h\nu</math> ईओण द्वारा अवशोषित फोटॉन का प्रतिनिधित्व करता है। पराबैंगनी लेसरों का उपयोग किया जा सकता है, लेकिन जैव अणुओं के अत्यधिक विखंडन का कारण बन सकता है।<ref name="pmid16401510">{{cite book | vauthors = Morgan JW, Hettick JM, Russell DH | title = जैविक मास स्पेक्ट्रोमेट्री| chapter = Peptide Sequencing by MALDI 193‐nm Photodissociation TOF MS | volume = 402 | pages = 186–209 | year = 2005 | pmid = 16401510 | doi = 10.1016/S0076-6879(05)02006-9 | series = Methods in Enzymology | isbn = 9780121828073 }}</ref> | ||
==== [[ अवरक्त |अवरक्त]] | ==== [[ अवरक्त |अवरक्त]] बहुफोटोन पृथक्करण ==== | ||
अवरक्त फोटॉन ईओणों को गर्म करेंगे और उनमें से पर्याप्त अवशोषित होने पर विघटन का कारण बनेंगे। इस प्रक्रिया को [[इन्फ्रारेड मल्टीफ़ोटो पृथक्करण|अवरक्त | अवरक्त फोटॉन ईओणों को गर्म करेंगे और उनमें से पर्याप्त अवशोषित होने पर विघटन का कारण बनेंगे। इस प्रक्रिया को [[इन्फ्रारेड मल्टीफ़ोटो पृथक्करण|अवरक्त बहुफ़ोटो पृथक्करण]] (आईआरएमपीडी) कहा जाता है और इसे प्रायः [[कार्बन डाइऑक्साइड लेजर]] और ईओण प्रपाशन मास स्पेक्ट्रोमीटर पूरा किया जाता है।<ref name="pmid7526742">{{cite journal | vauthors = Little DP, Speir JP, Senko MW, O'Connor PB, McLafferty FW | title = बायोमोलेक्यूल सीक्वेंसिंग के लिए बड़े बहु आवेशित आयनों का इन्फ्रारेड मल्टीफ़ोटो पृथक्करण| journal = Analytical Chemistry | volume = 66 | issue = 18 | pages = 2809–15 | date = September 1994 | pmid = 7526742 | doi = 10.1021/ac00090a004}}</ref> | ||
==== ब्लैकबॉडी अवरक्त विकिरण पृथक्करण ==== | ==== ब्लैकबॉडी अवरक्त विकिरण पृथक्करण ==== | ||
ब्लैकबॉडी विकिरण का उपयोग ब्लैकबॉडी अवरक्त विकिरण पृथक्करण (ब्लैकबॉडी इंफ्रारेड रेडियेटिव डिसोसिएशन) (BIRD) नामक तकनीक में फोटोपृथक्करण के लिए किया जा सकता है।<ref name="pmid16525512">{{cite journal | vauthors = Schnier PD, Price WD, Jockusch RA, Williams ER | title = Blackbody infrared radiative dissociation of bradykinin and its analogues: energetics, dynamics, and evidence for salt-bridge structures in the gas phase | journal = Journal of the American Chemical Society | volume = 118 | issue = 30 | pages = 7178–89 | date = July 1996 | pmid = 16525512 | pmc = 1393282 | doi = 10.1021/ja9609157 }}</ref> BIRD विधि में, अवरक्त प्रकाश बनाने के लिए पूरे मास स्पेक्ट्रोमीटर निर्वात कक्ष को गर्म किया जाता है। | ब्लैकबॉडी विकिरण का उपयोग ब्लैकबॉडी अवरक्त विकिरण पृथक्करण (ब्लैकबॉडी इंफ्रारेड रेडियेटिव डिसोसिएशन) (BIRD) नामक तकनीक में फोटोपृथक्करण के लिए किया जा सकता है।<ref name="pmid16525512">{{cite journal | vauthors = Schnier PD, Price WD, Jockusch RA, Williams ER | title = Blackbody infrared radiative dissociation of bradykinin and its analogues: energetics, dynamics, and evidence for salt-bridge structures in the gas phase | journal = Journal of the American Chemical Society | volume = 118 | issue = 30 | pages = 7178–89 | date = July 1996 | pmid = 16525512 | pmc = 1393282 | doi = 10.1021/ja9609157 }}</ref> BIRD विधि में, अवरक्त प्रकाश बनाने के लिए पूरे मास स्पेक्ट्रोमीटर निर्वात कक्ष को गर्म किया जाता है। BIRD विकिरण का उपयोग ईओणों के तेजी से अधिक ऊर्जावान [[आणविक कंपन]] को उत्तेजित करने के लिए जब तक कि एक बंधन टूट न जाए, जिससे टुकड़े बन जाएं करता है।<ref name="pmid16525512"/><ref>{{cite journal | vauthors = Dunbar RC | title = BIRD (blackbody infrared radiative dissociation): evolution, principles, and applications | journal = Mass Spectrometry Reviews | volume = 23 | issue = 2 | pages = 127–58 | year = 2004 | pmid = 14732935 | doi = 10.1002/mas.10074 | bibcode = 2004MSRv...23..127D}}</ref> यह अवरक्त बहुफ़ोटो पृथक्करण के समान है जो अवरक्त लाइट का भी उपयोग एक अलग स्रोत से।<ref name="pmid15481084"/>BIRD का उपयोग प्रायः फूरियर रूपांतरण ईओण साइक्लोट्रॉन अनुनाद मास स्पेक्ट्रोमेट्री के साथ किया जाता है। | ||
=== सतह प्रेरित पृथक्करण === | === सतह प्रेरित पृथक्करण === | ||
सतह-प्रेरित पृथक्करण के साथ, विखंडन उच्च | सतह-प्रेरित पृथक्करण के साथ, विखंडन उच्च शून्यक के तहत सतह के साथ ईओण की टकराव का परिणाम है।<ref>{{Cite journal| last1 = Grill | first1 = Verena | year = 2001 | title = Collisions of ions with surfaces at chemically relevant energies: Instrumentation and phenomena | journal = Review of Scientific Instruments | volume = 72 | page = 3149 | doi = 10.1063/1.1382641 | last2 = Shen | first2 = Jianwei | last3 = Evans | first3 = Chris | last4 = Cooks | first4 = R. Graham | name-list-style = vanc | issue = 8|bibcode = 2001RScI...72.3149G}}</ref><ref>{{Cite journal| last = Mabud | first = M. | year = 1985 | title = आणविक आयनों की सतह-प्रेरित पृथक्करण| journal = International Journal of Mass Spectrometry and Ion Processes | volume = 67 | pages = 285–294 | doi = 10.1016/0168-1176(85)83024-X | issue = 3|bibcode = 1985IJMSI..67..285M}}</ref> आज, सतह-प्रेरित पृथक्करण का उपयोग ईओणों की एक विस्तृत श्रृंखला को विखंडित करने के लिए किया जाता है। वर्षों पहले, केवल कम मास, एकल आवेशित प्रजातियों पर सतह-प्रेरित पृथक्करण का उपयोग करना सामान्य था क्योंकि ईओणीकरण विधियाँ और मास विश्लेषक प्रौद्योगिकियाँ उच्च m/z के ईओणों को ठीक से बनाने, संचारित करने या उनकी विशेषता बताने के लिए पर्याप्त उन्नत नहीं थीं। समय के साथ स्वर्ण पर , CF से बना स्व-संकलित मोनोलेयर सतहें CF<sub>3</sub>(CF<sub>2</sub>)<sub>10</sub>CH<sub>2</sub>CH<sub>2</sub>S एक टेंडेम स्पेक्ट्रोमीटर में सतह प्रेरित पृथक्करण सबसे प्रमुख रूप से प्रयोग की जाने वाली टकराव की सतह रही है। स्व-संकलित मोनोलेयर ने आने वाले ईओणों की टकराव के लिए अपने विशेष रूप से बड़े प्रभावी मास के कारण सबसे वांछनीय टकराव लक्ष्य के रूप में काम किया है। इसके अतिरिक्त, ये सतहें कठोर फ्लोरोकार्बन श्रृंखलाओं से बनी होती हैं, जो प्रक्षेप्य ईओणों की ऊर्जा को महत्वपूर्ण रूप से कम नहीं करती हैं। धातु की सतह से आने वाले ईओणों में सुगम इलेक्ट्रॉन हस्तांतरण का विरोध करने की उनकी क्षमता के कारण फ्लोरोकार्बन श्रृंखला भी उपयोगी होती है।<ref name="Surface-Induced Dissociation: An Eff">{{cite journal |last1=Stiving |first1=Alyssa |last2=VanAernum |first2=Zachary |last3=Busch |first3=Florian |last4=Harvey |first4=Sophie |last5=Sarni |first5=Samantha |last6=Wysocki |first6=Vicki |title=Surface-Induced Dissociation: An Effective Method for Characterization of Protein Quaternary Structure |journal=Analytical Chemistry |date=9 November 2018 |volume=91 |issue=1 |pages=190–191 |doi=10.1021/acs.analchem.8b05071 |pmc=6571034 |pmid=30412666 }}</ref> सतह प्रेरित पृथक्करण की उप-परिसरों का उत्पादन करने की क्षमता जो स्थिर रहती है और संयोजकता पर मूल्यवान जानकारी प्रदान करती है, किसी भी अन्य पृथक्करण तकनीक से बेजोड़ है। चूंकि सतह-प्रेरित पृथक्करण से निर्मित मिश्रित स्थिर होते हैं और खंड पर आवेश के वितरण को बनाए रखते हैं, यह एक अद्वितीय स्पेक्ट्रा का उत्पादन करता है जो एक संकरे m/z वितरण के आसपास केंद्रित होता है। सतह-प्रेरित पृथक्करण उत्पाद और जिस ऊर्जा पर वे बनते हैं, वे मिश्रित की ताकत और टोपोलॉजी को दर्शाते हैं। अद्वितीय पृथक्करण पैटर्न परिसर की चतुर्धातुक संरचना की खोज में मदद करते हैं। सममित आवेश वितरण और पृथक्करण निर्भरता सतह-प्रेरित पृथक्करण के लिए अद्वितीय हैं और किसी भी अन्य पृथक्करण तकनीक से निर्मित स्पेक्ट्रा को विशिष्ट बनाते हैं।<ref name="Surface-Induced Dissociation: An Eff"/> | ||
सतह-प्रेरित पृथक्करण तकनीक ईओण-गतिशीलता मास स्पेक्ट्रोमेट्री (IM-MS) पर भी लागू होती है। इस तकनीक के लिए तीन अलग-अलग तरीकों में टोपोलॉजी के लक्षण वर्णन, | सतह-प्रेरित पृथक्करण तकनीक ईओण-गतिशीलता मास स्पेक्ट्रोमेट्री (IM-MS) पर भी लागू होती है। इस तकनीक के लिए तीन अलग-अलग तरीकों में टोपोलॉजी के लक्षण वर्णन, अंतरc संयोजकता और प्रोटीन संरचना के लिए संक्षिप्त करने की परिमाण का विश्लेषण सम्मिलित है। प्रोटीन संरचना का संक्षिप्त करना सतह-प्रेरित पृथक्करण तकनीक का सबसे अधिक प्रयोग किया जाने वाला अनुप्रयोग है। ईओण-गतिशीलता मास स्पेक्ट्रोमेट्री (IM-MS) के लिए, सतह-प्रेरित पृथक्करण का उपयोग तीन अलग-अलग प्रकार के प्रोटीन परिसरों के स्रोत सक्रिय पूर्ववर्तीों के पृथक्करण के लिए किया जाता है: C-रिएक्टिव प्रोटीन (CRP), ट्रांसथायरेटिन (TTR), और कॉनकावेलिन A (Con A) . इस पद्धति का उपयोग इन परिसरों में से प्रत्येक के लिए संक्षिप्त परिमाण का निरीक्षण करने के लिए किया जाता है। इस अवलोकन के लिए, सतह-प्रेरित पृथक्करण ने पूर्ववर्ती ईओणों की संरचनाओं को दिखाया जो सतह से टकराने से पहले उपस्थिति थीं। IM-MS सतह-प्रेरित पृथक्करण का उपयोग प्रत्येक प्रोटीन की परिमाण के संरूपण के प्रत्यक्ष माप के रूप में करता है।<ref>{{Cite journal|last1=Quintyn|first1=Royston S.|last2=Zhou|first2=Mowei|last3=Yan|first3=Jing|last4=Wysocki|first4=Vicki H.|date=2015-12-01|title=गैस-चरण मल्टीमेरिक प्रोटीन परिसरों के विभिन्न संरचनात्मक रूपों को अलग करने के लिए एक उपकरण के रूप में सतह-प्रेरित पृथक्करण द्रव्यमान स्पेक्ट्रा|journal=Analytical Chemistry|volume=87|issue=23|pages=11879–11886|doi=10.1021/acs.analchem.5b03441|pmid=26499904|issn=0003-2700}}</ref> | ||
सांध्वनिक अंतरण ईओण द्विताणुत्वर अनुनाद (FTICR) बड़े स्तर पर माप लेने वाले उपकरणों को अति उच्च समाधान और उच्च मास सटीकता प्रदान करने में सक्षम हैं। ये विशेषताएं FTICR मास स्पेक्ट्रोमीटर को विभिन्न प्रकार के अनुप्रयोगों के लिए एक उपयोगी उपकरण बनाती हैं।<ref>{{Cite journal|last1=Laskin|first1=Julia|author-link=Julia Laskin|last2=Futrell|first2=Jean H.|date=2005|title=एफटी-आईसीआर मास स्पेक्ट्रोमेट्री में बड़े लोन का सक्रियण|journal=Mass Spectrometry Reviews|volume=24|issue=2|pages=135–167|doi=10.1002/mas.20012|pmid=15389858|issn=0277-7037|bibcode=2005MSRv...24..135L|url=https://zenodo.org/record/1229281}}</ref>जैसे कई पृथक्करण प्रयोगों जैसे टकराव-प्रेरित पृथक्करण (CID, इलेक्ट्रॉन स्थानांतरण पृथक्करण (ETD),<ref>{{Cite journal|last1=Kaplan|first1=Desmond A.|last2=Hartmer|first2=Ralf|last3=Speir|first3=J. Paul|last4=Stoermer|first4=Carsten|last5=Gumerov|first5=Dmitry|last6=Easterling|first6=Michael L.|last7=Brekenfeld|first7=Andreas|last8=Kim|first8=Taeman|last9=Laukien|first9=Frank|last10=Park|first10=Melvin A.|date=2008|title=हाइब्रिड क्वाड्रुपोल-हेक्सापोल फूरियर ट्रांसफॉर्म आयन साइक्लोट्रॉन रेजोनेंस मास स्पेक्ट्रोमीटर के हेक्सापोल टक्कर सेल में इलेक्ट्रॉन स्थानांतरण पृथक्करण|journal=Rapid Communications in Mass Spectrometry|volume=22|issue=3|pages=271–278|doi=10.1002/rcm.3356|pmid=18181247|issn=0951-4198|bibcode=2008RCMS...22..271K}}</ref> और दूसरे। इसके अतिरिक्त, सतह- मौलिक पेप्टाइड विखंडन के अध्ययन के लिए इस उपकरण के साथ प्रेरित पृथक्करण लागू किया गया है। विशेष रूप से, SID को आईसीआर उपकरण के भीतर गैस-चरण विखंडन के ऊर्जावान और गतिकी के अध्ययन के लिए लागू किया गया है।<ref>{{Cite journal|last=Laskin|first=Julia|date=June 2015|title=Surface-Induced Dissociation: A Unique Tool for Studying Energetics and Kinetics of the Gas-Phase Fragmentation of Large Ions|journal=European Journal of Mass Spectrometry|volume=21|issue=3|pages=377–389|doi=10.1255/ejms.1358|pmid=26307719|s2cid=19837927|issn=1469-0667}}</ref> इस दृष्टिकोण का उपयोग प्रोटोनेटेड पेप्टाइड्स, विषम-इलेक्ट्रॉन पेप्टाइड आयनों, अतिरिक्त-सहसंयोजक लिगैंड-पेप्टाइड कॉम्प्लेक्स और लिगेटेड धातु समूहों के गैस-चरण विखंडन को समझने के लिए किया गया है | |||
== [[मात्रात्मक प्रोटिओमिक्स]] == | == [[मात्रात्मक प्रोटिओमिक्स]] == | ||
एक उदाहरण में प्रोटीन की सापेक्षिक या निरपेक्ष मात्रा निर्धारित करने के लिए मात्रात्मक प्रोटिओमिक्स का उपयोग किया जाता है।<ref>{{cite journal | vauthors = Ong SE, Mann M | title = मास स्पेक्ट्रोमेट्री-आधारित प्रोटिओमिक्स मात्रात्मक बदल जाता है| journal = Nature Chemical Biology | volume = 1 | issue = 5 | pages = 252–62 | date = October 2005 | pmid = 16408053 | doi = 10.1038/nchembio736| s2cid = 32054251 }}</ref><ref>{{cite journal | vauthors = Bantscheff M, Schirle M, Sweetman G, Rick J, Kuster B | title = Quantitative mass spectrometry in proteomics: a critical review | journal = Analytical and Bioanalytical Chemistry | volume = 389 | issue = 4 | pages = 1017–31 | date = October 2007 | pmid = 17668192 | doi = 10.1007/s00216-007-1486-6 | doi-access = free}}</ref><ref>{{cite book | vauthors = Nikolov M, Schmidt C, Urlaub H | chapter = Quantitative mass spectrometry-based proteomics: an overview | volume = 893 | pages = 85–100 | year = 2012 | pmid = 22665296 | doi = 10.1007/978-1-61779-885-6_7 | series = Methods in Molecular Biology | isbn = 978-1-61779-884-9 | title = प्रोटिओमिक्स में मात्रात्मक तरीके| hdl = 11858/00-001M-0000-0029-1A75-8| s2cid = 33009117 }}</ref> कई मात्रात्मक प्रोटिओमिक्स विधियाँ | एक उदाहरण में प्रोटीन की सापेक्षिक या निरपेक्ष मात्रा निर्धारित करने के लिए मात्रात्मक प्रोटिओमिक्स का उपयोग किया जाता है।<ref>{{cite journal | vauthors = Ong SE, Mann M | title = मास स्पेक्ट्रोमेट्री-आधारित प्रोटिओमिक्स मात्रात्मक बदल जाता है| journal = Nature Chemical Biology | volume = 1 | issue = 5 | pages = 252–62 | date = October 2005 | pmid = 16408053 | doi = 10.1038/nchembio736| s2cid = 32054251 }}</ref><ref>{{cite journal | vauthors = Bantscheff M, Schirle M, Sweetman G, Rick J, Kuster B | title = Quantitative mass spectrometry in proteomics: a critical review | journal = Analytical and Bioanalytical Chemistry | volume = 389 | issue = 4 | pages = 1017–31 | date = October 2007 | pmid = 17668192 | doi = 10.1007/s00216-007-1486-6 | doi-access = free}}</ref><ref>{{cite book | vauthors = Nikolov M, Schmidt C, Urlaub H | chapter = Quantitative mass spectrometry-based proteomics: an overview | volume = 893 | pages = 85–100 | year = 2012 | pmid = 22665296 | doi = 10.1007/978-1-61779-885-6_7 | series = Methods in Molecular Biology | isbn = 978-1-61779-884-9 | title = प्रोटिओमिक्स में मात्रात्मक तरीके| hdl = 11858/00-001M-0000-0029-1A75-8| s2cid = 33009117 }}</ref> कई मात्रात्मक प्रोटिओमिक्स विधियाँ टेंडेम मास स्पेक्ट्रोमेट्री पर आधारित हैं। MS/MS जटिल जैव-अणुओं की संरचनात्मक व्याख्या के लिए एक सतह प्रक्रिया बन गई है।<ref>{{cite journal |vauthors = Maher S, Jjunju FP, Taylor S | title = 100 years of mass spectrometry: Perspectives and future trends |journal=Rev. Mod. Phys. |volume=87 |issue=1 |pages=113–135 |year=2015 |doi= 10.1103/RevModPhys.87.113 |bibcode=2015RvMP...87..113M}}</ref> | ||
मात्रात्मक प्रोटिओमिक्स के लिए सामान्यतः प्रयोग की जाने वाली एक विधि समदाब रेखीय उपनाम अंकितक है। समदाब रेखीय उपनाम अंकितक एक ही विश्लेषण में कई उदाहरण से एक साथ पहचान और प्रोटीन की मात्रा का ठहराव सक्षम बनाता है। प्रोटीन की मात्रा निर्धारित करने के लिए, [[पेप्टाइड्स]] को रासायनिक उपनाम के साथ अंकितक किया जाता है जिनकी संरचना और | मात्रात्मक प्रोटिओमिक्स के लिए सामान्यतः प्रयोग की जाने वाली एक विधि समदाब रेखीय उपनाम अंकितक है। समदाब रेखीय उपनाम अंकितक एक ही विश्लेषण में कई उदाहरण से एक साथ पहचान और प्रोटीन की मात्रा का ठहराव सक्षम बनाता है। प्रोटीन की मात्रा निर्धारित करने के लिए, [[पेप्टाइड्स]] को रासायनिक उपनाम के साथ अंकितक किया जाता है जिनकी संरचना और नाम मात्र मास समान होते हैं, लेकिन उनकी संरचना में भारी समस्थानिकों के वितरण में भिन्नता होती है। ये उपनाम, जिन्हें सामान्यतः टेंडेम मास उपनाम के रूप में संदर्भित किया जाता है, को बनावट किया गया है जिससे बड़े पैमाने पर मास स्पेक्ट्रोमेट्री के समय उच्च-ऊर्जा संपार्श्विक-प्रेरित पृथक्करण (HCD) पर एक विशिष्ट संयोजक क्षेत्र में बड़े पैमाने पर उपनाम अलग-अलग मास केसूचना देने वाले ईओणों को उत्पन्न करता है। MS/MS स्पेक्ट्रा मेंसूचना देने वाले ईओणों की तीव्रता की तुलना करके प्रोटीन की मात्रा निर्धारित की जाती है।। व्यावसायिक रूप से उपलब्ध दो समदाब रेखीय उपनाम iTRAQ और TMT अभिकर्मक हैं। | ||
=== सापेक्ष और निरपेक्ष मात्रा के लिए समदाब रेखीय उपनाम (iTRAQ) === | === सापेक्ष और निरपेक्ष मात्रा के लिए समदाब रेखीय उपनाम (iTRAQ) === | ||
[[Image:Isobaric labeling.png|right|thumb|300px| | [[Image:Isobaric labeling.png|right|thumb|300px|टेंडेम मास स्पेक्ट्रोमेट्री के लिए आइसोबैरिक अंकितकिंग: प्रोटीन को कोशिकाओं से निकाला जाता है, पचाया जाता है और उसी मास के उपनाम के साथ अंकितक किया जाता है। जब MS/MS केसमय खंडित किया जाता है, तोसूचना देने वाले ईओण उदाहरण में पेप्टाइड्स की सापेक्ष मात्रा दिखाते हैं।]]सापेक्ष और निरपेक्ष परिमाणीकरण के लिए समदाब रेखीय उपनाम टेंडेम मास स्पेक्ट्रोमेट्री के लिए एक अभिकर्मक है जिसका उपयोग एक ही प्रयोग में विभिन्न स्रोतों से प्रोटीन की मात्रा निर्धारित करने के लिए किया जाता है।<ref>{{cite journal | vauthors = Ross PL, Huang YN, Marchese JN, Williamson B, Parker K, Hattan S, Khainovski N, Pillai S, Dey S, Daniels S, Purkayastha S, Juhasz P, Martin S, Bartlet-Jones M, He F, Jacobson A, Pappin DJ | title = एमाइन-प्रतिक्रियाशील आइसोबैरिक टैगिंग अभिकर्मकों का उपयोग करके सैक्रोमाइसेस सेरेविसिया में बहुसंकेतित प्रोटीन परिमाणीकरण| journal = Molecular & Cellular Proteomics | volume = 3 | issue = 12 | pages = 1154–69 | date = December 2004 | pmid = 15385600 | doi = 10.1074/mcp.M400129-MCP200 | doi-access = free}}</ref><ref>{{cite journal | vauthors = Zieske LR | title = प्रोटीन कॉम्प्लेक्स और प्रोफाइलिंग अध्ययन के लिए iTRAQ अभिकर्मक प्रौद्योगिकी के उपयोग पर एक परिप्रेक्ष्य| journal = Journal of Experimental Botany | volume = 57 | issue = 7 | pages = 1501–8 | year = 2006 | pmid = 16574745 | doi = 10.1093/jxb/erj168 | doi-access = free}}</ref><ref>{{cite journal | vauthors = Gafken PR, Lampe PD | title = मास स्पेक्ट्रोमेट्री द्वारा फॉस्फोप्रोटीन को चिह्नित करने के तरीके| journal = Cell Communication & Adhesion | volume = 13 | issue = 5–6 | pages = 249–62 | year = 2006 | pmid = 17162667 | pmc = 2185548 | doi = 10.1080/15419060601077917}}</ref>यह स्थिर [[समस्थानिक लेबलिंग|समस्थानिक अंकितग]] अणुओं का उपयोग करता है जो प्रोटीन के N-टर्मिनस और [[पक्ष श्रृंखला]] [[अमाइन]] के साथ एक [[सहसंयोजक बंधन]] बना सकते हैं। ITRAQ अभिकर्मकों का उपयोग विभिन्न उदाहरण से पेप्टाइड्स को अंकितक करने के लिए किया जाता है जिन्हें [[तरल क्रोमाटोग्राफी]] और टेंडेम मास स्पेक्ट्रोमेट्री द्वारा एकत्रित और विश्लेषण किया जाता है। संलग्न उपनाम का विखंडन एक कम आणविक माससूचना देने वाले ईओण उत्पन्न करता है जिसका उपयोग पेप्टाइड्स और उन प्रोटीनों को अपेक्षाकृत मापने के लिए किया जा सकता है जिनसे वे उत्पन्न हुए थे। | ||
=== [[Index.php?title=अग्रानुक्रम मास टैग| | === [[Index.php?title=अग्रानुक्रम मास टैग|टेंडेम मास उपनाम]] (टीएमटी) === | ||
एक | एक टेंडेम मास उपनाम (टीएमटी) क आइसोबैरिक मास उपनाम रासायनिक अंकितक है जिसका उपयोग प्रोटीन मात्रा निर्धारण और पहचान के लिए किया जाता है।<ref>{{cite journal | vauthors = Thompson A, Schäfer J, Kuhn K, Kienle S, Schwarz J, Schmidt G, Neumann T, Johnstone R, Mohammed AK, Hamon C | title = Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS | journal = Analytical Chemistry | volume = 75 | issue = 8 | pages = 1895–904 | date = April 2003 | pmid = 12713048 | doi = 10.1021/ac0262560}}</ref> उपनाम में चार क्षेत्र माससूचना देने वाले, क्लीवेबल लिंकर, मास नॉर्मलाइजेशन और प्रोटीन रिएक्टिव ग्रुप होते हैं। टीएमटी अभिकर्मकों का उपयोग कोशिकाओं, ऊतकों या जैविक तरल पदार्थों से तैयार किए गए 2 से 11 विभिन्न पेप्टाइड उदाहरण का एक साथ विश्लेषण करने के लिए किया जा सकता है। हाल के विकास 16 और यहां तक कि 18 उदाहरण (क्रमशः 16plex या 18plex) तक का विश्लेषण करने की अनुमति देते हैं।<ref>{{Cite journal |last1=Li |first1=Jiaming |last2=Van Vranken |first2=Jonathan G. |last3=Pontano Vaites |first3=Laura |last4=Schweppe |first4=Devin K. |last5=Huttlin |first5=Edward L. |last6=Etienne |first6=Chris |last7=Nandhikonda |first7=Premchendar |last8=Viner |first8=Rosa |last9=Robitaille |first9=Aaron M. |last10=Thompson |first10=Andrew H. |last11=Kuhn |first11=Karsten |last12=Pike |first12=Ian |last13=Bomgarden |first13=Ryan D. |last14=Rogers |first14=John C. |last15=Gygi |first15=Steven P. |date=April 2020 |title=TMTpro reagents: a set of isobaric labeling mass tags enables simultaneous proteome-wide measurements across 16 samples |journal=Nature Methods |language=en |volume=17 |issue=4 |pages=399–404 |doi=10.1038/s41592-020-0781-4 |issn=1548-7105 |pmc=7302421 |pmid=32203386}}</ref><ref>{{Cite journal |last1=Li |first1=Jiaming |last2=Cai |first2=Zhenying |last3=Bomgarden |first3=Ryan D. |last4=Pike |first4=Ian |last5=Kuhn |first5=Karsten |last6=Rogers |first6=John C. |last7=Roberts |first7=Thomas M. |last8=Gygi |first8=Steven P. |last9=Paulo |first9=Joao A. |date=2021-05-07 |title=TMTpro-18plex: The Expanded and Complete Set of TMTpro Reagents for Sample Multiplexing |journal=Journal of Proteome Research |language=en |volume=20 |issue=5 |pages=2964–2972 |doi=10.1021/acs.jproteome.1c00168 |issn=1535-3893 |pmc=8210943 |pmid=33900084}}</ref> विभिन्न रासायनिक अभिक्रियाओं के साथ तीन प्रकार के टीएमटी अभिकर्मक उपलब्ध हैं: (1) प्राथमिक अमाइन (TMTduplex, TMTsixplex, TMT10plex plus TMT11-131C) की अंकितकिंग के लिए एक प्रतिक्रियाशील NHS एस्टर कार्यात्मक समूह, (2) मुक्त सल्फहाइड्रील्स की अंकितकिंग के लिए एक प्रतिक्रियाशील आयोडोसमूहाइल कार्यात्मक समूह (2) iodoTMT) और (3) कार्बोनिल्स (aminoxyTMT) की अंकितकिंग के लिए प्रतिक्रियाशील एल्कोक्सीमाइन कार्यात्मक समूह है। | ||
== अनुप्रयोग == | == अनुप्रयोग == | ||
=== पेप्टाइड्स === | === पेप्टाइड्स === | ||
[[Image:PeptideMSMS.jpg|right|thumb|300px|पेप्टाइड का क्रोमैटोग्राफी ट्रेस (ऊपर) और | [[Image:PeptideMSMS.jpg|right|thumb|300px|पेप्टाइड का क्रोमैटोग्राफी ट्रेस (ऊपर) और टेंडेम मास स्पेक्ट्रम (नीचे)।]]टेंडेम मास स्पेक्ट्रोमेट्री का उपयोग [[प्रोटीन अनुक्रमण]] के लिए किया जा सकता है।<ref>{{cite journal | vauthors = Angel TE, Aryal UK, Hengel SM, Baker ES, Kelly RT, Robinson EW, Smith RD | title = Mass spectrometry-based proteomics: existing capabilities and future directions | journal = Chemical Society Reviews | volume = 41 | issue = 10 | pages = 3912–28 | date = May 2012 | pmid = 22498958 | doi = 10.1039/c2cs15331a | pmc=3375054}}</ref> जब अक्षुण्ण प्रोटीन को मास विश्लेषक में प्रस्तुत किया जाता है, तो इसे [[नीचे-ऊपर प्रोटिओमिक्स|ऊपर]]-[[नीचे-ऊपर प्रोटिओमिक्स|नीचे]] प्रोटिओमिक्स कहा जाता है और जब प्रोटीन को छोटे पेप्टाइड्स में पचाया जाता है और बाद में मास स्पेक्ट्रोमीटर में प्रस्तुत किया जाता है, इसे [[नीचे-ऊपर प्रोटिओमिक्स]] कहा जाता है। [[शॉटगन प्रोटिओमिक्स|मशीनगन प्रोटिओमिक्स]] नीचे से ऊपर प्रोटिओमिक्स का एक प्रकार है जिसमें मिश्रण में प्रोटीन अलग होने से पहले पच जाते हैं और सामूहिक मास स्पेक्ट्रोमेट्री होते हैं। | ||
टेंडेममास स्पेक्ट्रोमेट्री एक [[पेप्टाइड अनुक्रम टैग|पेप्टाइड अनुक्रम उपनाम]] का उत्पादन कर सकती है जिसका उपयोग प्रोटीन डेटाबेस में पेप्टाइड की पहचान के लिए किया जा सकता है।<ref>{{cite journal | vauthors = Hardouin J | title = Protein sequence information by matrix-assisted laser desorption/ionization in-source decay mass spectrometry | journal = Mass Spectrometry Reviews | volume = 26 | issue = 5 | pages = 672–82 | year = 2007 | pmid = 17492750 | doi = 10.1002/mas.20142 | bibcode = 2007MSRv...26..672H}}</ref><ref>{{cite journal | vauthors = Shadforth I, Crowther D, Bessant C | title = उच्च-थ्रूपुट, स्वचालित पाइपलाइनों में उपयोग के लिए एमएस का उपयोग कर प्रोटीन और पेप्टाइड पहचान एल्गोरिदम| journal = Proteomics | volume = 5 | issue = 16 | pages = 4082–95 | date = November 2005 | pmid = 16196103 | doi = 10.1002/pmic.200402091| s2cid = 38068737 }}</ref><ref>{{cite journal | vauthors = Mørtz E, O'Connor PB, Roepstorff P, Kelleher NL, Wood TD, McLafferty FW, Mann M | title = अनुक्रम डेटा बेस के विरुद्ध टेंडेन मास वर्णक्रमीय डेटा का मिलान करके अक्षुण्ण प्रोटीन की अनुक्रम टैग पहचान| journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 93 | issue = 16 | pages = 8264–7 | date = August 1996 | pmid = 8710858 | pmc = 38658 | doi = 10.1073/pnas.93.16.8264 | bibcode = 1996PNAS...93.8264M| doi-access = free }}</ref> टेंडेम मास स्पेक्ट्रम से उत्पन्न होने वाले पेप्टाइड अंशों को इंगित करने के लिए एक संकेतन विकसित किया गया है।<ref>{{cite journal | vauthors = Roepstorff P, Fohlman J | title = पेप्टाइड्स के मास स्पेक्ट्रा में अनुक्रम आयनों के लिए एक सामान्य नामकरण का प्रस्ताव| journal = Biomedical Mass Spectrometry | volume = 11 | issue = 11 | pages = 601 | date = November 1984 | pmid = 6525415 | doi = 10.1002/bms.1200111109}}</ref> पेप्टाइड खंड ईओणों को a, b, या c द्वारा इंगित किया जाता है यदि चार्ज [[ N- टर्मिनस ]] पर और x, y या z द्वारा [[ सी टर्मिनल | C टर्मिनल]] पर बनाए रखा जाता है। सबस्क्रिप्ट टुकड़े में अमीनो अम्ल अवशेषों की संख्या को इंगित करता है। सुपरस्क्रिप्ट का उपयोग कभी-कभी आधार के विखंडन के अलावा उदासीन क्षति अमोनिया के क्षति और पानी के क्षति के लिए को इंगित करने के लिए किया जाता है। यद्यपि पेप्टाइड आधार का दरार अनुक्रमण और पेप्टाइड पहचान के लिए सबसे उपयोगी है, लेकिन उच्च ऊर्जा पृथक्करण स्थितियों के तहत अन्य टुकड़े ईओणों को देखा जा सकता है। इनमें साइड चेन क्षति ईओण d, v, w और अमोनियम ईओण<ref>{{cite journal|last1=Johnson|first1=Richard S.|last2=Martin|first2=Stephen A.|author3 = [[Klaus Biemann]]| name-list-style = vanc |title=पेप्टाइड्स के (एम + एच) + आयनों का टकराव-प्रेरित विखंडन। साइड चेन विशिष्ट अनुक्रम आयन|journal=International Journal of Mass Spectrometry and Ion Processes|date=December 1988|volume=86|pages=137–154|doi=10.1016/0168-1176(88)80060-0|bibcode=1988IJMSI..86..137J}}</ref><ref>{{cite journal | vauthors = Falick AM, Hines WM, Medzihradszky KF, Baldwin MA, Gibson BW | title = टेंडेम मास स्पेक्ट्रोमेट्री में उच्च-ऊर्जा टकराव-प्रेरित पृथक्करण द्वारा पेप्टाइड्स से उत्पन्न कम-द्रव्यमान आयन| journal = Journal of the American Society for Mass Spectrometry | volume = 4 | issue = 11 | pages = 882–93 | date = November 1993 | pmid = 24227532 | doi = 10.1016/1044-0305(93)87006-X | doi-access = free}}</ref> और विशेष अमीनो अम्ल अवशेषों से जुड़े अतिरिक्त अनुक्रम-विशिष्ट खंड ईओण सम्मिलित हैं।<ref>{{cite journal|last1=Downard|first1=Kevin M.|last2=Biemann|first2=Klaus |authorlink2 = Klaus Biemann| name-list-style = vanc |title=उच्च टक्कर ऊर्जा पर प्रोटोनेटेड पेप्टाइड्स के पृथक्करण द्वारा गठित मेथियोनीन विशिष्ट अनुक्रम आयन|journal=Journal of Mass Spectrometry|date=January 1995|volume=30|issue=1|pages=25–32|doi=10.1002/jms.1190300106|bibcode=1995JMSp...30...25D}}</ref> | |||
=== | === ओलिगोसेकेराइड्स === | ||
ओलिगोसेकेराइड्स को पेप्टाइड अनुक्रमण के समान प्रयोग से | ओलिगोसेकेराइड्स को पेप्टाइड अनुक्रमण के समान प्रयोग से टेंडेम मास स्पेक्ट्रोमेट्री का उपयोग करके अनुक्रमित किया जा सकता है।<ref>{{cite journal|vauthors=Zaia J|year=2004|title=ऑलिगोसेकेराइड्स का मास स्पेक्ट्रोमेट्री|journal=Mass Spectrometry Reviews|volume=23|issue=3|pages=161–227|bibcode=2004MSRv...23..161Z|doi=10.1002/mas.10073|pmid=14966796}}</ref> विखंडन सामान्यतः [[ ग्लाइकोसिडिक बंध ]] (B, C, Y और Z ईओणों) के दोनों ओर होता है, लेकिन एक संकर-चक्राकार अनुभेदन (x ईओण) में चीनी चक्राकार संरचना के माध्यम से अधिक ऊर्जावान परिस्थितियों में भी होता है। श्रृंखला के साथ दरार की स्थिति को इंगित करने के लिए फिर से अनुगामी सबस्क्रिप्ट का उपयोग किया जाता है। संकर चक्राकार अनुभेदन ईओणों के लिए संकर चक्राकार अनुभेदन की प्रकृति पूर्ववर्ती अभिलेख द्वारा इंगित की जाती है।<ref>{{Cite journal|author1=Bruno Domon|author2=Catherine E Costello|year=1988|title=A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates|journal=Glycoconj. J.|volume=5|issue=4|pages=397–409|doi=10.1007/BF01049915|s2cid=206787925 }}</ref><ref>{{cite journal|vauthors=Spina E, Cozzolino R, Ryan E, Garozzo D|date=August 2000|title=Sequencing of oligosaccharides by collision-induced dissociation matrix-assisted laser desorption/ionization mass spectrometry|journal=Journal of Mass Spectrometry|volume=35|issue=8|pages=1042–8|bibcode=2000JMSp...35.1042S|doi=10.1002/1096-9888(200008)35:8<1042::AID-JMS33>3.0.CO;2-Y|pmid=10973004}}</ref> | ||
=== ओलिगोन्यूक्लियोटाइड्स === | === ओलिगोन्यूक्लियोटाइड्स === | ||
टेंडेम मास स्पेक्ट्रोमेट्री डीएनए अनुक्रमण और [[आरएनए अनुक्रमण]] के लिए लागू किया गया है।<ref>{{cite journal | vauthors = Banoub JH, Newton RP, Esmans E, Ewing DF, Mackenzie G | title = न्यूक्लियोसाइड्स, न्यूक्लियोटाइड्स, ऑलिगोन्यूक्लियोटाइड्स और न्यूक्लिक एसिड के लक्षण वर्णन के लिए मास स्पेक्ट्रोमेट्री में हालिया विकास| journal = Chemical Reviews | volume = 105 | issue = 5 | pages = 1869–915 | date = May 2005 | pmid = 15884792 | doi = 10.1021/cr030040w}}</ref><ref>{{cite journal | vauthors = Thomas B, Akoulitchev AV | title = आरएनए का मास स्पेक्ट्रोमेट्री| journal = Trends in Biochemical Sciences | volume = 31 | issue = 3 | pages = 173–81 | date = March 2006 | pmid = 16483781 | doi = 10.1016/j.tibs.2006.01.004}}</ref> [[oligonucleotide|ओलिगोन्यूक्लियोटाइड्स]] ईओणों के गैस-चरण विखंडन के लिए एक संकेतन प्रस्तावित किया गया है।<ref>{{Cite journal | vauthors = Wu J, McLuckey SA | author-link2 = Scott A. McLuckey | year = 2004 | title = ऑलिगोन्यूक्लियोटाइड आयनों का गैस-चरण विखंडन| journal = International Journal of Mass Spectrometry | volume = 237 | pages = 197–241 | doi = 10.1016/j.ijms.2004.06.014 | issue = 2–3 |bibcode = 2004IJMSp.237..197W}}</ref> | |||
===नवजात स्क्रीनिंग === | ===नवजात स्क्रीनिंग(जाँच) === | ||
नवजात स्क्रीनिंग उपचार योग्य [[आनुवंशिक विकार]], [[अंतःस्त्राविका]], [[चयापचय की जन्मजात त्रुटि]] और[[ रुधिर ]]रोगों के लिए नवजात शिशुओं के परीक्षण की प्रक्रिया है।<ref>{{cite journal | vauthors = Tarini BA | title = The current revolution in newborn screening: new technology, old controversies | journal = Archives of Pediatrics & Adolescent Medicine | volume = 161 | issue = 8 | pages = 767–72 | date = August 2007 | pmid = 17679658 | doi = 10.1001/archpedi.161.8.767 | doi-access = free}}</ref><ref>{{cite journal | vauthors = Kayton A | title = Newborn screening: a literature review | journal = Neonatal Network | volume = 26 | issue = 2 | pages = 85–95 | year = 2007 | pmid = 17402600 | doi = 10.1891/0730-0832.26.2.85| s2cid = 28372085 }}</ref> 1990 के दशक की प्रारंम्भ में टेंडेम मास स्पेक्ट्रोमेट्री स्क्रीनिंग के विकास ने संभावित रूप से पता लगाने योग्य [[जन्मजात चयापचय रोग]] का एक बड़ा विस्तार किया जो रक्त में कार्बनिक अम्लों के स्तर को प्रभावित करते हैं।।<ref>{{cite journal | vauthors = Chace DH, Kalas TA, Naylor EW | title = नवजात शिशुओं के सूखे रक्त के नमूनों की बहुविश्लेषणात्मक जांच के लिए टैंडेम मास स्पेक्ट्रोमेट्री का उपयोग| journal = Clinical Chemistry | volume = 49 | issue = 11 | pages = 1797–817 | date = November 2003 | pmid = 14578311 | doi = 10.1373/clinchem.2003.022178 | doi-access = free}}</ref> | |||
नवजात स्क्रीनिंग उपचार योग्य [[आनुवंशिक विकार]], [[अंतःस्त्राविका]], [[चयापचय की जन्मजात त्रुटि]] और [[ रुधिर ]] रोगों के लिए नवजात शिशुओं के परीक्षण की प्रक्रिया है।<ref>{{cite journal | vauthors = Tarini BA | title = The current revolution in newborn screening: new technology, old controversies | journal = Archives of Pediatrics & Adolescent Medicine | volume = 161 | issue = 8 | pages = 767–72 | date = August 2007 | pmid = 17679658 | doi = 10.1001/archpedi.161.8.767 | doi-access = free}}</ref><ref>{{cite journal | vauthors = Kayton A | title = Newborn screening: a literature review | journal = Neonatal Network | volume = 26 | issue = 2 | pages = 85–95 | year = 2007 | pmid = 17402600 | doi = 10.1891/0730-0832.26.2.85| s2cid = 28372085 }}</ref> 1990 के दशक की | |||
== सीमा == | == सीमा == | ||
टेंडेम मास स्पेक्ट्रोमेट्री को एकल-कोशिका विश्लेषण के लिए लागू नहीं किया जा सकता क्योंकि यह इतनी छोटी मात्रा में कोशिका का विश्लेषण करने के लिए असंवेदनशील है। ये सीमाएं मुख्य रूप से विलायक के रासायनिक किंवदंती स्रोतों के कारण उपकरणों के भीतर अकुशल ईओण उत्पादन और ईओण क्षतियों के संयोजन के कारण हैं।<ref>{{Cite journal|last1=Angel|first1=Thomas E.|last2=Aryal|first2=Uma K.|last3=Hengel|first3=Shawna M.|last4=Baker|first4=Erin S.|last5=Kelly|first5=Ryan T.|last6=Robinson|first6=Errol W.|last7=Smith|first7=Richard D.|date=2012-05-21|title=Mass spectrometry based proteomics: existing capabilities and future directions|journal=Chemical Society Reviews|volume=41|issue=10|pages=3912–3928|doi=10.1039/c2cs15331a|issn=0306-0012|pmc=3375054|pmid=22498958}}</ref> | |||
== भविष्य का दृष्टिकोण == | == भविष्य का दृष्टिकोण == | ||
टेंडेम मास स्पेक्ट्रोमेट्री प्रोटीन लक्षण वर्णन, मिश्रित न्यूक्लियोप्रोटीन और अन्य जैविक संरचनाओं के लिए एक उपयोगी उपकरण होगा। यद्यपि, कुछ चुनौतियाँ जैसे मात्रात्मक और गुणात्मक रूप से प्रोटिओम के लक्षण वर्णन का विश्लेषण करना शेष हैं।<ref>{{Cite journal|last1=Han|first1=Xuemei|last2=Aslanian|first2=Aaron|last3=Yates|first3=John R.|date=October 2008|title=प्रोटिओमिक्स के लिए मास स्पेक्ट्रोमेट्री|journal=Current Opinion in Chemical Biology|volume=12|issue=5|pages=483–490|doi=10.1016/j.cbpa.2008.07.024|issn=1367-5931|pmc=2642903|pmid=18718552}}</ref> | |||
== यह भी देखें == | == यह भी देखें == | ||
*त्वरक जन स्पेक्ट्रोमेट्री | *त्वरक जन स्पेक्ट्रोमेट्री | ||
*[[क्रॉस सेक्शन (भौतिकी)]] | *[[क्रॉस सेक्शन (भौतिकी)|व्यापक प्रतिनिधित्व (भौतिकी)]] | ||
*मास-विश्लेषण ईओण- | *मास-विश्लेषण ईओण-गतिज-ऊर्जा स्पेक्ट्रोमेट्री | ||
*अनिमोलेक्युलर ईओण अपघटन | *अनिमोलेक्युलर ईओण अपघटन | ||
| Line 157: | Line 158: | ||
* [http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm An Introduction to Mass Spectrometry by Dr Alison E. Ashcroft] {{Webarchive|url=https://web.archive.org/web/20200808031742/http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm |date=8 August 2020 }} | * [http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm An Introduction to Mass Spectrometry by Dr Alison E. Ashcroft] {{Webarchive|url=https://web.archive.org/web/20200808031742/http://www.astbury.leeds.ac.uk/facil/MStut/mstutorial.htm |date=8 August 2020 }} | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category: | [[Category:CS1 English-language sources (en)]] | ||
[[Category:CS1 errors]] | |||
[[Category:Collapse templates]] | |||
[[Category: | |||
[[Category:Created On 18/06/2023]] | [[Category:Created On 18/06/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with broken file links]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Use dmy dates from March 2020]] | |||
[[Category:Webarchive template wayback links]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:टैंडेम मास स्पेक्ट्रोमेट्री| टैंडेम मास स्पेक्ट्रोमेट्री ]] | |||
Latest revision as of 12:56, 12 September 2023
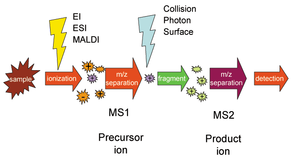
टेंडेम मास स्पेक्ट्रोमेट्री, जिसे MS/MS या के रूप में भी जाना जाता है, वाद्य विश्लेषण में एक तकनीक है जहां दो या दो से अधिक मास स्पेक्ट्रोमेट्री को रासायनिक उदाहरण का विश्लेषण करने की उनकी क्षमताओं को बढ़ाने के लिए अतिरिक्त प्रतिक्रिया चरण का उपयोग करके एक साथ जोड़ा जाता है।[1] टेंडेम MS का सामान्य उपयोग प्रोटीन और पेप्टाइड्स जैसे जैव अणुओं का विश्लेषण है।
किसी दिए गए उदाहरण के अणु ईओणित होते हैं और पहला स्पेक्ट्रोमीटर (निर्दिष्ट MS1) इन ईओणों को उनके मास-से-आवेश अनुपात (प्रायः m/z या m/Q के रूप में दिया जाता है) द्वारा अलग करता है। MS1 से आने वाले एक विशेष m/z-अनुपात के ईओणों का चयन किया जाता है और फिर उन्हें छोटे विखंडन वाले ईओणों जैसे टकराव-प्रेरित पृथक्करण, ईओण-अणु प्रतिक्रिया, या फोटोपृथक्करण में विभाजित किया जाता है फिर इन अंशों को दूसरे मास स्पेक्ट्रोमीटर (MS2) में डाला जाता है, जो बदले में टुकड़ों को उनके m/z-अनुपात से अलग करता है और उनका पता लगाता है। विखंडन चरण नियमित मास स्पेक्ट्रोमीटर में बहुत समान m/z-अनुपात वाले ईओणों को पहचानना और अलग करना संभव बनाता है।
संरचना
विशिष्ट टेंडेम मास स्पेक्ट्रोमेट्री उपकरण व्यवस्था में त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर (QqQ), बहु-क्षेत्र मास स्पेक्ट्रोमीटर, चतुर्भुज ध्रुव-उड़ान का समय (Q-TOF), सांध्वनिक अंतरण ईओण द्विताणुत्वर
प्रतिध्वनि मास स्पेक्ट्रोमीटर और संकर मास स्पेक्ट्रोमीटर सम्मिलित हैं।
त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर
त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर मास निस्पंदन के रूप में पहले और तीसरे चतुर्भुज ध्रुव का उपयोग करते हैं। जब विश्लेषण दूसरे चतुर्भुज से गुजरते हैं, तो विखंडन गैस के साथ टकराव के माध्यम से आगे बढ़ता है।
चतुर्भुज ध्रुव-उड़ान का समय (Q-TOF)
Q-TOF मास स्पेक्ट्रोमीटर TOF और चतुर्भुज ध्रुव उपकरणों को जोड़ता है, जो उत्पाद ईओणों के लिए उच्च मास सटीकता, सटीक मात्रा क्षमता और विखंडन प्रयोग प्रयोज्यता का कारण बनता है। यह मास स्पेक्ट्रोमेट्री का एक प्रयोग है जो ईओण विखंडन (m/z) अनुपात उड़ान माप के समय के माध्यम से निर्धारित किया जाता है।
संकर मास स्पेक्ट्रोमीटर
संकर मास स्पेक्ट्रोमीटर में दो से अधिक मास विश्लेषक होते हैं।
उपकरण
मास विश्लेषण पृथक्करण के कई चरणों को स्थान में अलग किए गए व्यक्तिगत मास स्पेक्ट्रोमीटर तत्वों के साथ या समय में अलग किए गए MS चरणों के साथ एकल मास स्पेक्ट्रोमीटर का उपयोग करके पूरा किया जा सकता है। स्थान में टेंडेम मास स्पेक्ट्रोमेट्री के लिए, विभिन्न तत्वों को प्रायः आशुलिपि में व्याख्या किया जाता है, जिससे उपयोग किए जाने वाले मास चयनकर्ता का प्रकार दिया जाता है।
स्थान में टेंडेम
स्थान में टेंडेम मास स्पेक्ट्रोमेट्री में, पृथक्करण तत्व भौतिक रूप से वियुक्त और अलग होते हैं, यद्यपि उच्च निर्वात बनाए रखने के लिए तत्वों के बीच एक भौतिक संबंध होता है। ये तत्व क्षेत्र, संचरण, चतुर्भुज ध्रुव, या उड़ान का समय हो सकते हैं। एकाधिक चतुष्कोणों का उपयोग करते समय, वे मास विश्लेषक और टकराव कक्ष दोनों के रूप में कार्य कर सकते हैं।
मास विश्लेषक के लिए सामान्य संकेतन Q - चतुर्भुज ध्रुव मास विश्लेषक है, q - आकाशवाणी आवृति टकराव चतुर्भुज ध्रुव, TOF - उड़ान समय. मास विश्लेषक, B - चुंबकीय क्षेत्र और E - विद्युत क्षेत्र है। विभिन्न संकर उपकरणों को इंगित संकेतन उदाहरण के लिए QqQ' - त्रिपक्षीय चतुर्भुज ध्रुव मास स्पेक्ट्रोमीटर हैं, QTOF - चतुर्भुज ध्रुव उड़ान समय. मास स्पेक्ट्रोमीटर (QqTOF भी) हैं और BEBE - चार-क्षेत्र (रिवर्स ज्योमेट्री) मास स्पेक्ट्रोमीटर को जोड़ा जा सकता है।
समय में टेंडेम
समय पर टेंडेम मास स्पेक्ट्रोमेट्री करने से, एक ही स्थान पर फंसे ईओणों के साथ पृथक्करण पूरा किया जाता है, जिसमें समय के साथ कई पृथक्करण चरण होते हैं। इस तरह के विश्लेषण के लिए चतुर्भुज ध्रुव ईओण जाल या फूरियर रूपांतरण ईओण द्विताणुत्वर अनुनाद (सांध्वनिक अंतरण ईओण साइक्लोट्रॉन रेज़ोनेंस)(FTICR) उपकरण का उपयोग किया जा सकता है।[2] प्रपाशन उपकरण विश्लेषण के कई चरण निष्पादित कर सकते हैं, जिसे कभी-कभी MSn (MS से N) कहा जाता है।[3] प्रायः चरणों की संख्या, n इंगित नहीं की जाती है, लेकिन कभी-कभी मान निर्दिष्ट किया जाता है, उदाहरण के लिए MS3 पृथक्करण के तीन चरणों को इंगित करता है।
समय के साथ मिलकर MS उपकरण अगले वर्णित प्रणाली का उपयोग नहीं करते हैं, लेकिन सामान्यतः संपूर्ण स्पेक्ट्रम के पूर्ववर्ती ईओण अवलोकन करना और मूल ईओण अवलोकन करना से सम्पूर्ण जानकारी एकत्र करते हैं। प्रत्येक वाद्य विन्यास सामूहिक पहचान की एक अद्वितीय विधा का उपयोग करता है।
स्थान MS/MS प्रणाली में टेंडेम
जब टेंडेम MS स्थान बनावट के साथ निष्पादित किया जाता है, तो उपकरण को विभिन्न प्रकार में से एक में काम करना चाहिए। कई अलग-अलग टेंडेम MS/MS प्रायोगिक व्यवस्था हैं और प्रत्येक प्रकार के अपने अनुप्रयोग हैं और विभिन्न जानकारी प्रदान करते हैं। स्थान में टेंडेम MS दो उपकरण घटकों के युग्मन का उपयोग करता है जो समान मास स्पेक्ट्रम श्रेणी स्थान में उनके बीच नियंत्रित अंशांकन के साथ को मापते हैं, जबकि समय में टेंडेम MS में ईओण जाल का उपयोग सम्मिलित होता है।
MS/MS का उपयोग करते हुए चार मुख्य अवलोकन पूर्ववर्ती ईओण अवलोकन करना, उत्पाद ईओण अवलोकन करना, उदासीन क्षति अवलोकन करना और चयनित प्रतिक्रिया निरीक्षण का प्रयोग संभव हैं।
पूर्ववर्ती ईओण अवलोकन करने के लिए, उत्पाद ईओण को दूसरे मास विश्लेषक में चुना जाता है, और पूर्ववर्ती मास को पहले मास विश्लेषक में अवलोकन किया जाता है। ध्यान दें कि पूर्ववर्ती ईओण[4] मूल ईओण [5] और उत्पाद ईओण[6] पुत्री ईओण का पर्याय है;[7] यद्यपि इन मानवरूपी शब्दों के उपयोग को हतोत्साहित किया जाता है।[8][9]
उत्पाद ईओण अवलोकन में, पहले चरण में एक पूर्ववर्ती ईओण का चयन किया जाता है, जिसे विखंडित करने की अनुमति दी जाती है और फिर सभी परिणामी मासों को दूसरे मास विश्लेषक में अवलोकन किया जाता है और दूसरे मास विश्लेषक के बाद स्थित संसूचक में पता लगाया जाता है। यह प्रयोग सामान्यतः टेंडेम MS द्वारा परिमाणीकरण के लिए उपयोग किए जाने वाले संक्रमणों की पहचान करने के लिए किया जाता है।
उदासीन क्षति अवलोकन में, पहला मास विश्लेषक सभी मास का अवलोकन करता है। दूसरा मास विश्लेषक भी पहले मास विश्लेषक से एक समूह समायोजन पर अवलोकन करता है।[10] लेकिन यह समायोजन एक उदासीन क्षति से मेल खाता है जो सामान्यतः यौगिकों के वर्ग के लिए लिए देखा जाता है। निरंतर-उदासीन-क्षति अवलोकन में, निर्दिष्ट सामान्य उदासीन के क्षति से गुजरने वाले सभी पूर्ववर्तीों की निरीक्षण की जाती है। इस जानकारी को प्राप्त करने के लिए, दोनों मास विश्लेषक को एक साथ अवलोकन किया जाता हैं, लेकिन मास समायोजन के साथ जो निर्दिष्ट उदासीन मास से संबंधित होता है। पूर्ववर्ती-ईओण अवलोकन के समान, यह तकनीक एक मिश्रण में निकट संबंधी यौगिकों के वर्ग की चयनात्मक पहचान में भी उपयोगी है।
चयनित प्रतिक्रिया निरीक्षण में, दोनों मास विश्लेषक एक चयनित मास समूह होते हैं। यह प्रणाली MS प्रयोगों के लिए चयनित ईओण निरीक्षण के अनुरूप है। एक चयनात्मक विश्लेषण प्रणाली, जो संवेदनशीलता को बढ़ा सकता है।[11]
विखंडन
मास स्पेक्ट्रोमेट्री को टेंडेमित करने के लिए गैस-चरण ईओणों का विखंडन आवश्यक है जो मास विश्लेषण के विभिन्न चरणों के बीच होता है। ईओणों को खंडित करने के लिए कई विधियों का उपयोग किया जाता है और इनके परिणामस्वरूप विभिन्न प्रकार के विखंडन हो सकते हैं और इस प्रकार अणु की संरचना और संरचना के विषय में अलग-अलग जानकारी मिलती है।
स्रोत में विखंडन
प्रायः ईओणीकरण प्रक्रिया इतनी तीव्र होती है कि परिणामी ईओणों को पर्याप्त आंतरिक ऊर्जा के साथ मास स्पेक्ट्रोमीटर के भीतर टुकड़े करने के लिए छोड़ दिया जाता है। यदि उत्पाद ईओण स्वतः-पृथक्करण से पहले मध्यम समय के लिए अपने अतिरिक्त-संतुलन अवस्था में बने रहते हैं, तो इस प्रक्रिया को मेटास्टेबल विखंडन कहा जाता है।[12] नोक पौना विखंडन सामान्यतः इलेक्ट्रोस्प्रे ईओणीकरण आधारित उपकरणों पर नोक पौना क्षमता को बढ़ाकर स्रोत में विखंडन के उद्देश्यपूर्ण प्रेरण को संदर्भित करता है। यद्यपि स्रोत में विखंडन, विखंडन विश्लेषण के लिए अनुमति देता है, यह तकनीकी रूप से टेंडेम मास स्पेक्ट्रोमेट्री नहीं है जब तक कि स्वतः- पृथक्करण से पहले मेटास्टेबल ईओणों का बड़े पैमाने पर विश्लेषण चयन नहीं किया जाता है और परिणामी टुकड़ों पर विश्लेषण का दूसरा चरण नहीं किया जाता है। स्रोत में विखंडन का उपयोग उन्नत स्रोत विखंडन टिप्पणी तकनीक के उपयोग के माध्यम से टेंडेम मास स्पेक्ट्रोमेट्री के बदले में किया जा सकता है, जो विखंडन उत्पन्न करता है और सीधे मास स्पेक्ट्रोमेट्री डेटा से मेल खाता है।[13]उन्नत स्रोत विखंडन टिप्पणी द्वारा देखे गए अंशों में पारंपरिक टुकड़ों की तुलना में उच्च संकेत तीव्रता होती है जो टेंडेम मास स्पेक्ट्रोमीटर की टकराव कोशिकाओं में क्षति का सामना करते हैं।[14] उन्नत स्रोत विखंडन टिप्पणी MS1 मास विश्लेषक जैसे उड़ान समय और एकल चतुर्भुज ध्रुव उपकरण पर विखंडन डेटा अधिकृत को सक्षम बनाता है। छद्म MS3 -प्रकार के विखंडन के दो चरणों की अनुमति देने के लिए स्रोत में विखंडन का उपयोग प्रायः टेंडेम मास स्पेक्ट्रोमेट्री (डाक-स्रोत विखंडन के साथ) के अतिरिक्त किया जाता है।[15]
टकराव-प्रेरित पृथक्करण
डाक-स्रोत विखंडन प्रायः मास स्पेक्ट्रोमेट्री प्रयोग में उपयोग किया जा रहा है। ऊर्जा को ईओणों में भी जोड़ा जा सकता है, जो सामान्यतः पहले कंपन, उदासीन परमाणुओं या अणुओं के साथ डाक-स्रोत टकराव के माध्यम से, विकिरण का अवशोषण, या गुणा आवेशित ईओण द्वारा एक इलेक्ट्रॉन के हस्तांतरण के माध्यम से उत्तेजित होते हैं। टकराव-प्रेरित पृथक्करण (CID), जिसे संपार्श्विक रूप से सक्रिय पृथक्करण (CAD) भी कहा जाता है, गैस चरण में एक उदासीन परमाणु या अणु के साथ ईओण की टकराव और ईओण के बाद के पृथक्करण सम्मिलित हैं।[16][17] उदाहरण के लिए विचार करें
जहाँ ईओण AB+ उदासीन प्रजाति M से टकराता है और बाद में अलग हो जाता है। इस प्रक्रिया का विवरण टकराव सिद्धांत द्वारा वर्णित है। विभिन्न वाद्य विन्यास के कारण, CID के दो मुख्य प्रकार संभव हैं: (i) बीम-प्रकार (जिसमें पूर्ववर्ती ईओण उड़ान केसमय खंडित होते हैं)[18] और (ii) ईओण जाल-प्रकार (जिसमें पूर्ववर्ती ईओण पहले फंस जाते हैं, और फिर खंडित हो जाते हैं)।[19][20]
CID विखंडन का एक तीसरा और नवीनतम प्रकार उच्च-ऊर्जा संपार्श्विक पृथक्करण (HCD) है। HCD एक CID तकनीक है जो ऑर्बिट्रप मास स्पेक्ट्रोमीटर के लिए विशिष्ट है जिसमें विखंडन ईओण ट्रैप के बाहर होता है,[21][22] यह HCD सेल में होता है (ईओण क्रम बहुपोल नाम के कुछ उपकरणों में)।[23] HCD एक जाल-प्रकार का विखंडन है जिसे बीम-प्रकार की विशेषताओं के लिए दिखाया गया है।[24][25] स्वतंत्र रूप से उपलब्ध बड़े पैमाने पर उच्च समाधान के टेंडेम मास स्पेक्ट्रोमेट्री डेटाबेस उपस्थिति हैं (उदाहरण के लिए प्रायोगिक CID MS / MS डेटा के साथ प्रत्येक 850,000 आणविक मानकों के साथ मेटलिन),[26] और सामान्यतः छोटे अणु पहचान की सुविधा के लिए उपयोग किया जाता है।
इलेक्ट्रॉन अधिकृत और स्थानांतरण विधियाँ
जब एक इलेक्ट्रॉन को एक बहु आवेशित ईओण में स्थानांतरित या उसके अधिकृत कर लिया जाता है तो निकलने वाली ऊर्जा विखंडन को प्रेरित कर सकती है।
[[इलेक्ट्रॉन-अधिकृत पृथक्करण]]
यदि एक इलेक्ट्रॉन को बहु आवेशित धनात्मक ईओण में जोड़ा जाता है, तो विधुत् की तीव्र प्रवाहित ऊर्जा मुक्त हो जाता है। एक मुक्त इलेक्ट्रॉन को जोड़ने को इलेक्ट्रॉन-अधिकृत पृथक्करण (ECD) कहा जाता है, [27] और इसे इसके द्वारा दर्शाया जाता है,[27]
एक बहुगुणित प्रोटोनेटेड अणु M के लिए।
इलेक्ट्रॉन-स्थानांतरण पृथक्करण
ईओण-ईओण प्रतिक्रिया के माध्यम से एक इलेक्ट्रॉन को जोड़ने को इलेक्ट्रॉन-स्थानांतरण पृथक्करण (ETD) कहा जाता है।[28][29] इलेक्ट्रॉन-अधिकृत पृथक्करण के समान, ETD इलेक्ट्रॉनों को स्थानांतरित करके धनायनों (जैसे पेप्टाइड्स या प्रोटीन) के विखंडन को प्रेरित करता है। इसका आविष्कार वर्जीनिया विश्वविद्यालय में डोनाल्ड एफ हंट, जोशुआ कून, जॉन ईपी साइका और जारोड मार्टो ने किया था।[30]
ETD मुक्त इलेक्ट्रॉनों का उपयोग नहीं करता है, लेकिन इस उद्देश्य के लिए तत्त्वरूप ईओणों (जैसे एन्थ्रेसीन या एज़ोबेंजीन) को नियोजित करता है:
जहां A ईओण है।[31]
ETD पेप्टाइड बैकबोन (c और z ईओणों) के साथ अव्यवस्थित ढंग से टूट जाता है जबकि पक्ष श्रृंखला और फास्फारिलीकरण जैसे संशोधनों संशोधन निरंतर रहते हैं तकनीक केवल उच्च आवेश वाले अवस्था ईओणों (z>2) के लिए अच्छी तरह से काम करती है, यद्यपि टकराव-प्रेरित पृथक्करण (CID) के सापेक्ष, ETD लंबे पेप्टाइड्स या यहां तक कि संपूर्ण प्रोटीन के विखंडन के लिए उपयोगी है। यह तकनीक को टॉप-डाउन प्रोटिओमिक्स के लिए महत्वपूर्ण बनाता है। ECD की तरह,ETD फास्फारिलीकरण जैसे संशोधनों के साथ पेप्टाइड्स के लिए प्रभावी है।[32]
इलेक्ट्रॉन-स्थानांतरण और उच्च-ऊर्जा टकराव पृथक्करण (STHSD) ETD और HCD का एक संयोजन है जहाँ पेप्टाइड पूर्ववर्ती को प्रारम्भ में एक रैखिक ईओण ट्रैप में फ्लोरांथीन ईओणों के साथ ईओण / ईओण प्रतिक्रिया के अधीन किया जाता है, जो c- और z- ईओण उत्पन्न करता है।[28][33] दूसरे चरण में ऑर्बिट्रप विश्लेषक में अंतिम विश्लेषण से पहले B- और Y-ईओण उत्पन्न करने के लिए सभी ETD व्युत्पन्न ईओणों पर HCD सभी-ईओण विखंडन लागू किया जाता है।[21]यह विधि ईओण उत्पन्न करने के लिए दोहरे विखंडन को नियोजित करती है- और इस प्रकार पेप्टाइड अनुक्रमण और अनुवाद के बाद का संशोधन स्थानीयकरण के लिए डेटा-समृद्ध MS/MS स्पेक्ट्रा का उपयोग करती है।[34]
नकारात्मक इलेक्ट्रॉन-हस्तांतरण पृथक्करण
विखंडन एक अवक्षेपित प्रजाति के साथ भी हो सकता है, जिसमें एक इलेक्ट्रॉन को एक नकारात्मक इलेक्ट्रॉन हस्तांतरण पृथक्करण (NETD) में प्रजातियों से एक धनायनित अभिकर्मक में स्थानांतरित किया जाता है:[35]
इस स्थानांतरण घटना के बाद, इलेक्ट्रॉन की कमी वाले ईओण आंतरिक पुनर्व्यवस्था और विखंडन (मास स्पेक्ट्रोमेट्री) से गुजरते हैं। NETD इलेक्ट्रॉन-अलगाव पृथक्करण (EDD) का ईओण/ईओण एनालॉग है।
NETD Cα-C संबंध पर आधार के साथ पेप्टाइड और प्रोटीन को खंडित करने के साथ संगत है। परिणामी टुकड़े सामान्यतः a- और x-प्रकार के उत्पाद आयन होते हैं।
इलेक्ट्रॉन-अनासक्ति पृथक्करण
इलेक्ट्रॉन-अनासक्ति पृथक्करण (EDD) मास स्पेक्ट्रोमेट्री में ईओणिक प्रजातियों को खंडित करने की एक विधि है।[36] यह इलेक्ट्रॉन अधिकृत पृथक्करण के लिए एक नकारात्मक काउंटर प्रणाली के रूप में कार्य करता है। मध्यम गतिज ऊर्जा के इलेक्ट्रॉनों के साथ विकिरण द्वारा नकारात्मक रूप से आवेशित ईओण सक्रिय होते हैं। इसका परिणाम मूल आयनिक अणु से इलेक्ट्रॉनों का निष्कासन है, जो पुनर्संयोजन के माध्यम से पृथक्करण का कारण बनता है।
चार्ज-स्थानांतरण पृथक्करण
सकारात्मक रूप से चार्ज किए गए पेप्टाइड्स और धनायनित अभिकर्मकों के बीच प्रतिक्रिया,[37] जिसे चार्ज ट्रांसफर पृथक्करण (सीटीडी) के रूप में भी जाना जाता है,[38]को हाल ही में कम-चार्ज स्थिति (1+ या 2+) पेप्टाइड्स के लिए एक वैकल्पिक उच्च-ऊर्जा विखंडन मार्ग के रूप में प्रदर्शित किया गया है। अभिकर्मक के रूप में हीलियम धनायनों का उपयोग करते हुए CTD का प्रस्तावित तंत्र है:
प्रारंभिक रिपोर्टें हैं कि CTD पेप्टाइड्स के बैकबोन Cα-C बॉन्ड अनुभेदन का कारण बनता है और a•- और x-प्रकार के उत्पाद आयन प्रदान करता है।
फोटोपृथक्करण
पृथक्करण के लिए आवश्यक ऊर्जा को फोटॉन अवशोषण द्वारा जोड़ा जा सकता है, जिसके परिणामस्वरूप ईओण फोटोविघटन होता है और इसके द्वारा प्रतिनिधित्व किया जाता है
कहाँ ईओण द्वारा अवशोषित फोटॉन का प्रतिनिधित्व करता है। पराबैंगनी लेसरों का उपयोग किया जा सकता है, लेकिन जैव अणुओं के अत्यधिक विखंडन का कारण बन सकता है।[39]
अवरक्त बहुफोटोन पृथक्करण
अवरक्त फोटॉन ईओणों को गर्म करेंगे और उनमें से पर्याप्त अवशोषित होने पर विघटन का कारण बनेंगे। इस प्रक्रिया को अवरक्त बहुफ़ोटो पृथक्करण (आईआरएमपीडी) कहा जाता है और इसे प्रायः कार्बन डाइऑक्साइड लेजर और ईओण प्रपाशन मास स्पेक्ट्रोमीटर पूरा किया जाता है।[40]
ब्लैकबॉडी अवरक्त विकिरण पृथक्करण
ब्लैकबॉडी विकिरण का उपयोग ब्लैकबॉडी अवरक्त विकिरण पृथक्करण (ब्लैकबॉडी इंफ्रारेड रेडियेटिव डिसोसिएशन) (BIRD) नामक तकनीक में फोटोपृथक्करण के लिए किया जा सकता है।[41] BIRD विधि में, अवरक्त प्रकाश बनाने के लिए पूरे मास स्पेक्ट्रोमीटर निर्वात कक्ष को गर्म किया जाता है। BIRD विकिरण का उपयोग ईओणों के तेजी से अधिक ऊर्जावान आणविक कंपन को उत्तेजित करने के लिए जब तक कि एक बंधन टूट न जाए, जिससे टुकड़े बन जाएं करता है।[41][42] यह अवरक्त बहुफ़ोटो पृथक्करण के समान है जो अवरक्त लाइट का भी उपयोग एक अलग स्रोत से।[17]BIRD का उपयोग प्रायः फूरियर रूपांतरण ईओण साइक्लोट्रॉन अनुनाद मास स्पेक्ट्रोमेट्री के साथ किया जाता है।
सतह प्रेरित पृथक्करण
सतह-प्रेरित पृथक्करण के साथ, विखंडन उच्च शून्यक के तहत सतह के साथ ईओण की टकराव का परिणाम है।[43][44] आज, सतह-प्रेरित पृथक्करण का उपयोग ईओणों की एक विस्तृत श्रृंखला को विखंडित करने के लिए किया जाता है। वर्षों पहले, केवल कम मास, एकल आवेशित प्रजातियों पर सतह-प्रेरित पृथक्करण का उपयोग करना सामान्य था क्योंकि ईओणीकरण विधियाँ और मास विश्लेषक प्रौद्योगिकियाँ उच्च m/z के ईओणों को ठीक से बनाने, संचारित करने या उनकी विशेषता बताने के लिए पर्याप्त उन्नत नहीं थीं। समय के साथ स्वर्ण पर , CF से बना स्व-संकलित मोनोलेयर सतहें CF3(CF2)10CH2CH2S एक टेंडेम स्पेक्ट्रोमीटर में सतह प्रेरित पृथक्करण सबसे प्रमुख रूप से प्रयोग की जाने वाली टकराव की सतह रही है। स्व-संकलित मोनोलेयर ने आने वाले ईओणों की टकराव के लिए अपने विशेष रूप से बड़े प्रभावी मास के कारण सबसे वांछनीय टकराव लक्ष्य के रूप में काम किया है। इसके अतिरिक्त, ये सतहें कठोर फ्लोरोकार्बन श्रृंखलाओं से बनी होती हैं, जो प्रक्षेप्य ईओणों की ऊर्जा को महत्वपूर्ण रूप से कम नहीं करती हैं। धातु की सतह से आने वाले ईओणों में सुगम इलेक्ट्रॉन हस्तांतरण का विरोध करने की उनकी क्षमता के कारण फ्लोरोकार्बन श्रृंखला भी उपयोगी होती है।[45] सतह प्रेरित पृथक्करण की उप-परिसरों का उत्पादन करने की क्षमता जो स्थिर रहती है और संयोजकता पर मूल्यवान जानकारी प्रदान करती है, किसी भी अन्य पृथक्करण तकनीक से बेजोड़ है। चूंकि सतह-प्रेरित पृथक्करण से निर्मित मिश्रित स्थिर होते हैं और खंड पर आवेश के वितरण को बनाए रखते हैं, यह एक अद्वितीय स्पेक्ट्रा का उत्पादन करता है जो एक संकरे m/z वितरण के आसपास केंद्रित होता है। सतह-प्रेरित पृथक्करण उत्पाद और जिस ऊर्जा पर वे बनते हैं, वे मिश्रित की ताकत और टोपोलॉजी को दर्शाते हैं। अद्वितीय पृथक्करण पैटर्न परिसर की चतुर्धातुक संरचना की खोज में मदद करते हैं। सममित आवेश वितरण और पृथक्करण निर्भरता सतह-प्रेरित पृथक्करण के लिए अद्वितीय हैं और किसी भी अन्य पृथक्करण तकनीक से निर्मित स्पेक्ट्रा को विशिष्ट बनाते हैं।[45]
सतह-प्रेरित पृथक्करण तकनीक ईओण-गतिशीलता मास स्पेक्ट्रोमेट्री (IM-MS) पर भी लागू होती है। इस तकनीक के लिए तीन अलग-अलग तरीकों में टोपोलॉजी के लक्षण वर्णन, अंतरc संयोजकता और प्रोटीन संरचना के लिए संक्षिप्त करने की परिमाण का विश्लेषण सम्मिलित है। प्रोटीन संरचना का संक्षिप्त करना सतह-प्रेरित पृथक्करण तकनीक का सबसे अधिक प्रयोग किया जाने वाला अनुप्रयोग है। ईओण-गतिशीलता मास स्पेक्ट्रोमेट्री (IM-MS) के लिए, सतह-प्रेरित पृथक्करण का उपयोग तीन अलग-अलग प्रकार के प्रोटीन परिसरों के स्रोत सक्रिय पूर्ववर्तीों के पृथक्करण के लिए किया जाता है: C-रिएक्टिव प्रोटीन (CRP), ट्रांसथायरेटिन (TTR), और कॉनकावेलिन A (Con A) . इस पद्धति का उपयोग इन परिसरों में से प्रत्येक के लिए संक्षिप्त परिमाण का निरीक्षण करने के लिए किया जाता है। इस अवलोकन के लिए, सतह-प्रेरित पृथक्करण ने पूर्ववर्ती ईओणों की संरचनाओं को दिखाया जो सतह से टकराने से पहले उपस्थिति थीं। IM-MS सतह-प्रेरित पृथक्करण का उपयोग प्रत्येक प्रोटीन की परिमाण के संरूपण के प्रत्यक्ष माप के रूप में करता है।[46]
सांध्वनिक अंतरण ईओण द्विताणुत्वर अनुनाद (FTICR) बड़े स्तर पर माप लेने वाले उपकरणों को अति उच्च समाधान और उच्च मास सटीकता प्रदान करने में सक्षम हैं। ये विशेषताएं FTICR मास स्पेक्ट्रोमीटर को विभिन्न प्रकार के अनुप्रयोगों के लिए एक उपयोगी उपकरण बनाती हैं।[47]जैसे कई पृथक्करण प्रयोगों जैसे टकराव-प्रेरित पृथक्करण (CID, इलेक्ट्रॉन स्थानांतरण पृथक्करण (ETD),[48] और दूसरे। इसके अतिरिक्त, सतह- मौलिक पेप्टाइड विखंडन के अध्ययन के लिए इस उपकरण के साथ प्रेरित पृथक्करण लागू किया गया है। विशेष रूप से, SID को आईसीआर उपकरण के भीतर गैस-चरण विखंडन के ऊर्जावान और गतिकी के अध्ययन के लिए लागू किया गया है।[49] इस दृष्टिकोण का उपयोग प्रोटोनेटेड पेप्टाइड्स, विषम-इलेक्ट्रॉन पेप्टाइड आयनों, अतिरिक्त-सहसंयोजक लिगैंड-पेप्टाइड कॉम्प्लेक्स और लिगेटेड धातु समूहों के गैस-चरण विखंडन को समझने के लिए किया गया है
मात्रात्मक प्रोटिओमिक्स
एक उदाहरण में प्रोटीन की सापेक्षिक या निरपेक्ष मात्रा निर्धारित करने के लिए मात्रात्मक प्रोटिओमिक्स का उपयोग किया जाता है।[50][51][52] कई मात्रात्मक प्रोटिओमिक्स विधियाँ टेंडेम मास स्पेक्ट्रोमेट्री पर आधारित हैं। MS/MS जटिल जैव-अणुओं की संरचनात्मक व्याख्या के लिए एक सतह प्रक्रिया बन गई है।[53]
मात्रात्मक प्रोटिओमिक्स के लिए सामान्यतः प्रयोग की जाने वाली एक विधि समदाब रेखीय उपनाम अंकितक है। समदाब रेखीय उपनाम अंकितक एक ही विश्लेषण में कई उदाहरण से एक साथ पहचान और प्रोटीन की मात्रा का ठहराव सक्षम बनाता है। प्रोटीन की मात्रा निर्धारित करने के लिए, पेप्टाइड्स को रासायनिक उपनाम के साथ अंकितक किया जाता है जिनकी संरचना और नाम मात्र मास समान होते हैं, लेकिन उनकी संरचना में भारी समस्थानिकों के वितरण में भिन्नता होती है। ये उपनाम, जिन्हें सामान्यतः टेंडेम मास उपनाम के रूप में संदर्भित किया जाता है, को बनावट किया गया है जिससे बड़े पैमाने पर मास स्पेक्ट्रोमेट्री के समय उच्च-ऊर्जा संपार्श्विक-प्रेरित पृथक्करण (HCD) पर एक विशिष्ट संयोजक क्षेत्र में बड़े पैमाने पर उपनाम अलग-अलग मास केसूचना देने वाले ईओणों को उत्पन्न करता है। MS/MS स्पेक्ट्रा मेंसूचना देने वाले ईओणों की तीव्रता की तुलना करके प्रोटीन की मात्रा निर्धारित की जाती है।। व्यावसायिक रूप से उपलब्ध दो समदाब रेखीय उपनाम iTRAQ और TMT अभिकर्मक हैं।
सापेक्ष और निरपेक्ष मात्रा के लिए समदाब रेखीय उपनाम (iTRAQ)
सापेक्ष और निरपेक्ष परिमाणीकरण के लिए समदाब रेखीय उपनाम टेंडेम मास स्पेक्ट्रोमेट्री के लिए एक अभिकर्मक है जिसका उपयोग एक ही प्रयोग में विभिन्न स्रोतों से प्रोटीन की मात्रा निर्धारित करने के लिए किया जाता है।[54][55][56]यह स्थिर समस्थानिक अंकितग अणुओं का उपयोग करता है जो प्रोटीन के N-टर्मिनस और पक्ष श्रृंखला अमाइन के साथ एक सहसंयोजक बंधन बना सकते हैं। ITRAQ अभिकर्मकों का उपयोग विभिन्न उदाहरण से पेप्टाइड्स को अंकितक करने के लिए किया जाता है जिन्हें तरल क्रोमाटोग्राफी और टेंडेम मास स्पेक्ट्रोमेट्री द्वारा एकत्रित और विश्लेषण किया जाता है। संलग्न उपनाम का विखंडन एक कम आणविक माससूचना देने वाले ईओण उत्पन्न करता है जिसका उपयोग पेप्टाइड्स और उन प्रोटीनों को अपेक्षाकृत मापने के लिए किया जा सकता है जिनसे वे उत्पन्न हुए थे।
टेंडेम मास उपनाम (टीएमटी)
एक टेंडेम मास उपनाम (टीएमटी) क आइसोबैरिक मास उपनाम रासायनिक अंकितक है जिसका उपयोग प्रोटीन मात्रा निर्धारण और पहचान के लिए किया जाता है।[57] उपनाम में चार क्षेत्र माससूचना देने वाले, क्लीवेबल लिंकर, मास नॉर्मलाइजेशन और प्रोटीन रिएक्टिव ग्रुप होते हैं। टीएमटी अभिकर्मकों का उपयोग कोशिकाओं, ऊतकों या जैविक तरल पदार्थों से तैयार किए गए 2 से 11 विभिन्न पेप्टाइड उदाहरण का एक साथ विश्लेषण करने के लिए किया जा सकता है। हाल के विकास 16 और यहां तक कि 18 उदाहरण (क्रमशः 16plex या 18plex) तक का विश्लेषण करने की अनुमति देते हैं।[58][59] विभिन्न रासायनिक अभिक्रियाओं के साथ तीन प्रकार के टीएमटी अभिकर्मक उपलब्ध हैं: (1) प्राथमिक अमाइन (TMTduplex, TMTsixplex, TMT10plex plus TMT11-131C) की अंकितकिंग के लिए एक प्रतिक्रियाशील NHS एस्टर कार्यात्मक समूह, (2) मुक्त सल्फहाइड्रील्स की अंकितकिंग के लिए एक प्रतिक्रियाशील आयोडोसमूहाइल कार्यात्मक समूह (2) iodoTMT) और (3) कार्बोनिल्स (aminoxyTMT) की अंकितकिंग के लिए प्रतिक्रियाशील एल्कोक्सीमाइन कार्यात्मक समूह है।
अनुप्रयोग
पेप्टाइड्स
टेंडेम मास स्पेक्ट्रोमेट्री का उपयोग प्रोटीन अनुक्रमण के लिए किया जा सकता है।[60] जब अक्षुण्ण प्रोटीन को मास विश्लेषक में प्रस्तुत किया जाता है, तो इसे ऊपर-नीचे प्रोटिओमिक्स कहा जाता है और जब प्रोटीन को छोटे पेप्टाइड्स में पचाया जाता है और बाद में मास स्पेक्ट्रोमीटर में प्रस्तुत किया जाता है, इसे नीचे-ऊपर प्रोटिओमिक्स कहा जाता है। मशीनगन प्रोटिओमिक्स नीचे से ऊपर प्रोटिओमिक्स का एक प्रकार है जिसमें मिश्रण में प्रोटीन अलग होने से पहले पच जाते हैं और सामूहिक मास स्पेक्ट्रोमेट्री होते हैं।
टेंडेममास स्पेक्ट्रोमेट्री एक पेप्टाइड अनुक्रम उपनाम का उत्पादन कर सकती है जिसका उपयोग प्रोटीन डेटाबेस में पेप्टाइड की पहचान के लिए किया जा सकता है।[61][62][63] टेंडेम मास स्पेक्ट्रम से उत्पन्न होने वाले पेप्टाइड अंशों को इंगित करने के लिए एक संकेतन विकसित किया गया है।[64] पेप्टाइड खंड ईओणों को a, b, या c द्वारा इंगित किया जाता है यदि चार्ज N- टर्मिनस पर और x, y या z द्वारा C टर्मिनल पर बनाए रखा जाता है। सबस्क्रिप्ट टुकड़े में अमीनो अम्ल अवशेषों की संख्या को इंगित करता है। सुपरस्क्रिप्ट का उपयोग कभी-कभी आधार के विखंडन के अलावा उदासीन क्षति अमोनिया के क्षति और पानी के क्षति के लिए को इंगित करने के लिए किया जाता है। यद्यपि पेप्टाइड आधार का दरार अनुक्रमण और पेप्टाइड पहचान के लिए सबसे उपयोगी है, लेकिन उच्च ऊर्जा पृथक्करण स्थितियों के तहत अन्य टुकड़े ईओणों को देखा जा सकता है। इनमें साइड चेन क्षति ईओण d, v, w और अमोनियम ईओण[65][66] और विशेष अमीनो अम्ल अवशेषों से जुड़े अतिरिक्त अनुक्रम-विशिष्ट खंड ईओण सम्मिलित हैं।[67]
ओलिगोसेकेराइड्स
ओलिगोसेकेराइड्स को पेप्टाइड अनुक्रमण के समान प्रयोग से टेंडेम मास स्पेक्ट्रोमेट्री का उपयोग करके अनुक्रमित किया जा सकता है।[68] विखंडन सामान्यतः ग्लाइकोसिडिक बंध (B, C, Y और Z ईओणों) के दोनों ओर होता है, लेकिन एक संकर-चक्राकार अनुभेदन (x ईओण) में चीनी चक्राकार संरचना के माध्यम से अधिक ऊर्जावान परिस्थितियों में भी होता है। श्रृंखला के साथ दरार की स्थिति को इंगित करने के लिए फिर से अनुगामी सबस्क्रिप्ट का उपयोग किया जाता है। संकर चक्राकार अनुभेदन ईओणों के लिए संकर चक्राकार अनुभेदन की प्रकृति पूर्ववर्ती अभिलेख द्वारा इंगित की जाती है।[69][70]
ओलिगोन्यूक्लियोटाइड्स
टेंडेम मास स्पेक्ट्रोमेट्री डीएनए अनुक्रमण और आरएनए अनुक्रमण के लिए लागू किया गया है।[71][72] ओलिगोन्यूक्लियोटाइड्स ईओणों के गैस-चरण विखंडन के लिए एक संकेतन प्रस्तावित किया गया है।[73]
नवजात स्क्रीनिंग(जाँच)
नवजात स्क्रीनिंग उपचार योग्य आनुवंशिक विकार, अंतःस्त्राविका, चयापचय की जन्मजात त्रुटि औररुधिर रोगों के लिए नवजात शिशुओं के परीक्षण की प्रक्रिया है।[74][75] 1990 के दशक की प्रारंम्भ में टेंडेम मास स्पेक्ट्रोमेट्री स्क्रीनिंग के विकास ने संभावित रूप से पता लगाने योग्य जन्मजात चयापचय रोग का एक बड़ा विस्तार किया जो रक्त में कार्बनिक अम्लों के स्तर को प्रभावित करते हैं।।[76]
सीमा
टेंडेम मास स्पेक्ट्रोमेट्री को एकल-कोशिका विश्लेषण के लिए लागू नहीं किया जा सकता क्योंकि यह इतनी छोटी मात्रा में कोशिका का विश्लेषण करने के लिए असंवेदनशील है। ये सीमाएं मुख्य रूप से विलायक के रासायनिक किंवदंती स्रोतों के कारण उपकरणों के भीतर अकुशल ईओण उत्पादन और ईओण क्षतियों के संयोजन के कारण हैं।[77]
भविष्य का दृष्टिकोण
टेंडेम मास स्पेक्ट्रोमेट्री प्रोटीन लक्षण वर्णन, मिश्रित न्यूक्लियोप्रोटीन और अन्य जैविक संरचनाओं के लिए एक उपयोगी उपकरण होगा। यद्यपि, कुछ चुनौतियाँ जैसे मात्रात्मक और गुणात्मक रूप से प्रोटिओम के लक्षण वर्णन का विश्लेषण करना शेष हैं।[78]
यह भी देखें
- त्वरक जन स्पेक्ट्रोमेट्री
- व्यापक प्रतिनिधित्व (भौतिकी)
- मास-विश्लेषण ईओण-गतिज-ऊर्जा स्पेक्ट्रोमेट्री
- अनिमोलेक्युलर ईओण अपघटन
संदर्भ
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "tandem mass spectrometer". doi:10.1351/goldbook.T06250
- ↑ Cody RB, Freiser BS (1982). "फूरियर-ट्रांसफॉर्म मास स्पेक्ट्रोमीटर में टक्कर-प्रेरित पृथक्करण". International Journal of Mass Spectrometry and Ion Physics. 41 (3): 199–204. Bibcode:1982IJMSI..41..199C. doi:10.1016/0020-7381(82)85035-3.
- ↑ Cody RB, Burnier RC, Cassady CJ, Freiser BS (1 November 1982). "फूरियर ट्रांसफॉर्म मास स्पेक्ट्रोमेट्री में लगातार टकराव-प्रेरित पृथक्करण". Analytical Chemistry. 54 (13): 2225–2228. doi:10.1021/ac00250a021.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "precursor ion". doi:10.1351/goldbook.P04807
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "parent ion". doi:10.1351/goldbook.P04406
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "product ion". doi:10.1351/goldbook.P04864
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "daughter ion". doi:10.1351/goldbook.D01524
- ↑ Bursey, Maurice M. (1991). "Comment to readers: Style and the lack of it". Mass Spectrometry Reviews. 10 (1): 1–2. Bibcode:1991MSRv...10....1B. doi:10.1002/mas.1280100102.
- ↑ Adams, J. (1992). "संपादक को". Journal of the American Society for Mass Spectrometry. 3 (4): 473. doi:10.1016/1044-0305(92)87078-D. PMID 24243061.
- ↑ Louris JN, Wright LG, Cooks RG, Schoen AE (1985). "हाइब्रिड मास स्पेक्ट्रोमीटर के साथ नए स्कैन मोड एक्सेस किए गए". Analytical Chemistry. 57 (14): 2918–2924. doi:10.1021/ac00291a039.
- ↑ deHoffman E, Stroobant V (2003). Mass Spectrometry: Principles and Applications. Toronto: Wiley. p. 133. ISBN 978-0-471-48566-7.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "transient (chemical) species". doi:10.1351/goldbook.T06451
- ↑ Domingo-Almenara, Xavier; Montenegro-Burke, J. Rafael; Guijas, Carlos; Majumder, Erica L.-W.; Benton, H. Paul; Siuzdak, Gary (5 March 2019). "अलक्षित मेटाबोलॉमिक्स के लिए ऑटोनॉमस मेटलिन-गाइडेड इन-सोर्स फ्रैगमेंट एनोटेशन". Analytical Chemistry. 91 (5): 3246–3253. doi:10.1021/acs.analchem.8b03126. PMC 6637741. PMID 30681830.
- ↑ Xue, Jingchuan; Domingo-Almenara, Xavier; Guijas, Carlos; Palermo, Amelia; Rinschen, Markus M.; Isbell, John; Benton, H. Paul; Siuzdak, Gary (21 April 2020). "संवर्धित इन-सोर्स फ्रैग्मेंटेशन एनोटेशन उपन्यास डेटा स्वतंत्र अधिग्रहण और स्वायत्त METLIN आणविक पहचान को सक्षम करता है". Analytical Chemistry. 92 (8): 6051–6059. doi:10.1021/acs.analchem.0c00409. PMC 8966047. PMID 32242660. S2CID 214768212.
- ↑ Körner R, Wilm M, Morand K, Schubert M, Mann M (February 1996). "नैनो इलेक्ट्रोस्प्रे को पेप्टाइड्स और प्रोटीन डाइजेस्ट के विश्लेषण के लिए क्वाड्रुपोल आयन ट्रैप के साथ जोड़ा गया". Journal of the American Society for Mass Spectrometry. 7 (2): 150–6. doi:10.1016/1044-0305(95)00626-5. PMID 24203235.
- ↑ Wells JM, McLuckey SA (2005). "Collision‐Induced Dissociation (CID) of Peptides and Proteins". जैविक मास स्पेक्ट्रोमेट्री. Methods in Enzymology. Vol. 402. pp. 148–85. doi:10.1016/S0076-6879(05)02005-7. ISBN 9780121828073. PMID 16401509.
- ↑ 17.0 17.1 Sleno L, Volmer DA (October 2004). "अग्रानुक्रम द्रव्यमान स्पेक्ट्रोमेट्री के लिए आयन सक्रियण विधियाँ". Journal of Mass Spectrometry. 39 (10): 1091–112. Bibcode:2004JMSp...39.1091S. doi:10.1002/jms.703. PMID 15481084.
- ↑ Xia Y, Liang X, McLuckey SA (February 2006). "आयन ट्रैप बनाम कम-ऊर्जा बीम-प्रकार की टक्कर-प्रेरित विखंडन प्रोटोनेटेड यूबिकिटिन आयनों का". Analytical Chemistry. 78 (4): 1218–27. doi:10.1021/ac051622b. PMID 16478115.
- ↑ March RE (1 April 1997). "क्वाड्रुपोल आयन ट्रैप मास स्पेक्ट्रोमेट्री का परिचय". Journal of Mass Spectrometry. 32 (4): 351–369. Bibcode:1997JMSp...32..351M. doi:10.1002/(sici)1096-9888(199704)32:4<351::aid-jms512>3.0.co;2-y. S2CID 16506573.
- ↑ Bantscheff M, Boesche M, Eberhard D, Matthieson T, Sweetman G, Kuster B (September 2008). "एलटीक्यू ऑर्बिट्रैप मास स्पेक्ट्रोमीटर पर मजबूत और संवेदनशील iTRAQ परिमाणीकरण". Molecular & Cellular Proteomics. 7 (9): 1702–13. doi:10.1074/mcp.M800029-MCP200. PMC 2556025. PMID 18511480.
- ↑ 21.0 21.1 Olsen JV, Macek B, Lange O, Makarov A, Horning S, Mann M (September 2007). "पेप्टाइड संशोधन विश्लेषण के लिए उच्च-ऊर्जा सी-जाल पृथक्करण". Nature Methods. 4 (9): 709–12. doi:10.1038/nmeth1060. PMID 17721543. S2CID 2538231.
- ↑ Senko MW, Remes PM, Canterbury JD, Mathur R, Song Q, Eliuk SM, Mullen C, Earley L, Hardman M, Blethrow JD, Bui H, Specht A, Lange O, Denisov E, Makarov A, Horning S, Zabrouskov V (December 2013). "Novel parallelized quadrupole/linear ion trap/Orbitrap tribrid mass spectrometer improving proteome coverage and peptide identification rates". Analytical Chemistry (in English). 85 (24): 11710–4. doi:10.1021/ac403115c. PMID 24251866.
- ↑ Riley NM, Westphall MS, Coon JJ (July 2017). "सक्रिय आयन-इलेक्ट्रॉन स्थानांतरण पृथक्करण व्यापक टॉप-डाउन प्रोटीन विखंडन को सक्षम करता है". Journal of Proteome Research. 16 (7): 2653–2659. doi:10.1021/acs.jproteome.7b00249. PMC 5555583. PMID 28608681.
- ↑ Nagaraj N, D'Souza RC, Cox J, Olsen JV, Mann M (December 2010). "उच्च ऊर्जा संपार्श्विक पृथक्करण विखंडन के साथ बड़े पैमाने पर फॉस्फोप्रोटोमिक्स की व्यवहार्यता". Journal of Proteome Research (in English). 9 (12): 6786–94. doi:10.1021/pr100637q. PMID 20873877.
- ↑ Jora M, Burns AP, Ross RL, Lobue PA, Zhao R, Palumbo CM, Beal PA, Addepalli B, Limbach PA (August 2018). "उच्च-ऊर्जा कोलिशनल डिसोसिएशन मास स्पेक्ट्रोमेट्री (एचसीडी एमएस) द्वारा न्यूक्लियोसाइड संशोधनों के विभेदक स्थितीय आइसोमर्स". Journal of the American Society for Mass Spectrometry. 29 (8): 1745–1756. Bibcode:2018JASMS..29.1745J. doi:10.1007/s13361-018-1999-6. PMC 6062210. PMID 29949056.
- ↑ "Article Metrics - METLIN MS 2 molecular standards database: a broad chemical and biological resource | Nature Methods" (in English). ISSN 1548-7105.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Cooper HJ, Håkansson K, Marshall AG (2005). "जैव-आणविक विश्लेषण में इलेक्ट्रॉन कैप्चर पृथक्करण की भूमिका". Mass Spectrometry Reviews. 24 (2): 201–22. Bibcode:2005MSRv...24..201C. doi:10.1002/mas.20014. PMID 15389856.
- ↑ 28.0 28.1 Syka JE, Coon JJ, Schroeder MJ, Shabanowitz J, Hunt DF (June 2004). "पेप्टाइड और प्रोटीन अनुक्रम विश्लेषण इलेक्ट्रॉन हस्तांतरण हदबंदी मास स्पेक्ट्रोमेट्री द्वारा". Proceedings of the National Academy of Sciences of the United States of America. 101 (26): 9528–33. Bibcode:2004PNAS..101.9528S. doi:10.1073/pnas.0402700101. PMC 470779. PMID 15210983.
- ↑ Mikesh LM, Ueberheide B, Chi A, Coon JJ, Syka JE, Shabanowitz J, Hunt DF (December 2006). "प्रोटिओमिक विश्लेषण में ETD मास स्पेक्ट्रोमेट्री की उपयोगिता". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1764 (12): 1811–22. doi:10.1016/j.bbapap.2006.10.003. PMC 1853258. PMID 17118725.
- ↑ US patent 7534622, Donald F. Hunt, Joshua J. Coon, John E.P. Syka, Jarrod A. Marto, "Electron transfer dissociation for biopolymer sequence mass spectrometric analysis", issued 2009-05-19
- ↑ McLuckey SA, Stephenson JL (1998). "Ion/ion chemistry of high-mass multiply charged ions". Mass Spectrometry Reviews. 17 (6): 369–407. Bibcode:1998MSRv...17..369M. doi:10.1002/(SICI)1098-2787(1998)17:6<369::AID-MAS1>3.0.CO;2-J. PMID 10360331.
- ↑ Chi A, Huttenhower C, Geer LY, Coon JJ, Syka JE, Bai DL, Shabanowitz J, Burke DJ, Troyanskaya OG, Hunt DF (February 2007). "इलेक्ट्रॉन हस्तांतरण पृथक्करण (ETD) मास स्पेक्ट्रोमेट्री द्वारा Saccharomyces cerevisiae से प्रोटीन पर फॉस्फोराइलेशन साइटों का विश्लेषण". Proceedings of the National Academy of Sciences of the United States of America. 104 (7): 2193–8. Bibcode:2007PNAS..104.2193C. doi:10.1073/pnas.0607084104. PMC 1892997. PMID 17287358.
- ↑ Frese CK, Altelaar AF, van den Toorn H, Nolting D, Griep-Raming J, Heck AJ, Mohammed S (November 2012). "इलेक्ट्रॉन-हस्तांतरण और उच्च-ऊर्जा टक्कर पृथक्करण अग्रानुक्रम मास स्पेक्ट्रोमेट्री के संयोजन से दोहरे विखंडन द्वारा पूर्ण पेप्टाइड अनुक्रम कवरेज की ओर". Analytical Chemistry. 84 (22): 9668–73. doi:10.1021/ac3025366. PMID 23106539.
- ↑ Frese CK, Zhou H, Taus T, Altelaar AF, Mechtler K, Heck AJ, Mohammed S (March 2013). "Unambiguous phosphosite localization using electron-transfer/higher-energy collision dissociation (EThcD)". Journal of Proteome Research. 12 (3): 1520–5. doi:10.1021/pr301130k. PMC 3588588. PMID 23347405.
- ↑ Coon JJ, Shabanowitz J, Hunt DF, Syka JE (June 2005). "पेप्टाइड आयनों का इलेक्ट्रॉन स्थानांतरण पृथक्करण". Journal of the American Society for Mass Spectrometry. 16 (6): 880–2. doi:10.1016/j.jasms.2005.01.015. PMID 15907703.
- ↑ Budnik BA, Haselmann KF, Zubarev RA (2001). "Electron detachment dissociation of peptide di-anions: an electron–hole recombination phenomenon". Chemical Physics Letters. 342 (3–4): 299–302. Bibcode:2001CPL...342..299B. doi:10.1016/S0009-2614(01)00501-2.
- ↑ Chingin K, Makarov A, Denisov E, Rebrov O, Zubarev RA (January 2014). "उच्च-ऊर्जा वाले धनायनों के एक बीम के साथ सक्रिय रूप से चार्ज किए गए जैविक आयनों का विखंडन". Analytical Chemistry. 86 (1): 372–9. doi:10.1021/ac403193k. PMID 24236851.
- ↑ Hoffmann WD, Jackson GP (November 2014). "किलोइलेक्ट्रॉनवोल्ट हीलियम केशन का उपयोग करके पेप्टाइड केशन का चार्ज ट्रांसफर डिसोसिएशन (CTD) मास स्पेक्ट्रोमेट्री". Journal of the American Society for Mass Spectrometry. 25 (11): 1939–43. Bibcode:2014JASMS..25.1939H. doi:10.1007/s13361-014-0989-6. PMID 25231159. S2CID 1400057.
- ↑ Morgan JW, Hettick JM, Russell DH (2005). "Peptide Sequencing by MALDI 193‐nm Photodissociation TOF MS". जैविक मास स्पेक्ट्रोमेट्री. Methods in Enzymology. Vol. 402. pp. 186–209. doi:10.1016/S0076-6879(05)02006-9. ISBN 9780121828073. PMID 16401510.
- ↑ Little DP, Speir JP, Senko MW, O'Connor PB, McLafferty FW (September 1994). "बायोमोलेक्यूल सीक्वेंसिंग के लिए बड़े बहु आवेशित आयनों का इन्फ्रारेड मल्टीफ़ोटो पृथक्करण". Analytical Chemistry. 66 (18): 2809–15. doi:10.1021/ac00090a004. PMID 7526742.
- ↑ 41.0 41.1 Schnier PD, Price WD, Jockusch RA, Williams ER (July 1996). "Blackbody infrared radiative dissociation of bradykinin and its analogues: energetics, dynamics, and evidence for salt-bridge structures in the gas phase". Journal of the American Chemical Society. 118 (30): 7178–89. doi:10.1021/ja9609157. PMC 1393282. PMID 16525512.
- ↑ Dunbar RC (2004). "BIRD (blackbody infrared radiative dissociation): evolution, principles, and applications". Mass Spectrometry Reviews. 23 (2): 127–58. Bibcode:2004MSRv...23..127D. doi:10.1002/mas.10074. PMID 14732935.
- ↑ Grill V, Shen J, Evans C, Cooks RG (2001). "Collisions of ions with surfaces at chemically relevant energies: Instrumentation and phenomena". Review of Scientific Instruments. 72 (8): 3149. Bibcode:2001RScI...72.3149G. doi:10.1063/1.1382641.
- ↑ Mabud, M. (1985). "आणविक आयनों की सतह-प्रेरित पृथक्करण". International Journal of Mass Spectrometry and Ion Processes. 67 (3): 285–294. Bibcode:1985IJMSI..67..285M. doi:10.1016/0168-1176(85)83024-X.
- ↑ 45.0 45.1 Stiving, Alyssa; VanAernum, Zachary; Busch, Florian; Harvey, Sophie; Sarni, Samantha; Wysocki, Vicki (9 November 2018). "Surface-Induced Dissociation: An Effective Method for Characterization of Protein Quaternary Structure". Analytical Chemistry. 91 (1): 190–191. doi:10.1021/acs.analchem.8b05071. PMC 6571034. PMID 30412666.
- ↑ Quintyn, Royston S.; Zhou, Mowei; Yan, Jing; Wysocki, Vicki H. (1 December 2015). "गैस-चरण मल्टीमेरिक प्रोटीन परिसरों के विभिन्न संरचनात्मक रूपों को अलग करने के लिए एक उपकरण के रूप में सतह-प्रेरित पृथक्करण द्रव्यमान स्पेक्ट्रा". Analytical Chemistry. 87 (23): 11879–11886. doi:10.1021/acs.analchem.5b03441. ISSN 0003-2700. PMID 26499904.
- ↑ Laskin, Julia; Futrell, Jean H. (2005). "एफटी-आईसीआर मास स्पेक्ट्रोमेट्री में बड़े लोन का सक्रियण". Mass Spectrometry Reviews. 24 (2): 135–167. Bibcode:2005MSRv...24..135L. doi:10.1002/mas.20012. ISSN 0277-7037. PMID 15389858.
- ↑ Kaplan, Desmond A.; Hartmer, Ralf; Speir, J. Paul; Stoermer, Carsten; Gumerov, Dmitry; Easterling, Michael L.; Brekenfeld, Andreas; Kim, Taeman; Laukien, Frank; Park, Melvin A. (2008). "हाइब्रिड क्वाड्रुपोल-हेक्सापोल फूरियर ट्रांसफॉर्म आयन साइक्लोट्रॉन रेजोनेंस मास स्पेक्ट्रोमीटर के हेक्सापोल टक्कर सेल में इलेक्ट्रॉन स्थानांतरण पृथक्करण". Rapid Communications in Mass Spectrometry. 22 (3): 271–278. Bibcode:2008RCMS...22..271K. doi:10.1002/rcm.3356. ISSN 0951-4198. PMID 18181247.
- ↑ Laskin, Julia (June 2015). "Surface-Induced Dissociation: A Unique Tool for Studying Energetics and Kinetics of the Gas-Phase Fragmentation of Large Ions". European Journal of Mass Spectrometry. 21 (3): 377–389. doi:10.1255/ejms.1358. ISSN 1469-0667. PMID 26307719. S2CID 19837927.
- ↑ Ong SE, Mann M (October 2005). "मास स्पेक्ट्रोमेट्री-आधारित प्रोटिओमिक्स मात्रात्मक बदल जाता है". Nature Chemical Biology. 1 (5): 252–62. doi:10.1038/nchembio736. PMID 16408053. S2CID 32054251.
- ↑ Bantscheff M, Schirle M, Sweetman G, Rick J, Kuster B (October 2007). "Quantitative mass spectrometry in proteomics: a critical review". Analytical and Bioanalytical Chemistry. 389 (4): 1017–31. doi:10.1007/s00216-007-1486-6. PMID 17668192.
- ↑ Nikolov M, Schmidt C, Urlaub H (2012). "Quantitative mass spectrometry-based proteomics: an overview". प्रोटिओमिक्स में मात्रात्मक तरीके. Methods in Molecular Biology. Vol. 893. pp. 85–100. doi:10.1007/978-1-61779-885-6_7. hdl:11858/00-001M-0000-0029-1A75-8. ISBN 978-1-61779-884-9. PMID 22665296. S2CID 33009117.
- ↑ Maher S, Jjunju FP, Taylor S (2015). "100 years of mass spectrometry: Perspectives and future trends". Rev. Mod. Phys. 87 (1): 113–135. Bibcode:2015RvMP...87..113M. doi:10.1103/RevModPhys.87.113.
- ↑ Ross PL, Huang YN, Marchese JN, Williamson B, Parker K, Hattan S, Khainovski N, Pillai S, Dey S, Daniels S, Purkayastha S, Juhasz P, Martin S, Bartlet-Jones M, He F, Jacobson A, Pappin DJ (December 2004). "एमाइन-प्रतिक्रियाशील आइसोबैरिक टैगिंग अभिकर्मकों का उपयोग करके सैक्रोमाइसेस सेरेविसिया में बहुसंकेतित प्रोटीन परिमाणीकरण". Molecular & Cellular Proteomics. 3 (12): 1154–69. doi:10.1074/mcp.M400129-MCP200. PMID 15385600.
- ↑ Zieske LR (2006). "प्रोटीन कॉम्प्लेक्स और प्रोफाइलिंग अध्ययन के लिए iTRAQ अभिकर्मक प्रौद्योगिकी के उपयोग पर एक परिप्रेक्ष्य". Journal of Experimental Botany. 57 (7): 1501–8. doi:10.1093/jxb/erj168. PMID 16574745.
- ↑ Gafken PR, Lampe PD (2006). "मास स्पेक्ट्रोमेट्री द्वारा फॉस्फोप्रोटीन को चिह्नित करने के तरीके". Cell Communication & Adhesion. 13 (5–6): 249–62. doi:10.1080/15419060601077917. PMC 2185548. PMID 17162667.
- ↑ Thompson A, Schäfer J, Kuhn K, Kienle S, Schwarz J, Schmidt G, Neumann T, Johnstone R, Mohammed AK, Hamon C (April 2003). "Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS". Analytical Chemistry. 75 (8): 1895–904. doi:10.1021/ac0262560. PMID 12713048.
- ↑ Li, Jiaming; Van Vranken, Jonathan G.; Pontano Vaites, Laura; Schweppe, Devin K.; Huttlin, Edward L.; Etienne, Chris; Nandhikonda, Premchendar; Viner, Rosa; Robitaille, Aaron M.; Thompson, Andrew H.; Kuhn, Karsten; Pike, Ian; Bomgarden, Ryan D.; Rogers, John C.; Gygi, Steven P. (April 2020). "TMTpro reagents: a set of isobaric labeling mass tags enables simultaneous proteome-wide measurements across 16 samples". Nature Methods (in English). 17 (4): 399–404. doi:10.1038/s41592-020-0781-4. ISSN 1548-7105. PMC 7302421. PMID 32203386.
- ↑ Li, Jiaming; Cai, Zhenying; Bomgarden, Ryan D.; Pike, Ian; Kuhn, Karsten; Rogers, John C.; Roberts, Thomas M.; Gygi, Steven P.; Paulo, Joao A. (7 May 2021). "TMTpro-18plex: The Expanded and Complete Set of TMTpro Reagents for Sample Multiplexing". Journal of Proteome Research (in English). 20 (5): 2964–2972. doi:10.1021/acs.jproteome.1c00168. ISSN 1535-3893. PMC 8210943. PMID 33900084.
- ↑ Angel TE, Aryal UK, Hengel SM, Baker ES, Kelly RT, Robinson EW, Smith RD (May 2012). "Mass spectrometry-based proteomics: existing capabilities and future directions". Chemical Society Reviews. 41 (10): 3912–28. doi:10.1039/c2cs15331a. PMC 3375054. PMID 22498958.
- ↑ Hardouin J (2007). "Protein sequence information by matrix-assisted laser desorption/ionization in-source decay mass spectrometry". Mass Spectrometry Reviews. 26 (5): 672–82. Bibcode:2007MSRv...26..672H. doi:10.1002/mas.20142. PMID 17492750.
- ↑ Shadforth I, Crowther D, Bessant C (November 2005). "उच्च-थ्रूपुट, स्वचालित पाइपलाइनों में उपयोग के लिए एमएस का उपयोग कर प्रोटीन और पेप्टाइड पहचान एल्गोरिदम". Proteomics. 5 (16): 4082–95. doi:10.1002/pmic.200402091. PMID 16196103. S2CID 38068737.
- ↑ Mørtz E, O'Connor PB, Roepstorff P, Kelleher NL, Wood TD, McLafferty FW, Mann M (August 1996). "अनुक्रम डेटा बेस के विरुद्ध टेंडेन मास वर्णक्रमीय डेटा का मिलान करके अक्षुण्ण प्रोटीन की अनुक्रम टैग पहचान". Proceedings of the National Academy of Sciences of the United States of America. 93 (16): 8264–7. Bibcode:1996PNAS...93.8264M. doi:10.1073/pnas.93.16.8264. PMC 38658. PMID 8710858.
- ↑ Roepstorff P, Fohlman J (November 1984). "पेप्टाइड्स के मास स्पेक्ट्रा में अनुक्रम आयनों के लिए एक सामान्य नामकरण का प्रस्ताव". Biomedical Mass Spectrometry. 11 (11): 601. doi:10.1002/bms.1200111109. PMID 6525415.
- ↑ Johnson RS, Martin SA, Klaus Biemann (December 1988). "पेप्टाइड्स के (एम + एच) + आयनों का टकराव-प्रेरित विखंडन। साइड चेन विशिष्ट अनुक्रम आयन". International Journal of Mass Spectrometry and Ion Processes. 86: 137–154. Bibcode:1988IJMSI..86..137J. doi:10.1016/0168-1176(88)80060-0.
- ↑ Falick AM, Hines WM, Medzihradszky KF, Baldwin MA, Gibson BW (November 1993). "टेंडेम मास स्पेक्ट्रोमेट्री में उच्च-ऊर्जा टकराव-प्रेरित पृथक्करण द्वारा पेप्टाइड्स से उत्पन्न कम-द्रव्यमान आयन". Journal of the American Society for Mass Spectrometry. 4 (11): 882–93. doi:10.1016/1044-0305(93)87006-X. PMID 24227532.
- ↑ Downard KM, Biemann K (January 1995). "उच्च टक्कर ऊर्जा पर प्रोटोनेटेड पेप्टाइड्स के पृथक्करण द्वारा गठित मेथियोनीन विशिष्ट अनुक्रम आयन". Journal of Mass Spectrometry. 30 (1): 25–32. Bibcode:1995JMSp...30...25D. doi:10.1002/jms.1190300106.
- ↑ Zaia J (2004). "ऑलिगोसेकेराइड्स का मास स्पेक्ट्रोमेट्री". Mass Spectrometry Reviews. 23 (3): 161–227. Bibcode:2004MSRv...23..161Z. doi:10.1002/mas.10073. PMID 14966796.
- ↑ Bruno Domon; Catherine E Costello (1988). "A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates". Glycoconj. J. 5 (4): 397–409. doi:10.1007/BF01049915. S2CID 206787925.
- ↑ Spina E, Cozzolino R, Ryan E, Garozzo D (August 2000). "Sequencing of oligosaccharides by collision-induced dissociation matrix-assisted laser desorption/ionization mass spectrometry". Journal of Mass Spectrometry. 35 (8): 1042–8. Bibcode:2000JMSp...35.1042S. doi:10.1002/1096-9888(200008)35:8<1042::AID-JMS33>3.0.CO;2-Y. PMID 10973004.
- ↑ Banoub JH, Newton RP, Esmans E, Ewing DF, Mackenzie G (May 2005). "न्यूक्लियोसाइड्स, न्यूक्लियोटाइड्स, ऑलिगोन्यूक्लियोटाइड्स और न्यूक्लिक एसिड के लक्षण वर्णन के लिए मास स्पेक्ट्रोमेट्री में हालिया विकास". Chemical Reviews. 105 (5): 1869–915. doi:10.1021/cr030040w. PMID 15884792.
- ↑ Thomas B, Akoulitchev AV (March 2006). "आरएनए का मास स्पेक्ट्रोमेट्री". Trends in Biochemical Sciences. 31 (3): 173–81. doi:10.1016/j.tibs.2006.01.004. PMID 16483781.
- ↑ Wu J, McLuckey SA (2004). "ऑलिगोन्यूक्लियोटाइड आयनों का गैस-चरण विखंडन". International Journal of Mass Spectrometry. 237 (2–3): 197–241. Bibcode:2004IJMSp.237..197W. doi:10.1016/j.ijms.2004.06.014.
- ↑ Tarini BA (August 2007). "The current revolution in newborn screening: new technology, old controversies". Archives of Pediatrics & Adolescent Medicine. 161 (8): 767–72. doi:10.1001/archpedi.161.8.767. PMID 17679658.
- ↑ Kayton A (2007). "Newborn screening: a literature review". Neonatal Network. 26 (2): 85–95. doi:10.1891/0730-0832.26.2.85. PMID 17402600. S2CID 28372085.
- ↑ Chace DH, Kalas TA, Naylor EW (November 2003). "नवजात शिशुओं के सूखे रक्त के नमूनों की बहुविश्लेषणात्मक जांच के लिए टैंडेम मास स्पेक्ट्रोमेट्री का उपयोग". Clinical Chemistry. 49 (11): 1797–817. doi:10.1373/clinchem.2003.022178. PMID 14578311.
- ↑ Angel, Thomas E.; Aryal, Uma K.; Hengel, Shawna M.; Baker, Erin S.; Kelly, Ryan T.; Robinson, Errol W.; Smith, Richard D. (21 May 2012). "Mass spectrometry based proteomics: existing capabilities and future directions". Chemical Society Reviews. 41 (10): 3912–3928. doi:10.1039/c2cs15331a. ISSN 0306-0012. PMC 3375054. PMID 22498958.
- ↑ Han, Xuemei; Aslanian, Aaron; Yates, John R. (October 2008). "प्रोटिओमिक्स के लिए मास स्पेक्ट्रोमेट्री". Current Opinion in Chemical Biology. 12 (5): 483–490. doi:10.1016/j.cbpa.2008.07.024. ISSN 1367-5931. PMC 2642903. PMID 18718552.
ग्रन्थसूची
- McLuckey SA, Busch KL, Glish GL (1988). Mass spectrometry/mass spectrometry: techniques and applications of tandem mass spectrometry. New York, N.Y: VCH Publishers. ISBN 978-0-89573-275-0.
- McLuckey SA, Glish GL (18 January 1989). Mass Spectrometry/Mass Spectrometry: Techniques and Applications of Tandem. Chichester: John Wiley & Sons. ISBN 978-0-471-18699-1.
- McLafferty FW (1983). Tandem mass spectrometry. New York: Wiley. ISBN 978-0-471-86597-1.
- Sherman NE, Kinter M (2000). Protein sequencing and identification using tandem mass spectrometry. New York: John Wiley. ISBN 978-0-471-32249-8.
बाहरी संबंध
- An Introduction to Mass Spectrometry by Dr Alison E. Ashcroft Archived 8 August 2020 at the Wayback Machine