इलेक्ट्रिक बैटरी: Difference between revisions
No edit summary |
No edit summary |
||
| Line 188: | Line 188: | ||
| | | | ||
| 830–1010 | | 830–1010 | ||
| महँगा। स्व-निर्वहन की बहुत कम दर के कारण केवल उच्च-ड्रेन उपकरणों में या लंबी शेल्फ-लाइफ के लिए उपयोग किया जाता है। अकेले 'लिथियम' | | महँगा। स्व-निर्वहन की बहुत कम दर के कारण केवल उच्च-ड्रेन उपकरणों में या लंबी शेल्फ-लाइफ के लिए उपयोग किया जाता है। अकेले 'लिथियम' सामान्यतः इस प्रकार के रसायन विज्ञान को संदर्भित करता है। | ||
| | | | ||
|- | |- | ||
| Line 312: | Line 312: | ||
| 460 | | 460 | ||
| | | | ||
| बहुत महँगा। बहुत उच्च ऊर्जा घनत्व. | | बहुत महँगा। बहुत उच्च ऊर्जा घनत्व. सामान्यतः "सामान्य" बैटरी आकारों में उपलब्ध नहीं है। लैपटॉप कंप्यूटर, डिजिटल कैमरा, कैमकोर्डर और सेलफोन में लिथियम पॉलिमर बैटरी आम है। स्व-निर्वहन की बहुत कम दर. डिस्चार्ज के दौरान टर्मिनल वोल्टेज 4.2 से 3.0 वोल्ट तक भिन्न होता है। अस्थिर: यदि शॉर्ट-सर्किट किया गया हो, ज़्यादा गरम होने दिया गया हो, या कठोर गुणवत्ता मानकों के साथ निर्मित न किया गया हो तो विस्फोट की संभावना। | ||
|} | |} | ||
== प्रदर्शन, क्षमता और निर्वहन == | == प्रदर्शन, क्षमता और निर्वहन == | ||
| Line 334: | Line 334: | ||
लंबी अवधि के लिए संग्रहीत या क्षमता के छोटे से अंश पर डिस्आवेश की जाने वाली बैटरियों में सामान्यतः अपरिवर्तनीय साइड प्रतिक्रियाओं की उपस्थिति के कारण क्षमता कम हो जाती है जो बिना धारा उत्पन्न किए आवेश कैरियर्स का उपभोग करती हैं। इस घटना को आंतरिक स्व-निर्वहन के रूप में जाना जाता है। इसके अतिरिक्त, जब बैटरियों को पुनः आवेशित किया जाता है, तो अतिरिक्त साइड रिएक्शन हो सकते हैं, जिससे बाद के डिस्आवेश की क्षमता कम हो जाती है। पर्याप्त रिआवेश के बाद, संक्षेप में सारी क्षमता समाप्त हो जाती है और बैटरी विद्युत का उत्पादन बंद कर देती है। आंतरिक ऊर्जा की हानि और उस दर पर सीमाएं जो आयन इलेक्ट्रोलाइट से गुजरते हैं, बैटरी के कुशल ऊर्जा उपयोग में भिन्नता का कारण बनते हैं। न्यूनतम सीमा से ऊपर, कम दर पर डिस्आवेश करने से उच्च दर की तुलना में बैटरी की क्षमता अधिक होती है। अलग-अलग A·h रेटिंग वाली बैटरियों को स्थापित करने से विशिष्ट वोल्टेज के लिए रेट किए गए उपकरण संचालन (चूंकि यह ऑपरेशन अंतराल को प्रभावित कर सकता है) को प्रभावित नहीं करता है, जब तक कि लोड सीमा पार न हो जाए। हाई-ड्रेन लोड जैसे डिजिटल कैमरे कुल क्षमता को कम कर सकते हैं, जैसा कि क्षारीय बैटरी के साथ होता है। उदाहरण के लिए, 10- या 20-घंटे के डिस्आवेश के लिए 2 A·h पर रेट की गई बैटरी पूरे दो घंटे तक 1 A की धारा को बनाए नहीं रखेगी, जैसा कि इसकी बताई गई क्षमता से पता चलता है। | लंबी अवधि के लिए संग्रहीत या क्षमता के छोटे से अंश पर डिस्आवेश की जाने वाली बैटरियों में सामान्यतः अपरिवर्तनीय साइड प्रतिक्रियाओं की उपस्थिति के कारण क्षमता कम हो जाती है जो बिना धारा उत्पन्न किए आवेश कैरियर्स का उपभोग करती हैं। इस घटना को आंतरिक स्व-निर्वहन के रूप में जाना जाता है। इसके अतिरिक्त, जब बैटरियों को पुनः आवेशित किया जाता है, तो अतिरिक्त साइड रिएक्शन हो सकते हैं, जिससे बाद के डिस्आवेश की क्षमता कम हो जाती है। पर्याप्त रिआवेश के बाद, संक्षेप में सारी क्षमता समाप्त हो जाती है और बैटरी विद्युत का उत्पादन बंद कर देती है। आंतरिक ऊर्जा की हानि और उस दर पर सीमाएं जो आयन इलेक्ट्रोलाइट से गुजरते हैं, बैटरी के कुशल ऊर्जा उपयोग में भिन्नता का कारण बनते हैं। न्यूनतम सीमा से ऊपर, कम दर पर डिस्आवेश करने से उच्च दर की तुलना में बैटरी की क्षमता अधिक होती है। अलग-अलग A·h रेटिंग वाली बैटरियों को स्थापित करने से विशिष्ट वोल्टेज के लिए रेट किए गए उपकरण संचालन (चूंकि यह ऑपरेशन अंतराल को प्रभावित कर सकता है) को प्रभावित नहीं करता है, जब तक कि लोड सीमा पार न हो जाए। हाई-ड्रेन लोड जैसे डिजिटल कैमरे कुल क्षमता को कम कर सकते हैं, जैसा कि क्षारीय बैटरी के साथ होता है। उदाहरण के लिए, 10- या 20-घंटे के डिस्आवेश के लिए 2 A·h पर रेट की गई बैटरी पूरे दो घंटे तक 1 A की धारा को बनाए नहीं रखेगी, जैसा कि इसकी बताई गई क्षमता से पता चलता है। | ||
बैटरी आवेश #C-रेट या C-रेट उस दर का माप है जिस पर बैटरी आवेश या पुनः आवेशित किया जाता है। इसे सैद्धांतिक धारा ड्रॉ द्वारा विभाजित बैटरी के माध्यम से धारा के रूप में परिभाषित किया जाता है जिसके अनुसार बैटरी घंटे में अपनी नाममात्र रेटेड क्षमता प्रदान करेगी।<ref>[http://web.mit.edu/evt/summary_battery_specifications.pdf A Guide to Understanding Battery Specifications], MIT Electric Vehicle Team, December 2008</ref> इसकी इकाइयाँ घंटे<sup>-1</sup> हैं, जिसके लिए आंतरिक प्रतिरोध हानि और कोशिकाओं के अंदर रासायनिक प्रक्रियाओं के कारण, बैटरी संभवतः ही कभी केवल घंटे में नेमप्लेट रेटेड क्षमता प्रदान करती है। सामान्यतः, अधिकतम क्षमता कम सी-दर पर पाई जाती है, और उच्च सी-दर पर आवेश करने या डिस्आवेश करने से बैटरी का उपयोग करने योग्य जीवन और क्षमता कम हो जाती है। निर्माता | बैटरी आवेश #C-रेट या C-रेट उस दर का माप है जिस पर बैटरी आवेश या पुनः आवेशित किया जाता है। इसे सैद्धांतिक धारा ड्रॉ द्वारा विभाजित बैटरी के माध्यम से धारा के रूप में परिभाषित किया जाता है जिसके अनुसार बैटरी घंटे में अपनी नाममात्र रेटेड क्षमता प्रदान करेगी।<ref>[http://web.mit.edu/evt/summary_battery_specifications.pdf A Guide to Understanding Battery Specifications], MIT Electric Vehicle Team, December 2008</ref> इसकी इकाइयाँ घंटे<sup>-1</sup> हैं, जिसके लिए आंतरिक प्रतिरोध हानि और कोशिकाओं के अंदर रासायनिक प्रक्रियाओं के कारण, बैटरी संभवतः ही कभी केवल घंटे में नेमप्लेट रेटेड क्षमता प्रदान करती है। सामान्यतः, अधिकतम क्षमता कम सी-दर पर पाई जाती है, और उच्च सी-दर पर आवेश करने या डिस्आवेश करने से बैटरी का उपयोग करने योग्य जीवन और क्षमता कम हो जाती है। निर्माता अधिकांशतः क्षमता बनाम सी-दर वक्र दिखाने वाले ग्राफ़ के साथ डेटाशीट प्रकाशित करते हैं। सी-रेट का उपयोग बैटरी पर रेटिंग के रूप में भी किया जाता है जिससे कि यह इंगित किया जा सके कि बैटरी परिपथ में सुरक्षित रूप से वितरित कर सकती है। रिआवेशेबल बैटरियों के लिए मानक सामान्यतः 4 घंटे (0.25C), 8 घंटे (0.125C) या लंबे समय तक डिस्आवेश होने की क्षमता और आवेश चक्रों को रेट करते हैं। विशेष उद्देश्यों के लिए अभिप्रेत प्रकार, जैसे कि कंप्यूटर में निर्बाध विद्युत की आपूर्ति, निर्माताओं द्वारा घंटे (1C) से बहुत कम निर्वहन अवधि के लिए मूल्यांकन किया जा सकता है, अपितु सीमित चक्र जीवन से पीड़ित हो सकता है। | ||
{{As of|2012}}, लिथियम आयरन फॉस्फेट या लिथियम आयरन फॉस्फेट ({{chem|LiFePO|4}}) बैटरी तकनीक 10-20 सेकंड में पूरी तरह से डिस्आवेश होने वाली सबसे तेज आवेशिंग/डिस्आवेशिंग थी।<ref>{{Cite journal | last1 = Kang | first1 = B. | last2 = Ceder | first2 = G. | doi = 10.1038/nature07853 | title = Battery materials for ultrafast charging and discharging | journal = Nature | volume = 458 | issue = 7235 | pages = 190–193 | year = 2009 | pmid = 19279634|bibcode = 2009Natur.458..190K | s2cid = 20592628 }} [http://media.nature.com/download/nature/nature/podcast/v458/n7235/nature-2009-03-12.mp3 1:00–6:50 (audio)] {{Webarchive|url=https://web.archive.org/web/20120222092433/http://media.nature.com/download/nature/nature/podcast/v458/n7235/nature-2009-03-12.mp3 |date=22 February 2012 }}</ref> | {{As of|2012}}, लिथियम आयरन फॉस्फेट या लिथियम आयरन फॉस्फेट ({{chem|LiFePO|4}}) बैटरी तकनीक 10-20 सेकंड में पूरी तरह से डिस्आवेश होने वाली सबसे तेज आवेशिंग/डिस्आवेशिंग थी।<ref>{{Cite journal | last1 = Kang | first1 = B. | last2 = Ceder | first2 = G. | doi = 10.1038/nature07853 | title = Battery materials for ultrafast charging and discharging | journal = Nature | volume = 458 | issue = 7235 | pages = 190–193 | year = 2009 | pmid = 19279634|bibcode = 2009Natur.458..190K | s2cid = 20592628 }} [http://media.nature.com/download/nature/nature/podcast/v458/n7235/nature-2009-03-12.mp3 1:00–6:50 (audio)] {{Webarchive|url=https://web.archive.org/web/20120222092433/http://media.nature.com/download/nature/nature/podcast/v458/n7235/nature-2009-03-12.mp3 |date=22 February 2012 }}</ref> | ||
| Line 351: | Line 351: | ||
NiCd कोशिकाएं, यदि विशेष दोहराव वाले तरीके से उपयोग की जाती हैं, तो स्मृति प्रभाव नामक क्षमता में कमी दिखा सकती है।<ref>{{cite web|url=http://www.repairfaq.org/ELE/F_Battery_info.html|title=Sci.Electronics FAQ: More Battery Info|author=Filip M. Gieszczykiewicz|work=repairfaq.org}}</ref> सरल अभ्यासों से प्रभाव से बचा जा सकता है। NiMH कोशिकाएं, चूंकि रसायन विज्ञान में समान हैं, स्मृति प्रभाव से कम प्रभावित होती हैं।<ref>{{citation |url=http://rechargeablebatteryinfo.com/rechargeable-batteries-memory-effect.php |title=What does 'memory effect' mean? |date=28 October 2005 |editor=RechargheableBatteryInfo.com |access-date=10 August 2007 |archive-url=https://web.archive.org/web/20070715173404/http://rechargeablebatteryinfo.com/rechargeable-batteries-memory-effect.php |archive-date=15 July 2007 <!-- 173404 --> }}</ref> | NiCd कोशिकाएं, यदि विशेष दोहराव वाले तरीके से उपयोग की जाती हैं, तो स्मृति प्रभाव नामक क्षमता में कमी दिखा सकती है।<ref>{{cite web|url=http://www.repairfaq.org/ELE/F_Battery_info.html|title=Sci.Electronics FAQ: More Battery Info|author=Filip M. Gieszczykiewicz|work=repairfaq.org}}</ref> सरल अभ्यासों से प्रभाव से बचा जा सकता है। NiMH कोशिकाएं, चूंकि रसायन विज्ञान में समान हैं, स्मृति प्रभाव से कम प्रभावित होती हैं।<ref>{{citation |url=http://rechargeablebatteryinfo.com/rechargeable-batteries-memory-effect.php |title=What does 'memory effect' mean? |date=28 October 2005 |editor=RechargheableBatteryInfo.com |access-date=10 August 2007 |archive-url=https://web.archive.org/web/20070715173404/http://rechargeablebatteryinfo.com/rechargeable-batteries-memory-effect.php |archive-date=15 July 2007 <!-- 173404 --> }}</ref> | ||
ऑटोमोटिव बैटरी लेड-एसिड रिआवेशेबल बैटरी को कंपन, झटके और तापमान सीमा के कारण तनाव सहना चाहिए। इन तनावों और लेड-एसिड बैटरी # उनकी लेड प्लेटों के सल्फेशन के कारण, कुछ ऑटोमोटिव बैटरियां नियमित उपयोग के छह साल से अधिक समय तक चलती हैं।<ref>Rich, Vincent (1994). ''The International Lead Trade''. Cambridge: Woodhead. 129.</ref> ऑटोमोटिव स्टार्टिंग (ऑटोमोटिव बैटरी: स्टार्टिंग, लाइटिंग, इग्निशन) बैटरियों में धारा को अधिकतम करने के लिए कई पतली प्लेट होती हैं। सामान्यतः, प्लेटें जितनी मोटी होती हैं, जीवन उतना ही लंबा होता है। उन्हें सामान्यतः रिआवेश से थोड़ा पहले ही डिस्आवेश किया जाता है। डीप-साइकिल लेड-एसिड बैटरी जैसे कि इलेक्ट्रिक गोल्फ कार्ट में उपयोग की जाने वाली बैटरियों में लंबी उम्र बढ़ाने के लिए बहुत मोटी प्लेट होती हैं।<ref>[http://www.windsun.com/Batteries/Battery_FAQ.htm Deep Cycle Battery FAQ] {{Webarchive|url=https://web.archive.org/web/20100722144045/http://www.windsun.com/Batteries/Battery_FAQ.htm |date=22 July 2010 }}. ''Northern Arizona Wind & Sun''. Retrieved 3 February 2009.</ref> लेड-एसिड बैटरी का मुख्य लाभ इसकी कम लागत है, इसकी मुख्य कमियां दी गई क्षमता और वोल्टेज के लिए बड़े आकार और वजन हैं। लेड-एसिड बैटरियों को उनकी क्षमता के 20% से कम पर कभी भी पुनः आवेशित नहीं किया जाना चाहिए,<ref>[http://www.rpc.com.au/products/batteries/car-deepcycle/carfaq14.htm Car and Deep Cycle Battery FAQ]. ''Rainbow Power Company''. Retrieved 3 February 2009.</ref> क्योंकि आंतरिक प्रतिरोध रिआवेश होने पर गर्मी और क्षति का कारण बनता है। डीप-साइकिल लेड-एसिड सिस्टम | ऑटोमोटिव बैटरी लेड-एसिड रिआवेशेबल बैटरी को कंपन, झटके और तापमान सीमा के कारण तनाव सहना चाहिए। इन तनावों और लेड-एसिड बैटरी # उनकी लेड प्लेटों के सल्फेशन के कारण, कुछ ऑटोमोटिव बैटरियां नियमित उपयोग के छह साल से अधिक समय तक चलती हैं।<ref>Rich, Vincent (1994). ''The International Lead Trade''. Cambridge: Woodhead. 129.</ref> ऑटोमोटिव स्टार्टिंग (ऑटोमोटिव बैटरी: स्टार्टिंग, लाइटिंग, इग्निशन) बैटरियों में धारा को अधिकतम करने के लिए कई पतली प्लेट होती हैं। सामान्यतः, प्लेटें जितनी मोटी होती हैं, जीवन उतना ही लंबा होता है। उन्हें सामान्यतः रिआवेश से थोड़ा पहले ही डिस्आवेश किया जाता है। डीप-साइकिल लेड-एसिड बैटरी जैसे कि इलेक्ट्रिक गोल्फ कार्ट में उपयोग की जाने वाली बैटरियों में लंबी उम्र बढ़ाने के लिए बहुत मोटी प्लेट होती हैं।<ref>[http://www.windsun.com/Batteries/Battery_FAQ.htm Deep Cycle Battery FAQ] {{Webarchive|url=https://web.archive.org/web/20100722144045/http://www.windsun.com/Batteries/Battery_FAQ.htm |date=22 July 2010 }}. ''Northern Arizona Wind & Sun''. Retrieved 3 February 2009.</ref> लेड-एसिड बैटरी का मुख्य लाभ इसकी कम लागत है, इसकी मुख्य कमियां दी गई क्षमता और वोल्टेज के लिए बड़े आकार और वजन हैं। लेड-एसिड बैटरियों को उनकी क्षमता के 20% से कम पर कभी भी पुनः आवेशित नहीं किया जाना चाहिए,<ref>[http://www.rpc.com.au/products/batteries/car-deepcycle/carfaq14.htm Car and Deep Cycle Battery FAQ]. ''Rainbow Power Company''. Retrieved 3 February 2009.</ref> क्योंकि आंतरिक प्रतिरोध रिआवेश होने पर गर्मी और क्षति का कारण बनता है। डीप-साइकिल लेड-एसिड सिस्टम अधिकांशतः कम आवेश वार्निंग लाइट या लो-आवेश पावर कट-ऑफ स्विच का उपयोग करते हैं, जिससे कि बैटरी के जीवन को छोटा करने वाले हानि को रोका जा सके।<ref>[http://www.energymatters.com.au/renewable-energy/batteries Deep cycle battery guide] {{Webarchive|url=https://web.archive.org/web/20090217030702/http://www.energymatters.com.au/renewable-energy/batteries/ |date=17 February 2009 }}. ''Energy Matters''. Retrieved 3 February 2009.</ref> | ||
बैटरी को कम तापमान पर स्टोर करके बैटरी लाइफ को बढ़ाया जा सकता है, जैसे कि रेफ्रिजरेटर या फ्रीजर में, जो साइड रिएक्शन को धीमा कर देता है। ऐसा भंडारण क्षारीय बैटरी के जीवन को लगभग 5% बढ़ा सकता है, रिआवेशेबल बैटरियां प्रकार के आधार पर अपने आवेश को अधिक समय तक धारण कर सकती हैं।<ref>[http://ask.yahoo.com/ask/20011219.html Ask Yahoo: Does putting batteries in the freezer make them last longer?] {{webarchive|url=https://web.archive.org/web/20060427025118/http://ask.yahoo.com/ask/20011219.html |date=27 April 2006 }}. Retrieved 7 March 2007.</ref> अपने अधिकतम वोल्टेज तक पहुंचने के लिए, बैटरी को कमरे के तापमान पर वापस करना होगा, 250 एमए पर 0 डिग्री सेल्सियस पर क्षारीय बैटरी का निर्वहन 20 डिग्री सेल्सियस पर केवल आधा कुशल है।<ref name="enralk" />ड्यूरासेल जैसे क्षारीय बैटरी निर्माता बैटरी को रेफ्रिजरेट करने की अनुशंसा नहीं करते हैं।<ref name="durcar" /> | बैटरी को कम तापमान पर स्टोर करके बैटरी लाइफ को बढ़ाया जा सकता है, जैसे कि रेफ्रिजरेटर या फ्रीजर में, जो साइड रिएक्शन को धीमा कर देता है। ऐसा भंडारण क्षारीय बैटरी के जीवन को लगभग 5% बढ़ा सकता है, रिआवेशेबल बैटरियां प्रकार के आधार पर अपने आवेश को अधिक समय तक धारण कर सकती हैं।<ref>[http://ask.yahoo.com/ask/20011219.html Ask Yahoo: Does putting batteries in the freezer make them last longer?] {{webarchive|url=https://web.archive.org/web/20060427025118/http://ask.yahoo.com/ask/20011219.html |date=27 April 2006 }}. Retrieved 7 March 2007.</ref> अपने अधिकतम वोल्टेज तक पहुंचने के लिए, बैटरी को कमरे के तापमान पर वापस करना होगा, 250 एमए पर 0 डिग्री सेल्सियस पर क्षारीय बैटरी का निर्वहन 20 डिग्री सेल्सियस पर केवल आधा कुशल है।<ref name="enralk" />ड्यूरासेल जैसे क्षारीय बैटरी निर्माता बैटरी को रेफ्रिजरेट करने की अनुशंसा नहीं करते हैं।<ref name="durcar" /> | ||
| Line 357: | Line 357: | ||
{{See also|लिथियम-आयन बैटरी सुरक्षा}} | {{See also|लिथियम-आयन बैटरी सुरक्षा}} | ||
[[File:BATTERY EXPLOSION IN TEST CELL - NARA - 17443202.jpg|thumb|विस्फोट के बाद बैटरी]] | [[File:BATTERY EXPLOSION IN TEST CELL - NARA - 17443202.jpg|thumb|विस्फोट के बाद बैटरी]] | ||
एक बैटरी विस्फोट | एक बैटरी विस्फोट सामान्यतः दुरुपयोग या खराबी के कारण होता है, जैसे प्राथमिक (गैर-रिचार्जेबल) बैटरी, या शॉर्ट सर्किट को रिचार्ज करने का प्रयास इसका प्रमुख उदाहरण हैं। | ||
जब एक बैटरी को अत्यधिक दर पर रिचार्ज किया जाता है, तो हाइड्रोजन और ऑक्सीजन का एक विस्फोटक गैस मिश्रण बैटरी के भीतर से बाहर निकलने की तुलना में तेजी से उत्पन्न हो सकता है (उदाहरण के लिए एक अंतर्निर्मित वेंट के माध्यम से), जिससे दबाव निर्माण और अंततः फटने का कारण बनता | जब एक बैटरी को अत्यधिक दर पर रिचार्ज किया जाता है, तो हाइड्रोजन और ऑक्सीजन का एक विस्फोटक गैस मिश्रण बैटरी के भीतर से बाहर निकलने की तुलना में तेजी से उत्पन्न हो सकता है (उदाहरण के लिए एक अंतर्निर्मित वेंट के माध्यम से), जिससे दबाव निर्माण और अंततः बैटरी का इस स्थिति में फटने का कारण बनता है। इसकी उच्चतम स्थितियों में, बैटरी रसायन आवरण से हिंसक रूप से स्प्रे कर सकते हैं और चोट का कारण बन सकते हैं। समस्या का एक विशेषज्ञ सारांश इंगित करता है कि यह प्रकार लिथियम आयनों को एनोड और कैथोड के बीच परिवहन के लिए तरल इलेक्ट्रोलाइट्स का उपयोग करता है। यदि बैटरी सेल को बहुत शीघ्रता से आवेशित किया जाता है, तो यह शॉर्ट सर्किट का कारण बन सकता है, जिससे विस्फोट और आग लग सकती है।<ref>{{cite web |url=http://theamericanenergynews.com/markham-on-energy/solid-state-battery-advance-goodenough |title=Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough |last=Hislop |first=Martin |date=1 March 2017 |website=North American Energy News |publisher=The American Energy News. |access-date=15 March 2017}}</ref><ref>{{cite web|url=https://www.youtube.com/playlist?list=PLAAoauVs9gEUQ1QfaueaDCjTMb9LoPEjX|title=battery hazards|website=YouTube|access-date=20 September 2018}}</ref> शॉर्ट सर्किट से बहुत बड़ी धाराएँ उत्पन्न होने पर कार की बैटरी में विस्फोट होने की सबसे अधिक संभावना होती है। ऐसी बैटरियां हाइड्रोजन का उत्पादन करती हैं, जो अत्यधिक विस्फोटक होने पर (इलेक्ट्रोलाइट में पानी के इलेक्ट्रोलिसिस के कारण) अत्यधिक विस्फोटक होती हैं। सामान्य उपयोग के समय, ओवरचार्जिंग की मात्रा सामान्यतः बहुत कम होती है और थोड़ा हाइड्रोजन उत्पन्न करती है, जो शीघ्रता से नष्ट हो जाती है। चूंकि, जब एक कार शुरू करते हैं, तो उच्च धारा हाइड्रोजन की बड़ी मात्रा में तेजी से रिलीज का कारण बन सकती है, जिसे पास की चिंगारी से विस्फोटक रूप से प्रज्वलित किया जा सकता है, उदाहरण के लिए जम्पर केबल को डिस्कनेक्ट करते समय इसका उपयोग करते हैं। | ||
ओवरचार्जिंग (बैटरी को उसकी विद्युत क्षमता से अधिक चार्ज करने का प्रयास) रिसाव या अपरिवर्तनीय क्षति के | ओवरचार्जिंग (बैटरी को उसकी विद्युत क्षमता से अधिक चार्ज करने का प्रयास) रिसाव या अपरिवर्तनीय क्षति के अतिरिक्त, बैटरी विस्फोट का कारण भी बन सकता है। यह उस चार्जर या डिवाइस को भी नुकसान पहुंचा सकता है जिसमें बाद में अधिक चार्ज की गई बैटरी का उपयोग किया जाता है। | ||
भस्मीकरण के माध्यम से बैटरी का निपटान करने से विस्फोट हो सकता है क्योंकि सीलबंद मामले में भाप का निर्माण होता है। | भस्मीकरण के माध्यम से बैटरी का निपटान करने से विस्फोट हो सकता है क्योंकि सीलबंद मामले में भाप का निर्माण होता है। | ||
[[File:LeakedBattery 2701a.jpg|thumb|लीक से क्षतिग्रस्त क्षारीय बैटरी]] | [[File:LeakedBattery 2701a.jpg|thumb|लीक से क्षतिग्रस्त क्षारीय बैटरी]] | ||
कई बैटरी रसायन संक्षारक, जहरीले या दोनों होते हैं। यदि रिसाव होता है, या तो अनायास या दुर्घटना से, जारी किए गए रसायन खतरनाक हो सकते हैं। उदाहरण के लिए, डिस्पोजेबल बैटरियां | कई बैटरी रसायन संक्षारक, जहरीले या दोनों होते हैं। यदि रिसाव होता है, या तो अनायास या दुर्घटना से, जारी किए गए रसायन खतरनाक हो सकते हैं। उदाहरण के लिए, डिस्पोजेबल बैटरियां अधिकांशतः एक जिंक कैन का उपयोग एक अभिकारक के रूप में और अन्य अभिकर्मकों को रखने के लिए कंटेनर के रूप में कर सकती हैं। यदि इस प्रकार की बैटरी अधिक डिस्चार्ज हो जाती है, तो अभिकर्मक कार्डबोर्ड और प्लास्टिक के माध्यम से निकल सकते हैं जो कंटेनर के शेष भाग को बनाते हैं। सक्रिय रासायनिक रिसाव तब बैटरी की शक्ति वाले उपकरणों को नुकसान पहुंचा सकता है या अक्षम कर सकता है। इस कारण से कई इलेक्ट्रॉनिक उपकरण निर्माता उन उपकरणों से बैटरियों को हटाने की सलाह देते हैं जिनका उपयोग विस्तारित अवधि के लिए नहीं किया जाएगा। | ||
कई प्रकार की बैटरियां एक इलेक्ट्रोड या इलेक्ट्रोलाइट के रूप में विषाक्त पदार्थों जैसे सीसा, पारा (तत्व), और कैडमियम का उपयोग करती हैं। जब प्रत्येक बैटरी जीवन के अंत तक पहुँच जाती है तो पर्यावरणीय क्षति को रोकने के लिए इसका निपटान किया जाना चाहिए।<ref>[https://web.archive.org/web/20060929214808/http://www.epa.gov/epr/products/batteries.htm Batteries. ''EPA''. Retrieved 11 September 2007]</ref> बैटरी इलेक्ट्रॉनिक अपशिष्ट (ई-कचरा) का एक रूप है। ई-कचरा रीसाइक्लिंग सेवाएं विषाक्त पदार्थों को पुनर्प्राप्त करती हैं, जिन्हें बाद में नई बैटरी के लिए उपयोग किया जा सकता है।<ref>[http://earth911.org/recycling/battery-recycling Battery Recycling » Earth 911]. Retrieved 9 September 2007.</ref> संयुक्त राज्य अमेरिका में सालाना खरीदी जाने वाली लगभग तीन बिलियन बैटरियों में से लगभग 179,000 टन देश भर में लैंडफिल में समाप्त हो जाती है।<ref>"San Francisco Supervisor Takes Aim at Toxic Battery Waste". ''Environmental News Network'' (11 July 2001).</ref> | कई प्रकार की बैटरियां एक इलेक्ट्रोड या इलेक्ट्रोलाइट के रूप में विषाक्त पदार्थों जैसे सीसा, पारा (तत्व), और कैडमियम का उपयोग करती हैं। जब प्रत्येक बैटरी जीवन के अंत तक पहुँच जाती है तो पर्यावरणीय क्षति को रोकने के लिए इसका निपटान किया जाना चाहिए।<ref>[https://web.archive.org/web/20060929214808/http://www.epa.gov/epr/products/batteries.htm Batteries. ''EPA''. Retrieved 11 September 2007]</ref> बैटरी इलेक्ट्रॉनिक अपशिष्ट (ई-कचरा) का एक रूप है। ई-कचरा रीसाइक्लिंग सेवाएं विषाक्त पदार्थों को पुनर्प्राप्त करती हैं, जिन्हें बाद में नई बैटरी के लिए उपयोग किया जा सकता है।<ref>[http://earth911.org/recycling/battery-recycling Battery Recycling » Earth 911]. Retrieved 9 September 2007.</ref> संयुक्त राज्य अमेरिका में सालाना खरीदी जाने वाली लगभग तीन बिलियन बैटरियों में से लगभग 179,000 टन देश भर में लैंडफिल में समाप्त हो जाती है।<ref>"San Francisco Supervisor Takes Aim at Toxic Battery Waste". ''Environmental News Network'' (11 July 2001).</ref> | ||
{{further|Lithium battery#Health issues on ingestion|Button cell#Accidental ingestion}} | {{further|Lithium battery#Health issues on ingestion|Button cell#Accidental ingestion}} | ||
निगलने पर बैटरियां हानिकारक या घातक हो सकती हैं।<ref>[http://data.energizer.com/PDFs/carbonzinc_psds.pdf Product Safety DataSheet. Energizer (p. 2). Retrieved 9 September 2007]</ref> छोटे बटन कोशिकाओं को विशेष रूप से छोटे बच्चों द्वारा निगला जा सकता है। पाचन तंत्र में रहते हुए, बैटरी के विद्युत निर्वहन से ऊतक क्षति हो सकती है;<ref>{{cite web|url=http://www.poison.org/battery/ |title=Swallowed a Button Battery? | Battery in the Nose or Ear? |publisher=Poison.org |date=3 March 2010 |access-date=26 July 2013 |url-status=dead |archive-url=https://web.archive.org/web/20130816183602/http://www.poison.org/battery/ |archive-date=16 August 2013 }}</ref> ऐसी क्षति कभी-कभी गंभीर होती है और इससे मृत्यु भी हो सकती है। जब तक वे गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में दर्ज नहीं हो जाते, तब तक इंजेस्टेड डिस्क बैटरियां समस्या पैदा नहीं करती हैं। डिस्क बैटरियों के दर्ज होने का सबसे | निगलने पर बैटरियां हानिकारक या घातक हो सकती हैं।<ref>[http://data.energizer.com/PDFs/carbonzinc_psds.pdf Product Safety DataSheet. Energizer (p. 2). Retrieved 9 September 2007]</ref> छोटे बटन कोशिकाओं को विशेष रूप से छोटे बच्चों द्वारा निगला जा सकता है। पाचन तंत्र में रहते हुए, बैटरी के विद्युत निर्वहन से ऊतक क्षति हो सकती है;<ref>{{cite web|url=http://www.poison.org/battery/ |title=Swallowed a Button Battery? | Battery in the Nose or Ear? |publisher=Poison.org |date=3 March 2010 |access-date=26 July 2013 |url-status=dead |archive-url=https://web.archive.org/web/20130816183602/http://www.poison.org/battery/ |archive-date=16 August 2013 }}</ref> ऐसी क्षति कभी-कभी गंभीर होती है और इससे मृत्यु भी हो सकती है। जब तक वे गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में दर्ज नहीं हो जाते, तब तक इंजेस्टेड डिस्क बैटरियां समस्या पैदा नहीं करती हैं। डिस्क बैटरियों के दर्ज होने का सबसे साधारण स्थान अन्नप्रणाली है, जिसके परिणामस्वरूप नैदानिक अनुक्रम होता है। एसोफैगस को सफलतापूर्वक पार करने वाली बैटरियों के कहीं और रहने की संभावना नहीं है। एसोफैगस में डिस्क बैटरी के जमा होने की संभावना रोगी की उम्र और बैटरी के आकार पर निर्भर करती है। बड़े बच्चों को 21-23 मिमी से छोटी बैटरी की समस्या नहीं होती है। द्रवीकरण परिगलन हो सकता है क्योंकि सोडियम हाइड्रॉक्साइड बैटरी द्वारा उत्पादित धारा (सामान्यतः एनोड पर) द्वारा उत्पन्न होता है। अंतर्ग्रहण के 6 घंटे बाद जितनी तेजी से वेध हुआ है।<ref>{{citation|url=http://emedicine.medscape.com/article/774838-overview|title=Disk Battery Ingestion: Background, Pathophysiology, Epidemiology |last=Dire |first=Daniel J. |editor-last=Vearrier |editor-first=David |work=Medscape |date=2016-06-09 |url-access=registration}}</ref> | ||
== विधान और विनियमन == | == विधान और विनियमन == | ||
{{see also|battery regulations in the United Kingdom}}इलेक्ट्रिक बैटरी से संबंधित कानून में सुरक्षित निपटान और पुनर्चक्रण जैसे विषय सम्मिलित हैं। | {{see also|battery regulations in the United Kingdom}}इलेक्ट्रिक बैटरी से संबंधित कानून में सुरक्षित निपटान और पुनर्चक्रण जैसे विषय सम्मिलित हैं। | ||
संयुक्त राज्य अमेरिका में, 1996 के मरकरी-कंटेनिंग एंड रिचार्जेबल बैटरी मैनेजमेंट एक्ट ने पारा युक्त बैटरी की बिक्री पर प्रतिबंध लगा दिया, रिचार्जेबल बैटरी के लिए एक समान लेबलिंग आवश्यकताओं को लागू किया और आवश्यक है कि रिचार्जेबल बैटरी आसानी से हटाने योग्य हो।<ref>{{cite web |title=Mercury-Containing and Rechargeable Battery Management Act |url=https://www.epa.gov/sites/production/files/2016-03/documents/p1104.pdf |website=EPA |access-date=15 February 2021}}</ref> कैलिफ़ोर्निया और न्यूयॉर्क शहर ठोस कचरे में रिचार्जेबल बैटरी के निपटान पर रोक लगाते हैं।<ref name="C2R_NY">{{cite web |url=https://www.call2recycle.org/newyork/ |title=Battery Recycling in New York... it's the law! |date=31 October 2013 |publisher=call2recycle.org |accessdate=2 June 2021}}</ref><ref name="RCBRA2006">{{Citation | title = Bill No. 1125 - Rechargeable Battery Recycling Act of 2006, State of California | year = 2006 | url =http://www.leginfo.ca.gov/pub/05-06/bill/asm/ab_1101-1150/ab_1125_bill_20051006_chaptered.pdf | accessdate = 2 June 2021}}</ref> रिचार्जेबल बैटरी उद्योग संयुक्त राज्य अमेरिका और कनाडा में स्थानीय खुदरा विक्रेताओं पर ड्रॉपऑफ़ बिंदुओं के साथ राष्ट्रव्यापी पुनर्चक्रण कार्यक्रम संचालित करता है।<ref name="rbrc">{{cite web |url=http://www.rbrc.org/consumer/howitallworks_faq.shtml |title=Rechargeable Battery Recycling Corporation |website=www.rbrc.org |access-date=15 January 2022 |archive-url=https://web.archive.org/web/20080812080100/http://www.rbrc.org/consumer/howitallworks_faq.shtml |archive-date=12 August 2008 |url-status=dead}}</ref> | संयुक्त राज्य अमेरिका में, 1996 के मरकरी-कंटेनिंग एंड रिचार्जेबल बैटरी मैनेजमेंट एक्ट ने पारा युक्त बैटरी की बिक्री पर प्रतिबंध लगा दिया, रिचार्जेबल बैटरी के लिए एक समान लेबलिंग आवश्यकताओं को लागू किया और आवश्यक है कि रिचार्जेबल बैटरी आसानी से हटाने योग्य हो।<ref>{{cite web |title=Mercury-Containing and Rechargeable Battery Management Act |url=https://www.epa.gov/sites/production/files/2016-03/documents/p1104.pdf |website=EPA |access-date=15 February 2021}}</ref> कैलिफ़ोर्निया और न्यूयॉर्क शहर ठोस कचरे में रिचार्जेबल बैटरी के निपटान पर रोक लगाते हैं।<ref name="C2R_NY">{{cite web |url=https://www.call2recycle.org/newyork/ |title=Battery Recycling in New York... it's the law! |date=31 October 2013 |publisher=call2recycle.org |accessdate=2 June 2021}}</ref><ref name="RCBRA2006">{{Citation | title = Bill No. 1125 - Rechargeable Battery Recycling Act of 2006, State of California | year = 2006 | url =http://www.leginfo.ca.gov/pub/05-06/bill/asm/ab_1101-1150/ab_1125_bill_20051006_chaptered.pdf | accessdate = 2 June 2021}}</ref> रिचार्जेबल बैटरी उद्योग संयुक्त राज्य अमेरिका और कनाडा में स्थानीय खुदरा विक्रेताओं पर ड्रॉपऑफ़ बिंदुओं के साथ राष्ट्रव्यापी पुनर्चक्रण कार्यक्रम संचालित करता है।<ref name="rbrc">{{cite web |url=http://www.rbrc.org/consumer/howitallworks_faq.shtml |title=Rechargeable Battery Recycling Corporation |website=www.rbrc.org |access-date=15 January 2022 |archive-url=https://web.archive.org/web/20080812080100/http://www.rbrc.org/consumer/howitallworks_faq.shtml |archive-date=12 August 2008 |url-status=dead}}</ref> | ||
बैटरी के पुनर्चक्रण को बढ़ाने और बेहतर बैटरी पुनर्चक्रण विधियों पर अनुसंधान को बढ़ावा देने के | बैटरी के पुनर्चक्रण को बढ़ाने और बेहतर बैटरी पुनर्चक्रण विधियों पर अनुसंधान को बढ़ावा देने के अतिरिक्त, यूरोपीय संघ के बैटरी निर्देश की समान आवश्यकताएं हैं।<ref>[http://europa.eu/legislation_summaries/environment/waste_management/l21202_en.htm Disposal of spent batteries and accumulators]. ''European Union''. Retrieved 27 July 2009.</ref> इस निर्देश के अनुसार यूरोपीय संघ के भीतर बेची जाने वाली सभी बैटरियों को संग्रह प्रतीक (एक क्रॉस-आउट व्हील्ड बिन) के साथ चिह्नित किया जाना चाहिए। इसमें प्रिज्मीय बैटरियों की सतह का कम से कम 3% और बेलनाकार बैटरी की सतह का 1.5% होना चाहिए। सभी पैकेजिंग को इसी प्रकार चिह्नित किया जाना चाहिए।<ref>{{Cite web|url=http://www.epbaeurope.net/documents/Newmarkingguidelines_final8March2011.pdf|archiveurl=https://web.archive.org/web/20111007014932/http://www.epbaeurope.net/documents/Newmarkingguidelines_final8March2011.pdf|title=Guidelines on Portable Batteries Marking Requirements in the European Union 2008 | publisher = EPBA-EU|archivedate=7 October 2011}}</ref> | ||
रिपोर्ट की गई दुर्घटनाओं और विफलताओं के | रिपोर्ट की गई दुर्घटनाओं और विफलताओं के उत्तर में, कभी-कभी प्रज्वलन या विस्फोट, हाल के वर्षों में लिथियम-आयन बैटरी का उपयोग करने वाले उपकरणों की याद अधिक साधारण हो गई है।<ref>{{cite web |url=http://electronics360.globalspec.com/article/5555/lithium-batteries-the-pros-and-cons |title=Lithium Batteries: The Pros and Cons |last=Schweber |first=Bill |date=August 4, 2015 |website=GlobalSpec |publisher=GlobalSpec |access-date=March 15, 2017}}</ref><ref>{{cite news |last=Fowler |first=Suzanne |date=21 September 2016 |title=Samsung's Recall – The Problem with Lithium Ion Batteries |url=https://www.nytimes.com/2016/09/03/technology/samsungs-recall-the-problem-with-lithium-ion-batteries.html?_r=0 | work=[[The New York Times]] |location=New York |access-date=15 March 2016}}</ref> | ||
| Line 384: | Line 384: | ||
* बैटरी सिम्युलेटर | * बैटरी सिम्युलेटर | ||
* नैनोवायर बैटरी | * नैनोवायर बैटरी | ||
* सुपर बैटरी | * सुपर बैटरी को खोजना | ||
== संदर्भ == | == संदर्भ == | ||
| Line 417: | Line 417: | ||
[[index.php?title=Category:बैटरी (बिजली)| ]] | [[index.php?title=Category:बैटरी (बिजली)| ]] | ||
[[Category: | |||
[[Category: | [[Category:18वीं सदी के आविष्कार]] | ||
[[Category: | [[Category:All articles containing potentially dated statements]] | ||
[[Category: | [[Category:Articles containing potentially dated statements from 2012]] | ||
[[Category: | [[Category:Articles containing potentially dated statements from 2017]] | ||
[[Category:Articles with Curlie links]] | |||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:Collapse templates]] | |||
[[Category:Commons category link is the pagename]] | |||
[[Category:Created On 09/09/2022]] | [[Category:Created On 09/09/2022]] | ||
Revision as of 23:33, 16 August 2023
 | |
| प्रकार | Power source |
|---|---|
| Working principle | Electrochemical reactions, Electromotive force |
| First production | 1800s |
| Electronic symbol | |
 The symbol for a battery in a circuit diagram. It originated as a schematic drawing of the earliest type of battery, a voltaic pile. | |
इलेक्ट्रिक बैटरी के बाह्य संयोजन के साथ एक या एक से अधिक विद्युत यांत्रिक कोशिकाओं से युक्त विद्युत शक्ति का मुख्य स्रोत है,[1] किसी विद्युत उपकरण को विद्युत प्रदान करने के लिए इसका उपयोग किया जाता हैं।
जब बैटरी विद्युत की आपूर्ति कर रही होती है, तो इसका धनात्मक टर्मिनल कैथोड होता है और इसका ऋणात्मक टर्मिनल एनोड होता है।[2] ऋणात्मक चिह्नित टर्मिनल मुख्य रूप से इलेक्ट्रॉन का स्रोत है, जो बाह्य विद्युत परिपथ से धनात्मक टर्मिनल तक प्रवाहित होते हैं। जब बैटरी को बाह्य विद्युत बल से संयोजित किया जाता है, तो रेडॉक्स प्रतिक्रिया उच्च-ऊर्जा अभिकारकों को निम्न-ऊर्जा उत्पादों में परिवर्तित करती है, और गिब्स मुक्त ऊर्जा या मुक्त-ऊर्जा अंतर को विद्युत ऊर्जा के रूप में बाह्य परिपथ तक पहुंचाया जाता है। इस प्रकार से ऐतिहासिक रूप से बैटरी शब्द को विशेष रूप से कई कोशिकाओं से बने उपकरण के लिए संदर्भित किया जाता है, चूंकि उपयोग एकल सेल से बने उपकरणों को सम्मिलित करने के लिए विकसित हुआ है।[3]
प्राथमिक बैटरी का एकल-उपयोग या डिस्पोजेबल बैटरी का उपयोग मुख्यतः डिस्पोजेबल उत्पाद के रूप में किया जाता है, क्योंकि डिस्आवेश के समय इलेक्ट्रोड सामग्री अपरिवर्तनीय रूप से परिवर्तित हो जाती है, सामान्य रूप से इसका प्रमुख उदाहरण फ्लैशलाइट और पोर्टेबल इलेक्ट्रॉनिक उपकरणों के समूह के लिए उपयोग की जाने वाली क्षारीय बैटरी है। इसके आधार पर रिआवेशेबल बैटरी या सेकेंडरी (रिआवेशेबल) बैटरियों पर लागू होने वाले विद्युत प्रवाह का उपयोग करके कई बार डिस्आवेश और रिआवेश किया जा सकता है, इलेक्ट्रोड की मूल संरचना को रिवर्स धारा द्वारा अलग किया जा सकता है। उदाहरणों के लिए वाहनों में उपयोग की जाने वाली लेड-एसिड बैटरी और पोर्टेबल इलेक्ट्रॉनिक्स जैसे लैपटॉप और मोबाइल फोन के लिए उपयोग की जाने वाली लिथियम-आयन बैटरी सम्मिलित हैं।
बैटरियां कई आकार और आकारों में आती हैं, इसके लिए लघु कोशिकाओं से लेकर श्रवण यंत्रों और कलाई में पहने जाने वाली घड़ी को विद्युत देने के लिए, सबसे बड़े सीमा तक विशाल बैटरी बैंकों के कमरों का आकार जो टेलीफोन एक्सचेंजों और कंप्यूटर डेटा केंद्रों के लिए स्टैंडबाय या आपातकालीन शक्ति प्रदान करते हैं।
गैसोलीन जैसे सामान्य ईंधन की तुलना में बैटरियों में बहुत कम विशिष्ट ऊर्जा (प्रति इकाई द्रव्यमान ऊर्जा) होती है। इस प्रकार ऑटोमोबाइल में, यह दहन इंजन की तुलना में विद्युत ऊर्जा को यांत्रिक कार्य में परिवर्तित करने में इलेक्ट्रिक मोटर्स की उच्च दक्षता से कुछ सीमा तक ऑफसेट होता है।
इतिहास
आविष्कार
बेंजामिन फ्रैंकलिन ने पहली बार बैटरी शब्द का उपयोग 1749 में किया था जब वह जुड़े हुए लेडेन जार कैपेसिटर के सेट का उपयोग करके विद्युत के साथ प्रयोग कर रहे थे। [4] इसके साथ ही कार्य करने वाले हथियारों के लिए सैन्य शब्द का उपयोग करते हुए, फ्रैंकलिन ने कई जारों को बैटरी के रूप में वर्णित किया गया है। [5] इसे धारण करने वाले जहाजों की संख्या को गुणा करके, शक्तिशाली आवेश संग्रहीत किये जा सकते है, और निर्वहन पर अधिक शक्ति उपलब्ध होगी।
इतालवी भौतिक विज्ञानी एलेसेंड्रो वोल्टा ने 1800 में पहली विद्युत यांत्रिक बैटरी, वोल्टाइक पाइल का निर्माण और वर्णन किया था।[6] यह तांबे और जस्ता प्लेटों का ढेर था, जो नमकीन पानी से लथपथ कागज डिस्क द्वारा अलग किया गया था, जो अत्यधिक लंबे समय तक स्थिर धारा उत्पन्न कर सकता था। इसके आधार पर वोल्टा को यह समझ में नहीं आया कि वोल्टेज रासायनिक प्रतिक्रियाओं के कारण था। उसने सोचा कि उसकी कोशिकाएँ ऊर्जा का अटूट स्रोत हैं,[7] और यह कि इलेक्ट्रोड पर संबंधित जंग प्रभाव उनके संचालन के अपरिहार्य परिणाम के अतिरिक्त मात्र उप-द्रव थे, जैसा कि माइकल फैराडे ने 1834 में दिखाया था।[8]
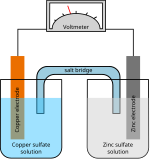
चूंकि प्रायोगिक उद्देश्यों के लिए प्रारम्भिक बैटरी बहुत महत्वपूर्ण थीं,[9] व्यवहार में उनके वोल्टेज में उतार-चढ़ाव होता था और वे निरंतर अवधि के लिए बड़ा धारा प्रदान नहीं कर सकते थे। 1836 में ब्रिटिश रसायनज्ञ जॉन फ्रेडरिक डेनियल द्वारा आविष्कार किया गया, डेनियल सेल, विद्युत का पहला व्यावहारिक स्रोत था, उद्योग मानक बन गया और विद्युत टेलीग्राफ नेटवर्क के लिए शक्ति स्रोत के रूप में व्यापक रूप से अपनाया गया था।[10] इसमें कॉपर सल्फेट के घोल से भरा तांबे का बर्तन होता था, जिसमें सल्फ्यूरिक एसिड और जिंक इलेक्ट्रोड से भरा बिना चमकता हुआ मिट्टी के बरतन कंटेनर में डुबोया जाता था।[11]
इन वेट सेल्स में लिक्विड इलेक्ट्रोलाइट्स का उपयोग किया गया था, जिन्हें सही तरीके से हैंडल न करने पर लीकेज और स्पिलेज होने का खतरा होता था। कई लोगों ने अपने घटकों को रखने के लिए कांच के जार का उपयोग किया, जिससे वे कम शक्तिशाली और संभावित रूप से खतरनाक हो गए। इन विशेषताओं ने गीली कोशिकाओं को पोर्टेबल उपकरणों के लिए अनुपयुक्त बना दिया। उन्नीसवीं सदी के अंत के समीप, शुष्क सेल के आविष्कार ने, जिसने तरल इलेक्ट्रोलाइट को पेस्ट से परिवर्तित दिया, पोर्टेबल विद्युत उपकरणों को व्यावहारिक बना दिया।[12]
वैक्यूम ट्यूब बैटरी ने ऐतिहासिक रूप से ए बैटरी (फिलामेंट को शक्ति प्रदान करने के लिए) और बी बैटरी (प्लेट वोल्टेज प्रदान करने के लिए) के लिए सूखी सेल के लिए गीले सेल का उपयोग किया था।
भविष्य
2010 और 2018 के बीच, वार्षिक बैटरी की मांग में 30% की वृद्धि हुई, जो 2018 में कुल 180 गीगावॉट तक पहुंच गई थी। इस प्रकार विकास दर अनुमानित 25% पर बनाए रखने की उम्मीद है, जिसकी परिणति 2030 में 2600 गीगावॉट तक पहुंच गई। इसके अतिरिक्त लागत में कटौती से मांग में 3562 GwH तक और वृद्धि होने की उम्मीद है।[13]
इलेक्ट्रिक बैटरी उद्योग के विकास की इस उच्च दर के महत्वपूर्ण कारणों में परिवहन का विद्युतीकरण,[13] और विद्युत ग्रिड में बड़े पैमाने पर प्रभाव,[13] मानवजनित जलवायु परिवर्तन द्वारा समर्थित, जीवाश्म-ईंधन के दहनशील ऊर्जा स्रोतों से दूर स्वच्छ, नवीकरणीय स्रोतों और अधिक कठोर उत्सर्जन व्यवस्थाओं की ओर ले जाता है।
वितरित इलेक्ट्रिक बैटरी, जैसे कि बैटरी इलेक्ट्रिक वाहनों (वाहन से ग्रिड) और घरेलू ऊर्जा भंडारण में, स्मार्ट मीटरिंग के साथ और जो मांग प्रतिक्रिया के लिए स्मार्ट ग्रिड से जुड़ी हैं, स्मार्ट पावर सप्लाई ग्रिड में सक्रिय भागीदार हैं।[14]
पुन: उपयोग के नए तरीके, जैसे आंशिक रूप से उपयोग की जाने वाली बैटरियों का सोपानक उपयोग, इलेक्ट्रिक बैटरी की समग्र उपयोगिता को बढ़ाते हैं, ऊर्जा भंडारण लागत को कम करते हैं, और लंबे जीवन के कारण प्रदूषण/उत्सर्जन प्रभावों को भी कम करते हैं। इस प्रकार की बैटरियों के सोपानक उपयोग में, वाहन इलेक्ट्रिक बैटरी जिनकी बैटरी क्षमता 80% से कम हो जाती है, सामान्यतः 5-8 वर्षों की सेवा के पश्चात बैकअप आपूर्ति के रूप में या अक्षय ऊर्जा भंडारण प्रणालियों के लिए उपयोग के लिए पुन: उपयोग की जाती हैं।[15]
ग्रिड स्केल एनर्जी स्टोरेज में ग्रिड या पावर प्लांट से बैटरी स्टोरेज पावर स्टेशन के लिए बैटरियों के बड़े पैमाने पर उपयोग की परिकल्पना की जाती है और फिर बाद में आवश्यकता पड़ने पर विद्युत या अन्य ग्रिड सेवाएं प्रदान करने के लिए उस ऊर्जा को डिस्आवेश किया जाता है। इस प्रकार ग्रिड स्केल ऊर्जा भंडारण (या तो टर्नकी या वितरित) स्मार्ट विद्युत आपूर्ति ग्रिड के महत्वपूर्ण घटक हैं।[16]
रसायन विज्ञान और सिद्धांत
बैटरियां रासायनिक ऊर्जा को सीधे विद्युत ऊर्जा में परिवर्तित करती हैं। कई स्थितियों में, प्रस्तुत विद्युत ऊर्जा संयोजक या विद्युत रासायनिक प्रतिक्रिया से गुजरने वाली धातुओं, आक्साइडों या अणुओं की बंध ऊर्जा में अंतर है।[17] उदाहरण के लिए, ऊर्जा को Zn या Li में संग्रहीत किया जा सकता है, जो उच्च-ऊर्जा धातु हैं क्योंकि वे संक्रमण धातुओं के विपरीत, d-इलेक्ट्रॉन बंधन द्वारा स्थिर नहीं होते हैं। बैटरियों को डिज़ाइन किया गया है जिससे कि ऊर्जावान रूप से अनुकूल रेडॉक्स प्रतिक्रिया केवल तभी हो सकती है जब इलेक्ट्रॉन परिपथ के बाह्य भाग से गुजरते हैं।
एक बैटरी में कुछ संख्या में वोल्टाइक सेल होते हैं। प्रत्येक कोशिका में दो अर्ध-कोशिकाएँ होती हैं जो धातु के धनायनों वाले प्रवाहकीय इलेक्ट्रोलाइट द्वारा श्रृंखला में जुड़ी होती हैं। इस प्रकार अर्ध-सेल में इलेक्ट्रोलाइट और ऋणात्मक इलेक्ट्रोड सम्मिलित हैं, वह इलेक्ट्रोड जिससे आयन#आयन और धनायन (ऋणात्मक रूप से आवेशित आयन) माइग्रेट होते हैं, इसके अन्य अर्ध-सेल में इलेक्ट्रोलाइट और धनात्मक इलेक्ट्रोड सम्मिलित हैं, जिससे आयन और धनायन (धनात्मक आवेशित आयन) माइग्रेट होते हैं। इस प्रकार कैथोड पर धनायन कम हो जाते हैं, जो इलेक्ट्रॉन से जोड़े जाते हैं, जबकि धातु के परमाणु एनोड पर ऑक्सीकृत होकर इलेक्ट्रॉन द्वारा हटा दिए जाते हैं।[18] कुछ कोशिकाएँ प्रत्येक अर्ध-कोशिका के लिए भिन्न-भिन्न इलेक्ट्रोलाइट्स का उपयोग करती हैं, तब विद्युत परिपथ को पूरा करने के लिए आयनों को अर्ध-कोशिकाओं के बीच प्रवाहित करने की अनुमति देते हुए इलेक्ट्रोलाइट्स के मिश्रण को रोकने के लिए विभाजक का उपयोग किया जाता है।
प्रत्येक अर्ध-सेल में मानक हाइड्रोजन इलेक्ट्रोड के सापेक्ष इलेक्ट्रोमोटिव बल (ईएमएफ, वोल्ट में मापा जाता है) होता है। सेल का नेट ईएमएफ उसकी अर्ध-कोशिकाओं के ईएमएफ के बीच का अंतर है।[19] इस प्रकार, यदि इलेक्ट्रोड में ईएमएफ है तथा , तो शुद्ध ईएमएफ है , दूसरे शब्दों में, शुद्ध ईएमएफ अर्ध-प्रतिक्रियाओं की कमी क्षमता के बीच का अंतर है।[20]
विद्युत ड्राइविंग बल or सेल के बैटरी टर्मिनल के आर-पार टर्मिनल वोल्टेज (अंतर) के रूप में जाना जाता है और इसे वोल्ट में मापा जाता है।[21] इस प्रकार सेल का टर्मिनल वोल्टेज जो न तो आवेश हो रहा है और न ही डिस्आवेश हो रहा है, ओपन-परिपथ वोल्टेज कहलाता है और सेल के ईएमएफ के बराबर होता है। इसके आधार पर आंतरिक प्रतिरोध के कारण,[22] डिस्आवेश करने वाले सेल का टर्मिनल वोल्टेज ओपन-परिपथ वोल्टेज की तुलना में परिमाण में छोटा होता है और आवेश करने वाले सेल का टर्मिनल वोल्टेज ओपन-परिपथ वोल्टेज से अधिक होता है।[23] इस प्रकार आदर्श सेल में नगण्य आंतरिक प्रतिरोध होता है, इसलिए यह का निरंतर टर्मिनल वोल्टेज बनाए रखेगा समाप्त होने तक, फिर शून्य पर गिरना। यदि ऐसा सेल 1.5 वोल्ट बनाए रखता है और कूलम्ब का आवेश उत्पन्न करता है तो पूर्ण निर्वहन पर यह 1.5 जूल कार्य करता हैं।[21] इस प्रकार वास्तविक कोशिकाओं में, निर्वहन के अनुसार आंतरिक प्रतिरोध बढ़ जाता है[22] और ओपन-परिपथ वोल्टेज भी डिस्आवेश के अनुसार कम हो जाता है। यदि वोल्टेज और प्रतिरोध को समय के विरुद्ध प्लॉट किया जाता है, तो परिणामी ग्राफ़ सामान्यतः वक्र होते हैं, वक्र का आकार रसायन विज्ञान और नियोजित आंतरिक व्यवस्था के अनुसार परिवर्तितता रहता है।
एक सेल के टर्मिनलों में विकसित वोल्टेज उसके इलेक्ट्रोड और इलेक्ट्रोलाइट की रासायनिक प्रतिक्रियाओं की ऊर्जा रिलीज पर निर्भर करता है। क्षारीय बैटरी और जिंक-कार्बन बैटरी|जिंक-कार्बन कोशिकाओं में अलग-अलग रसायन होते हैं, अपितु लगभग 1.5 वोल्ट का ही ईएमएफ, इसी तरह निकेल-कैडमियम बैटरी और निकेल-मेटल हाइड्राइड बैटरी सेल में अलग-अलग रसायन होते हैं, अपितु लगभग 1.2 वोल्ट का ईएमएफ समान होता है।[24] लिथियम यौगिकों की प्रतिक्रियाओं में उच्च विद्युत रासायनिक संभावित परिवर्तन लिथियम कोशिकाओं को 3 वोल्ट या उससे अधिक के ईएमएफ देते हैं।[25]
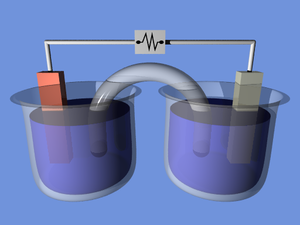
लगभग कोई भी तरल या नम वस्तु जिसमें विद्युत प्रवाहकीय होने के लिए पर्याप्त आयन होते हैं, सेल के लिए इलेक्ट्रोलाइट के रूप में कार्य कर सकते हैं। इस प्रकार इसकी नवीनता या विज्ञान प्रदर्शन के रूप में, नींबू बैटरी में विभिन्न धातुओं से बने दो इलेक्ट्रोड डालना संभव है,[26] आलू,[27] आदि और कम मात्रा में विद्युत उत्पन्न करते हैं।
एक वोल्टाइक ढेर दो सिक्कों (जैसे निकल और पैसा) से बनाया जा सकता है और कागज़ के तौलिये को खारे पानी में डुबोया जा सकता है। ऐसा ढेर बहुत कम वोल्टेज उत्पन्न करता है अपितु, जब कई श्रृंखला परिपथ में ढेर हो जाते हैं, तो वे थोड़े समय के लिए सामान्य बैटरी को परिवर्तित सकते हैं।[28]
प्रकार
प्राथमिक और माध्यमिक बैटरी
बैटरियों को प्राथमिक और द्वितीयक रूपों में वर्गीकृत किया गया है:
- प्राथमिक बैटरियों को तब तक उपयोग करने के लिए डिज़ाइन किया गया है जब तक कि ऊर्जा समाप्त नहीं हो जाती है और फिर छोड़ दी जाती है। उनकी रासायनिक प्रतिक्रियाएं सामान्यतः प्रतिवर्ती नहीं होती हैं, इसलिए उन्हें रिआवेश नहीं किया जा सकता है। जब बैटरी में अभिकारकों की आपूर्ति समाप्त हो जाती है, तो बैटरी धारा उत्पन्न करना बंद कर देती है और बेकार हो जाती है।[29]
- सेकेंडरी बैटरी को रिआवेश किया जा सकता है, अर्थात्, वे सेल में विद्युत धारा लगाकर अपनी रासायनिक प्रतिक्रियाओं को परिवर्तित कर सकते हैं। यह मूल रासायनिक अभिकारकों को पुन: उत्पन्न करता है, इसलिए उनका उपयोग, रिआवेश और कई बार फिर से उपयोग किया जा सकता है।[30]
कुछ प्रकार की प्राथमिक बैटरियों का उपयोग किया जाता है, उदाहरण के लिए, टेलीग्राफी परिपथ के लिए, इलेक्ट्रोड को परिवर्तितकर संचालन के लिए हटा दिया गया था।[31] सक्रिय सामग्री के अपव्यय, इलेक्ट्रोलाइट की हानि और आंतरिक जंग के कारण माध्यमिक बैटरी अनिश्चित काल के लिए रिआवेशेबल नहीं हैं।
प्राथमिक बैटरी, या प्राथमिक सेल, असेंबली पर तुरंत धारा उत्पन्न कर सकते हैं। ये सामान्यतः पोर्टेबल उपकरणों में उपयोग किए जाते हैं जिनमें कम धारा ड्रेन होता है, केवल रुक-रुक कर उपयोग किया जाता है, या वैकल्पिक विद्युत स्रोत से दूर उपयोग किया जाता है, जैसे अलार्म और संचार परिपथ में जहां अन्य विद्युत शक्ति केवल रुक-रुक कर उपलब्ध होती है। डिस्पोजेबल प्राथमिक कोशिकाओं को मज़बूती से रिआवेश नहीं किया जा सकता है, क्योंकि रासायनिक प्रतिक्रियाएं आसानी से प्रतिवर्ती नहीं होती हैं और सक्रिय सामग्री अपने मूल रूपों में वापस नहीं आ सकती हैं। बैटरी निर्माता प्राथमिक कोशिकाओं को रिआवेश करने के प्रयास के विरुद्ध सलाह देते हैं।[32] सामान्यतः, इनमें रिआवेशेबल बैटरी की तुलना में अधिक ऊर्जा घनत्व होता है,[33] अपितु डिस्पोजेबल बैटरी 75 ओम (75 ) से कम विद्युत के बल वाले उच्च-ड्रेनेज अनुप्रयोगों के अनुसार अच्छी तरह से कार्य नहीं करती हैं। सामान्य प्रकार की डिस्पोजेबल बैटरियों में जिंक-कार्बन बैटरी और क्षारीय बैटरी सम्मिलित हैं।
सेकेंडरी बैटरी, जिसे सेकेंडरी सेल या रिआवेशेबल बैटरी के रूप में भी जाना जाता है, को पहले उपयोग से पहले आवेश किया जाना चाहिए, वे सामान्यतः छुट्टी दे दी गई अवस्था में सक्रिय सामग्री के साथ एकत्रित होते हैं। इस प्रकार रिआवेशेबल बैटरियों को विद्युत धारा लगाकर (पुनः) आवेश किया जाता है, जो डिस्आवेश/उपयोग के समय होने वाली रासायनिक प्रतिक्रियाओं को परिवर्तित कर देता है। इसके आधार पर उपयुक्त धारा की आपूर्ति करने वाले उपकरणों को आवेशर कहा जाता है। रिआवेशेबल बैटरी का सबसे पुराना रूप लेड-एसिड बैटरी है, जिसका व्यापक रूप से ऑटोमोटिव और बोटिंग अनुप्रयोगों में उपयोग किया जाता है। इस तकनीक में सीलबंद कंटेनर में तरल इलेक्ट्रोलाइट होता है, जिसकी आवश्यकता होती है कि बैटरी को सीधा रखा जाए और ओवरआवेशिंग (बैटरी) के समय उत्पन्न होने वाली हाइड्रोजन गैस के सुरक्षित फैलाव को सुनिश्चित करने के लिए क्षेत्र को अच्छी तरह वायु युक्त किया जाता हैं। इस प्रकार लेड-एसिड बैटरी जितनी विद्युत ऊर्जा की आपूर्ति कर सकती है, उसके लिए अपेक्षाकृत बली होती है। इसकी कम विनिर्माण लागत और इसके उच्च उछाल वाले वर्तमान स्तर इसे सामान्य बनाते हैं ,जहां इसकी क्षमता (लगभग 10 आह से अधिक) वजन और हैंडलिंग मुद्दों से अधिक महत्वपूर्ण है। सामान्य अनुप्रयोग आधुनिक कार बैटरी है, जो सामान्य रूप से, 450 एम्पीयर की चरम धारा प्रदान कर सकती है।
रचना
गैल्वेनिक कोशिकाओं, इलेक्ट्रोलाइटिक कोशिकाओं, ईंधन कोशिकाओं, प्रवाह बैटरी और वोल्टाइक ढेर सहित विभिन्न रासायनिक प्रक्रियाओं और डिजाइनों के साथ कई प्रकार के विद्युत रासायनिक कोशिकाओं का उत्पादन किया गया है।[34]
एक गीली सेल बैटरी में तरल इलेक्ट्रोलाइट होता है। अन्य नाम बाढ़ वाले सेल हैं, क्योंकि तरल सभी आंतरिक भागों या वेंटेड सेल को कवर करता है, क्योंकि ऑपरेशन के समय उत्पन्न गैसें हवा से बच सकती हैं। गीली कोशिकाएं शुष्क कोशिकाओं की अग्रदूत थीं और सामान्यतः इलेक्ट्रोकैमिस्ट्री के लिए सीखने के उपकरण के रूप में उपयोग की जाती हैं। विद्युत यांत्रिक सेल कैसे कार्य करते हैं, इसके प्रदर्शन के लिए उन्हें सामान्य प्रयोगशाला आपूर्ति, जैसे बीकर (कांच के बने पदार्थ) के साथ बनाया जा सकता है। विशेष प्रकार की गीली कोशिका जिसे सांद्रता कोशिका के रूप में जाना जाता है, क्षरण को समझने में महत्वपूर्ण है। गीली कोशिकाएँ प्राथमिक कोशिकाएँ (गैर-रिआवेशेबल) या द्वितीयक कोशिकाएँ (रिआवेशेबल) हो सकती हैं। मूल रूप से, सभी व्यावहारिक प्राथमिक बैटरी जैसे डेनियल सेल को ओपन-टॉप ग्लास जार वेट सेल के रूप में बनाया गया था। अन्य प्राथमिक गीली कोशिकाएं लेक्लेन्श सेल, ग्रोव सेल, बन्सन सेल, क्रोमिक एसिड सेल, क्लार्क सेल और वेस्टन सेल हैं। लेक्लेन्श कोशिका रसायन को पहले शुष्क कोशिकाओं के अनुकूल बनाया गया था। गीले सेल अभी भी कार बैटरी और उद्योग में स्विचगियर, दूरसंचार या बड़ी निर्बाध विद्युत आपूर्ति के लिए स्टैंडबाय पावर के लिए उपयोग किए जाते हैं, अपितु कई जगहों पर इसके अतिरिक्त जेल कोशिकाओं के साथ बैटरी का उपयोग किया गया है। ये एप्लिकेशन सामान्यतः लेड-एसिड या निकेल-कैडमियम बैटरी (वेंटेड सेल टाइप) या निकेल-कैडमियम सेल का उपयोग करते हैं। पिघला हुआ नमक बैटरी प्राथमिक या द्वितीयक बैटरी होती है जो पिघला हुआ नमक इलेक्ट्रोलाइट के रूप में उपयोग करती है। वे उच्च तापमान पर कार्य करते हैं और गर्मी बनाए रखने के लिए अच्छी तरह से अलग होना चाहिए।
एक सूखे सेल के पेस्ट पर इलेक्ट्रोलाइट का उपयोग करती है, जिसमें केवल पर्याप्त नमी होती है जिससे धारा प्रवाहित हो सके। गीले सेल के विपरीत, सूखी सेल बिना स्पिलिंग के किसी भी अभिविन्यास में कार्य कर सकती है, क्योंकि इसमें कोई मुक्त तरल नहीं होता है, जो इसे पोर्टेबल उपकरणों के लिए उपयुक्त बनाता है। इस प्रकार तुलनात्मक रूप से, पहली गीली कोशिकाएँ सामान्यतः कांच के कंटेनर होते थे, जिनमें सीसा की खुली छड़ें लटकती थीं और छलकने से बचने के लिए सावधानीपूर्वक संचालन की आवश्यकता होती थी। जेल बैटरी के विकास तक लेड-एसिड बैटरियों ने ड्राई सेल की सुरक्षा और सुवाह्यता प्राप्त नहीं की हैं। इसके आधार पर सामान्य ड्राई सेल जिंक-कार्बन बैटरी है, जिसे कभी-कभी ड्राई लेक्लेन्च सेल कहा जाता है, जिसमें 1.5 वोल्ट का नाममात्र वोल्टेज होता है, जो क्षारीय बैटरी के समान होता है (क्योंकि दोनों ही जिंक-मैंगनीज डाइऑक्साइड संयोजन का उपयोग करते हैं)। मानक शुष्क सेल में जस्ता एनोड होता है, जो सामान्यतः बेलनाकार बर्तन के रूप में होता है, जिसमें केंद्रीय रॉड के रूप में कार्बन कैथोड होता है। इलेक्ट्रोलाइट जिंक एनोड के बगल में पेस्ट के रूप में अमोनियम क्लोराइड है। इलेक्ट्रोलाइट और कार्बन कैथोड के बीच की शेष जगह को अमोनियम क्लोराइड और मैंगनीज डाइऑक्साइड से युक्त दूसरे पेस्ट द्वारा लिया जाता है, जो बाद में विध्रुवक के रूप में कार्य करता है। कुछ डिजाइनों में, अमोनियम क्लोराइड को जिंक क्लोराइड से परिवर्तित दिया जाता है।
एक रिजर्व बैटरी को लंबी अवधि (संभवतः वर्षों) के लिए असंबद्ध (निष्क्रिय और बिना विद्युत की आपूर्ति) संग्रहीत किया जा सकता है। जब बैटरी की आवश्यकता होती है, तब इसे असेंबल किया जाता है (उदाहरण के लिए, इलेक्ट्रोलाइट जोड़कर), बार असेंबल करने के पश्चात, बैटरी आवेश हो जाती है और कार्य करने के लिए तैयार हो जाती है। उदाहरण के लिए, इलेक्ट्रॉनिक आर्टिलरी फ़्यूज़ के लिए बैटरी को बंदूक से फायर करने के प्रभाव से सक्रिय किया जा सकता है। त्वरण इलेक्ट्रोलाइट के कैप्सूल को तोड़ता है जो बैटरी को सक्रिय करता है और फ़्यूज़ के परिपथ को शक्ति देता है। रिजर्व बैटरी सामान्यतः लंबे भंडारण (वर्षों) के बाद छोटी सेवा जीवन (सेकंड या मिनट) के लिए डिज़ाइन की जाती हैं। समुद्र संबंधी उपकरणों या सैन्य अनुप्रयोगों के लिए पानी से सक्रिय बैटरी पानी में विसर्जन पर सक्रिय हो जाती है।
28 फरवरी 2017 को, ऑस्टिन में टेक्सास विश्वविद्यालय ने लिथियम-आयन बैटरी आविष्कारक जॉन गुडएनफ के नेतृत्व में टीम द्वारा विकसित नई प्रकार की सॉलिड-स्टेट बैटरी के बारे में प्रेस विज्ञप्ति प्रस्तुत की, जिससे सुरक्षित, तेज-आवेशिंग, लंबे समय तक हो सके। हैंडहेल्ड मोबाइल उपकरणों, इलेक्ट्रिक कारों और स्थिर ऊर्जा भंडारण के लिए स्थायी रिआवेशेबल बैटरी का उपयोग किया जाता हैं।[35] उदाहरण के लिए, सॉलिड-स्टेट बैटरी में ऊर्जा घनत्व का तीन गुना होना कहा जाता है, जिससे इलेक्ट्रिक वाहनों में इसका उपयोगी जीवन बढ़ जाता है। यह अधिक पारिस्थितिक रूप से भी ध्वनि होना चाहिए क्योंकि प्रौद्योगिकी कम खर्चीली, पृथ्वी के अनुकूल सामग्री जैसे समुद्री जल से निकाले गए सोडियम का उपयोग करती है। उनका जीवन भी बहुत लंबा होता है।[36] सोनी ने जैविक बैटरी विकसित की है जो चीनी से विद्युत उत्पन्न करती है जो जीवित जीवों में देखी जाने वाली प्रक्रियाओं के समान है। बैटरी कार्बोहाइड्रेट को तोड़ने वाले एंजाइमों के उपयोग के माध्यम से विद्युत उत्पन्न करती है।[37]
सील्ड-एसिड वेट सेल के प्रतिस्थापन के रूप में ऑटोमोटिव उद्योग में सील वाल्व रेगुलेटेड लेड-एसिड बैटरी (VRLA बैटरी) लोकप्रिय है। VRLA बैटरी स्थिर सल्फ्यूरिक एसिड इलेक्ट्रोलाइट का उपयोग करती है, रिसाव की संभावना को कम करती है और शेल्फ जीवन को बढ़ाती है।[38] VRLA बैटरी इलेक्ट्रोलाइट को स्थिर करती है। दो प्रकार हैं:
- जेल बैटरी (या जेल सेल) अर्ध-ठोस इलेक्ट्रोलाइट का उपयोग करती हैं।
- अवशोषित ग्लास मैट (एजीएम) बैटरी विशेष फाइबरग्लास मैटिंग में इलेक्ट्रोलाइट को अवशोषित करती है।
अन्य पोर्टेबल रिआवेशेबल बैटरियों में कई सीलबंद ड्राई सेल प्रकार सम्मिलित हैं, जो मोबाइल फोन और लैपटॉप जैसे अनुप्रयोगों में उपयोगी हैं। इस प्रकार की कोशिकाओं (शक्ति घनत्व और लागत में वृद्धि के क्रम में) में निकेल-कैडमियम बैटरी या निकेल-कैडमियम (NiCd), निकल-जस्ता बैटरी | निकल-जस्ता (NiZn), निकल धातु हाइड्राइड बैटरी (NiMH), और लिथियम- सम्मिलित हैं। आयन बैटरी या लिथियम-आयन (ली-आयन) सेल। ली-आयन का ड्राई सेल रिआवेशेबल बाजार में अब तक का सबसे अधिक हिस्सा है। NiMH ने अपनी उच्च क्षमता के कारण अधिकांश अनुप्रयोगों में NiCd को परिवर्तित दिया है, अपितु NiCd विद्युत उपकरणों, दो-तरफ़ा रेडियो और चिकित्सा उपकरणों में उपयोग में है।
2000 के दशक में, विकास में USBCELL जैसे एम्बेडेड इलेक्ट्रॉनिक्स के साथ बैटरी सम्मिलित हैं, जो USB कनेक्टर के माध्यम से AA बैटरी आवेश करने की अनुमति देता है, नैनोबॉल बैटरी जो वर्तमान बैटरी की तुलना में लगभग 100x अधिक डिस्आवेश दर की अनुमति देती है, और स्मार्ट बैटरी पैक स्टेट-ऑफ़-आवेश मॉनिटर और बैटरी सुरक्षा परिपथ जो ओवर-डिस्आवेश पर क्षति को रोकते हैं। कम स्व-निर्वहन NiMH बैटरी या कम स्व-निर्वहन (LSD) शिपिंग से पहले द्वितीयक कोशिकाओं को आवेश करने की अनुमति देता है।
लिथियम-सल्फर बैटरी का उपयोग सबसे लंबी और सबसे ऊंची सौर ऊर्जा से चलने वाली उड़ान में किया जाता था।[39]
उपभोक्ता और औद्योगिक ग्रेड
सभी प्रकार की बैटरियों का निर्माण उपभोक्ता और औद्योगिक ग्रेड में किया जाता है। महंगी औद्योगिक-श्रेणी की बैटरियां रसायन विज्ञानों का उपयोग कर सकती हैं जो उच्च शक्ति-से-आकार अनुपात प्रदान करती हैं, कम स्व-निर्वहन होती है और इसलिए उपयोग में नहीं होने पर जीवन लंबा होता है, रिसाव के लिए अधिक प्रतिरोध और, उदाहरण के लिए, उच्च तापमान और आर्द्रता को संभालने की क्षमता को चिकित्सा आटोक्लेव के साथ उपयोग किया गया था।[40]
संयोजन और प्रबंधन
मानक-प्रारूप वाली बैटरियों को उनका उपयोग करने वाले उपकरण में बैटरी होल्डर में डाला जाता है। जब कोई उपकरण मानक-प्रारूप बैटरियों का उपयोग नहीं करता है, तो उन्हें सामान्यतः कस्टम बैटरी पैक में जोड़ा जाता है, जिसमें बैटरी प्रबंधन प्रणाली और बैटरी आइसोलेटर जैसी सुविधाओं के अतिरिक्त कई बैटरी होती हैं, जो सुनिश्चित करती हैं कि भीतर की बैटरियों को समान रूप से आवेश और डिस्आवेश किया जाता है।
आकार
उपभोक्ताओं के लिए सरलता से उपलब्ध प्राथमिक बैटरियां इलेक्ट्रिक घड़ियों के लिए उपयोग किए जाने वाले छोटे बटन सेल से लेकर सिग्नल परिपथ या अन्य लंबी अवधि के अनुप्रयोगों के लिए उपयोग किए जाने वाले नंबर 6 सेल तक होती हैं। द्वितीयक कोशिकाएँ बहुत बड़े आकार में बनती हैं, बहुत बड़ी बैटरियां पनडुब्बी को शक्ति प्रदान कर सकती हैं या विद्युत ग्रिड को स्थिर कर सकती हैं और चरम बल को कम करने में सहायता कर सकती हैं।
As of 2017[update], दुनिया की सबसे बड़ी बैटरी दक्षिण ऑस्ट्रेलिया में टेस्ला इंक द्वारा बनाई गई थी। यह 129 MWh स्टोर कर सकती है।[41] चीन के हेबेई प्रांत में बैटरी, जो 36 मेगावाट विद्युत स्टोर कर सकती है, 2013 में 500 मिलियन डॉलर की लागत से बनाई गई थी।[42] निकल-कैडमियम बैटरी | नी-सीडी कोशिकाओं से बनी और बड़ी बैटरी, फेयरबैंक्स, अलास्का में थी। इसने कवर किया 2,000 square metres (22,000 sq ft)—एक फुटबॉल पिच से भी बड़ा — और इसका वजन 1,300 टन था। ब्लैकआउट की स्थिति में बैकअप पावर प्रदान करने के लिए इसे एबीबी ग्रुप द्वारा निर्मित किया गया था। बैटरी 40 मेगावाट विद्युत सात मिनट तक दे सकती है।[43] पवन ऊर्जा को स्टोर करने के लिए सोडियम-सल्फर बैटरी का उपयोग किया गया है।[44] 4.4 मेगावाट की बैटरी प्रणाली जो 25 मिनट के लिए 11 मेगावाट की आपूर्ति कर सकती है, हवाई में औवाही पवन फार्म के उत्पादन को स्थिर करती है।[45]
तुलना
कई महत्वपूर्ण सेल गुण, जैसे वोल्टेज, ऊर्जा घनत्व, ज्वलनशीलता, उपलब्ध सेल निर्माण, ऑपरेटिंग तापमान रेंज और शेल्फ जीवन, बैटरी रसायन विज्ञान द्वारा निर्धारित होते हैं।[46]
| रसायन विज्ञान | ऐनोड (−) | कैथोड (+) | अधिकतम. वोल्टेज, सैद्धांतिक (V) | नाममात्र वोल्टेज, व्यावहारिक (V) | विशिष्ट ऊर्जा (kJ/kg) | विस्तार | 25°C पर शेल्फ जीवन, 80% क्षमता (महीने) |
|---|---|---|---|---|---|---|---|
| जिंक-कार्बन | Zn | C | 1.6 | 1.2 | 130 | सस्ता. | 18 |
| जिंक-क्लोराइड | 1.5 | इसे "हेवी-ड्यूटी" के रूप में भी जाना जाता है, सस्ता। | |||||
| क्षारीय (जस्ता-मैंगनीज डाइऑक्साइड) | Zn | MnO2 | 1.5 | 1.15 | 400-590 | मध्यम ऊर्जा घनत्व. उच्च और निम्न-ड्रेन उपयोग के लिए अच्छा है। | 30 |
| निकेल ऑक्सीहाइड्रॉक्साइड (जिंक-मैंगनीज डाइऑक्साइड/निकेल ऑक्सीहाइड्रॉक्साइड) | 1.7 | मध्यम ऊर्जा घनत्व. उच्च नाली उपयोग के लिए अच्छा है। | |||||
| लिथियम (लिथियम-कॉपर ऑक्साइड) Li–CuO | Li | CuO | 1.7 | अब निर्मित नहीं है. सिल्वर ऑक्साइड (आईईसी-प्रकार "एसआर") बैटरियों द्वारा प्रतिस्थापित। | |||
| लिथियम (लिथियम-आयरन डाइसल्फ़ाइड) LiFeS2 | Li | FeS2 | 1.8 | 1.5 | 1070 | महँगा। 'प्लस' या 'अतिरिक्त' बैटरियों में उपयोग किया जाता है। | 337[47] |
| लिथियम (लिथियम-मैंगनीज डाइऑक्साइड) LiMnO2 | Li | MnO2 | 3.0 | 830–1010 | महँगा। स्व-निर्वहन की बहुत कम दर के कारण केवल उच्च-ड्रेन उपकरणों में या लंबी शेल्फ-लाइफ के लिए उपयोग किया जाता है। अकेले 'लिथियम' सामान्यतः इस प्रकार के रसायन विज्ञान को संदर्भित करता है। | ||
| लिथियम (लिथियम-कार्बन फ्लोराइड) Li–(CF)n | Li | (CF)n | 3.6 | 3.0 | 120 | ||
| लिथियम (लिथियम-क्रोमियम)।oxide) Li–CrO2 | Li | CrO2 | 3.8 | 3.0 | 108 | ||
| Lithium (lithium-silicon) | Li22Si5 | ||||||
| मरकरी ऑक्साइड | Zn | HgO | 1.34 | 1.2 | हाई-ड्रेन और निरंतर वोल्टेज। स्वास्थ्य संबंधी चिंताओं के कारण अधिकांश देशों में प्रतिबंधित है। | 36 | |
| जिंक एयर | Zn | O2 | 1.6 | 1.1 | 1590[48] | अधिकतर श्रवण यंत्रों में उपयोग किया जाता है। | |
| जंबोनी पाइल | Zn | Ag or Au | 0.8 | बहुत लंबा जीवन. बहुत कम (नैनोएम्प, एनए) धारा | >2,000 | ||
| सिल्वर-ऑक्साइड (सिल्वर-जिंक) | Zn | Ag2O | 1.85 | 1.5 | 470 | बहुत महँगा। केवल 'बटन' सेल में व्यावसायिक रूप से उपयोग किया जाता है। | 30 |
| मैगनीशियम | Mg | MnO2 | 2.0 | 1.5 | 40 |
| रसायन विज्ञान | सेल वोल्टेज | विशिष्ट ऊष्मा (kJ/kg) | ऊष्मा घनत्व (kJ/liter) | Comments |
|---|---|---|---|---|
| NiCd | 1.2 | 140 | सस्ता. उच्च-/निम्न-जल निकासी, मध्यम ऊर्जा घनत्व। वस्तुतः क्षमता की कोई हानि के बिना बहुत अधिक डिस्चार्ज दर का सामना कर सकता है। स्व-निर्वहन की मध्यम दर. कैडमियम के कारण पर्यावरण को ख़तरा, यूरोप में अब इसका उपयोग लगभग प्रतिबंधित है। | |
| Lead–acid | 2.1 | 140 | मध्यम महंगा. मध्यम ऊर्जा घनत्व. स्व-निर्वहन की मध्यम दर. उच्च डिस्चार्ज दर के परिणामस्वरूप क्षमता का काफी नुकसान होता है। सीसे के कारण पर्यावरण को खतरा। सामान्य उपयोग: ऑटोमोबाइल बैटरी | |
| NiMH | 1.2 | 360 | सस्ता. उच्च निकास वाले उपकरणों में क्षारीय बैटरियों से बेहतर प्रदर्शन करता है। पारंपरिक रसायन शास्त्र में उच्च ऊर्जा घनत्व है, लेकिन स्व-निर्वहन की उच्च दर भी है। नए रसायन शास्त्र में स्व-निर्वहन दर कम है, लेकिन ~25% कम ऊर्जा घनत्व भी है।
कुछ कारों में उपयोग किया जाता है। | |
| NiZn | 1.6 | 360 | मध्यम रूप से सस्ता. उच्च नाली उपकरण उपयुक्त. कम स्व-निर्वहन दर. वोल्टेज अन्य माध्यमिक कोशिकाओं की तुलना में क्षारीय प्राथमिक कोशिकाओं के करीब है। कोई विषैला घटक नहीं. बाज़ार में नया पेश किया गया (2009)। अभी तक कोई ट्रैक रिकॉर्ड स्थापित नहीं किया है. सीमित आकार की उपलब्धता. | |
| AgZn | 1.86 1.5 | 460 | समतुल्य ली-आयन से छोटी मात्रा। चांदी के कारण बेहद महंगा. बहुत उच्च ऊर्जा घनत्व. बहुत ऊंची नाली सक्षम. चांदी की ऊंची कीमतों के कारण कई वर्षों तक इसे अप्रचलित माना गया। यदि उपयोग न किया जाए तो कोशिका ऑक्सीकरण से ग्रस्त हो जाती है। प्रतिक्रियाएँ पूरी तरह समझ में नहीं आतीं। टर्मिनल वोल्टेज बहुत स्थिर है लेकिन 70-80% चार्ज पर अचानक 1.5 वोल्ट तक गिर जाता है (ऐसा माना जाता है कि पॉजिटिव प्लेट में अर्जेंटस और अर्जेंटिक ऑक्साइड दोनों की उपस्थिति के कारण, पहले एक का उपभोग होता है)। प्राइमरी बैटरी (मून बग्गी) के स्थान पर इसका उपयोग किया गया है। ली-आयन के प्रतिस्थापन के रूप में एक बार फिर विकसित किया जा रहा है। | |
| LiFePO4 | 3.3 3.0 | 360 | 790 | लिथियम-आयरन-फॉस्फेट रसायन। |
| Lithium ion | 3.6 | 460 | बहुत महँगा। बहुत उच्च ऊर्जा घनत्व. सामान्यतः "सामान्य" बैटरी आकारों में उपलब्ध नहीं है। लैपटॉप कंप्यूटर, डिजिटल कैमरा, कैमकोर्डर और सेलफोन में लिथियम पॉलिमर बैटरी आम है। स्व-निर्वहन की बहुत कम दर. डिस्चार्ज के दौरान टर्मिनल वोल्टेज 4.2 से 3.0 वोल्ट तक भिन्न होता है। अस्थिर: यदि शॉर्ट-सर्किट किया गया हो, ज़्यादा गरम होने दिया गया हो, या कठोर गुणवत्ता मानकों के साथ निर्मित न किया गया हो तो विस्फोट की संभावना। |
प्रदर्शन, क्षमता और निर्वहन
आंतरिक रसायन विज्ञान, विद्युत प्रवाह नलिका, और तापमान सहित कई कारकों के कारण बैटरी की विशेषताएं लोड चक्र, अधिक आवेश चक्र और जीवनकाल में भिन्न हो सकती हैं। कम तापमान पर, बैटरी उतनी शक्ति नहीं दे सकती है। जैसे, ठंडी जलवायु में, कुछ कार मालिक बैटरी वार्मर लगाते हैं, जो छोटे इलेक्ट्रिक हीटिंग पैड होते हैं जो कार की बैटरी को गर्म रखते हैं।
एक बैटरी की क्षमता विद्युत आवेश की मात्रा है जो वह रेटेड वोल्टेज पर वितरित कर सकती है। सेल में जितनी अधिक इलेक्ट्रोड सामग्री होती है, उसकी क्षमता उतनी ही अधिक होती है। छोटे सेल में समान रसायन विज्ञान वाले बड़े सेल की तुलना में कम क्षमता होती है, चूंकि वे समान ओपन-परिपथ वोल्टेज विकसित करते हैं।[49]क्षमता को amp-hour (A·h) जैसी इकाइयों में मापा जाता है। बैटरी की रेटेड क्षमता को सामान्यतः 20 घंटे के उत्पाद के रूप में व्यक्त किया जाता है जो वर्तमान से गुणा होता है कि नई बैटरी लगातार 20 घंटे तक आपूर्ति कर सकती है 68 °F (20 °C)प्रति सेल निर्दिष्ट टर्मिनल वोल्टेज से ऊपर रहते हुए। उदाहरण के लिए, 100 A·h पर रेट की गई बैटरी कमरे के तापमान पर 20 घंटे की अवधि में 5 A डिलीवर कर सकती है। संग्रहीत आवेश का अंश जो बैटरी वितरित कर सकता है, बैटरी रसायन विज्ञान, जिस दर पर आवेश वितरित किया जाता है (वर्तमान), आवश्यक टर्मिनल वोल्टेज, भंडारण अवधि, परिवेश तापमान और अन्य कारकों सहित कई कारकों पर निर्भर करता है।[49]
डिस्आवेश दर जितनी अधिक होगी, क्षमता उतनी ही कम होगी।[50] लीड एसिड बैटरी के लिए धारा, डिस्आवेश समय और क्षमता के बीच संबंध प्यूकर्ट के नियम द्वारा अनुमानित है (वर्तमान मूल्यों की विशिष्ट सीमा से अधिक):
जहाँ पर
- क्षमता है जब 1 amp की दर से हटा दिया जाता है।
- बैटरी (एम्पीयर) से ली गई धारा है।
- समय (घंटों में) की मात्रा है जो बैटरी बनाए रख सकती है।
- 1.3 के आसपास स्थिर है।
लंबी अवधि के लिए संग्रहीत या क्षमता के छोटे से अंश पर डिस्आवेश की जाने वाली बैटरियों में सामान्यतः अपरिवर्तनीय साइड प्रतिक्रियाओं की उपस्थिति के कारण क्षमता कम हो जाती है जो बिना धारा उत्पन्न किए आवेश कैरियर्स का उपभोग करती हैं। इस घटना को आंतरिक स्व-निर्वहन के रूप में जाना जाता है। इसके अतिरिक्त, जब बैटरियों को पुनः आवेशित किया जाता है, तो अतिरिक्त साइड रिएक्शन हो सकते हैं, जिससे बाद के डिस्आवेश की क्षमता कम हो जाती है। पर्याप्त रिआवेश के बाद, संक्षेप में सारी क्षमता समाप्त हो जाती है और बैटरी विद्युत का उत्पादन बंद कर देती है। आंतरिक ऊर्जा की हानि और उस दर पर सीमाएं जो आयन इलेक्ट्रोलाइट से गुजरते हैं, बैटरी के कुशल ऊर्जा उपयोग में भिन्नता का कारण बनते हैं। न्यूनतम सीमा से ऊपर, कम दर पर डिस्आवेश करने से उच्च दर की तुलना में बैटरी की क्षमता अधिक होती है। अलग-अलग A·h रेटिंग वाली बैटरियों को स्थापित करने से विशिष्ट वोल्टेज के लिए रेट किए गए उपकरण संचालन (चूंकि यह ऑपरेशन अंतराल को प्रभावित कर सकता है) को प्रभावित नहीं करता है, जब तक कि लोड सीमा पार न हो जाए। हाई-ड्रेन लोड जैसे डिजिटल कैमरे कुल क्षमता को कम कर सकते हैं, जैसा कि क्षारीय बैटरी के साथ होता है। उदाहरण के लिए, 10- या 20-घंटे के डिस्आवेश के लिए 2 A·h पर रेट की गई बैटरी पूरे दो घंटे तक 1 A की धारा को बनाए नहीं रखेगी, जैसा कि इसकी बताई गई क्षमता से पता चलता है।
बैटरी आवेश #C-रेट या C-रेट उस दर का माप है जिस पर बैटरी आवेश या पुनः आवेशित किया जाता है। इसे सैद्धांतिक धारा ड्रॉ द्वारा विभाजित बैटरी के माध्यम से धारा के रूप में परिभाषित किया जाता है जिसके अनुसार बैटरी घंटे में अपनी नाममात्र रेटेड क्षमता प्रदान करेगी।[51] इसकी इकाइयाँ घंटे-1 हैं, जिसके लिए आंतरिक प्रतिरोध हानि और कोशिकाओं के अंदर रासायनिक प्रक्रियाओं के कारण, बैटरी संभवतः ही कभी केवल घंटे में नेमप्लेट रेटेड क्षमता प्रदान करती है। सामान्यतः, अधिकतम क्षमता कम सी-दर पर पाई जाती है, और उच्च सी-दर पर आवेश करने या डिस्आवेश करने से बैटरी का उपयोग करने योग्य जीवन और क्षमता कम हो जाती है। निर्माता अधिकांशतः क्षमता बनाम सी-दर वक्र दिखाने वाले ग्राफ़ के साथ डेटाशीट प्रकाशित करते हैं। सी-रेट का उपयोग बैटरी पर रेटिंग के रूप में भी किया जाता है जिससे कि यह इंगित किया जा सके कि बैटरी परिपथ में सुरक्षित रूप से वितरित कर सकती है। रिआवेशेबल बैटरियों के लिए मानक सामान्यतः 4 घंटे (0.25C), 8 घंटे (0.125C) या लंबे समय तक डिस्आवेश होने की क्षमता और आवेश चक्रों को रेट करते हैं। विशेष उद्देश्यों के लिए अभिप्रेत प्रकार, जैसे कि कंप्यूटर में निर्बाध विद्युत की आपूर्ति, निर्माताओं द्वारा घंटे (1C) से बहुत कम निर्वहन अवधि के लिए मूल्यांकन किया जा सकता है, अपितु सीमित चक्र जीवन से पीड़ित हो सकता है।
As of 2012[update], लिथियम आयरन फॉस्फेट या लिथियम आयरन फॉस्फेट (LiFePO
4) बैटरी तकनीक 10-20 सेकंड में पूरी तरह से डिस्आवेश होने वाली सबसे तेज आवेशिंग/डिस्आवेशिंग थी।[52]
जीवनकाल
बैटरी का जीवन (और इसके पर्यायवाची बैटरी जीवनकाल) के रिआवेशेबल बैटरी के लिए दो अर्थ हैं अपितु गैर-प्रबल्य के लिए केवल है। रिआवेशेबल के लिए, इसका अर्थ यह हो सकता है कि उपकरण पूर्ण रूप से आवेश बैटरी पर चल सकता है या सेल संतोषजनक ढंग से कार्य करने में विफल होने से पहले आवेश/डिस्आवेश चक्रों की संख्या संभव है। गैर-रिआवेशेबल के लिए ये दोनों जीवन समान हैं क्योंकि कोशिकाएँ परिभाषा के अनुसार केवल चक्र तक चलती हैं। (शैल्फ जीवन शब्द का उपयोग यह वर्णन करने के लिए किया जाता है कि निर्माण और उपयोग के बीच बैटरी कितने समय तक अपना प्रदर्शन बनाए रखेगी।) सभी बैटरियों की उपलब्ध क्षमता घटते तापमान के साथ गिरती है। आज की अधिकांश बैटरियों के विपरीत, 1812 में आविष्कार किया गया ज़ांबोनी ढेर, नवीनीकरण या रिआवेश के बिना बहुत लंबी सेवा जीवन प्रदान करता है, चूंकि यह केवल नैनोएम्प रेंज में ही आपूर्ति करता है। ऑक्सफ़ोर्ड इलेक्ट्रिक बेल अपनी मूल बैटरियों पर 1840 से लगभग क्रमशः बज रही है, जिसे ज़ांबोनी पाइल्स माना जाता है।
कमरे के तापमान (20-30 डिग्री सेल्सियस) पर संग्रहीत करने पर डिस्पोजेबल बैटरी सामान्यतः प्रति वर्ष अपने मूल आवेश का 8 से 20 प्रतिशत खो देती है।[53] इसे स्व-निर्वहन दर के रूप में जाना जाता है, और यह गैर-वर्तमान-उत्पादक पक्ष रासायनिक प्रतिक्रियाओं के कारण होता है जो सेल के भीतर तब भी होते हैं जब कोई बल लागू नहीं होता है। कम तापमान पर संग्रहीत बैटरियों के लिए साइड रिएक्शन की दर कम हो जाती है, चूंकि कुछ फ्रीजिंग से क्षतिग्रस्त हो सकते हैं। पुरानी रिआवेशेबल बैटरी डिस्पोजेबल क्षारीय बैटरी, विशेष रूप से निकल-आधारित बैटरी की तुलना में अधिक तेजी से स्व-निर्वहन करती है, ताजा आवेश निकल कैडमियम (एनआईसीडी) बैटरी पहले 24 घंटों में अपने आवेश का 10% खो देती है, और उसके बाद लगभग 10% प्रति माह की दर से निर्वहन करती है। चूंकि, नई लो सेल्फ-डिस्आवेश NiMH बैटरी या कम सेल्फ-डिस्आवेश निकल मेटल हाइड्राइड (NiMH) बैटरी और आधुनिक लिथियम डिज़ाइन कम सेल्फ-डिस्आवेश दर (अपितु प्राथमिक बैटरी की तुलना में अभी भी अधिक) प्रदर्शित करते हैं।
बैटरी प्लेटों पर सक्रिय सामग्री प्रत्येक आवेश और डिस्आवेश चक्र पर रासायनिक संरचना को परिवर्तितती है, वॉल्यूम के भौतिक परिवर्तनों के कारण सक्रिय सामग्री खो सकती है, बैटरी को रिआवेश किए जाने की संख्या को और सीमित कर सकता है। अधिकांश निकल-आधारित बैटरियों को खरीदे जाने पर आंशिक रूप से छुट्टी दे दी जाती है, और पहले उपयोग से पहले आवेश की जानी चाहिए।[54] इसे खरीदे जाने पर नई NiMH बैटरियां उपयोग के लिए तैयार हैं, और वर्ष में केवल 15% डिस्आवेश होती हैं।[55]
प्रत्येक आवेश-डिस्आवेश चक्र पर कुछ गिरावट होती है। क्षरण सामान्यतः इसलिए होता है क्योंकि इलेक्ट्रोलाइट इलेक्ट्रोड से दूर चला जाता है या क्योंकि सक्रिय सामग्री इलेक्ट्रोड से अलग हो जाती है। कम क्षमता वाली NiMH बैटरियों (1,700-2,000 mA·h) को लगभग 1,000 बार आवेश किया जा सकता है, जबकि उच्च क्षमता वाली NiMH बैटरी (2,500 mA·h से ऊपर) लगभग 500 चक्र तक चलती हैं।[56] NiCd बैटरियों को उनके आंतरिक प्रतिरोध स्थायी रूप से प्रयोग करने योग्य मूल्यों से आगे बढ़ने से पहले 1,000 चक्रों के लिए रेट किया जाता है। फास्ट आवेशिंग से कंपोनेंट में परिवर्तिताव होता है, बैटरी का जीवनकाल छोटा होता है।[56]अगर बैटरी पूरी तरह आवेश होने पर आवेशर का पता नहीं चल पाता है तो ओवरआवेशिंग से उसे हानि होने की संभावना है।[57]
NiCd कोशिकाएं, यदि विशेष दोहराव वाले तरीके से उपयोग की जाती हैं, तो स्मृति प्रभाव नामक क्षमता में कमी दिखा सकती है।[58] सरल अभ्यासों से प्रभाव से बचा जा सकता है। NiMH कोशिकाएं, चूंकि रसायन विज्ञान में समान हैं, स्मृति प्रभाव से कम प्रभावित होती हैं।[59]
ऑटोमोटिव बैटरी लेड-एसिड रिआवेशेबल बैटरी को कंपन, झटके और तापमान सीमा के कारण तनाव सहना चाहिए। इन तनावों और लेड-एसिड बैटरी # उनकी लेड प्लेटों के सल्फेशन के कारण, कुछ ऑटोमोटिव बैटरियां नियमित उपयोग के छह साल से अधिक समय तक चलती हैं।[60] ऑटोमोटिव स्टार्टिंग (ऑटोमोटिव बैटरी: स्टार्टिंग, लाइटिंग, इग्निशन) बैटरियों में धारा को अधिकतम करने के लिए कई पतली प्लेट होती हैं। सामान्यतः, प्लेटें जितनी मोटी होती हैं, जीवन उतना ही लंबा होता है। उन्हें सामान्यतः रिआवेश से थोड़ा पहले ही डिस्आवेश किया जाता है। डीप-साइकिल लेड-एसिड बैटरी जैसे कि इलेक्ट्रिक गोल्फ कार्ट में उपयोग की जाने वाली बैटरियों में लंबी उम्र बढ़ाने के लिए बहुत मोटी प्लेट होती हैं।[61] लेड-एसिड बैटरी का मुख्य लाभ इसकी कम लागत है, इसकी मुख्य कमियां दी गई क्षमता और वोल्टेज के लिए बड़े आकार और वजन हैं। लेड-एसिड बैटरियों को उनकी क्षमता के 20% से कम पर कभी भी पुनः आवेशित नहीं किया जाना चाहिए,[62] क्योंकि आंतरिक प्रतिरोध रिआवेश होने पर गर्मी और क्षति का कारण बनता है। डीप-साइकिल लेड-एसिड सिस्टम अधिकांशतः कम आवेश वार्निंग लाइट या लो-आवेश पावर कट-ऑफ स्विच का उपयोग करते हैं, जिससे कि बैटरी के जीवन को छोटा करने वाले हानि को रोका जा सके।[63]
बैटरी को कम तापमान पर स्टोर करके बैटरी लाइफ को बढ़ाया जा सकता है, जैसे कि रेफ्रिजरेटर या फ्रीजर में, जो साइड रिएक्शन को धीमा कर देता है। ऐसा भंडारण क्षारीय बैटरी के जीवन को लगभग 5% बढ़ा सकता है, रिआवेशेबल बैटरियां प्रकार के आधार पर अपने आवेश को अधिक समय तक धारण कर सकती हैं।[64] अपने अधिकतम वोल्टेज तक पहुंचने के लिए, बैटरी को कमरे के तापमान पर वापस करना होगा, 250 एमए पर 0 डिग्री सेल्सियस पर क्षारीय बैटरी का निर्वहन 20 डिग्री सेल्सियस पर केवल आधा कुशल है।[33]ड्यूरासेल जैसे क्षारीय बैटरी निर्माता बैटरी को रेफ्रिजरेट करने की अनुशंसा नहीं करते हैं।[32]
खतरे
एक बैटरी विस्फोट सामान्यतः दुरुपयोग या खराबी के कारण होता है, जैसे प्राथमिक (गैर-रिचार्जेबल) बैटरी, या शॉर्ट सर्किट को रिचार्ज करने का प्रयास इसका प्रमुख उदाहरण हैं।
जब एक बैटरी को अत्यधिक दर पर रिचार्ज किया जाता है, तो हाइड्रोजन और ऑक्सीजन का एक विस्फोटक गैस मिश्रण बैटरी के भीतर से बाहर निकलने की तुलना में तेजी से उत्पन्न हो सकता है (उदाहरण के लिए एक अंतर्निर्मित वेंट के माध्यम से), जिससे दबाव निर्माण और अंततः बैटरी का इस स्थिति में फटने का कारण बनता है। इसकी उच्चतम स्थितियों में, बैटरी रसायन आवरण से हिंसक रूप से स्प्रे कर सकते हैं और चोट का कारण बन सकते हैं। समस्या का एक विशेषज्ञ सारांश इंगित करता है कि यह प्रकार लिथियम आयनों को एनोड और कैथोड के बीच परिवहन के लिए तरल इलेक्ट्रोलाइट्स का उपयोग करता है। यदि बैटरी सेल को बहुत शीघ्रता से आवेशित किया जाता है, तो यह शॉर्ट सर्किट का कारण बन सकता है, जिससे विस्फोट और आग लग सकती है।[65][66] शॉर्ट सर्किट से बहुत बड़ी धाराएँ उत्पन्न होने पर कार की बैटरी में विस्फोट होने की सबसे अधिक संभावना होती है। ऐसी बैटरियां हाइड्रोजन का उत्पादन करती हैं, जो अत्यधिक विस्फोटक होने पर (इलेक्ट्रोलाइट में पानी के इलेक्ट्रोलिसिस के कारण) अत्यधिक विस्फोटक होती हैं। सामान्य उपयोग के समय, ओवरचार्जिंग की मात्रा सामान्यतः बहुत कम होती है और थोड़ा हाइड्रोजन उत्पन्न करती है, जो शीघ्रता से नष्ट हो जाती है। चूंकि, जब एक कार शुरू करते हैं, तो उच्च धारा हाइड्रोजन की बड़ी मात्रा में तेजी से रिलीज का कारण बन सकती है, जिसे पास की चिंगारी से विस्फोटक रूप से प्रज्वलित किया जा सकता है, उदाहरण के लिए जम्पर केबल को डिस्कनेक्ट करते समय इसका उपयोग करते हैं।
ओवरचार्जिंग (बैटरी को उसकी विद्युत क्षमता से अधिक चार्ज करने का प्रयास) रिसाव या अपरिवर्तनीय क्षति के अतिरिक्त, बैटरी विस्फोट का कारण भी बन सकता है। यह उस चार्जर या डिवाइस को भी नुकसान पहुंचा सकता है जिसमें बाद में अधिक चार्ज की गई बैटरी का उपयोग किया जाता है।
भस्मीकरण के माध्यम से बैटरी का निपटान करने से विस्फोट हो सकता है क्योंकि सीलबंद मामले में भाप का निर्माण होता है।
कई बैटरी रसायन संक्षारक, जहरीले या दोनों होते हैं। यदि रिसाव होता है, या तो अनायास या दुर्घटना से, जारी किए गए रसायन खतरनाक हो सकते हैं। उदाहरण के लिए, डिस्पोजेबल बैटरियां अधिकांशतः एक जिंक कैन का उपयोग एक अभिकारक के रूप में और अन्य अभिकर्मकों को रखने के लिए कंटेनर के रूप में कर सकती हैं। यदि इस प्रकार की बैटरी अधिक डिस्चार्ज हो जाती है, तो अभिकर्मक कार्डबोर्ड और प्लास्टिक के माध्यम से निकल सकते हैं जो कंटेनर के शेष भाग को बनाते हैं। सक्रिय रासायनिक रिसाव तब बैटरी की शक्ति वाले उपकरणों को नुकसान पहुंचा सकता है या अक्षम कर सकता है। इस कारण से कई इलेक्ट्रॉनिक उपकरण निर्माता उन उपकरणों से बैटरियों को हटाने की सलाह देते हैं जिनका उपयोग विस्तारित अवधि के लिए नहीं किया जाएगा।
कई प्रकार की बैटरियां एक इलेक्ट्रोड या इलेक्ट्रोलाइट के रूप में विषाक्त पदार्थों जैसे सीसा, पारा (तत्व), और कैडमियम का उपयोग करती हैं। जब प्रत्येक बैटरी जीवन के अंत तक पहुँच जाती है तो पर्यावरणीय क्षति को रोकने के लिए इसका निपटान किया जाना चाहिए।[67] बैटरी इलेक्ट्रॉनिक अपशिष्ट (ई-कचरा) का एक रूप है। ई-कचरा रीसाइक्लिंग सेवाएं विषाक्त पदार्थों को पुनर्प्राप्त करती हैं, जिन्हें बाद में नई बैटरी के लिए उपयोग किया जा सकता है।[68] संयुक्त राज्य अमेरिका में सालाना खरीदी जाने वाली लगभग तीन बिलियन बैटरियों में से लगभग 179,000 टन देश भर में लैंडफिल में समाप्त हो जाती है।[69]
निगलने पर बैटरियां हानिकारक या घातक हो सकती हैं।[70] छोटे बटन कोशिकाओं को विशेष रूप से छोटे बच्चों द्वारा निगला जा सकता है। पाचन तंत्र में रहते हुए, बैटरी के विद्युत निर्वहन से ऊतक क्षति हो सकती है;[71] ऐसी क्षति कभी-कभी गंभीर होती है और इससे मृत्यु भी हो सकती है। जब तक वे गैस्ट्रोइंटेस्टाइनल ट्रैक्ट में दर्ज नहीं हो जाते, तब तक इंजेस्टेड डिस्क बैटरियां समस्या पैदा नहीं करती हैं। डिस्क बैटरियों के दर्ज होने का सबसे साधारण स्थान अन्नप्रणाली है, जिसके परिणामस्वरूप नैदानिक अनुक्रम होता है। एसोफैगस को सफलतापूर्वक पार करने वाली बैटरियों के कहीं और रहने की संभावना नहीं है। एसोफैगस में डिस्क बैटरी के जमा होने की संभावना रोगी की उम्र और बैटरी के आकार पर निर्भर करती है। बड़े बच्चों को 21-23 मिमी से छोटी बैटरी की समस्या नहीं होती है। द्रवीकरण परिगलन हो सकता है क्योंकि सोडियम हाइड्रॉक्साइड बैटरी द्वारा उत्पादित धारा (सामान्यतः एनोड पर) द्वारा उत्पन्न होता है। अंतर्ग्रहण के 6 घंटे बाद जितनी तेजी से वेध हुआ है।[72]
विधान और विनियमन
इलेक्ट्रिक बैटरी से संबंधित कानून में सुरक्षित निपटान और पुनर्चक्रण जैसे विषय सम्मिलित हैं।
संयुक्त राज्य अमेरिका में, 1996 के मरकरी-कंटेनिंग एंड रिचार्जेबल बैटरी मैनेजमेंट एक्ट ने पारा युक्त बैटरी की बिक्री पर प्रतिबंध लगा दिया, रिचार्जेबल बैटरी के लिए एक समान लेबलिंग आवश्यकताओं को लागू किया और आवश्यक है कि रिचार्जेबल बैटरी आसानी से हटाने योग्य हो।[73] कैलिफ़ोर्निया और न्यूयॉर्क शहर ठोस कचरे में रिचार्जेबल बैटरी के निपटान पर रोक लगाते हैं।[74][75] रिचार्जेबल बैटरी उद्योग संयुक्त राज्य अमेरिका और कनाडा में स्थानीय खुदरा विक्रेताओं पर ड्रॉपऑफ़ बिंदुओं के साथ राष्ट्रव्यापी पुनर्चक्रण कार्यक्रम संचालित करता है।[76] बैटरी के पुनर्चक्रण को बढ़ाने और बेहतर बैटरी पुनर्चक्रण विधियों पर अनुसंधान को बढ़ावा देने के अतिरिक्त, यूरोपीय संघ के बैटरी निर्देश की समान आवश्यकताएं हैं।[77] इस निर्देश के अनुसार यूरोपीय संघ के भीतर बेची जाने वाली सभी बैटरियों को संग्रह प्रतीक (एक क्रॉस-आउट व्हील्ड बिन) के साथ चिह्नित किया जाना चाहिए। इसमें प्रिज्मीय बैटरियों की सतह का कम से कम 3% और बेलनाकार बैटरी की सतह का 1.5% होना चाहिए। सभी पैकेजिंग को इसी प्रकार चिह्नित किया जाना चाहिए।[78] रिपोर्ट की गई दुर्घटनाओं और विफलताओं के उत्तर में, कभी-कभी प्रज्वलन या विस्फोट, हाल के वर्षों में लिथियम-आयन बैटरी का उपयोग करने वाले उपकरणों की याद अधिक साधारण हो गई है।[79][80]
यह भी देखें
- बैटरी सिम्युलेटर
- नैनोवायर बैटरी
- सुपर बैटरी को खोजना
संदर्भ
- ↑ Crompton, T. R. (2000-03-20). Battery Reference Book (third ed.). Newnes. p. Glossary 3. ISBN 978-0-08-049995-6. Retrieved 2016-03-18.
- ↑ Pauling, Linus (1988). "15: Oxidation-Reduction Reactions; Electrolysis". General Chemistry. New York: Dover Publications, Inc. p. 539. ISBN 978-0-486-65622-9.
- ↑ Pistoia, Gianfranco (2005-01-25). Batteries for Portable Devices. Elsevier. p. 1. ISBN 978-0-08-045556-3. Retrieved 2016-03-18.
- ↑ "The history and development of batteries". 30 April 2015.
- ↑ ""Electrical battery" of Leyden jars, 1760-1769".
- ↑ Bellis, Mary. Biography of Alessandro Volta, Inventor of the Battery. About.com. Retrieved 7 August 2008
- ↑ Stinner, Arthur. Alessandro Volta and Luigi Galvani Archived 10 September 2008 at the Wayback Machine (PDF). Retrieved 11 August 2008.
- ↑ Fascinating facts about the invention of the Electric Battery by Alessandro Volta in 1800. The Great Idea Finder. Retrieved 11 August 2008
- ↑ for instance, in the discovery of electromagnetism in 1820
- ↑ Battery History, Technology, Applications and Development. MPower Solutions Ltd. Retrieved 19 March 2007.
- ↑ Borvon, Gérard (10 September 2012). "History of the electrical units". Association S-EAU-S.
- ↑ "Columbia Dry Cell Battery". National Historic Chemical Landmarks. American Chemical Society. Archived from the original on 23 February 2013. Retrieved 25 March 2013.
- ↑ 13.0 13.1 13.2 Brudermüller, Martin; Sobotka, Benedikt; Dominic, Waughray (September 2019). Insight Report — A Vision for a Sustainable Battery Value Chain in 2030 : Unlocking the Full Potential to Power Sustainable Development and Climate Change Mitigation (PDF) (Report). World Economic Forum & Global Battery Alliance. pp. 11, 29. Retrieved 2 June 2021.
- ↑ Siano, Pierluigi (2014). "Demand response and smart grids-A survey". Renewable and Sustainable Energy Reviews. Elsevier. 30: 461–478. doi:10.1016/j.rser.2013.10.022. ISSN 1364-0321.
- ↑ Pan, AQ; Li, XZ; Shang, J; Feng, JH; Tao, YB; Ye, JL; Yang, X; Li, C; Liao, QQ (2019). The applications of echelon use batteries from electric vehicles to distributed energy storage systems. 2019 International Conference on New Energy and Future Energy System (IOP Conf. Series: Earth and Environmental Science). Vol. 354. IOP Publishing Ltd. doi:10.1088/1755-1315/354/1/012012. 012012.
- ↑ Leisch, Jennifer E.; Chernyakhovskiy, Ilya (September 2019). Grid-Scale Battery Storage : Frequently Asked Questions (PDF) (Report). National Renewable Energy Laboratory (NREL) & greeningthegrid.org. Retrieved 21 May 2021.
- ↑ Ashcroft, N.W.; Mermin (1976). Solid State Physics. N.D. Belmont, CA: Brooks/Cole.
- ↑ Dingrando 665.
- ↑ Saslow 338.
- ↑ Dingrando 666.
- ↑ 21.0 21.1 Knight 943.
- ↑ 22.0 22.1 Knight 976.
- ↑ Terminal Voltage. Tiscali Reference. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007
- ↑ Dingrando 674.
- ↑ Dingrando 677.
- ↑ "The Lemon Battery". ushistory.org. Archived from the original on 2007-05-09. Retrieved 10 April 2007.
- ↑ ZOOM activities: phenom Potato Battery. Accessed 10 April 2007.
- ↑ Howstuffworks "Battery Experiments: Voltaic Pile". Accessed 10 April 2007.
- ↑ Dingrando 675.
- ↑ Fink, Ch. 11, Sec. "Batteries and Fuel Cells."
- ↑ Franklin Leonard Pope, Modern Practice of the Electric Telegraph 15th Edition, D. Van Nostrand Company, New York, 1899, pp. 7–11. Available on the Internet Archive
- ↑ 32.0 32.1 Duracell: Battery Care. Retrieved 10 August 2008.
- ↑ 33.0 33.1 Alkaline Manganese Dioxide Handbook and Application Manual (PDF). Energizer. Retrieved 25 August 2008.
- ↑ "Spotlight on Photovoltaics & Fuel Cells: A Web-based Study & Comparison" (PDF). pp. 1–2. Retrieved 14 March 2007.
- ↑ "Lithium-Ion Battery Inventor Introduces New Technology for Fast-Charging, Noncombustible Batteries". University of Texas at Austin. University of Texas. 28 February 2017. Retrieved 15 March 2017.
- ↑ Hislop, Martin (1 March 2017). "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough". North American Energy News. The American Energy News. Retrieved 15 March 2017.
But even John Goodenough's work doesn't change my forecast that EVs will take at least 50 years to reach 70 to 80 percent of the global vehicle market.
- ↑ Sony Develops A Bio Battery Powered By Sugar Archived 11 October 2007 at the Wayback Machine. Accessed 24 August 2007.
- ↑ Dynasty VRLA Batteries and Their Application Archived 6 February 2009 at the Wayback Machine. C&D Technologies, Inc. Retrieved 26 August 2008.
- ↑ Amos, J. (24 August 2008) "Solar plane makes record flight" BBC News
- ↑ Adams, Louis (November 2015). "Powering Tomorrow's Medicine: Critical Decisions for Batteries in Medical Applications". Medical Design Briefs.
- ↑ "Elon Musk wins $50m bet with giant battery for South Australia". Sky News. 24 November 2017. Retrieved 20 September 2018.
- ↑ Dillow, Clay (21 December 2012). "China Builds the World's Largest Battery, a Building-Sized, 36-Megawatt-Hour Behemoth | Popular Science". Popsci.com. Retrieved 31 July 2013.
- ↑ Conway, E. (2 September 2008) "World's biggest battery switched on in Alaska" Telegraph.co.uk
- ↑ Biello, D. (22 December 2008) "Storing the Breeze: New Battery Might Make Wind Power More Reliable" Scientific American
- ↑ "Auwahi Wind | Energy Solutions | Sempra U.S. Gas & Power, LLC". Semprausgp.com. Archived from the original on 2 May 2014. Retrieved 31 July 2013.
- ↑ "How a battery works". Curious (in English). 25 February 2016. Archived from the original on 26 Mar 2022.
- ↑ "Lithium Iron Disulfide Handbook and Application Manual" (PDF). energizer.com. Retrieved 20 September 2018.
- ↑ Excludes the mass of the air oxidizer.
- ↑ 49.0 49.1 Battery Knowledge – AA Portable Power Corp. Retrieved 16 April 2007. Archived 23 May 2007 at the Wayback Machine
- ↑ "Battery Capacity". techlib.com.
- ↑ A Guide to Understanding Battery Specifications, MIT Electric Vehicle Team, December 2008
- ↑ Kang, B.; Ceder, G. (2009). "Battery materials for ultrafast charging and discharging". Nature. 458 (7235): 190–193. Bibcode:2009Natur.458..190K. doi:10.1038/nature07853. PMID 19279634. S2CID 20592628. 1:00–6:50 (audio) Archived 22 February 2012 at the Wayback Machine
- ↑ Self discharge of batteries. Corrosion Doctors. Retrieved 9 September 2007
- ↑ Energizer Rechargeable Batteries and Chargers: Frequently Asked Questions Archived 9 February 2009 at the Wayback Machine. Energizer. Retrieved 3 February 2009.
- ↑ "eneloop, environmentally friendly and energy saving batteries | Panasonic eneloop". www.panasonic-eneloop.eu. Archived from the original on 2 February 2010.
- ↑ 56.0 56.1 Rechargeable battery Tips. NIMH Technology Information. Retrieved 10 August 2007
- ↑ Battery Myths vs Battery Facts. Retrieved 10 August 2007
- ↑ Filip M. Gieszczykiewicz. "Sci.Electronics FAQ: More Battery Info". repairfaq.org.
- ↑ RechargheableBatteryInfo.com, ed. (28 October 2005), What does 'memory effect' mean?, archived from the original on 15 July 2007, retrieved 10 August 2007
- ↑ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ↑ Deep Cycle Battery FAQ Archived 22 July 2010 at the Wayback Machine. Northern Arizona Wind & Sun. Retrieved 3 February 2009.
- ↑ Car and Deep Cycle Battery FAQ. Rainbow Power Company. Retrieved 3 February 2009.
- ↑ Deep cycle battery guide Archived 17 February 2009 at the Wayback Machine. Energy Matters. Retrieved 3 February 2009.
- ↑ Ask Yahoo: Does putting batteries in the freezer make them last longer? Archived 27 April 2006 at the Wayback Machine. Retrieved 7 March 2007.
- ↑ Hislop, Martin (1 March 2017). "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough". North American Energy News. The American Energy News. Retrieved 15 March 2017.
- ↑ "battery hazards". YouTube. Retrieved 20 September 2018.
- ↑ Batteries. EPA. Retrieved 11 September 2007
- ↑ Battery Recycling » Earth 911. Retrieved 9 September 2007.
- ↑ "San Francisco Supervisor Takes Aim at Toxic Battery Waste". Environmental News Network (11 July 2001).
- ↑ Product Safety DataSheet. Energizer (p. 2). Retrieved 9 September 2007
- ↑ "Swallowed a Button Battery? | Battery in the Nose or Ear?". Poison.org. 3 March 2010. Archived from the original on 16 August 2013. Retrieved 26 July 2013.
- ↑ Dire, Daniel J. (2016-06-09), Vearrier, David (ed.), "Disk Battery Ingestion: Background, Pathophysiology, Epidemiology", Medscape
- ↑ "Mercury-Containing and Rechargeable Battery Management Act" (PDF). EPA. Retrieved 15 February 2021.
- ↑ "Battery Recycling in New York... it's the law!". call2recycle.org. 31 October 2013. Retrieved 2 June 2021.
- ↑ Bill No. 1125 - Rechargeable Battery Recycling Act of 2006, State of California (PDF), 2006, retrieved 2 June 2021
- ↑ "Rechargeable Battery Recycling Corporation". www.rbrc.org. Archived from the original on 12 August 2008. Retrieved 15 January 2022.
- ↑ Disposal of spent batteries and accumulators. European Union. Retrieved 27 July 2009.
- ↑ "Guidelines on Portable Batteries Marking Requirements in the European Union 2008" (PDF). EPBA-EU. Archived from the original (PDF) on 7 October 2011.
- ↑ Schweber, Bill (August 4, 2015). "Lithium Batteries: The Pros and Cons". GlobalSpec. GlobalSpec. Retrieved March 15, 2017.
- ↑ Fowler, Suzanne (21 September 2016). "Samsung's Recall – The Problem with Lithium Ion Batteries". The New York Times. New York. Retrieved 15 March 2016.
ग्रन्थसूची
- Dingrando, Laurel; et al. (2007). Chemistry: Matter and Change. New York: Glencoe/McGraw-Hill. ISBN 978-0-07-877237-5. Ch. 21 (pp. 662–695) is on electrochemistry.
- Fink, Donald G.; H. Wayne Beaty (1978). Standard Handbook for Electrical Engineers, Eleventh Edition. New York: McGraw-Hill. ISBN 978-0-07-020974-9.
- Knight, Randall D. (2004). Physics for Scientists and Engineers: A Strategic Approach. San Francisco: Pearson Education. ISBN 978-0-8053-8960-9. Chs. 28–31 (pp. 879–995) contain information on electric potential.
- Linden, David; Thomas B. Reddy (2001). Handbook of Batteries. New York: McGraw-Hill. ISBN 978-0-07-135978-8.
- Saslow, Wayne M. (2002). Electricity, Magnetism, and Light. Toronto: Thomson Learning. ISBN 978-0-12-619455-5. Chs. 8–9 (pp. 336–418) have more information on batteries.
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
बाहरी संबंध
 Media related to इलेक्ट्रिक बैटरी at Wikimedia Commons
Media related to इलेक्ट्रिक बैटरी at Wikimedia Commons- Batteries at Curlie
- Non-rechargeable batteries
- HowStuffWorks: How batteries work
- Other Battery Cell Types
- DoITPoMS Teaching and Learning Package- "Batteries"
- The Physics arXiv Blog (17 August 2013). "First Atomic Level Simulation of a Whole Battery | MIT Technology Review". Technologyreview.com. Retrieved 21 August 2013.