आयन: Difference between revisions
No edit summary |
No edit summary |
||
| (26 intermediate revisions by 5 users not shown) | |||
| Line 1: | Line 1: | ||
'''''आयन''''' <ref>[http://www.collinsdictionary.com/dictionary/english/ion "Ion"] {{Webarchive|url=https://web.archive.org/web/20131224095801/http://www.collinsdictionary.com/dictionary/english/ion |date=2013-12-24 }} entry in ''[[Collins English Dictionary]]''.</ref> शुद्ध विद्युत आवेश वाला परमाणु या अणु होता है। | |||
इलेक्ट्रॉन का आवेश ऋणात्मक माना जाता है तथा यह आवेश प्रोटॉन के आवेश के समान एवं विपरीत होता है, जिसे परिपाटी द्वारा धनात्मक माना जाता है। एक आयन का शुद्ध आवेश शून्य नहीं होता है क्योंकि उसके इलेक्ट्रान की कुल संख्या उसके प्रोटोन की कुल संख्या के असमान होती है। | |||
'''धनायन''' धनावेशित आयन होता है जिसमें प्रोटॉन की तुलना में इलेक्ट्रॉन कम होते हैं<ref>{{Cite web|title=Definition of CATION|url=https://www.merriam-webster.com/dictionary/cation|access-date=2021-10-06|website=www.merriam-webster.com|language=en|archive-date=2021-10-06|archive-url=https://web.archive.org/web/20211006215047/https://www.merriam-webster.com/dictionary/cation|url-status=live}}</ref> जबकि '''ऋणायन''' ऋणावेशित आयन होता है जिसमें प्रोटॉन की तुलना में इलेक्ट्रॉन अधिक होते हैं।<ref>{{Cite web|title=Definition of ANION|url=https://www.merriam-webster.com/dictionary/anion|access-date=2021-10-06|website=www.merriam-webster.com|language=en|archive-date=2021-10-06|archive-url=https://web.archive.org/web/20211006215049/https://www.merriam-webster.com/dictionary/anion|url-status=live}}</ref> विपरीत विद्युत आवेश स्थिर वैद्युत बल द्वारा एक दूसरे की ओर आकर्षित होते हैं, इसलिए धनायन तथा ऋणायन एक दूसरे को आकर्षित करते हैं तथा आसानी से आयनिक यौगिक बनाते हैं। | |||
केवल एक परमाणु वाले आयनों को परमाणु या | केवल एक परमाणु वाले आयनों को परमाणु या एकपरमाण्विक आयन कहा जाता है, जबकि दो या दो से अधिक परमाणु आणविक आयन या बहुपरमाण्विक आयन बनाते हैं। द्रव (गैस या तरल) में भौतिक आयनीकरण की परिस्थिति में, "आयन युग्म" स्वतः अणु टकराव द्वारा बनते हैं, तथा जहां प्रत्येक उत्पन्न युग्म में एक मुक्त इलेक्ट्रॉन तथा एक धनात्मक आयन होता है।<ref name = "knoll">{{cite book |first=Glenn F |last=Knoll |title=Radiation detection and measurement |edition=3rd |date=1999 |location=New York |publisher=Wiley |isbn=978-0-471-07338-3}}</ref> आयनों की रचना रासायनिक अंतःक्रियाओं द्वारा भी की जाती है जैसे द्रवों में नमक के विघटन द्वारा, या दुसरे माध्यमों से, जैसे एक चालक विलयन में दिष्ट धारा को प्रवाहित करके या आयनीकरण द्वारा ऋणायन को भंग करके। | ||
==खोज का इतिहास | ==खोज का इतिहास== | ||
''आयन'' शब्द यूनानी शब्द ''आयीएनाइ'' (यूनानी रूप: ἰέναι) के नपुंसक लिंगीय वर्तमान कालिक विशेषण से निर्मित हुआ शब्द है जिसका अर्थ होता है "चल देना"। ''कैटायन'' (धनायन) का अर्थ होता है "कोई ऐसी वस्तु जो नीचे जाती हो" (यूनानी रूप: κάτω जिसका उच्चारण | ''आयन'' शब्द यूनानी शब्द ''आयीएनाइ'' (यूनानी रूप: ἰέναι) के नपुंसक लिंगीय वर्तमान कालिक विशेषण से निर्मित हुआ शब्द है जिसका अर्थ होता है "चल देना"। ''कैटायन'' (धनायन) का अर्थ होता है "कोई ऐसी वस्तु जो नीचे जाती हो" (यूनानी रूप: κάτω जिसका उच्चारण काटो''<nowiki/>' तथा अर्थ '''नीचे'' ' होता है) तथा ''एनायन'' (ऋणायन) का अर्थ होता है "कोई ऐसी वस्तु जो ऊपर जाती हो" (यूनानी रूप: ano ἄνω जिसका अर्थ ऊपर'' ' होता है)। ऐसा इसलिए कहते हैं क्यूंकि आयन विपरीत आवेश के इलेक्ट्रोड की दिशा में चलते हैं। इस शब्द का प्रयोग अंग्रेज़ भौतिक एवं रसायन शास्त्री माइकल फैराडे द्वारा १८३४ में (अंग्रेज़ बहुज्ञ विलियम व्हीवेल के सुझाव के उपरान्त), तत्कालीन अज्ञात, ऐसी प्रजाति के लिए किया गया जो किसी तरल माध्यम में एक इलेक्ट्रोड से दुसरे इलेक्ट्रोड की दिशा में चलती है।<ref>{{cite video | url=https://www.bbc.co.uk/history/historic_figures/faraday_michael.shtml | title=Michael Faraday (1791-1867) | publisher=[[BBC]] | location=UK}}</ref><ref>{{cite web | url=http://www.etymonline.com/index.php?term=ion | title=Online etymology dictionary | access-date=2011-01-07 | archive-date=2011-05-14 | archive-url=https://web.archive.org/web/20110514084635/http://www.etymonline.com/index.php?term=ion | url-status=live }}</ref> फैराडे को इन प्रजातियों के गुणों का पता नहीं था, लेकिन वह जानते थे कि चूंकि धातुएं इलेक्ट्रोड पर विघटित हो कर विलयन में प्रवेश करती हैं तथा दूसरे इलेक्ट्रोड पर विलयन से नई धातु निकलती है; इसलिए किसी प्रकार का पदार्थ विलयन में एक धारा में द्रवित हुआ है। यह पदार्थ को एक स्थान से दूसरे स्थान तक पहुँचाता है। फैराडे के साथ पत्राचार में, व्हीवेल ने एनोड (धनाग्र) तथा कैथोड (ऋणाग्र) शब्दों कि रचना की, साथ ही क्रमशः इनकी ओर आकर्षित होने वाले आयनों, एनायन (ऋणायन) एवं कैटायन (धनायन) शब्दों कि भी रचना की।<ref name="whewell">{{cite book |url=https://books.google.com/books?id=9lknVoNGj30C&q=The%20Correspondence%20of%20Michael%20Faraday%20whewell&pg=PA183 |title=The Correspondence of Michael Faraday, Vol. 2: 1832-1840 |year=1991 |editor=Frank A. J. L. James |isbn=9780863412493 |page=183 |access-date=2020-10-16 |archive-date=2021-04-14 |archive-url=https://web.archive.org/web/20210414164907/https://books.google.com/books?id=9lknVoNGj30C&q=The%20Correspondence%20of%20Michael%20Faraday%20whewell&pg=PA183 |url-status=live }}</ref> | ||
स्वान्ते अरहेनियस ने अपने 1884 के शोध प्रबंध में इस तथ्य की व्याख्या की कि ठोस क्रिस्टलीय लवण विघटित होने पर युग्मित आवेशित कणों में वियोजित हो जाते हैं। इसके लिए उन्हें १९०३ में रसायन विज्ञान के नोबेल पुरस्कार से सम्मानित किया गया।<ref>{{cite web|url=https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/index.html|title=The Nobel Prize in Chemistry 1903|website=www.nobelprize.org|access-date=2017-06-13|archive-date=2018-07-08|archive-url=https://web.archive.org/web/20180708044958/https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/index.html|url-status=live}}</ref> अरहेनियस की व्याख्या यह थी कि एक घोल बनाने में लवण, फैराडे द्वारा आविष्कारित आयनों में अलग हो जाता है अतः उन्होंने प्रस्तावित किया कि आयन विद्युत प्रवाह की अनुपस्थिति में भी बनते हैं।<ref name="columbia">{{cite book|editor1-last=Harris|editor1-first=William|editor2-last=Levey|editor2-first=Judith|title=The New Columbia Encyclopedia|date=1976|publisher=[[Columbia University]]|location=New York City|isbn=978-0-231-03572-9|page=[https://archive.org/details/newcolumbiaencyc00harr/page/155 155]|edition=4th|url=https://archive.org/details/newcolumbiaencyc00harr/page/155}}</ref><ref name="EncBrit">{{cite book|editor1-last=McHenry|editor1-first=Charles|title=The New Encyclopædia Britannica|journal=Chicago: Encyclopaedia Britannica Inc|date=1992|publisher=[[Encyclopædia Britannica, Inc.]]|location=Chicago|isbn=978-0-85229-553-3|page=587|volume=1|edition=15|bibcode=1991neb..book.....G|last1=Goetz|first1=Philip W.}}</ref><ref name="SciBio">{{cite book|editor1-last=Cillispie|editor1-first=Charles|title=Dictionary of Scientific Biography|date=1970|publisher=[[Charles Scribner's Sons]]|location=New York City|isbn=978-0-684-10112-5|pages=296–302|edition=1}}</ref> | स्वान्ते अरहेनियस ने अपने 1884 के शोध प्रबंध में इस तथ्य की व्याख्या की कि ठोस क्रिस्टलीय लवण विघटित होने पर युग्मित आवेशित कणों में वियोजित हो जाते हैं। इसके लिए उन्हें १९०३ में रसायन विज्ञान के नोबेल पुरस्कार से सम्मानित किया गया।<ref>{{cite web|url=https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/index.html|title=The Nobel Prize in Chemistry 1903|website=www.nobelprize.org|access-date=2017-06-13|archive-date=2018-07-08|archive-url=https://web.archive.org/web/20180708044958/https://www.nobelprize.org/nobel_prizes/chemistry/laureates/1903/index.html|url-status=live}}</ref> अरहेनियस की व्याख्या यह थी कि एक घोल बनाने में लवण, फैराडे द्वारा आविष्कारित आयनों में अलग हो जाता है अतः उन्होंने प्रस्तावित किया कि आयन विद्युत प्रवाह की अनुपस्थिति में भी बनते हैं।<ref name="columbia">{{cite book|editor1-last=Harris|editor1-first=William|editor2-last=Levey|editor2-first=Judith|title=The New Columbia Encyclopedia|date=1976|publisher=[[Columbia University]]|location=New York City|isbn=978-0-231-03572-9|page=[https://archive.org/details/newcolumbiaencyc00harr/page/155 155]|edition=4th|url=https://archive.org/details/newcolumbiaencyc00harr/page/155}}</ref><ref name="EncBrit">{{cite book|editor1-last=McHenry|editor1-first=Charles|title=The New Encyclopædia Britannica|journal=Chicago: Encyclopaedia Britannica Inc|date=1992|publisher=[[Encyclopædia Britannica, Inc.]]|location=Chicago|isbn=978-0-85229-553-3|page=587|volume=1|edition=15|bibcode=1991neb..book.....G|last1=Goetz|first1=Philip W.}}</ref><ref name="SciBio">{{cite book|editor1-last=Cillispie|editor1-first=Charles|title=Dictionary of Scientific Biography|date=1970|publisher=[[Charles Scribner's Sons]]|location=New York City|isbn=978-0-684-10112-5|pages=296–302|edition=1}}</ref> | ||
== लक्षण == | == लक्षण == | ||
आयन अपनी गैस जैसी अवस्था में अत्यधिक प्रतिक्रियाशील होते हैं तथा तीव्रता से विपरीत आवेश वाले आयनों के साथ मिलकर उदासीन अणु या आयनिक लवण देते हैं। आयन तरल या ठोस अवस्था में भी उत्पन्न होते हैं जब लवण विलायकों (उदाहरण के लिए, जल) के साथ अन्तःक्रिया करके विलायकयोजित आयनों का निर्माण करते हैं जो कि आयनों की द्रवों से अन्तःक्रिया करने के लिए एक दुसरे से दूर जाने से होने वाले ऊर्जा एवं परिक्षय (एन्ट्रॉपी) में परिवर्तनों के मिलाप से उत्पन्न होने वाले कारणों से अधिक स्थिर होते हैं। ये स्थिर प्रजातियां साधारणतः पर्यावरण में कम तापमान पर पाई जाती हैं। | आयन अपनी गैस जैसी अवस्था में अत्यधिक प्रतिक्रियाशील होते हैं तथा तीव्रता से विपरीत आवेश वाले आयनों के साथ मिलकर उदासीन अणु या आयनिक लवण देते हैं। आयन तरल या ठोस अवस्था में भी उत्पन्न होते हैं जब लवण विलायकों (उदाहरण के लिए, जल) के साथ अन्तःक्रिया करके ''विलायकयोजित आयनों'' का निर्माण करते हैं जो कि आयनों की द्रवों से अन्तःक्रिया करने के लिए एक दुसरे से दूर जाने से होने वाले ऊर्जा एवं परिक्षय (एन्ट्रॉपी) में परिवर्तनों के मिलाप से उत्पन्न होने वाले कारणों से अधिक स्थिर होते हैं। ये स्थिर प्रजातियां साधारणतः पर्यावरण में कम तापमान पर पाई जाती हैं। सामान्य उदाहरण समुद्री जल में उपलब्ध आयन हैं, जो घुले हुए लवणों से प्राप्त होते हैं। | ||
आवेशित वस्तुओं के रूप में, आयन विपरीत विद्युत आवेशों (धनात्मक से ऋणात्मक, तथा इसके विपरीत) की ओर आकर्षित होते हैं तथा समान आवेशों द्वारा प्रतिकर्षित होते हैं। जब वे चलते हैं, तो उनके प्रक्षेपवक्र को चुंबकीय क्षेत्र द्वारा विक्षेपित किया जा सकता है। | आवेशित वस्तुओं के रूप में, आयन विपरीत विद्युत आवेशों (धनात्मक से ऋणात्मक, तथा इसके विपरीत) की ओर आकर्षित होते हैं तथा समान आवेशों द्वारा प्रतिकर्षित होते हैं। जब वे चलते हैं, तो उनके प्रक्षेपवक्र को चुंबकीय क्षेत्र द्वारा विक्षेपित किया जा सकता है। | ||
इलेक्ट्रॉनों के छोटे द्रव्यमान अतः इस कारणवश पदार्थ तरंगों के रूप में बड़े स्थान-भरने वाले गुणों के कारण वे परमाणुओं तथा अणुओं के आकार को निर्धारित करते हैं जिनमें एक | इलेक्ट्रॉनों के छोटे द्रव्यमान अतः इस कारणवश पदार्थ तरंगों के रूप में बड़े स्थान-भरने वाले गुणों के कारण वे परमाणुओं तथा अणुओं के आकार को निर्धारित करते हैं जिनमें केवल एक ही इलेक्ट्रॉन होता है। इस प्रकार, आयन (नकारात्मक रूप से आवेशित आयन) मूल अणु या परमाणु से बड़े होते हैं, क्योंकि अतिरिक्त इलेक्ट्रॉन एक दूसरे को प्रतिकर्षित करते हैं तथा आयन के भौतिक आकार में जुड़ जाते हैं, अतः इसका आकार इसके इलेक्ट्रॉन अभ्र द्वारा निर्धारित किया जाता है। इलेक्ट्रॉन अभ्र के छोटे आकार के कारण धनायन संबंधित मूल परमाणु या अणु से छोटे होते हैं। एक धनायन (हाइड्रोजन का) में कोई इलेक्ट्रॉन नहीं होता है तथा इस प्रकार यह अकेला प्रोटॉन होता है जो मूल हाइड्रोजन परमाणु से ''बहुत छोटा'' होता है। | ||
=== ऋणायन तथा धनायन === | === ऋणायन तथा धनायन === | ||
[[File:Ions.svg|thumb|upright=1.75|हाइड्रोजन परमाणु (केंद्र) में एक प्रोटॉन तथा एक इलेक्ट्रॉन होता है। इलेक्ट्रॉन को हटाने से एक धनायन (बाएं) मिलता है, जबकि एक इलेक्ट्रॉन के जुड़ने से एक आयन (दाएं) मिलता है। हाइड्रोजन आयन, अपने ढीले-ढाले दो-इलेक्ट्रॉन बादल के साथ, उदासीन परमाणु की तुलना में बड़ा त्रिज्या है, जो बदले में धनायन के नंगे प्रोटॉन से बहुत बड़ा है। हाइड्रोजन एकमात्र आवेश बनाता है-+1 धनायन जिसमें कोई इलेक्ट्रॉन नहीं होता है, लेकिन यहां तक कि ऐसे धनायन जो (हाइड्रोजन के विपरीत) एक या अधिक इलेक्ट्रॉनों को बनाए रखते हैं, वे अभी भी उदासीन परमाणुओं या अणुओं से छोटे होते हैं जिनसे वे व्युत्पन्न होते हैं।]] | |||
[[File:Ions.svg|thumb|upright=1.75| | चूँकि एक प्रोटॉन पर विद्युत आवेश एक इलेक्ट्रॉन पर आवेश के परिमाण के बराबर होता है अतः एक आयन पर शुद्ध विद्युत आवेश आयन में प्रोटॉनों तथा इलेक्ट्रॉनों की संख्या में अंतर के बराबर होता है। | ||
चूँकि एक प्रोटॉन पर विद्युत आवेश एक इलेक्ट्रॉन पर आवेश के परिमाण के बराबर होता है | |||
एनायन'' (ऋणायन) ''(−) ({{IPAc-en|ˈ|æ|n|,|aɪ|.|ən}} एन-आई-एन, ग्रीक शब्द ἄνω (''एनो'') से, जिसका अर्थ है ''"''ऊपर''" ''<ref>{{cite web | url =http://oxfordindex.oup.com/view/10.1093/oi/authority.20110803095414154 | title =Oxford Reference: OVERVIEW anion | author =Oxford University Press | author-link =Oxford University Press | publisher =oxfordreference.com | date =2013 | access-date =2017-01-15 | archive-date =2017-01-18 | archive-url =https://web.archive.org/web/20170118065532/http://oxfordindex.oup.com/view/10.1093/oi/authority.20110803095414154 | url-status =live }}</ref>) प्रोटॉन की तुलना में अधिक इलेक्ट्रॉनों वाला आयन है, जो इसे शुद्ध ऋणात्मक आवेश देता है (चूंकि इलेक्ट्रॉन ऋणात्मक रूप से आवेशित होते हैं तथा प्रोटॉन धनात्मक रूप से आवेशित होते हैं)।<ref>{{cite web | url =http://ruby.colorado.edu/~smyth/G101-2.html | title =Atoms and Elements, Isotopes and Ions | author =University of Colorado Boulder | author-link =University of Colorado Boulder | publisher =colorado.edu | date =November 21, 2013 | access-date =November 22, 2013 | archive-date =February 2, 2015 | archive-url =https://web.archive.org/web/20150202061438/http://ruby.colorado.edu/~smyth/G101-2.html | url-status =live }}</ref> | |||
कैटायन (''धनायन'') (+) ({{IPAc-en|ˈ|k|æ|t|,|aɪ|.|ən}} कैट-आई-एन, ग्रीक शब्द κάτω (काटो) से, जिसका अर्थ है "नीचे''"''<ref>{{cite web | url =http://oxfordindex.oup.com/view/10.1093/oi/authority.20110803095555447 | title =Oxford Reference: OVERVIEW cation | author =Oxford University Press | author-link =Oxford University Press | publisher =oxfordreference.com | date =2013 | access-date =2017-01-15 | archive-date =2017-01-18 | archive-url =https://web.archive.org/web/20170118065659/http://oxfordindex.oup.com/view/10.1093/oi/authority.20110803095555447 | url-status =live }}</ref>) प्रोटॉन की तुलना में कम इलेक्ट्रॉनों वाला आयन है, जो इसे धनात्मक आवेश देता है।<ref>{{cite web | url =http://www.usouthal.edu/geology/haywick/GY111/111-4.pdf | title =Elemental Chemistry | author =Douglas W. Haywick, Ph.D. | author2 =University of South Alabama | publisher =usouthal.edu | date =2007–2008 | author-link2 =University of South Alabama | access-date =2013-11-22 | archive-date =2011-12-04 | archive-url =https://web.archive.org/web/20111204134213/http://www.usouthal.edu/geology/haywick/GY111/111-4.pdf | url-status =live }}</ref> | |||
धनायन तथा ऋणायन उनके | |||
बहु आवेशी आयनों के लिए अतिरिक्त नामों का उपयोग किया जाता है। उदाहरण के लिए, -२ आवेश वाले आयन को द्विऋणायन कहते हैं तथा +२ आवेश वाले आयन को द्विधानायन कहते हैं। ज़्वीटेरायन अणु के अंदर ही विभिन्न स्थानों पर धनात्मक एवं ऋणात्मक आवेशों वाला उदासीन अणु होता है।<ref>{{cite web | url =http://chemed.chem.purdue.edu/genchem/topicreview/bp/1biochem/amino2.html#zwitter | title =Amino Acids | author =Purdue University | author-link =Purdue University | publisher =purdue.edu | date =November 21, 2013 | access-date =November 22, 2013 | archive-date =July 13, 2011 | archive-url =https://web.archive.org/web/20110713040227/http://chemed.chem.purdue.edu/genchem/topicreview/bp/1biochem/amino2.html#zwitter | url-status =live }}</ref> | |||
धनायन तथा ऋणायन को उनके आयनिक त्रिज्या द्वारा मापा जाता है तथा वे सापेक्ष आकार में भिन्न होते हैं: "धनायन छोटे होते हैं, उनमें से अधिकांश की त्रिज्या 10<sup>−10</sup> मी (10<sup>−8</sup> सेमी) से कम होती है। लेकिन अधिकांश ''ऋणायन ''बड़े होते हैं, जैसा कि पृथ्वी का सबसे साधारण ऋणायन, ऑक्सीजन है। इस तथ्य द्वारा यह स्पष्ट है कि क्रिस्टल में सर्वाधिक स्थान ऋणायन द्वारा अभिगृहीत होता है तथा धनायन उनके मध्य उपलब्ध रिक्त स्थानों को ग्रहण कर लेते हैं"।<ref name="Press1986">{{cite book |last1=Press |first1=Frank |last2=Siever |first2=Raymond |title=Earth |edition=14th |publisher=[[W. H. Freeman and Company]] |publication-place=New York |year=1986 | isbn=0-7167-1743-3 | oclc=12556840 | page=63}}</ref> | |||
''धनायन'' तथा ''ऋणायन'' (उन आयनों के लिए जो विद्युत् अपघटन के समय, क्रमशः धनाग्र तथा ऋणाग्र कि ओर चलते हैं) शब्दों को माइकल फैराडे ने सन्न १८३४ में विलियम व्हीवेल से परामर्श के उपरान्त प्रस्तावित किया था। | |||
=== प्राकृतिक घटनाएं === | === प्राकृतिक घटनाएं === | ||
{{further| | {{further|तत्वों के ऑक्सीकरण अवस्थाओं की सूची}} | ||
आयन [[ प्रकृति ]] में सर्वव्यापी हैं तथा सूर्य की चमक से लेकर पृथ्वी के आयनमंडल के अस्तित्व तक विविध घटनाओं के लिए | आयन [[ प्रकृति ]] में सर्वव्यापी हैं तथा सूर्य की चमक से लेकर पृथ्वी के आयनमंडल के अस्तित्व तक विविध घटनाओं के लिए उत्तरदायी हैं। अपने आयनिक अवस्था में परमाणुओं का रंग उदासीन परमाणुओं से भिन्न हो सकता है, तथा इस प्रकार धातु आयनों द्वारा प्रकाश अवशोषण रत्नों का रंग देता है। अकार्बनिक तथा कार्बनिक रसायन विज्ञान (जैव रसायन सहित) दोनों में, पानी तथा आयनों की परस्पर क्रिया अत्यंत महत्वपूर्ण है; उदाहरण ऊर्जा है जो एडेनोसाइन ट्रायफ़ोस्फेट (ATP) के विघटन को संचालित करती है। निम्नलिखित खंड उन संदर्भों का वर्णन करते हैं जिनमें आयन प्रमुख रूप से प्रदर्शित होते हैं; ये खगोलीय से सूक्ष्म तक, भौतिक लंबाई-पैमाने के घटते हुए क्रम, में व्यवस्थित हैं। | ||
== संबंधित | == संबंधित प्रौद्योगिकी == | ||
आयनों को विभिन्न | आयनों को विभिन्न आयन स्रोतों का उपयोग करके गैर-रासायनिक रूप से तैयार किया जा सकता है, जिसमें साधारणतः उच्च वोल्टता या तापमान संलिप्त होते हैं। इनका उपयोग द्रव्यमान स्पेक्ट्रममापी, प्रकाशीय उत्सर्जन स्पेक्ट्रममापी, कण त्वरक, आयन आरोपकों तथा आयन इंजन जैसे कई उपकरणों में किया जाता है। | ||
प्रतिक्रियाशील आवेशित कणों के रूप में, उनका उपयोग | प्रतिक्रियाशील आवेशित कणों के रूप में, उनका उपयोग वायु स्वच्छीकरण में रोगाणुओं को बाधित करके, तथा घरेलू वस्तुओं जैसे धूम्र संसूचकों (स्मोक डिटेक्टर) में भी किया जाता है। | ||
चूंकि जीवों में | चूंकि जीवों में संकेतन तथा चयापचय कोशिका झिल्ली में एक सटीक आयनिक ढाल द्वारा नियंत्रित होते हैं, इस ढाल का विघटन कोशिका की मृत्यु में अंशदान करती है। यह प्राकृतिक तथा कृत्रिम जीवनाशियों द्वारा शोषित सामान्य तंत्र है, जिसमें ग्रेमिसिडिन तथा एम्फोटेरिसिन (कवकनाशी) सम्मिलित हैं। | ||
अकार्बनिक भंग आयन कुल घुलित ठोस का | अकार्बनिक भंग आयन कुल घुलित ठोस का घटक है, जो पानी की गुणवत्ता का व्यापक रूप से जाना जाने वाला संकेतक है। | ||
=== आयनकारी विकिरण का | === आयनकारी विकिरण का संसूचन === | ||
[[File:Ion chamber operation.gif|thumb|right|300px|आयनों के बहाव को दर्शाने वाले आयन कक्ष का आरेख। इलेक्ट्रॉन अपने बहुत छोटे द्रव्यमान के कारण धनात्मक आयनों की तुलना में तेजी से बहाव करते हैं।<ref name = "knoll"/>]] | [[File:Ion chamber operation.gif|thumb|right|300px|आयनों के बहाव को दर्शाने वाले आयन कक्ष का आरेख। इलेक्ट्रॉन अपने बहुत छोटे द्रव्यमान के कारण धनात्मक आयनों की तुलना में तेजी से बहाव करते हैं।<ref name = "knoll"/>]] | ||
[[File:Electron avalanche.gif|thumbnail|300px|दो | [[File:Electron avalanche.gif|thumbnail|300px|दो विद्युदग्र के बीच अवधाव प्रभाव। मूल आयनीकरण घटना एक इलेक्ट्रॉन को मुक्त करती है, तथा प्रत्येक बाद की टक्कर एक और इलेक्ट्रॉन को मुक्त करती है, इसलिए प्रत्येक टकराव से दो इलेक्ट्रॉन निकलते हैं: आयनकारी इलेक्ट्रॉन तथा मुक्त इलेक्ट्रॉन।]] | ||
गैस पर विकिरण के आयनकारी प्रभाव का व्यापक रूप से | गैस पर विकिरण के आयनकारी प्रभाव का व्यापक रूप से अल्फा, बीटा, गामा किरण तथा एक्स-रे जैसे विकिरण का पता लगाने के लिए उपयोग किया जाता है। इन उपकरणों में मूल आयनीकरण घटना के परिणामस्वरूप एक घनात्मक आयन तथा एक मुक्त इलेक्ट्रॉन "आयन की जोड़ी" का निर्माण होता है जो कि गैस के अणुओं पर विकिरण द्वारा आयन प्रभाव के कारण उत्पन्न होता है। आयनीकरण कक्ष इन डिटेक्टरों में सबसे सरल है, तथा विद्युत क्षेत्र के अनुप्रयोग के माध्यम से गैस के भीतर ''प्रत्यक्ष आयनीकरण'' द्वारा बनाए गए सभी आवेशों को एकत्र करता है।<ref name = "knoll"/> | ||
गीजर-मुलर ट्यूब तथा | गीजर-मुलर ट्यूब तथा आनुपातिक काउंटर दोनों टाउनसेन्ड अवधाव नामक परिघटना का उपयोग करते हैं जिसके अंतर्गत सोपानी प्रभाव के द्वारा, जिसमें मुक्त एलेक्ट्रॉनों को विद्युत् क्षेत्र द्वारा पर्याप्त ऊर्जा देकर आयन संघात के प्रभाव से और अधिक एलेक्ट्रॉनों को मुक्त करके, मूलभूत आयनीकरण के प्रभाव में वृद्धि करते हैं। | ||
== रसायन विज्ञान == | == रसायन विज्ञान == | ||
| Line 53: | Line 56: | ||
=== आवेशित अवस्था को इंगित करना === | === आवेशित अवस्था को इंगित करना === | ||
[[File:Ions notation.svg|thumb|right|लोहे के परमाणु (Fe) के लिए समतुल्य संकेतन जिसने दो इलेक्ट्रॉनों को खो दिया, जिसे [[ लौह ]] कहा जाता है।]] | [[File:Ions notation.svg|thumb|right|लोहे के परमाणु (Fe) के लिए समतुल्य संकेतन जिसने दो इलेक्ट्रॉनों को खो दिया, जिसे [[ लौह ]] कहा जाता है।]] | ||
किसी आयन का | किसी आयन का रासायनिक सूत्र लिखते समय उसका शुद्ध आवेश अणु/परमाणु की रासायनिक संरचना के ठीक ''बाद'' अधिलेख में लिखा जाता है। शुद्ध आवेश को चिन्ह से पहले परिमाण के साथ लिखा जाता है; अर्थात्, एक दोगुने आवेशित धनायन को '+2' के स्थान पर '2+' के रूप में दर्शाया जाता है। तथापि, एकल आवेशित अणुओं/परमाणुओं के लिए आवेश के परिमाण को छोड़ दिया जाता है; उदाहरण के लिए, सोडियम धनायन को {{chem2|Na+}} के रूप में दर्शाया जाता है ''न'' कि {{chem2|Na(1+)}} के रूप में। | ||
एक अणु/परमाणु को कई आवेशों के साथ दिखाने का | एक अणु/परमाणु को कई आवेशों के साथ दिखाने का वैकल्पिक (तथा स्वीकार्य) तरीका कई बार संकेतों को चित्रित करना है, जैसा कि प्राय: संक्रमण धातुओं के साथ देखा जाता है। रसानज्ञ कभी-कभी चिन्ह पर एक गोला बना देते हैं; यह केवल सजावटी होता है तथा रासायनिक अर्थ को नहीं बदलता है। इस प्रकार {{chem2|Fe(2+)}}, {{chem2|Fe^{++} }}, तथा {{chem2|Fe^{⊕⊕} }} यह तीनों प्रतिनिधित्व, जैसा कि चित्र में दिखाया गया है, समतुल्य हैं। | ||
[[File:Ions notation2.svg|thumb|[[ यूरेनिल ]] आयन के लिए मिश्रित रोमन अंक तथा | [[File:Ions notation2.svg|thumb|[[ यूरेनिल ]] आयन के लिए मिश्रित रोमन अंक तथा आवेश नोटेशन। धातु के ऑक्सीकरण राज्य को अधिलेखित रोमन अंकों के रूप में दिखाया गया है, जबकि पूरे संकर का आवेश कोण के प्रतीक के साथ-साथ शुद्ध आवेश के परिमाण तथा चिह्न के साथ दिखाया गया है।]] | ||
एकपरमाण्विक आयनों को कभी-कभी रोमन अंकों के साथ भी दर्शाया जाता है, विशेष रूप से स्पेक्ट्रोमिती में; उदाहरण के लिए, ऊपर देखे गए उदाहरण में {{chem2|Fe(2+)}} को {{chem2|Fe(II)}} या {{chem2|Fe^{II} }} के रूप में उल्लिखित किया जाता हैै। रोमन अंक तत्व की ''औपचारिक ऑक्सीकरण अवस्था'' को दर्शाता है, जबकि अधिलेखित भारतीय अरब संख्यांक शुद्ध आवेश को दर्शाते हैं। इसलिए, दोनों संकेतन एकपरमाण्विक आयनों के लिए विनिमेय हैं, लेकिन रोमन अंकों को बहुपरमाणु आयनों पर लागू ''नहीं किया जा सकता है''। तथापि, एक बहुपरमाणु संकर किसी धातु केंद्र के लिए इन दोनों संकेतनों को मिश्रित करना संभव है, जैसा कि यूरेनिल आयन उदाहरण द्वारा दिखाया गया है। | |||
=== उपवर्ग === | === उपवर्ग === | ||
यदि किसी आयन में | यदि किसी आयन में अयुग्मित इलेक्ट्रॉन होते हैं, तो इसे ''मूलक आयन'' कहा जाता है। अनावेशित मूलकों की तरह, मूलक आयन बहुत प्रतिक्रियाशील होते हैं। ऑक्सीजन युक्त पॉलीऐटोमिक आयन, जैसे कार्बोनेट तथा सल्फेट, ''ऑक्सीऋणायन'' कहलाते हैं। आणविक आयन जिनमें कम से कम एक कार्बन से हाइड्रोजन बंध होता है, ''कार्बनिक आयन'' कहलाते हैं। यदि कार्बनिक आयन में आवेश औपचारिक रूप से कार्बन पर केंद्रित होता है, तो इसे ''कार्बधनायन'' (यदि धनात्मक रूप से आवेशित किया जाता है) या ''कार्बऋणायन'' (यदि ऋणात्मक रूप से आवेशित किया जाता है) कहा जाता है। | ||
=== | === निर्माण === | ||
==== एकपरमाण्विक आयनों का निर्माण ==== | ==== एकपरमाण्विक आयनों का निर्माण ==== | ||
एकपरमाण्विक आयन परमाणु में संयोजकता कोश (सबसे बाहरी इलेक्ट्रॉन शेल) में इलेक्ट्रॉनों कि लाभ या हानि से बनते हैं। परमाणु के भीतरी कक्ष इलेक्ट्रॉनों से भरे होते हैं जो धनात्मक रूप से आवेशित परमाणु नाभिक से कसकर बंधे होते हैं, तथा इसलिए इस तरह की रासायनिक अंतःक्रिया में भाग नहीं लेते हैं। किसी उदासीन परमाणु या अणु से इलेक्ट्रॉन ग्रहण करने या खोने की प्रक्रिया को ''आयनन'' कहते हैं। | |||
परमाणुओं को | परमाणुओं को विकिरण के साथ बमबारी द्वारा आयनित किया जा सकता है, लेकिन रसायन विज्ञान में आयनीकरण की अधिक सामान्य प्रक्रिया परमाणुओं या अणुओं के बीच इलेक्ट्रॉनों का स्थानांतरण है। यह स्थानांतरण सामान्यतः स्थिर ("संवृत कोश") इलेक्ट्रॉनी विन्यास प्राप्त करने से प्रेरित होता है। परमाणु इलेक्ट्रॉनों को प्राप्त करेंगे या खो देंगे, इस पर निर्भर करता है कि किस क्रिया में सबसे कम ऊर्जा लगती है। | ||
उदाहरण के लिए, | उदाहरण के लिए, सोडियम परमाणु, Na, के संयोजकता कोश में एकल इलेक्ट्रॉन होता है, जो 2 तथा 8 इलेक्ट्रॉनों के 2 स्थिर भरे हुए आंतरिक कोश को घेरे होता है। क्योंकि ये भरे हुए कोश बहुत स्थिर होते हैं, सोडियम परमाणु अपने अतिरिक्त इलेक्ट्रॉन को खो देता है तथा इस स्थिर विन्यास को प्राप्त कर लेता है, इस प्रक्रिया में सोडियम धनायन बन जाता है। | ||
:< | :<chem>Na -> Na+ + e-</chem> | ||
दूसरी ओर, | दूसरी ओर, क्लोरीन परमाणु, Cl, के संयोजकता कोश में 7 इलेक्ट्रॉन होते हैं, जो कि 8 इलेक्ट्रॉनों से भरे स्थिर कोश से एक कम है। इस प्रकार, क्लोरीन परमाणु एक अतिरिक्त इलेक्ट्रॉन ''प्राप्त'' करता है तथा एक स्थिर 8-इलेक्ट्रॉन विन्यास प्राप्त करता है, इस प्रक्रिया में क्लोराइड ऋणायन बन जाता है: | ||
:< | :<chem>Cl + e- -> Cl-</chem> | ||
यह प्रेरक शक्ति है जो सोडियम तथा क्लोरीन को | यह प्रेरक शक्ति है जो सोडियम तथा क्लोरीन को रासायनिक प्रतिक्रिया से गुजरने का कारण बनती है, जिसमें "अतिरिक्त" इलेक्ट्रॉन को सोडियम से क्लोरीन में स्थानांतरित किया जाता है, जिससे सोडियम धनायन तथा क्लोराइड ऋणायन बनते हैं। विपरीत रूप से आवेशित होने के कारण, ये धनायन तथा ऋणायन आयोनिक बंध बनाते हैं तथा सोडियम क्लोराइड, NaCl बनाने के लिए संयोजित होते हैं, जिसे सामान्यतः टेबल सॉल्ट के रूप में जाना जाता है। | ||
:< | :<chem>Na+ + Cl- -> NaCl</chem> | ||
==== बहुपरमाणुक तथा आणविक आयनों का निर्माण ==== | ==== बहुपरमाणुक तथा आणविक आयनों का निर्माण ==== | ||
[[File:Nitrate-ion-elpot.png|thumb|right|[[ नाइट्रेट आयन ]] का विद्युत विभव मानचित्र ({{chem2|2NO3-}}) 3-आयामी खोल एकल मनमानी | [[File:Nitrate-ion-elpot.png|thumb|right|[[ नाइट्रेट आयन ]] का विद्युत विभव मानचित्र ({{chem2|2NO3-}}) 3-आयामी खोल एकल मनमानी समविभव का प्रतिनिधित्व करता है।]] | ||
बहुपरमाणुक तथा आणविक आयन | बहुपरमाणुक तथा आणविक आयन सामान्यतः उदासीन अणुओं में, मौलिक आयनों जैसे के एक प्रोटॉन, {{chem2|H+}}, को प्राप्त या खोने से बनते हैं। उदाहरण के लिए, जब अमोनिया, {{chem2|NH3}}, प्रोटॉन {{chem2|H+}} स्वीकार करता है (इस प्रक्रिया को प्रोटॉनीकरण कहा जाता है), यह अमोनियम आयन, {{chem2|NH4+}}, बनाती है। अमोनिया तथा अमोनियम में अनिवार्य रूप से एक ही इलेक्ट्रॉन विन्यास में इलेक्ट्रॉनों की संख्या समान होती है, लेकिन अमोनियम में एक अतिरिक्त प्रोटॉन होता है जो इसे शुद्ध धनात्मक आवेश देता है। | ||
आयन बनाने के लिए अमोनिया एक | आयन बनाने के लिए अमोनिया एक धनात्मक आवेश प्राप्त करने के लिए एक इलेक्ट्रॉन भी खो सकता है जिससे कि {{chem2|NH3+}} आयन निर्मित होता है। तथापि, यह आयन अस्थिर होता है, क्योंकि इसमें नाइट्रोजन परमाणु के चारों ओर एक अधूरा संयोजकता कक्ष होता है, जिससे यह बहुत ही प्रतिक्रियाशील मूलक आयन बन जाता है। | ||
मूलक आयनों की अस्थिरता के कारण, बहुपरमाणुक तथा आणविक आयन सामान्यतः इलेक्ट्रॉनों को प्राप्त करने या खोने से नहीं अपितु मौलिक आयनों, जैसे कि {{chem2|H+}}, को प्राप्त करने या खोने से बनते हैं। यह अणु को विद्युत आवेश प्राप्त करते समय अपने स्थिर इलेक्ट्रॉनिक विन्यास को संरक्षित करने की अनुमति देता है। | |||
==== | ==== आयनन विभव ==== | ||
कम शुद्ध विद्युत आवेश वाली गैस के परमाणु या अणु से अपनी न्यूनतम ऊर्जा अवस्था में इलेक्ट्रॉन को अलग करने के लिए आवश्यक ऊर्जा को ''आयनन विभव या आयनन ऊर्जा'' कहा जाता है। किसी परमाणु की nवीं आयनन ऊर्जा वह ऊर्जा है जो, {{math|''n'' − 1}} इलेक्ट्रॉनों को अलग करने के बाद, उसके ''n''वें इलेक्ट्रॉन को अलग करने के लिए आवश्यक होती है। | |||
कम शुद्ध विद्युत आवेश वाली गैस के परमाणु या अणु से अपनी न्यूनतम ऊर्जा अवस्था में | |||
प्रत्येक क्रमिक | प्रत्येक क्रमिक आयनन ऊर्जा पिछले की तुलना में स्पष्ट रूप से अधिक होती है। विशेष रूप से अत्याधिक वृद्धि तब होती है जब दी गयी परमाणु कक्षाओं के समूह के इलेक्ट्रान समाप्त हो जाते हैं। इस कारण से, आयन उन तरीकों से बनते हैं जो उन्हें पूर्ण कक्षीय समूहों के साथ छोड़ते हैं। उदाहरण के लिए, सोडियम के सबसे बाहरी कोश में एक ''संयोजकता इलेक्ट्रॉन'' होता है, इसलिए आयनित रूप में यह सामान्यतः एक खोए हुए इलेक्ट्रॉन के साथ पाया जाता है, जैसे {{chem2|Na+}}। आवर्त सारणी के दूसरी ओर, क्लोरीन में सात वैलेंस इलेक्ट्रॉन होते हैं, इसलिए आयनित रूप में यह सामान्यतः एक प्राप्त इलेक्ट्रॉन के साथ पाया जाता है, जैसे {{chem2|Cl-}}। सीज़ियम में सभी तत्वों की सबसे कम तथा हीलियम में सबसे अधिक मापी गई आयनन ऊर्जा होती है।<ref name="lenntech.com">[http://www.lenntech.com/Periodic-chart-elements/ionization-energy.htm Chemical elements listed by ionization energy] {{Webarchive|url=https://web.archive.org/web/20090330155714/http://www.lenntech.com/Periodic-chart-elements/ionization-energy.htm |date=2009-03-30 }}. Lenntech.com</ref> साधारणतः, धातुओं की आयनन ऊर्जा अधातुओं की आयनन ऊर्जा की तुलना में बहुत कम होती है, यही कारण है कि, सामान्यतः , धातुएँ धनात्मक रूप से आवेशित आयन बनाने के लिए इलेक्ट्रॉनों को खो देंगी तथा अधातुओं को ऋणात्मक रूप से आवेशित आयन बनाने के लिए इलेक्ट्रॉन प्राप्त होंगे। | ||
=== आयनिक | === आयनिक आबंध === | ||
''आयनिक आबंध'' रासायनिक बंध होता है जो विपरीत आवेशित आयनों के पारस्परिक आकर्षण से उत्पन्न होता है। समान आवेश वाले आयन एक दूसरे को प्रतिकर्षित करते हैं तथा विपरीत आवेश वाले आयन आकर्षित करते हैं। इसलिए, आयन सामान्यतः स्वयं के बल पर उपस्थित नहीं होते हैं, लेकिन क्रिस्टल जालक बनाने के लिए विपरीत आवेश के आयनों से बंधे होंगे। परिणामी यौगिक को ''आयनिक यौगिक'' कहा जाता है, तथा कहा जाता है कि यह ''आयनिक आबंध'' द्वारा बंधा रहता है। आयनिक यौगिकों में आयन पड़ोसियों के बीच विशिष्ट दूरी उत्पन्न होती है जिससे स्थानिक विस्तार तथा आयनों की आयनिक त्रिज्या प्राप्त की जा सकती है। | |||
आयनिक | |||
सबसे आम प्रकार का आयनिक बंधन धातुओं तथा अधातुओं के यौगिकों में देखा जाता है (उत्कृष्ट गैसों को छोड़कर, जो शायद ही कभी रासायनिक यौगिक बनाते हैं)। धातुओं | सबसे आम प्रकार का आयनिक बंधन धातुओं तथा अधातुओं के यौगिकों में देखा जाता है (उत्कृष्ट गैसों को छोड़कर, जो शायद ही कभी रासायनिक यौगिक बनाते हैं)। धातुओं का लक्षण यह होता है कि वे स्थिर-संवृत कोश संरचना वाले इलेक्ट्रॉनी विन्यास, जिसमें एलेक्ट्रॉनों की संख्या कम होती है, के साथ उपस्थित होते हैं। इस प्रकार, स्थिर विन्यास प्राप्त करने के लिए उनमें इन अतिरिक्त इलेक्ट्रॉनों को खोने की प्रवृत्ति होती है। यह गुण ''वैद्युतीयधनात्मकता'' कहलाता है। दूसरी ओर, अधातुओं का लक्षण यह होता है कि उनमें इलेक्ट्रॉनी विन्यास के लिए कुछ ही इलेक्ट्रान कम होते हैं। अतः, उनके पास स्थिर विन्यास प्राप्त करने के लिए अधिक इलेक्ट्रॉन प्राप्त करने की प्रवृत्ति होती है। यह गुण ''वैद्युतीयऋणात्मकता'' कहलाता है। जब अत्यधिक विद्युत धनात्मक धातु को अत्यधिक विद्युत ऋणात्मक अधातु के साथ जोड़ा जाता है, तो धातु परमाणुओं से अतिरिक्त इलेक्ट्रॉनों को इलेक्ट्रॉन-कमी वाले अधातु परमाणुओं में स्थानांतरित कर दिया जाता है। यह अभिक्रिया धातु धनायन तथा अधातु ऋणायन का उत्पादन करती है, जो एक दूसरे के प्रति आकर्षित होकर ''लवण'' बनाते हैं। | ||
=== आम आयन === | === आम आयन === | ||
| Line 107: | Line 108: | ||
|valign="top"| | |valign="top"| | ||
{|class="wikitable" | {|class="wikitable" | ||
|+ | |+सामान्य धनायन<ref name=":0">{{Cite web|url=http://www.sciencegeek.net/Chemistry/chempdfs/CommonIons.pdf|title=Common Ions and Their Charges|website=Science Geek|access-date=2018-05-11|archive-date=2018-02-18|archive-url=https://web.archive.org/web/20180218214350/http://www.sciencegeek.net/Chemistry/chempdfs/CommonIons.pdf|url-status=live}}</ref> | ||
|- | |- | ||
!style="text-align: left"| | !style="text-align: left"|सामान्य नाम | ||
!style="text-align: left"| | !style="text-align: left"|सूत्र | ||
!style="text-align: left"| | !style="text-align: left"|ऐतिहासिक नाम | ||
|- | |- | ||
! colspan="3" style="background:aliceblue;"|'' | ! colspan="3" style="background:aliceblue;"|''एकपरमाण्विक धनायन'' | ||
|- | |- | ||
| | |एल्युमीनियम||{{chem2|Al(3+)}}|| | ||
|- | |- | ||
|[[Barium]]||{{chem2|Ba(2+)}}|| | |[[Barium|बेरियम]]||{{chem2|Ba(2+)}}|| | ||
|- | |- | ||
|[[Beryllium]]||{{chem2|Be(2+)}}|| | |[[Beryllium|बेरेलियम]]||{{chem2|Be(2+)}}|| | ||
|- | |- | ||
|[[Calcium]]||{{chem2|Ca(2+)}}|| | |[[Calcium|कैल्शियम]]||{{chem2|Ca(2+)}}|| | ||
|- | |- | ||
| | |क्रोमियम (III)||{{chem2|Cr(3+)}}|| | ||
|- | |- | ||
| | |कॉपर (I)||{{chem2|Cu+}}||क्यूप्रस | ||
|- | |- | ||
| | |कॉपर (II)||{{chem2|Cu(2+)}}||क्यूप्रिक | ||
|- | |- | ||
|[[Gold| | |[[Gold|सोना (I)]]||{{chem2|Au+}}||औरस | ||
|- | |- | ||
| | |सोना (III)||{{chem2|Au(3+)}}||औरिक | ||
|- | |- | ||
| | |हाइड्रोजन||{{chem2|H+}}|| | ||
|- | |- | ||
| | |लोहा (II)||{{chem2|Fe(2+)}}||फेरस | ||
|- | |- | ||
| | |लोहा (III)||{{chem2|Fe(3+)}}||फेरिक | ||
|- | |- | ||
| | |सीसा (II)||{{chem2|Pb(2+)}}||प्लमबॉस | ||
|- | |- | ||
| | |सीसा (IV)||{{chem2|Pb(4+)}}||प्लम्बिक | ||
|- | |- | ||
| | |लिथियम||{{chem2|Li+}}|| | ||
|- | |- | ||
| | |मैग्नीशियम||{{chem2|Mg(2+)}}|| | ||
|- | |- | ||
| | |मैंगनीज (II)||{{chem2|Mn(2+)}}||मैंगनस | ||
|- | |- | ||
| | |मैंगनीज (III)||{{chem2|Mn(3+)}}||मैंगनिक | ||
|- | |- | ||
| | |मैंगनीज (IV)||{{chem2|Mn(4+)}}|| | ||
|- | |- | ||
| | |पारा (II)||{{chem2|Hg(2+)}}||मरक्यूरिक | ||
|- | |- | ||
| | |पोटैशियम ||{{chem2|K+}}||कैलिक | ||
|- | |- | ||
| | |चाँदी||{{chem2|Ag+}}||अर्जेंटॉस | ||
|- | |- | ||
| | |सोडियम||{{chem2|Na+}}||नैट्रिक | ||
|- | |- | ||
| | |स्ट्रोन्सियम||{{chem2|Sr(2+)}}|| | ||
|- | |- | ||
| | |टिन (II)||{{chem2|Sn(2+)}}||स्टैनोस | ||
|- | |- | ||
| | |टिन (IV)||{{chem2|Sn(4+)}}||स्टैनिक | ||
|- | |- | ||
| | |जिंक||{{chem2|Zn(2+)}}|| | ||
|- | |- | ||
! colspan="3" style="background:aliceblue;"|''[[Polyatomic ion| | ! colspan="3" style="background:aliceblue;"|''[[Polyatomic ion|बहुपरमाण्विक]] धनायन'' | ||
|- | |- | ||
| | |अमोनियम||{{chem2|NH4+}}|| | ||
|- | |- | ||
| | |हाइड्रोनियम||{{chem2|H3O+}}|| | ||
|- | |- | ||
| | |पारा (I)||{{chem2|Hg2(2+)}}||मरक्यूरोस | ||
|} | |} | ||
|वैलिग्न = शीर्ष | | |वैलिग्न = शीर्ष | | ||
{|class="wikitable" | {|class="wikitable" | ||
|+ | |+सामान्य ऋणायन<ref name=":0" /> | ||
|- | |- | ||
!style="text-align: left"| | !style="text-align: left"|औपचारिक नाम | ||
!style="text-align: left"| | !style="text-align: left"|सूत्र | ||
!style="text-align: left"| | !style="text-align: left"|वैकल्पिक नाम | ||
|- | |- | ||
! colspan="3" style="background:aliceblue;"|'' | ! colspan="3" style="background:aliceblue;"|''एकपरमाण्विक ऋणायन'' | ||
|- | |- | ||
| | |ऐज़ाइड||{{chem2|N3-}}|| | ||
|- | |- | ||
| | |ब्रोमाइड||{{chem2|Br-}}|| | ||
|- | |- | ||
| | |कार्बाइड||{{chem2|C-}}|| | ||
|- | |- | ||
| | |क्लोराइड||{{chem2|Cl-}}|| | ||
|- | |- | ||
| | |फ्लोराइड||{{chem2|F-}}|| | ||
|- | |- | ||
| | |हाइड्रॉइड||{{chem2|H-}}|| | ||
|- | |- | ||
| | |आयोडाइड||{{chem2|I-}}|| | ||
|- | |- | ||
| | |नाइट्राइड||{{chem2|N(3-)}}|| | ||
|- | |- | ||
| | |फास्फाइड||{{chem2|P(3-)}}|| | ||
|- | |- | ||
| | |ऑक्साइड||{{chem2|O(2-)}}|| | ||
|- | |- | ||
| | |सल्फाइड||{{chem2|S(2-)}}|| | ||
|- | |- | ||
| | |सेलेनाइड||{{chem2|Se(2-)}}|| | ||
|- | |- | ||
! colspan="3" style="background:aliceblue;"|'' | ! colspan="3" style="background:aliceblue;"|''ऑक्सीऋणायन (बहुपरमाण्विक आयन)<ref name=":0" />'' | ||
|- | |- | ||
| | |कार्बोनेट||{{chem2|CO3(2-)}}|| | ||
|- | |- | ||
| | |क्लोरेट||{{chem2|ClO3-}}|| | ||
|- | |- | ||
| | |क्रोमेट||{{chem2|CrO4(2−)}}|| | ||
|- | |- | ||
| | |डाइक्रोमैट ||{{chem2|Cr2O7(2-)}}|| | ||
|- | |- | ||
| | |डाईहाइड्रोजन फॉस्फेट||{{chem2|H2PO4-}}|| | ||
|- | |- | ||
| | |हाइड्रोजन कार्बोनेट||{{chem2|HCO3-}}||बाइकार्बोनेट | ||
|- | |- | ||
| | |हाइड्रोजन सल्फेट||{{chem2|HSO4-}}||बाइसल्फ़ेट | ||
|- | |- | ||
| | |हाइड्रोजन सल्फाइट||{{chem2|HSO3-}}||बाईसल्फाइट | ||
|- | |- | ||
| | |हीड्राकसीड||{{chem2|OH-}}|| | ||
|- | |- | ||
| | |हाइपोक्लोराइट||{{chem2|ClO-}}|| | ||
|- | |- | ||
| | |मोनोहाइड्रोजन फॉस्फेट||{{chem2|HPO4(2-)}}|| | ||
|- | |- | ||
| | |नाइट्रेट||{{chem2|NO3-}}|| | ||
|- | |- | ||
| | |नाइट्राइट||{{chem2|NO2-}}|| | ||
|- | |- | ||
| | |परक्लोरेट||{{chem2|ClO4-}}|| | ||
|- | |- | ||
| | |परमैंगनेट||{{chem2|MnO4-}}|| | ||
|- | |- | ||
| | |पेरोक्साइड||{{chem2|O2(2-)}}|| | ||
|- | |- | ||
| | |फॉस्फेट||{{chem2|PO4(3-)}}|| | ||
|- | |- | ||
| | |सल्फेट||{{chem2|SO4(2-)}}|| | ||
|- | |- | ||
| | |सल्फाइट||{{chem2|SO3(2-)}}|| | ||
|- | |- | ||
| | |सुपरऑक्साइड||{{chem2|O2-}}|| | ||
|- | |- | ||
| | |थाइओसलफेट||{{chem2|S2O3(2-)}}|| | ||
|- | |- | ||
| | |सिलिकेट||{{chem2|SiO4(4-)}}|| | ||
|- | |- | ||
| | |मेटासिलिकेट||{{chem2|SiO3(2-)}}|| | ||
|- | |- | ||
| | |एल्युमीनियम सिलिकेट||{{chem2|AlSiO4-}}|| | ||
|- | |- | ||
! colspan="3" style="background:aliceblue;"|'' | ! colspan="3" style="background:aliceblue;"|''कार्बनिक अम्लों से ऋणायन'' | ||
|- | |- | ||
| | |एसीटेट||{{chem2|CH3COO-}}||एथेनोएट | ||
|- | |- | ||
| | |फॉर्मेट||{{chem2|HCOO-}}||मेथेनोएट | ||
|- | |- | ||
| | |ऑक्सालेट||{{chem2|C2O4(2-)}}||एथेन्डायोएट | ||
|- | |- | ||
| | |साइनाइड||{{chem2|CN-}}|| | ||
|} | |} | ||
|} | |} | ||
| Line 275: | Line 276: | ||
==यह भी देखें== | ==यह भी देखें== | ||
{{Div col|small=yes}} | {{Div col|small=yes}} | ||
* [[ वायु | * [[ वायु अयोनाइज़र ]] | ||
* [[ | * [[ ऊषा ]] | ||
* [[ | * [[ विद्युत् अपघटय ]] | ||
* [[ गैसीय आयनीकरण | * [[ गैसीय आयनीकरण संसूचक ]] | ||
* [[ | * [[ आयोलियोमिक्स ]] | ||
*[[ आयन | *[[ आयन किरणपुंज ]] | ||
* [[ आयन विनिमय ]] | * [[ आयन विनिमय ]] | ||
* [[ आयनीकरण विकिरण ]] | * [[ आयनीकरण विकिरण ]] | ||
* [[ रोकने की शक्ति | * [[ विकिरण की रोकने की शक्ति ]] | ||
{{Div col end}} | {{Div col end}} | ||
==संदर्भ== | ==संदर्भ== | ||
{{Reflist}} | {{Reflist}} | ||
| Line 313: | Line 293: | ||
{{Galvanic cells|state=collapsed}} | {{Galvanic cells|state=collapsed}} | ||
{{Authority control}} | {{Authority control}} | ||
[[Category: | [[Category:Machine Translated Page]] | ||
[[Category:AC with 0 elements]] | |||
[[Category: | [[Category:Articles with hatnote templates targeting a nonexistent page]] | ||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 09/09/2022]] | [[Category:Created On 09/09/2022]] | ||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages using div col with small parameter]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Webarchive template wayback links]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:आयन्स| ]] | |||
[[Category:प्रभारी वाहक]] | |||
[[Category:भौतिक रसायन विज्ञान]] | |||
Latest revision as of 14:23, 24 November 2022
आयन [1] शुद्ध विद्युत आवेश वाला परमाणु या अणु होता है।
इलेक्ट्रॉन का आवेश ऋणात्मक माना जाता है तथा यह आवेश प्रोटॉन के आवेश के समान एवं विपरीत होता है, जिसे परिपाटी द्वारा धनात्मक माना जाता है। एक आयन का शुद्ध आवेश शून्य नहीं होता है क्योंकि उसके इलेक्ट्रान की कुल संख्या उसके प्रोटोन की कुल संख्या के असमान होती है।
धनायन धनावेशित आयन होता है जिसमें प्रोटॉन की तुलना में इलेक्ट्रॉन कम होते हैं[2] जबकि ऋणायन ऋणावेशित आयन होता है जिसमें प्रोटॉन की तुलना में इलेक्ट्रॉन अधिक होते हैं।[3] विपरीत विद्युत आवेश स्थिर वैद्युत बल द्वारा एक दूसरे की ओर आकर्षित होते हैं, इसलिए धनायन तथा ऋणायन एक दूसरे को आकर्षित करते हैं तथा आसानी से आयनिक यौगिक बनाते हैं।
केवल एक परमाणु वाले आयनों को परमाणु या एकपरमाण्विक आयन कहा जाता है, जबकि दो या दो से अधिक परमाणु आणविक आयन या बहुपरमाण्विक आयन बनाते हैं। द्रव (गैस या तरल) में भौतिक आयनीकरण की परिस्थिति में, "आयन युग्म" स्वतः अणु टकराव द्वारा बनते हैं, तथा जहां प्रत्येक उत्पन्न युग्म में एक मुक्त इलेक्ट्रॉन तथा एक धनात्मक आयन होता है।[4] आयनों की रचना रासायनिक अंतःक्रियाओं द्वारा भी की जाती है जैसे द्रवों में नमक के विघटन द्वारा, या दुसरे माध्यमों से, जैसे एक चालक विलयन में दिष्ट धारा को प्रवाहित करके या आयनीकरण द्वारा ऋणायन को भंग करके।
खोज का इतिहास
आयन शब्द यूनानी शब्द आयीएनाइ (यूनानी रूप: ἰέναι) के नपुंसक लिंगीय वर्तमान कालिक विशेषण से निर्मित हुआ शब्द है जिसका अर्थ होता है "चल देना"। कैटायन (धनायन) का अर्थ होता है "कोई ऐसी वस्तु जो नीचे जाती हो" (यूनानी रूप: κάτω जिसका उच्चारण काटो' तथा अर्थ 'नीचे ' होता है) तथा एनायन (ऋणायन) का अर्थ होता है "कोई ऐसी वस्तु जो ऊपर जाती हो" (यूनानी रूप: ano ἄνω जिसका अर्थ ऊपर ' होता है)। ऐसा इसलिए कहते हैं क्यूंकि आयन विपरीत आवेश के इलेक्ट्रोड की दिशा में चलते हैं। इस शब्द का प्रयोग अंग्रेज़ भौतिक एवं रसायन शास्त्री माइकल फैराडे द्वारा १८३४ में (अंग्रेज़ बहुज्ञ विलियम व्हीवेल के सुझाव के उपरान्त), तत्कालीन अज्ञात, ऐसी प्रजाति के लिए किया गया जो किसी तरल माध्यम में एक इलेक्ट्रोड से दुसरे इलेक्ट्रोड की दिशा में चलती है।[5][6] फैराडे को इन प्रजातियों के गुणों का पता नहीं था, लेकिन वह जानते थे कि चूंकि धातुएं इलेक्ट्रोड पर विघटित हो कर विलयन में प्रवेश करती हैं तथा दूसरे इलेक्ट्रोड पर विलयन से नई धातु निकलती है; इसलिए किसी प्रकार का पदार्थ विलयन में एक धारा में द्रवित हुआ है। यह पदार्थ को एक स्थान से दूसरे स्थान तक पहुँचाता है। फैराडे के साथ पत्राचार में, व्हीवेल ने एनोड (धनाग्र) तथा कैथोड (ऋणाग्र) शब्दों कि रचना की, साथ ही क्रमशः इनकी ओर आकर्षित होने वाले आयनों, एनायन (ऋणायन) एवं कैटायन (धनायन) शब्दों कि भी रचना की।[7]
स्वान्ते अरहेनियस ने अपने 1884 के शोध प्रबंध में इस तथ्य की व्याख्या की कि ठोस क्रिस्टलीय लवण विघटित होने पर युग्मित आवेशित कणों में वियोजित हो जाते हैं। इसके लिए उन्हें १९०३ में रसायन विज्ञान के नोबेल पुरस्कार से सम्मानित किया गया।[8] अरहेनियस की व्याख्या यह थी कि एक घोल बनाने में लवण, फैराडे द्वारा आविष्कारित आयनों में अलग हो जाता है अतः उन्होंने प्रस्तावित किया कि आयन विद्युत प्रवाह की अनुपस्थिति में भी बनते हैं।[9][10][11]
लक्षण
आयन अपनी गैस जैसी अवस्था में अत्यधिक प्रतिक्रियाशील होते हैं तथा तीव्रता से विपरीत आवेश वाले आयनों के साथ मिलकर उदासीन अणु या आयनिक लवण देते हैं। आयन तरल या ठोस अवस्था में भी उत्पन्न होते हैं जब लवण विलायकों (उदाहरण के लिए, जल) के साथ अन्तःक्रिया करके विलायकयोजित आयनों का निर्माण करते हैं जो कि आयनों की द्रवों से अन्तःक्रिया करने के लिए एक दुसरे से दूर जाने से होने वाले ऊर्जा एवं परिक्षय (एन्ट्रॉपी) में परिवर्तनों के मिलाप से उत्पन्न होने वाले कारणों से अधिक स्थिर होते हैं। ये स्थिर प्रजातियां साधारणतः पर्यावरण में कम तापमान पर पाई जाती हैं। सामान्य उदाहरण समुद्री जल में उपलब्ध आयन हैं, जो घुले हुए लवणों से प्राप्त होते हैं।
आवेशित वस्तुओं के रूप में, आयन विपरीत विद्युत आवेशों (धनात्मक से ऋणात्मक, तथा इसके विपरीत) की ओर आकर्षित होते हैं तथा समान आवेशों द्वारा प्रतिकर्षित होते हैं। जब वे चलते हैं, तो उनके प्रक्षेपवक्र को चुंबकीय क्षेत्र द्वारा विक्षेपित किया जा सकता है।
इलेक्ट्रॉनों के छोटे द्रव्यमान अतः इस कारणवश पदार्थ तरंगों के रूप में बड़े स्थान-भरने वाले गुणों के कारण वे परमाणुओं तथा अणुओं के आकार को निर्धारित करते हैं जिनमें केवल एक ही इलेक्ट्रॉन होता है। इस प्रकार, आयन (नकारात्मक रूप से आवेशित आयन) मूल अणु या परमाणु से बड़े होते हैं, क्योंकि अतिरिक्त इलेक्ट्रॉन एक दूसरे को प्रतिकर्षित करते हैं तथा आयन के भौतिक आकार में जुड़ जाते हैं, अतः इसका आकार इसके इलेक्ट्रॉन अभ्र द्वारा निर्धारित किया जाता है। इलेक्ट्रॉन अभ्र के छोटे आकार के कारण धनायन संबंधित मूल परमाणु या अणु से छोटे होते हैं। एक धनायन (हाइड्रोजन का) में कोई इलेक्ट्रॉन नहीं होता है तथा इस प्रकार यह अकेला प्रोटॉन होता है जो मूल हाइड्रोजन परमाणु से बहुत छोटा होता है।
ऋणायन तथा धनायन

चूँकि एक प्रोटॉन पर विद्युत आवेश एक इलेक्ट्रॉन पर आवेश के परिमाण के बराबर होता है अतः एक आयन पर शुद्ध विद्युत आवेश आयन में प्रोटॉनों तथा इलेक्ट्रॉनों की संख्या में अंतर के बराबर होता है।
एनायन (ऋणायन) (−) (/ˈænˌaɪ.ən/ एन-आई-एन, ग्रीक शब्द ἄνω (एनो) से, जिसका अर्थ है "ऊपर" [12]) प्रोटॉन की तुलना में अधिक इलेक्ट्रॉनों वाला आयन है, जो इसे शुद्ध ऋणात्मक आवेश देता है (चूंकि इलेक्ट्रॉन ऋणात्मक रूप से आवेशित होते हैं तथा प्रोटॉन धनात्मक रूप से आवेशित होते हैं)।[13]
कैटायन (धनायन) (+) (/ˈkætˌaɪ.ən/ कैट-आई-एन, ग्रीक शब्द κάτω (काटो) से, जिसका अर्थ है "नीचे"[14]) प्रोटॉन की तुलना में कम इलेक्ट्रॉनों वाला आयन है, जो इसे धनात्मक आवेश देता है।[15]
बहु आवेशी आयनों के लिए अतिरिक्त नामों का उपयोग किया जाता है। उदाहरण के लिए, -२ आवेश वाले आयन को द्विऋणायन कहते हैं तथा +२ आवेश वाले आयन को द्विधानायन कहते हैं। ज़्वीटेरायन अणु के अंदर ही विभिन्न स्थानों पर धनात्मक एवं ऋणात्मक आवेशों वाला उदासीन अणु होता है।[16]
धनायन तथा ऋणायन को उनके आयनिक त्रिज्या द्वारा मापा जाता है तथा वे सापेक्ष आकार में भिन्न होते हैं: "धनायन छोटे होते हैं, उनमें से अधिकांश की त्रिज्या 10−10 मी (10−8 सेमी) से कम होती है। लेकिन अधिकांश ऋणायन बड़े होते हैं, जैसा कि पृथ्वी का सबसे साधारण ऋणायन, ऑक्सीजन है। इस तथ्य द्वारा यह स्पष्ट है कि क्रिस्टल में सर्वाधिक स्थान ऋणायन द्वारा अभिगृहीत होता है तथा धनायन उनके मध्य उपलब्ध रिक्त स्थानों को ग्रहण कर लेते हैं"।[17]
धनायन तथा ऋणायन (उन आयनों के लिए जो विद्युत् अपघटन के समय, क्रमशः धनाग्र तथा ऋणाग्र कि ओर चलते हैं) शब्दों को माइकल फैराडे ने सन्न १८३४ में विलियम व्हीवेल से परामर्श के उपरान्त प्रस्तावित किया था।
प्राकृतिक घटनाएं
आयन प्रकृति में सर्वव्यापी हैं तथा सूर्य की चमक से लेकर पृथ्वी के आयनमंडल के अस्तित्व तक विविध घटनाओं के लिए उत्तरदायी हैं। अपने आयनिक अवस्था में परमाणुओं का रंग उदासीन परमाणुओं से भिन्न हो सकता है, तथा इस प्रकार धातु आयनों द्वारा प्रकाश अवशोषण रत्नों का रंग देता है। अकार्बनिक तथा कार्बनिक रसायन विज्ञान (जैव रसायन सहित) दोनों में, पानी तथा आयनों की परस्पर क्रिया अत्यंत महत्वपूर्ण है; उदाहरण ऊर्जा है जो एडेनोसाइन ट्रायफ़ोस्फेट (ATP) के विघटन को संचालित करती है। निम्नलिखित खंड उन संदर्भों का वर्णन करते हैं जिनमें आयन प्रमुख रूप से प्रदर्शित होते हैं; ये खगोलीय से सूक्ष्म तक, भौतिक लंबाई-पैमाने के घटते हुए क्रम, में व्यवस्थित हैं।
संबंधित प्रौद्योगिकी
आयनों को विभिन्न आयन स्रोतों का उपयोग करके गैर-रासायनिक रूप से तैयार किया जा सकता है, जिसमें साधारणतः उच्च वोल्टता या तापमान संलिप्त होते हैं। इनका उपयोग द्रव्यमान स्पेक्ट्रममापी, प्रकाशीय उत्सर्जन स्पेक्ट्रममापी, कण त्वरक, आयन आरोपकों तथा आयन इंजन जैसे कई उपकरणों में किया जाता है।
प्रतिक्रियाशील आवेशित कणों के रूप में, उनका उपयोग वायु स्वच्छीकरण में रोगाणुओं को बाधित करके, तथा घरेलू वस्तुओं जैसे धूम्र संसूचकों (स्मोक डिटेक्टर) में भी किया जाता है।
चूंकि जीवों में संकेतन तथा चयापचय कोशिका झिल्ली में एक सटीक आयनिक ढाल द्वारा नियंत्रित होते हैं, इस ढाल का विघटन कोशिका की मृत्यु में अंशदान करती है। यह प्राकृतिक तथा कृत्रिम जीवनाशियों द्वारा शोषित सामान्य तंत्र है, जिसमें ग्रेमिसिडिन तथा एम्फोटेरिसिन (कवकनाशी) सम्मिलित हैं।
अकार्बनिक भंग आयन कुल घुलित ठोस का घटक है, जो पानी की गुणवत्ता का व्यापक रूप से जाना जाने वाला संकेतक है।
आयनकारी विकिरण का संसूचन
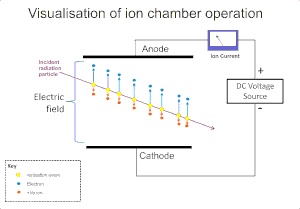
गैस पर विकिरण के आयनकारी प्रभाव का व्यापक रूप से अल्फा, बीटा, गामा किरण तथा एक्स-रे जैसे विकिरण का पता लगाने के लिए उपयोग किया जाता है। इन उपकरणों में मूल आयनीकरण घटना के परिणामस्वरूप एक घनात्मक आयन तथा एक मुक्त इलेक्ट्रॉन "आयन की जोड़ी" का निर्माण होता है जो कि गैस के अणुओं पर विकिरण द्वारा आयन प्रभाव के कारण उत्पन्न होता है। आयनीकरण कक्ष इन डिटेक्टरों में सबसे सरल है, तथा विद्युत क्षेत्र के अनुप्रयोग के माध्यम से गैस के भीतर प्रत्यक्ष आयनीकरण द्वारा बनाए गए सभी आवेशों को एकत्र करता है।[4]
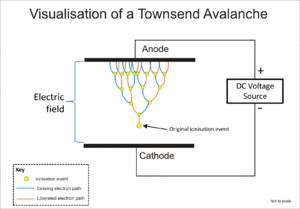
गीजर-मुलर ट्यूब तथा आनुपातिक काउंटर दोनों टाउनसेन्ड अवधाव नामक परिघटना का उपयोग करते हैं जिसके अंतर्गत सोपानी प्रभाव के द्वारा, जिसमें मुक्त एलेक्ट्रॉनों को विद्युत् क्षेत्र द्वारा पर्याप्त ऊर्जा देकर आयन संघात के प्रभाव से और अधिक एलेक्ट्रॉनों को मुक्त करके, मूलभूत आयनीकरण के प्रभाव में वृद्धि करते हैं।
रसायन विज्ञान
आवेशित अवस्था को इंगित करना

किसी आयन का रासायनिक सूत्र लिखते समय उसका शुद्ध आवेश अणु/परमाणु की रासायनिक संरचना के ठीक बाद अधिलेख में लिखा जाता है। शुद्ध आवेश को चिन्ह से पहले परिमाण के साथ लिखा जाता है; अर्थात्, एक दोगुने आवेशित धनायन को '+2' के स्थान पर '2+' के रूप में दर्शाया जाता है। तथापि, एकल आवेशित अणुओं/परमाणुओं के लिए आवेश के परिमाण को छोड़ दिया जाता है; उदाहरण के लिए, सोडियम धनायन को Na+ के रूप में दर्शाया जाता है न कि Na1+ के रूप में।
एक अणु/परमाणु को कई आवेशों के साथ दिखाने का वैकल्पिक (तथा स्वीकार्य) तरीका कई बार संकेतों को चित्रित करना है, जैसा कि प्राय: संक्रमण धातुओं के साथ देखा जाता है। रसानज्ञ कभी-कभी चिन्ह पर एक गोला बना देते हैं; यह केवल सजावटी होता है तथा रासायनिक अर्थ को नहीं बदलता है। इस प्रकार Fe2+, Fe++, तथा Fe⊕⊕ यह तीनों प्रतिनिधित्व, जैसा कि चित्र में दिखाया गया है, समतुल्य हैं।

एकपरमाण्विक आयनों को कभी-कभी रोमन अंकों के साथ भी दर्शाया जाता है, विशेष रूप से स्पेक्ट्रोमिती में; उदाहरण के लिए, ऊपर देखे गए उदाहरण में Fe2+ को Fe(II) या FeII के रूप में उल्लिखित किया जाता हैै। रोमन अंक तत्व की औपचारिक ऑक्सीकरण अवस्था को दर्शाता है, जबकि अधिलेखित भारतीय अरब संख्यांक शुद्ध आवेश को दर्शाते हैं। इसलिए, दोनों संकेतन एकपरमाण्विक आयनों के लिए विनिमेय हैं, लेकिन रोमन अंकों को बहुपरमाणु आयनों पर लागू नहीं किया जा सकता है। तथापि, एक बहुपरमाणु संकर किसी धातु केंद्र के लिए इन दोनों संकेतनों को मिश्रित करना संभव है, जैसा कि यूरेनिल आयन उदाहरण द्वारा दिखाया गया है।
उपवर्ग
यदि किसी आयन में अयुग्मित इलेक्ट्रॉन होते हैं, तो इसे मूलक आयन कहा जाता है। अनावेशित मूलकों की तरह, मूलक आयन बहुत प्रतिक्रियाशील होते हैं। ऑक्सीजन युक्त पॉलीऐटोमिक आयन, जैसे कार्बोनेट तथा सल्फेट, ऑक्सीऋणायन कहलाते हैं। आणविक आयन जिनमें कम से कम एक कार्बन से हाइड्रोजन बंध होता है, कार्बनिक आयन कहलाते हैं। यदि कार्बनिक आयन में आवेश औपचारिक रूप से कार्बन पर केंद्रित होता है, तो इसे कार्बधनायन (यदि धनात्मक रूप से आवेशित किया जाता है) या कार्बऋणायन (यदि ऋणात्मक रूप से आवेशित किया जाता है) कहा जाता है।
निर्माण
एकपरमाण्विक आयनों का निर्माण
एकपरमाण्विक आयन परमाणु में संयोजकता कोश (सबसे बाहरी इलेक्ट्रॉन शेल) में इलेक्ट्रॉनों कि लाभ या हानि से बनते हैं। परमाणु के भीतरी कक्ष इलेक्ट्रॉनों से भरे होते हैं जो धनात्मक रूप से आवेशित परमाणु नाभिक से कसकर बंधे होते हैं, तथा इसलिए इस तरह की रासायनिक अंतःक्रिया में भाग नहीं लेते हैं। किसी उदासीन परमाणु या अणु से इलेक्ट्रॉन ग्रहण करने या खोने की प्रक्रिया को आयनन कहते हैं।
परमाणुओं को विकिरण के साथ बमबारी द्वारा आयनित किया जा सकता है, लेकिन रसायन विज्ञान में आयनीकरण की अधिक सामान्य प्रक्रिया परमाणुओं या अणुओं के बीच इलेक्ट्रॉनों का स्थानांतरण है। यह स्थानांतरण सामान्यतः स्थिर ("संवृत कोश") इलेक्ट्रॉनी विन्यास प्राप्त करने से प्रेरित होता है। परमाणु इलेक्ट्रॉनों को प्राप्त करेंगे या खो देंगे, इस पर निर्भर करता है कि किस क्रिया में सबसे कम ऊर्जा लगती है।
उदाहरण के लिए, सोडियम परमाणु, Na, के संयोजकता कोश में एकल इलेक्ट्रॉन होता है, जो 2 तथा 8 इलेक्ट्रॉनों के 2 स्थिर भरे हुए आंतरिक कोश को घेरे होता है। क्योंकि ये भरे हुए कोश बहुत स्थिर होते हैं, सोडियम परमाणु अपने अतिरिक्त इलेक्ट्रॉन को खो देता है तथा इस स्थिर विन्यास को प्राप्त कर लेता है, इस प्रक्रिया में सोडियम धनायन बन जाता है।
दूसरी ओर, क्लोरीन परमाणु, Cl, के संयोजकता कोश में 7 इलेक्ट्रॉन होते हैं, जो कि 8 इलेक्ट्रॉनों से भरे स्थिर कोश से एक कम है। इस प्रकार, क्लोरीन परमाणु एक अतिरिक्त इलेक्ट्रॉन प्राप्त करता है तथा एक स्थिर 8-इलेक्ट्रॉन विन्यास प्राप्त करता है, इस प्रक्रिया में क्लोराइड ऋणायन बन जाता है:
यह प्रेरक शक्ति है जो सोडियम तथा क्लोरीन को रासायनिक प्रतिक्रिया से गुजरने का कारण बनती है, जिसमें "अतिरिक्त" इलेक्ट्रॉन को सोडियम से क्लोरीन में स्थानांतरित किया जाता है, जिससे सोडियम धनायन तथा क्लोराइड ऋणायन बनते हैं। विपरीत रूप से आवेशित होने के कारण, ये धनायन तथा ऋणायन आयोनिक बंध बनाते हैं तथा सोडियम क्लोराइड, NaCl बनाने के लिए संयोजित होते हैं, जिसे सामान्यतः टेबल सॉल्ट के रूप में जाना जाता है।
बहुपरमाणुक तथा आणविक आयनों का निर्माण

बहुपरमाणुक तथा आणविक आयन सामान्यतः उदासीन अणुओं में, मौलिक आयनों जैसे के एक प्रोटॉन, H+, को प्राप्त या खोने से बनते हैं। उदाहरण के लिए, जब अमोनिया, NH3, प्रोटॉन H+ स्वीकार करता है (इस प्रक्रिया को प्रोटॉनीकरण कहा जाता है), यह अमोनियम आयन, NH+4, बनाती है। अमोनिया तथा अमोनियम में अनिवार्य रूप से एक ही इलेक्ट्रॉन विन्यास में इलेक्ट्रॉनों की संख्या समान होती है, लेकिन अमोनियम में एक अतिरिक्त प्रोटॉन होता है जो इसे शुद्ध धनात्मक आवेश देता है।
आयन बनाने के लिए अमोनिया एक धनात्मक आवेश प्राप्त करने के लिए एक इलेक्ट्रॉन भी खो सकता है जिससे कि NH+3 आयन निर्मित होता है। तथापि, यह आयन अस्थिर होता है, क्योंकि इसमें नाइट्रोजन परमाणु के चारों ओर एक अधूरा संयोजकता कक्ष होता है, जिससे यह बहुत ही प्रतिक्रियाशील मूलक आयन बन जाता है।
मूलक आयनों की अस्थिरता के कारण, बहुपरमाणुक तथा आणविक आयन सामान्यतः इलेक्ट्रॉनों को प्राप्त करने या खोने से नहीं अपितु मौलिक आयनों, जैसे कि H+, को प्राप्त करने या खोने से बनते हैं। यह अणु को विद्युत आवेश प्राप्त करते समय अपने स्थिर इलेक्ट्रॉनिक विन्यास को संरक्षित करने की अनुमति देता है।
आयनन विभव
कम शुद्ध विद्युत आवेश वाली गैस के परमाणु या अणु से अपनी न्यूनतम ऊर्जा अवस्था में इलेक्ट्रॉन को अलग करने के लिए आवश्यक ऊर्जा को आयनन विभव या आयनन ऊर्जा कहा जाता है। किसी परमाणु की nवीं आयनन ऊर्जा वह ऊर्जा है जो, n − 1 इलेक्ट्रॉनों को अलग करने के बाद, उसके nवें इलेक्ट्रॉन को अलग करने के लिए आवश्यक होती है।
प्रत्येक क्रमिक आयनन ऊर्जा पिछले की तुलना में स्पष्ट रूप से अधिक होती है। विशेष रूप से अत्याधिक वृद्धि तब होती है जब दी गयी परमाणु कक्षाओं के समूह के इलेक्ट्रान समाप्त हो जाते हैं। इस कारण से, आयन उन तरीकों से बनते हैं जो उन्हें पूर्ण कक्षीय समूहों के साथ छोड़ते हैं। उदाहरण के लिए, सोडियम के सबसे बाहरी कोश में एक संयोजकता इलेक्ट्रॉन होता है, इसलिए आयनित रूप में यह सामान्यतः एक खोए हुए इलेक्ट्रॉन के साथ पाया जाता है, जैसे Na+। आवर्त सारणी के दूसरी ओर, क्लोरीन में सात वैलेंस इलेक्ट्रॉन होते हैं, इसलिए आयनित रूप में यह सामान्यतः एक प्राप्त इलेक्ट्रॉन के साथ पाया जाता है, जैसे Cl−। सीज़ियम में सभी तत्वों की सबसे कम तथा हीलियम में सबसे अधिक मापी गई आयनन ऊर्जा होती है।[18] साधारणतः, धातुओं की आयनन ऊर्जा अधातुओं की आयनन ऊर्जा की तुलना में बहुत कम होती है, यही कारण है कि, सामान्यतः , धातुएँ धनात्मक रूप से आवेशित आयन बनाने के लिए इलेक्ट्रॉनों को खो देंगी तथा अधातुओं को ऋणात्मक रूप से आवेशित आयन बनाने के लिए इलेक्ट्रॉन प्राप्त होंगे।
आयनिक आबंध
आयनिक आबंध रासायनिक बंध होता है जो विपरीत आवेशित आयनों के पारस्परिक आकर्षण से उत्पन्न होता है। समान आवेश वाले आयन एक दूसरे को प्रतिकर्षित करते हैं तथा विपरीत आवेश वाले आयन आकर्षित करते हैं। इसलिए, आयन सामान्यतः स्वयं के बल पर उपस्थित नहीं होते हैं, लेकिन क्रिस्टल जालक बनाने के लिए विपरीत आवेश के आयनों से बंधे होंगे। परिणामी यौगिक को आयनिक यौगिक कहा जाता है, तथा कहा जाता है कि यह आयनिक आबंध द्वारा बंधा रहता है। आयनिक यौगिकों में आयन पड़ोसियों के बीच विशिष्ट दूरी उत्पन्न होती है जिससे स्थानिक विस्तार तथा आयनों की आयनिक त्रिज्या प्राप्त की जा सकती है।
सबसे आम प्रकार का आयनिक बंधन धातुओं तथा अधातुओं के यौगिकों में देखा जाता है (उत्कृष्ट गैसों को छोड़कर, जो शायद ही कभी रासायनिक यौगिक बनाते हैं)। धातुओं का लक्षण यह होता है कि वे स्थिर-संवृत कोश संरचना वाले इलेक्ट्रॉनी विन्यास, जिसमें एलेक्ट्रॉनों की संख्या कम होती है, के साथ उपस्थित होते हैं। इस प्रकार, स्थिर विन्यास प्राप्त करने के लिए उनमें इन अतिरिक्त इलेक्ट्रॉनों को खोने की प्रवृत्ति होती है। यह गुण वैद्युतीयधनात्मकता कहलाता है। दूसरी ओर, अधातुओं का लक्षण यह होता है कि उनमें इलेक्ट्रॉनी विन्यास के लिए कुछ ही इलेक्ट्रान कम होते हैं। अतः, उनके पास स्थिर विन्यास प्राप्त करने के लिए अधिक इलेक्ट्रॉन प्राप्त करने की प्रवृत्ति होती है। यह गुण वैद्युतीयऋणात्मकता कहलाता है। जब अत्यधिक विद्युत धनात्मक धातु को अत्यधिक विद्युत ऋणात्मक अधातु के साथ जोड़ा जाता है, तो धातु परमाणुओं से अतिरिक्त इलेक्ट्रॉनों को इलेक्ट्रॉन-कमी वाले अधातु परमाणुओं में स्थानांतरित कर दिया जाता है। यह अभिक्रिया धातु धनायन तथा अधातु ऋणायन का उत्पादन करती है, जो एक दूसरे के प्रति आकर्षित होकर लवण बनाते हैं।
आम आयन
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
यह भी देखें
संदर्भ
- ↑ "Ion" Archived 2013-12-24 at the Wayback Machine entry in Collins English Dictionary.
- ↑ "Definition of CATION". www.merriam-webster.com (in English). Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ↑ "Definition of ANION". www.merriam-webster.com (in English). Archived from the original on 2021-10-06. Retrieved 2021-10-06.
- ↑ 4.0 4.1 4.2 Knoll, Glenn F (1999). Radiation detection and measurement (3rd ed.). New York: Wiley. ISBN 978-0-471-07338-3.
- ↑ Michael Faraday (1791-1867). UK: BBC.
- ↑ "Online etymology dictionary". Archived from the original on 2011-05-14. Retrieved 2011-01-07.
- ↑ Frank A. J. L. James, ed. (1991). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. p. 183. ISBN 9780863412493. Archived from the original on 2021-04-14. Retrieved 2020-10-16.
- ↑ "The Nobel Prize in Chemistry 1903". www.nobelprize.org. Archived from the original on 2018-07-08. Retrieved 2017-06-13.
- ↑ Harris, William; Levey, Judith, eds. (1976). The New Columbia Encyclopedia (4th ed.). New York City: Columbia University. p. 155. ISBN 978-0-231-03572-9.
- ↑ Goetz, Philip W. (1992). McHenry, Charles (ed.). The New Encyclopædia Britannica. p. 587. Bibcode:1991neb..book.....G. ISBN 978-0-85229-553-3.
{{cite book}}:|journal=ignored (help) - ↑ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (1 ed.). New York City: Charles Scribner's Sons. pp. 296–302. ISBN 978-0-684-10112-5.
- ↑ Oxford University Press (2013). "Oxford Reference: OVERVIEW anion". oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ↑ University of Colorado Boulder (November 21, 2013). "Atoms and Elements, Isotopes and Ions". colorado.edu. Archived from the original on February 2, 2015. Retrieved November 22, 2013.
- ↑ Oxford University Press (2013). "Oxford Reference: OVERVIEW cation". oxfordreference.com. Archived from the original on 2017-01-18. Retrieved 2017-01-15.
- ↑ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). "Elemental Chemistry" (PDF). usouthal.edu. Archived (PDF) from the original on 2011-12-04. Retrieved 2013-11-22.
- ↑ Purdue University (November 21, 2013). "Amino Acids". purdue.edu. Archived from the original on July 13, 2011. Retrieved November 22, 2013.
- ↑ Press, Frank; Siever, Raymond (1986). Earth (14th ed.). New York: W. H. Freeman and Company. p. 63. ISBN 0-7167-1743-3. OCLC 12556840.
- ↑ Chemical elements listed by ionization energy Archived 2009-03-30 at the Wayback Machine. Lenntech.com
- ↑ 19.0 19.1 19.2 "Common Ions and Their Charges" (PDF). Science Geek. Archived (PDF) from the original on 2018-02-18. Retrieved 2018-05-11.