यूरेनिल
यूरेनिल आयन ऑक्सीकरण अवस्था +6 में यूरेनियम का ऑक्सीकरण है, जिसका रासायनिक सूत्र UO2+
2 है। इसमें छोटे U-O बंध के साथ एक रैखिक संरचना है, जो यूरेनियम और ऑक्सीजन के बीच कई बंधनों की उपस्थिति का संकेत है। यूरेनियम परमाणु के चारों ओर एक भूमध्यरेखीय तल में चार या अधिक लिगेंड यूरेनिल आयन से बंधे हो सकते हैं। यूरेनिल आयन कई जटिल (रसायन विज्ञान) का निर्माण करता है, विशेष रूप से लिगेंड के साथ जिसमें ऑक्सीजन दाता परमाणु होते हैं। यूरेनियम के अयस्कों से और परमाणु ईंधन पुनर्संसाधन में यूरेनियम के निष्कर्षण में यूरेनियम आयन के परिसर महत्वपूर्ण हैं।
संरचना और संबंध
यूरेनिल आयन रैखिक और सममित है, दोनों U-O बंध की लंबाई लगभग 180 पीएम है। बंध की लंबाई यूरेनियम और ऑक्सीजन परमाणुओं के बीच कई बंधनों की उपस्थिति का संकेत है। चूंकि यूरेनियम (VI) में पूर्ववर्ती नोबल गैस, रेडॉन का इलेक्ट्रॉनिक विन्यास है, U-O बंध बनाने में प्रयुक्त इलेक्ट्रॉनों को ऑक्सीजन परमाणुओं द्वारा आपूर्ति की जाती है। यूरेनियम परमाणु पर इलेक्ट्रॉनों को खाली परमाणु कक्षाओं में दान किया जाता है। निम्नतम ऊर्जा के रिक्त कक्षक 7s, 5f तथा 6d हैं। वैलेंस बंध सिद्धांत के सिद्धांत के संदर्भ में, sd, sf और df हाइब्रिड ऑर्बिटल्स (Z-अक्ष ऑक्सीजन परमाणुओं के माध्यम से निकलता है) के निर्माण के लिए dz2 और fz3 का उपयोग करके सिग्मा बंध का गठन किया जा सकता है। (dxz, dyz) और (fxz2 और fyz2) का उपयोग पी बंधन बनाने के लिए किया जा सकता है। चूँकि बॉन्डिंग में प्रयुक्त d या f ऑर्बिटल्स की जोड़ी पतित कक्षीय हैं, यह तीन के समग्र अनुबंध आदेश के बराबर है।[1]

यूरेनिल आयन हमेशा अन्य लिगेंड से जुड़ा होता है। सबसे आम व्यवस्था तथाकथित भूमध्यरेखीय लिगेंड के लिए O-U-O रेखा के लंबवत विमान में स्थित है और यूरेनियम परमाणु से गुजरती है। चार लिगंड्स के साथ, जैसा कि [UO2Cl4]2−, यूरेनियम में एक विकृत अष्टभुजाकार वातावरण है। कई स्थितियों में चार से अधिक लिगेंड भूमध्य रेखा पर कब्जा कर लेते हैं।
यूरेनिल फ्लोराइड में, UO2F2, यूरेनियम परमाणु एक यूरेनिल विन्यास में दो ऑक्सीजन परमाणुओं के साथ एक परत संरचना बनाकर और यूरेनिल समूहों के बीच छह फ्लोराइड आयनों के साथ एक समन्वय संख्या 8 प्राप्त करता है। फ्लोराइड के स्थान पर ऑक्सीजन के साथ α-यूरेनियम ट्राइऑक्साइड में एक समान संरचना पाई जाती है, सिवाय इसके कि उस स्थिति में परतें यूरेनिल समूहों से ऑक्सीजन परमाणु साझा करके जुड़ी होती हैं, जिन्हें अपेक्षाकृत कम U-O दूरी होने से पहचाना जाता है। इसी प्रकार की संरचना कुछ यूरेनेट्स में एक समान संरचना होती है, जैसे कि कैल्शियम यूरेनेट, CaUO4, जिसे Ca(UO2)O2 के रूप में लिखा जा सकता है, तथापि संरचना में पृथक यूरेनिल समूह नहीं होते हैं। ।[3]
स्पेक्ट्रोस्कोपी
यूरेनिल यौगिकों का रंग दृश्यमान स्पेक्ट्रम के नीले किनारे पर सीए 420 एनएम पर लिगैंड टू मेटल चार्ज ट्रांसफर कॉम्प्लेक्स ट्रांज़िशन के कारण होता है।[4][5] अवशोषण बैंड और नेक्सफ्स बैंड का सटीक स्थान भूमध्यरेखीय लिगेंड की प्रकृति पर निर्भर करता है।[6] यूरेनिल आयन वाले यौगिक सामान्यतः पीले होते हैं, चूंकि कुछ यौगिक लाल, नारंगी या हरे रंग के होते हैं।
यूरेनिल यौगिकों में ल्यूमिनेसेंस भी प्रदर्शित होता है। 1849 में डेविड ब्रूस्टर[7] द्वारा यूरेनियम ग्लास की हरी चमक का पहला अध्ययन, और यूरेनिल आयन की स्पेक्ट्रोस्कोपी का व्यापक अध्ययन प्रारंभ किया था। इस स्पेक्ट्रम की विस्तृत समझ 130 साल बाद प्राप्त की गई थी।[8] अब यह अच्छी तरह से स्थापित हो गया है कि यूरेनिल ल्यूमिनेसेंस अधिक विशेष रूप से एक स्फुरदीप्ति है, क्योंकि यह निम्नतम त्रिक उत्तेजित अवस्था से सिंगलेट ग्राउंड अवस्था में संक्रमण के कारण होता है।[9] K2UO2(SO4)2 की चमक रेडियोधर्मिता की खोज में सम्मिलित थी।
यूरेनिल आयन में सीए 880 सेमी−1 (रमन स्पेक्ट्रम) और 950 सेमी-1 ( अवरक्त स्पेक्ट्रम ) पर विशेषता νU–O आणविक कंपन है। ये आवृत्तियाँ कुछ सीमा तक इस बात पर निर्भर करती हैं कि विषुवतीय तल में कौन से लिगेंड उपस्थित हैं। स्ट्रेचिंग फ्रीक्वेंसी और U-O बॉन्ड लंबाई के बीच संबंध उपलब्ध हैं। यह भी देखा गया है कि स्ट्रेचिंग फ्रीक्वेंसी स्पेक्ट्रोकेमिकल श्रृंखला में इक्वेटोरियल लिगेंड की स्थिति से संबंधित है।[10]
जलीय रसायन
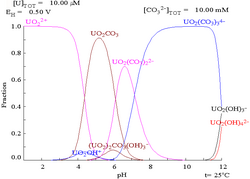
जलीय यूरेनिल आयन एक दुर्बल अम्ल है।
- [UO2(H2O)4]2+ ⇌ [UO2(H2O)3(OH)]+ + H+; pKa = ca. 4.2
जैसे-जैसे पीएच बढ़ता है, हाइड्रॉक्साइड UO2(OH)2 अवक्षेपित होने से पहले स्टोइकोमेट्री [(UO2)2(OH)2]2+ और [(UO2)3(OH)5]+ के साथ पॉलिमरिक प्रजातियां बनती हैं। हाइड्रॉक्साइड यूरेनिल आयन के हाइड्रॉक्सो कॉम्प्लेक्स देने के लिए जोरदार क्षारीय घोल में घुल जाता है।
ऑक्सीकरण अवस्था +4 में जिंक धातु जैसे हल्के कम करने वाले एजेंटों द्वारा यूरेनिल आयन में कमी (रसायन विज्ञान) हो सकती है। जोन्स रिड्यूसर का उपयोग करके यूरेनियम (III) में कमी की जा सकती है।
कॉम्प्लेक्स
यूरेनिल आयन एक कठोर स्वीकर्ता के रूप में व्यवहार करता है और फ्लोराइड और ऑक्सीजन दाता लिगेंड, जैसे हाइड्रॉक्साइड, कार्बोनेट, नाइट्रेट, सल्फेट और कार्बोक्सिलेट की तुलना में नाइट्रोजन-दाता लिगेंड के साथ कमजोर परिसरों का निर्माण करता है। विषुवतीय तल में 4, 5 या 6 दाता परमाणु हो सकते हैं। यूरेनिल नाइट्रेट में [[UO2(NO3)2]·2H2O, उदाहरण के लिए, भूमध्यरेखीय तल में छह दाता परमाणु हैं, जिनमें चार बाइडेंटेट नाइट्राटो लिगैंड्स से और दो पानी के अणुओं से। संरचना को हेक्सागोनल द्विपिरामिड के रूप में वर्णित किया गया है। अन्य ऑक्सीजन-दाता लिगेंड में फॉस्फीन ऑक्साइड और फॉस्फेट एस्टर सम्मिलित हैं।[11]
यूरेनिल नाइट्रेट, UO2 (NO3)2, डायथाइल ईथर में जलीय घोल से विलायक निष्कर्षण किया जा सकता है। जिस कॉम्प्लेक्स को निकाला जाता है, उसमें यूरेनिल आयन से जुड़े दो नाइट्राटो लिगेंड होते हैं, जो बिना किसी विद्युत आवेश के एक कॉम्प्लेक्स बनाते हैं और साथ ही पानी के अणुओं को ईथर के अणुओं द्वारा प्रतिस्थापित किया जाता है, जिससे पूरे कॉम्प्लेक्स को उल्लेखनीय जल विरोधी चरित्र मिलता है। कार्बनिक सॉल्वैंट्स में जटिल घुलनशील बनाने में इलेक्ट्रोन्यूट्रलिटी सबसे महत्वपूर्ण कारक है। नाइट्रेट आयन संक्रमण धातु और लैंथेनाइड आयनों की तुलना में यूरेनिल आयन के साथ बहुत मजबूत परिसरों का निर्माण करता है। इस कारण से केवल यूरेनिल और प्लूटोनील आयन सहित अन्य एक्टिनिल आयन, PuO2+
2, अन्य आयनों वाले मिश्रण से निकाला जा सकता है। पानी के अणुओं को एक दूसरे, हाइड्रोफोबिक, लिगैंड द्वारा जलीय घोल में यूरेनिल आयन से बांधकर कार्बनिक विलायक में तटस्थ परिसर की घुलनशीलता को बढ़ाता है। इसे सहक्रियात्मक प्रभाव कहा गया है।[12]
जलीय घोल में यूरेनिल आयन द्वारा गठित परिसरों का इसके अयस्कों से यूरेनियम के निष्कर्षण और परमाणु ईंधन पुनर्संसाधन दोनों में बड़ा महत्व है। औद्योगिक प्रक्रियाओं में, यूरेनिल नाइट्रेट को ट्राइब्यूटिल फॉस्फेट (TBP, (CH3CH2CH2CH2O)3PO) के साथ पसंदीदा दूसरे लिगैंड और मिट्टी के तेल को पसंदीदा कार्बनिक विलायक के रूप में निकाला जाता है। बाद में इस प्रक्रिया में, कार्बनिक विलायक से यूरेनियम को मजबूत नाइट्रिक एसिड के साथ अभिक्रिया करके अलग कर दिया जाता है, जो [UO2(NO3)4]2− जैसे कॉम्प्लेक्स बनाता है जो जलीय चरण में अधिक घुलनशील होते हैं। घोल को वाष्पित करके यूरेनिल नाइट्रेट को पुनः प्राप्त किया जाता है।[11]
खनिज
यूरेनिल आयन यूरेनियम युक्त खनिज सीमों में होने वाली जल-चट्टान अंतःक्रियाओं द्वारा यूरेनियम जमा से प्राप्त खनिजों में होता है। यूरेनिल युक्त खनिजों के उदाहरणों में सम्मिलित हैं:
- सिलिकेट्स: यूरेनोफेन (H3O)2Ca(UO2)2(SiO4)·3H2O)
- फॉस्फेट: ऑटुनाइट (Ca(UO2)2(PO4)2·8–12H2O), टॉर्निट (Cu(UO2)2(PO4)·8–12H2O)
- आर्सेनेट्स: आर्सेनुरानोस्पाथाइट (Al(UO2)2(AsO4)2F·20H2O)
- वनाडेट्स: कार्नोटाइट (K2(UO2)2(VO4)2·3H2O), तुयमुनिते (Ca(UO2)2V2O8·8H2O)
- कार्बोनेट: श्रोकिंगराइट NaCa3(UO2)(CO3)3(SO4)F·10H2O
- ऑक्सलेट: यूरोक्साइट [(UO2)2(C2O4)(OH)2(H2O)2]·H2O.
ये खनिज कम व्यावसायिक मूल्य के हैं क्योंकि अधिकांश यूरेनियम पिचब्लेंड से निकाले जाते हैं।
उपयोग
डीएनए के इलेक्ट्रॉन और इलेक्ट्रोमैग्नेटिक माइक्रोस्कोपी अध्ययन के लिए नमूनों को दागने के लिए यूरेनिल लवण का उपयोग किया जाता है।[13]
स्वास्थ्य और पर्यावरण की समस्याएँ
यूरेनिल लवण जहरीले होते हैं और गंभीर दीर्घकालिक वृक्क रोग और तीव्र ट्यूबलर नेक्रोसिस का कारण बन सकते हैं। लक्षित अंगों में गुर्दे, यकृत, फेफड़े और मस्तिष्क सम्मिलित हैं। गोनोसाइट्स सहित ऊतकों में यूरेनिल आयन संचय[14] जन्मजात विकार उत्पन्न करता है, और सफेद रक्त कोशिकाओं में प्रतिरक्षा प्रणाली को हानि पहुंचाता है।[15] यूरेनिल यौगिक भी न्यूरोटॉक्सिन हैं। घटे हुए यूरेनियम लक्ष्य पर और उसके आसपास यूरेनिल आयन संदूषण पाया गया है।[16]
सभी यूरेनियम यौगिक रेडियोधर्मी हैं। चूँकि, परमाणु उद्योग के संदर्भ को छोड़कर, यूरेनियम सामान्यतः समाप्त रूप में होता है। क्षीण यूरेनियम में मुख्य रूप से यूरेनियम के 238U समस्थानिक होते हैं जो अल्फा क्षय द्वारा 4.468(3)×109 years के आधे जीवन के साथ क्षय होता है। यहां तक कि अगर यूरेनियम में 235U समस्थानिक होता है जो लगभग 7.038×108 years के समान अर्ध-आयु के साथ क्षय होता है, दोनों को अभी भी कमजोर अल्फा उत्सर्जक माना जाएगा और उनकी रेडियोधर्मिता सीधे संपर्क या अंतर्ग्रहण के साथ ही खतरनाक है।
संदर्भ
- ↑ Cotton, S (1991). लैंथेनाइड्स और एक्टिनाइड्स. New York: Oxford University Press. p. 128.
- ↑ Mueller, Melvin Henry; Dalley, N. Kent; Simonsen, Stanley H. (1971). "यूरेनिल नाइट्रेट डाइहाइड्रेट का न्यूट्रॉन विवर्तन अध्ययन". Inorganic Chemistry. 10 (2): 323–328. doi:10.1021/ic50096a021.
- ↑ Wells, A.F (1962). संरचनात्मक अकार्बनिक रसायन (3rd. ed.). Oxford: Clarendon Press. p. 966. ISBN 0-19-855125-8.
- ↑ Umreiko, D.S. (1965). "यूरेनिल यौगिकों के इलेक्ट्रॉनिक अवशोषण स्पेक्ट्रा में समरूपता". J. Appl. Spectrosc. 2 (5): 302–304. Bibcode:1965JApSp...2..302U. doi:10.1007/BF00656800. S2CID 96229881.
- ↑ Berto, Silvia; Crea, Francesco; Daniele, Pier G.; De Stefano, Concetta; Prenesti, Enrico; Sammartano, Silvio (2006). "Dioxouranium(VI)-Carboxylate Complexes. Interaction with dicarboxylic acids in Aqueous Solution: Speciation and Structure". Annali di Chimica. 96 (7–8): 399–420. doi:10.1002/adic.200690042. PMID 16948430.
- ↑ Fillaux, C.; Guillaumont, D.; Berthet, J-C; Copping, R.; Shuh, D.K.; Tyliszczak, T.; Den Auwer, C. (2010). "NEXAFS स्पेक्ट्रोस्कोपी और क्वांटम रसायन विज्ञान के संयोजन से यूरेनिल यौगिकों में इलेक्ट्रॉनिक संरचना और बंधन की जांच". Phys. Chem. Chem. Phys. 12 (42): 14253–14262. Bibcode:2010PCCP...1214253F. doi:10.1039/C0CP00386G. PMID 20886130.
- ↑ Brewster, David (1849). "ठोस और द्रव निकायों के भीतर प्रकाश के अपघटन और फैलाव पर". Transactions of the Royal Society of Edinburgh. 16 (2): 111–121. doi:10.1017/S0080456800024972. S2CID 94834106.
- ↑ Denning, R. G. (2007). "एक्टिनाइल आयनों और उनके एनालॉग्स में इलेक्ट्रॉनिक संरचना और बंधन". J. Phys. Chem. A. 111 (20): 4125–4143. Bibcode:2007JPCA..111.4125D. doi:10.1021/jp071061n. PMID 17461564.
- ↑ V. Balzani & V. Carassiti (1970). समन्वय यौगिकों की फोटोकैमिस्ट्री. Academic Press. ISBN 0-12-077250-7.
- ↑ Nakamoto, K. (1997). अकार्बनिक और समन्वय यौगिकों के इन्फ्रारेड और रमन स्पेक्ट्रा. Part A (5th ed.). Wiley. p. 167. ISBN 0-471-16394-5.Nakamoto, K. अकार्बनिक और समन्वय यौगिकों के इन्फ्रारेड और रमन स्पेक्ट्रा. Part B. p. 168. ISBN 0-471-16392-9.
- ↑ Jump up to: 11.0 11.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1273–1274. ISBN 978-0-08-037941-8.
- ↑ Irving, H.M.N.H. (1965). "सॉल्वेंट एक्सट्रैक्शन में सिनर्जिक प्रभाव". Angewandte Chemie International Edition. 4 (1): 95–96. doi:10.1002/anie.196500951.
- ↑ Zobel R.; Beer M. (1961). "Electron Stains: I. Chemical Studies on the Interaction of DNA with Uranyl Salts". Journal of Cell Biology. 10 (3): 335–346. doi:10.1083/jcb.10.3.335. PMC 2225082. PMID 13788706.
- ↑ Arfsten DP, Still KR, Ritchie GD (2001). "प्रजनन और भ्रूण के विकास पर यूरेनियम और घटे हुए यूरेनियम के प्रभाव की समीक्षा". Toxicology and Industrial Health. 17 (5–10): 180–191. doi:10.1191/0748233701th111oa. PMID 12539863. S2CID 25310165.
- ↑ Schröder H, Heimers A, Frentzel-Beyme R, Schott A, Hoffman W (2003). "खाड़ी युद्ध और बाल्कन युद्ध के दिग्गजों के परिधीय लिम्फोसाइटों में गुणसूत्र विपथन विश्लेषण" (PDF). Radiation Protection Dosimetry. 103 (3): 211–219. doi:10.1093/oxfordjournals.rpd.a006135. PMID 12678382. Archived from the original (PDF) on 2014-01-08. Retrieved 2014-01-08.
- ↑ Salbu B, Janssens K, Linda OC, Proost K, Gijsels L, Danesic PR (2004). "कुवैत से घटे हुए यूरेनियम कणों में यूरेनियम का ऑक्सीकरण राज्य". Journal of Environmental Radioactivity. 78 (2): 125–135. doi:10.1016/j.jenvrad.2004.04.001. PMID 15511555.