हीम: Difference between revisions
(Created page with "{{Short description|Chemical coordination complex of an iron ion chelated to a porphyrin}} File:Mboxygenation.png|thumb|420 px|हीम प्रोस्थेटिक...") |
No edit summary |
||
| (33 intermediate revisions by 6 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Chemical coordination complex of an iron ion chelated to a porphyrin}} | {{Short description|Chemical coordination complex of an iron ion chelated to a porphyrin}} | ||
[[File:Mboxygenation.png|thumb|420 px|हीम | [[File:Mboxygenation.png|thumb|420 px|कृत्रिम हीम समूह में ऑक्सीजन का बंधन।]]हीेम या हेम (उच्चारण HEEM), [[ हीमोग्लोबिन |हीमोग्लोबिन]] का अग्रदूत है, जो रक्तप्रवाह में [[ऑक्सीजन]] को संगठित करने के लिए आवश्यक है। हीम अस्थि मज्जा और यकृत दोनों में जैवसंश्लेषित होता है।<ref name="bloomer98">{{cite journal |doi=10.1111/j.1440-1746.1998.01548.x |title=पोर्फिरीन और हीम का जिगर चयापचय|year=1998 |last1=Bloomer |first1=Joseph R. |journal=Journal of Gastroenterology and Hepatology |volume=13 |issue=3 |pages=324–329 |pmid=9570250 |s2cid=25224821 }} | ||
</ref> | </ref> | ||
जैव रासायनिक शब्दों में, हीम एक [[ समन्वय परिसर ]] है | जैव रासायनिक शब्दों में, हीम एक [[ समन्वय परिसर |समन्वय परिसर]] है जो "एक लोहे के आयन से मिलकर बना है व एक [[पॉरफाइरिन]] के लिए एक टेट्राडेंटेट लिगैंड और एक या द्वि अक्षीय लिगैंड के रूप में कार्य करता है।" <ref>{{cite book|chapter-url=https://goldbook.iupac.org/html/H/H02773.html|title=रासायनिक शब्दावली का IUPAC संग्रह:|first=International Union of Pure and Applied|last=Chemistry|publisher=IUPAC|website=iupac.org|access-date=28 April 2018|doi=10.1351/goldbook.H02773|url-status=live|archive-url=https://web.archive.org/web/20170822011820/http://goldbook.iupac.org/html/H/H02773.html|archive-date=22 August 2017|chapter=Hemes (heme derivatives)|year=2009|isbn=978-0-9678550-9-7}}</ref> परिभाषा अस्पष्ट है और कई चित्रण अक्षीय लिगेंड को त्याग देते हैं।<ref>A standard biochemistry text defines heme as the "iron-porphyrin prosthetic group of heme proteins"(Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. {{ISBN|1-57259-153-6}}.)</ref>[[मेटालोप्रोटीन]] द्वारा कृत्रिम समूहों के रूप में स्थित मेटालोपोर्फिरिन में, हीम सबसे व्यापक रूप से उपयोग किया जाता है।<ref>{{Cite journal|last=Poulos|first=Thomas L.|date=2014-04-09|title=हीम एंजाइम संरचना और कार्य|url= |journal=Chemical Reviews|language=en|volume=114|issue=7|pages=3919–3962|doi=10.1021/cr400415k|issn=0009-2665|pmc=3981943|pmid=24400737}}</ref> जो प्रोटीन के एक परिवार को परिभाषित करता है जिसे [[ हीमोप्रोटीन |हीमोप्रोटीन]] कहा जाता है। हीम को सामान्यत: हीमोग्लोबिन के घटकों के रूप में पहचाना जाता है, रक्त में लाल रंगद्रव्य, लेकिन कई अन्य जैविक रूप से महत्वपूर्ण हेमोप्रोटीन जैसे कि [[ Myoglobin |मायोग्लोबिन]], साइटोक्रोमेस, कैटेलेज, हीम पेरोक्सीडेज और एंडोथेलियल नाइट्रिक ऑक्साइड सिंथेज़ में भी पाए जाते हैं।<ref>{{cite journal | last=Paoli|first= M. | title=हीम-प्रोटीन में संरचना-कार्य संबंध।| journal=DNA Cell Biol.| year=2002 | volume=21 | issue=4 | pages= 271–280 | pmid=12042067 | doi=10.1089/104454902753759690|hdl= 20.500.11820/67200894-eb9f-47a2-9542-02877d41fdd7 |url= https://www.pure.ed.ac.uk/ws/files/9103491/Paoli_Marles_Wright_Smith_2002_Structure_function_relationships_in_heme_proteins.pdf }}</ref><ref>{{cite journal | last=Alderton|first= W.K. | title=नाइट्रिक ऑक्साइड सिंथेज़: संरचना, कार्य और निषेध।| journal=Biochem. J.| year=2001 | volume=357 | issue=3 | pages= 593–615 | pmid=11463332 | doi=10.1042/bj3570593 | pmc=1221991}}</ref> | ||
== | हेम शब्द ग्रीक αἷμα हाइमा से लिया गया है जिसका अर्थ है "रक्त"। | ||
[[Image:Succinate Dehygrogenase 1YQ3 Haem group.png|thumb|right|माइटोकॉन्ड्रियल इलेक्ट्रॉन हस्तांतरण श्रृंखला में एक इलेक्ट्रॉन वाहक, हिस्टिडीन से बंधे हुए सक्सेनेट डिहाइड्रोजनेज का हीम समूह। बड़ा अर्ध-पारदर्शी गोला लौह आयन के स्थान को इंगित करता है। से {{PDB|1YQ3}}.]] | [[Image:Haem-B-3D-vdW.png|thumb|right|200px|हेम बी के Fe-प्रोटोपोर्फिरिन IX सबयूनिट का स्पेस-फिलिंग मॉडल। एक्सियल लिगैंड्स को छोड़ दिया गया। रंग योजना: ग्रे = लोहा, नीला = नाइट्रोजन, काला = कार्बन, सफेद = हाइड्रोजन, लाल = ऑक्सीजन]] | ||
== कार्य == | |||
[[Image:Succinate Dehygrogenase 1YQ3 Haem group.png|thumb|right|माइटोकॉन्ड्रियल इलेक्ट्रॉन हस्तांतरण श्रृंखला में एक इलेक्ट्रॉन वाहक, हिस्टिडीन से बंधे हुए सक्सेनेट डिहाइड्रोजनेज का हीम समूह। बड़ा अर्ध-पारदर्शी गोला लौह आयन के स्थान को इंगित करता है। से {{PDB|1YQ3}}.]]हीमोप्रोटीन में विविध जैविक कार्य होते हैं जिनमें द्विपरमाणुक गैसों का परिवहन, रासायनिक उत्प्रेरण, द्विपरमाणुक गैस का पता लगाना और इलेक्ट्रॉन स्थानांतरण सम्मिलित हैं। हीम आयरन इलेक्ट्रॉन स्थानांतरण या रेडॉक्स रसायन के पर्यंत इलेक्ट्रॉनों के स्रोत या सिंक के रूप में कार्य करता है। परऑक्सीडेस अभिक्रिया में, पोर्फिरीन अणु एक इलेक्ट्रॉन स्रोत के रूप में भी कार्य करता है, जो संयुग्मित चक्र में मूल इलेक्ट्रॉनों को निरूपित करने में सक्षम होता है। द्विपरमाणुक गैसों के परिवहन या पता लगाने में, गैस हीम आयरन से बंध जाती है। द्विपरमाणुक गैसों का पता लगाने के पर्यंत, हीम आयरन के लिए संलग्नी गैस का बंधन आसपास के प्रोटीन में परिवर्तन को प्रेरित करता है।<ref>{{cite journal | last=Milani|first= M.| title=काटे गए हीमोग्लोबिन में हीम बाइंडिंग और डायटोमिक लिगैंड रिकग्निशन के लिए स्ट्रक्चरल बेस।| journal=J. Inorg. Biochem.| year=2005 | volume=99 | issue=1 | pages= 97–109 | pmid=15598494 | doi=10.1016/j.jinorgbio.2004.10.035}}</ref> सामान्य तौर पर, द्विपरमाणुक गैसें केवल फेरस Fe (II) के रूप में कम हीम से बंधती हैं, जबकि Fe (III) और Fe (IV) के बीच अधिकांश परआक्सीडेस चक्र और माइटोकॉन्ड्रियल रेडॉक्स व ऑक्सीकरण-कमी, Fe (II) और Fe(III) के बीच चक्र में सम्मिलित हीमोप्रोटीन है। | |||
यह अनुमान लगाया गया है कि हीमोप्रोटीन का मूल विकासवादी कार्य आणविक ऑक्सीजन की उपस्थिति से पहले मूल साइनोबैक्टीरिया जैसे जीवों में प्राचीन सल्फर-आधारित प्रकाश संश्लेषण मार्गों में इलेक्ट्रॉन स्थानांतरण था।<ref>{{cite journal | last=Hardison|first= R.| title=हीमोग्लोबिन का विकास: एक बहुत प्राचीन प्रोटीन के अध्ययन से पता चलता है कि जीन विनियमन में परिवर्तन विकासवादी कहानी का एक महत्वपूर्ण हिस्सा है।| journal=American Scientist| year=1999 | volume=87 | issue=2 | pages= 126|doi= 10.1511/1999.20.809}}</ref> | |||
हीमोप्रोटीन प्रोटीन आधात्री के अंतर्गत हीम मैक्रोसायकल के वातावरण को संशोधित करके अपनी उल्लेखनीय कार्यात्मक विविधता प्राप्त करते हैं।<ref>{{cite journal | last=Poulos|first= T.| title=हीम एंजाइम संरचना और कार्य।| journal=Chem. Rev. | year=2014 | volume=114 | issue=7 | pages=3919–3962 | pmid=24400737 | doi=10.1021/cr400415k | pmc=3981943}}</ref> उदाहरण के लिए, हीमोग्लोबिन के ऊतक (जीव विज्ञान) को प्रभावी ढंग से ऑक्सीजन पहुंचाने की क्षमता हीम अणु के पास स्थित विशिष्ट अमीनो एसिड अवशेषों के कारण होती है।<ref>{{cite journal | last=Thom|first= C. S.| title=हीमोग्लोबिन वेरिएंट: जैव रासायनिक गुण और नैदानिक सहसंबंध।| journal=Cold Spring Harbor Perspectives in Medicine | year=2013 | volume=3 | issue=3 | pages=a011858 | pmid=23388674 | doi=10.1101/cshperspect.a011858 | pmc=3579210}}</ref> जब पीएच अधिक होता है और कार्बन डाइऑक्साइड की सांद्रता कम होती है तो हीमोग्लोबिन ऊतकों में ऑक्सीजन मुक्त करता हैै। जब स्थिति विपरीत हो जाती है (कम पीएच और उच्च कार्बन डाइऑक्साइड सांद्रता), तब हीमोग्लोबिन ऊतकों में ऑक्सीजन छोड़ देता है। यह घटना, जिसमें कहा गया है कि हीमोग्लोबिन की ऑक्सीजन बाध्यकारी आत्मीयता अम्लता और कार्बन डाइऑक्साइड की सांद्रता दोनों के विपरीत आनुपातिक होती है, यह बोहर प्रभाव के रूप में जानी जाती है।<ref name=":2">{{cite journal|last=Bohr|author2=Hasselbalch, Krogh|title=एक जैविक रूप से महत्वपूर्ण संबंध के संबंध में - इसके ऑक्सीजन बंधन पर रक्त की कार्बन डाइऑक्साइड सामग्री का प्रभाव|url=http://www.udel.edu/chem/white/C342/Bohr%281904%29.html|url-status=live|archive-url=https://web.archive.org/web/20170418183908/http://www1.udel.edu/chem/white/C342/Bohr(1904).html|archive-date=2017-04-18}}</ref> इस प्रभाव के पीछे आणविक तंत्र ग्लोबिन श्रृंखला का स्थैतिक संगठन है, हीम समूह के निकट स्थित एक हिस्टिडीन अवशेष, अम्लीय परिस्थितियों में सकारात्मक रूप से आवेशित हो जाता है (जो कार्यशील मांसपेशियों आदि में घुलित CO2 के कारण होता है) व हीम समूह से ऑक्सीजन मुक्त करता है।<ref>{{cite journal | last1=Ackers|first1= G. K.| last2=Holt| first2=J. M.|title=एक सममित टेट्रामर में असममित सहकारिता: मानव हीमोग्लोबिन।| journal=J. Biol. Chem. | year=2006 | volume=281 | issue=17 | pages=11441–3 | pmid=16423822 | doi=10.1074/jbc.r500019200|s2cid= 6696041| doi-access=free}}</ref> | |||
| Line 20: | Line 23: | ||
{| class="wikitable" | {| class="wikitable" | ||
| colspan=2| | | colspan=2| | ||
! [[Heme A]] | ! [[Heme A|हीम A]] | ||
! [[Heme B]] | ! [[Heme B|हीम B]] | ||
! [[Heme C]] | ! [[Heme C|हीम C]] | ||
! [[Heme O]] | ! [[Heme O|हीम O]] | ||
|- | |- | ||
| colspan=2| | | colspan=2|पबकेम नंबर | ||
| [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=7888115 7888115] | | [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=7888115 7888115] | ||
| [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=444098 444098] | | [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=444098 444098] | ||
| Line 31: | Line 34: | ||
| [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=6323367 6323367] | | [https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=6323367 6323367] | ||
|- | |- | ||
| colspan=2| | | colspan=2|रासायनिक सूत्र | ||
| C<sub>49</sub>H<sub>56</sub>O<sub>6</sub>N<sub>4</sub>Fe | | C<sub>49</sub>H<sub>56</sub>O<sub>6</sub>N<sub>4</sub>Fe | ||
| C<sub>34</sub>H<sub>32</sub>O<sub>4</sub>N<sub>4</sub>Fe | | C<sub>34</sub>H<sub>32</sub>O<sub>4</sub>N<sub>4</sub>Fe | ||
| Line 37: | Line 40: | ||
| C<sub>49</sub>H<sub>58</sub>O<sub>5</sub>N<sub>4</sub>Fe | | C<sub>49</sub>H<sub>58</sub>O<sub>5</sub>N<sub>4</sub>Fe | ||
|- | |- | ||
| | | C<sub>3</sub> पर कार्यात्मक समूह | ||
| rowspan=3|[[File:Porphyrine General Formula V.1.svg|140px]] | | rowspan=3|[[File:Porphyrine General Formula V.1.svg|140px]] | ||
| –CH(OH)CH<sub>2</sub>[[farnesene|Far]] | | –CH(OH)CH<sub>2</sub>[[farnesene|Far]] | ||
| Line 44: | Line 47: | ||
| –CH(OH)CH<sub>2</sub>[[farnesene|Far]] | | –CH(OH)CH<sub>2</sub>[[farnesene|Far]] | ||
|- | |- | ||
| | | C<sub>8</sub> पर कार्यात्मक समूह | ||
| –CH=CH<sub>2</sub> | | –CH=CH<sub>2</sub> | ||
| –CH=CH<sub>2</sub> | | –CH=CH<sub>2</sub> | ||
| Line 50: | Line 53: | ||
| –CH=CH<sub>2</sub> | | –CH=CH<sub>2</sub> | ||
|- | |- | ||
| | | C<sub>18</sub> पर कार्यात्मक समूह | ||
| [[formyl|–CH=O]] | | [[formyl|–CH=O]] | ||
| [[methyl|–CH<sub>3</sub>]] | | [[methyl|–CH<sub>3</sub>]] | ||
| Line 57: | Line 60: | ||
|} | |} | ||
[[Image:Heme b.svg|thumb|right|200px|हेम बी के फे-पोर्फिरिन सबयूनिट की संरचना।]] | [[Image:Heme b.svg|thumb|right|200px|हेम बी के फे-पोर्फिरिन सबयूनिट की संरचना।]] | ||
[[Image:Heme a.svg|thumb|200px|हेम ए के फे-पोर्फिरिन सबयूनिट की संरचना।<ref>{{cite journal | last1=Caughey |first1=W. S.| last2=Smythe | first2=G. E. | last3=O'Keeffe | first3= D. H. | last4=Maskasky | first4=J. E. | last5=Smith | first5=M. L. | title=साइटोक्रोम सी ऑक्सीडेज का हेम ए: संरचना और गुण: हेम्स बी, सी, और एस और डेरिवेटिव के साथ तुलना| journal=J. Biol. Chem.| year=1975| volume=250| issue=19| pages=7602–7622 |doi=10.1016/S0021-9258(19)40860-0| pmid=170266|doi-access=free}}</ref> हेम ए को हीम बी से संश्लेषित किया जाता है। दो अनुक्रमिक प्रतिक्रियाओं में 2-स्थिति में एक 17-हाइड्रॉक्सीएथिलफार्नेसिल की मात्रा को जोड़ा जाता है और 8-स्थिति में एक एल्डिहाइड जोड़ा जाता है।<ref>{{cite journal | last=Hegg |first=Eric L.| title=हेम एक सिंथेज़ हेम ए के फॉर्मिल समूह में आणविक ऑक्सीजन को शामिल नहीं करता है| journal=Biochemistry| year=2004 | volume=43 | issue=27 | pages= 8616–8624 | doi=10.1021/bi049056m | pmid=15236569}}</ref>]]सबसे | [[Image:Heme a.svg|thumb|200px|हेम ए के फे-पोर्फिरिन सबयूनिट की संरचना।<ref>{{cite journal | last1=Caughey |first1=W. S.| last2=Smythe | first2=G. E. | last3=O'Keeffe | first3= D. H. | last4=Maskasky | first4=J. E. | last5=Smith | first5=M. L. | title=साइटोक्रोम सी ऑक्सीडेज का हेम ए: संरचना और गुण: हेम्स बी, सी, और एस और डेरिवेटिव के साथ तुलना| journal=J. Biol. Chem.| year=1975| volume=250| issue=19| pages=7602–7622 |doi=10.1016/S0021-9258(19)40860-0| pmid=170266|doi-access=free}}</ref> हेम ए को हीम बी से संश्लेषित किया जाता है। दो अनुक्रमिक प्रतिक्रियाओं में 2-स्थिति में एक 17-हाइड्रॉक्सीएथिलफार्नेसिल की मात्रा को जोड़ा जाता है और 8-स्थिति में एक एल्डिहाइड जोड़ा जाता है।<ref>{{cite journal | last=Hegg |first=Eric L.| title=हेम एक सिंथेज़ हेम ए के फॉर्मिल समूह में आणविक ऑक्सीजन को शामिल नहीं करता है| journal=Biochemistry| year=2004 | volume=43 | issue=27 | pages= 8616–8624 | doi=10.1021/bi049056m | pmid=15236569}}</ref>]]सबसे सामान्य प्रकार '''[[ हीम बी |हीम बी]]''' है, अन्य महत्वपूर्ण प्रकारों में [[ हीम ए |हीम ए]] और [[ हीम सी |हीम सी]] सम्मिलित हैं। पृथक हीम्स को सामान्यत: बड़े अक्षरों द्वारा नामित किया जाता है जबकि प्रोटीन से बंधे हीम्स को लघु अक्षरों द्वारा नामित किया जाता है। साइटोक्रोम ए [[ साइटोक्रोम सी ऑक्सीडेज |साइटोक्रोम सी ऑक्सीडेज]] का एक हिस्सा बनाने वाले झिल्ली प्रोटीन के साथ विशिष्ट संयोजन में हीम ए को संदर्भित करता है।<ref>{{cite journal | last=Yoshikawa |first=S.| title=गोजातीय हृदय साइटोक्रोम सी ऑक्सीडेज पर संरचनात्मक अध्ययन| journal=Biochim. Biophys. Acta| year=2012 | volume=1817 | issue=4 | pages= 579–589 | pmid=22236806 | doi=10.1016/j.bbabio.2011.12.012| doi-access=free }}</ref> | ||
=== अन्य हीम्स === | === अन्य हीम्स === | ||
: | :''पोर्फिरीन की निम्नलिखित कार्बन क्रमांकन प्रणाली जैव रसायनज्ञों द्वारा उपयोग की जाने वाली एक पुरानी संख्या है, न कि IUPAC द्वारा अनुशंसित 1-24 क्रमांकन प्रणाली जो ऊपर दी गई तालिका में दिखाई गई है।'' | ||
* ' | * '''''<nowiki/>'हीम एल'''''' हीम बी का व्युत्पन्न है जो सहसंयोजक रूप से लैक्टोपरोक्सीडेज, ईोसिनोफिल पेरोक्सीडेज और थायरॉयड पेरोक्सीडेज के प्रोटीन से जुड़ा होता है। ग्लूटामाइल-375 और लैक्टोपेरॉक्सीडेज के एस्पार्टिल-225 के साथ परऑक्सीडेज़ जोड़ने से इन अमीनो एसिड अवशेषों और हीम 1- और 5-मिथाइल समूहों के बीच क्रमशः एस्टर बंध बनते हैं।<ref name="pmid9774411"/> इन दो मिथाइल समूहों के साथ इसी तरह के एस्टर बंध ईोसिनोफिल और थायरॉयड पेरोक्सीडेस में बनते हैं। हेम एल पशु पेरोक्साइडस की एक महत्वपूर्ण विशेषता है, प्लांट पेरोक्सीडेज में हीम बी सम्मिलित होता है। लैक्टोपेरोक्सीडेज और ईोसिनोफिल पेरोक्सीडेज सुरक्षात्मक एंजाइम होते हैं जो हमलावर बैक्टीरिया और वायरस के विनाश के लिए जिम्मेदार होते हैं। थायराइड पेरोक्सीडेज महत्वपूर्ण थायराइड हार्मोन के जैवसंश्लेषण को उत्प्रेरित करने वाला एंजाइम है। चूंकि लैक्टोपरोक्सीडेज फेफड़ों और मलमूत्र में हमलावर जीवों को नष्ट कर देता है, इसलिए इसे एक महत्वपूर्ण सुरक्षात्मक एंजाइम माना जाता है।<ref>{{cite journal | last=Purdy|first= M.A.| title=लैक्टोपरोक्सीडेज-थियोसाइनेट-हाइड्रोजन पेरोक्साइड प्रणाली के लिए साल्मोनेला विजयी की संवेदनशीलता पर विकास चरण और सेल लिफाफा संरचना का प्रभाव| journal=Infect. Immun.| year=1983 | volume=39 | issue=3 | pages= 1187–95 |doi= 10.1128/IAI.39.3.1187-1195.1983| pmid=6341231 | pmc=348082}}</ref> | ||
* | * '''हीम एम''' माइलोपरोक्सीडेज के सक्रिय स्थल पर सहसंयोजक रूप से बंधे हीम बी का व्युत्पन्न है। हीम एम में हीम 1- और 5-मिथाइल समूह में दो एस्टर बंध होते हैं जो अन्य स्तनधारी पेरोक्सीडेस, जैसे लैक्टोपरोक्सीडेज और ईोसिनोफिल पेरोक्सीडेज के हीम एल में भी उपस्थित होते हैं। इसके अतिरिक्त, मेथियोनील एमिनो-एसिड अवशेषों के सल्फर और हीम 2-विनाइल समूह के बीच एक अद्वितीय सल्फोनामाइड्स आयन संयोजन बनता है, जिससे इस एंजाइम को हाइपोक्लोराइट और हाइपोब्रोमाइट के क्लोराइड और ब्रोमाइड आयनों से ऑक्सीकरण करने की अनूठी क्षमता मिलती है। माइलोपरऑक्सिडेज स्तनधारी न्यूट्रोफिल में उपस्थित है और हमलावर बैक्टीरिया और वायरल कारकों के विनाश के लिए जिम्मेदार है। यह शायद गलती से हाइपोब्रोमाइट को संश्लेषित करता है। हाइपोक्लोराइट और हाइपोब्रोमाइट दोनों ही बहुत अभिक्रियाशील प्रजातियां हैं जो हैलोजेनेटेड न्यूक्लियोसाइड के उत्पादन के लिए जिम्मेदार हैं व उत्परिवर्तजन यौगिक हैं।<ref>{{cite journal | last=Ohshima|first= H.| title=सूजन-प्रेरित कार्सिनोजेनेसिस का रासायनिक आधार| journal=Arch. Biochem. Biophys. | year=2003 | volume=417 | issue=1 | pages= 3–11 | pmid=12921773 | doi=10.1016/s0003-9861(03)00283-2}}</ref><ref>{{cite journal | last=Henderson|first= J.P.| title=फागोसाइट्स मानव भड़काऊ ऊतक में 5-क्लोरोरासिल और 5-ब्रोमोरासिल, मायलोपरोक्सीडेज के दो उत्परिवर्तजन उत्पाद उत्पन्न करते हैं| journal=J. Biol. Chem. | year=2003 | volume=278 | issue=26 | pages= 23522–8 | pmid=12707270 | doi=10.1074/jbc.m303928200|s2cid= 19631565| doi-access=free }}</ref> | ||
* | * '''हीम डी''' हीम बी का एक अन्य व्युत्पन्न है, लेकिन इसमें प्रोपियोनिक अम्ल पार्श्व शृंखला 6 के कार्बन पर है, जो हाइड्रॉक्सिलेटेड भी है, एक γ-स्पिरोलैक्टोन बनाता है। रिंग III भी नए लैक्टोन समूह के लिए एक संरूपण ट्रांस में स्थिति 5 पर हाइड्रॉक्सिलेटेड है।<ref name="pmid8621527"/> हीम डी कम ऑक्सीजन तनाव पर कई प्रकार के जीवाणुओं के पानी में ऑक्सीजन की कमी का स्थान है।<ref>{{cite journal | last=Belevich|first= I.| title=एस्चेरिचिया कोलाई से साइटोक्रोम बीडी का ऑक्सीजन युक्त परिसर: स्थिरता और फोटोलेबिलिटी| journal=FEBS Letters| year=2005 | volume=579 | issue=21 | pages= 4567–70 | pmid=16087180 | doi=10.1016/j.febslet.2005.07.011|s2cid= 36465802}}</ref> | ||
* | * '''हीम एस''' 2-विनाइल समूह के स्थान पर स्थिति 2 पर फॉर्मल्डेहाइड समूह होने से हीम बी से संबंधित है। हीम एस समुद्री कृमियों की कुछ प्रजातियों के हीमोग्लोबिन में पाया जाता है। हीम बी और हीम एस की सही संरचनाओं को सबसे पहले जर्मन रसायनज्ञ हैंस फिशर ने स्पष्ट किया था।<ref>{{cite book | last1 = Fischer|first1=H. | last2 = Orth|first2=H. | title =पाइरोल की केमिस्ट्री| location = Liepzig | publisher = [[Ischemia Verlagsgesellschaft]] | date =1934 |title-link=पाइरोल की केमिस्ट्री}}</ref> | ||
साइटोक्रोम के नाम | साइटोक्रोम के नाम सामान्यत: (लेकिन हमेशा नहीं) उनमें उपस्थित हीम के प्रकार को दर्शाते हैं: साइटोक्रोम ए में हीम ए होता है व साइटोक्रोम सी में हीम सी होता है। इस '''सम्मेलन''' को पहली बार हीम ए की संरचना के प्रकाशन के साथ पेश किया गया हो सकता है। | ||
=== हीम के प्रकार को निर्दिष्ट करने के लिए | === हीम के प्रकार को निर्दिष्ट करने के लिए दीर्घ अक्षरों का प्रयोग === | ||
पुस्टिनेन और विकस्ट्रॉम द्वारा एक पेपर में | पुस्टिनेन और विकस्ट्रॉम द्वारा एक पेपर में पाद टिप्पणी में दीर्घ अक्षरों के साथ हीम्स को नामित करने की प्रथा को औपचारिक रूप दिया गया था।<ref>{{cite journal |pmid=2068092|pmc=52034|title=Escherichia coli . से साइटोक्रोम ओ के हीम समूह|author = Puustinen A, Wikström M. | journal = Proc. Natl. Acad. Sci. U.S.A. | volume = 88 |issue=14| pages = 6122–6 | year = 1991 |bibcode=1991PNAS...88.6122P|doi=10.1073/pnas.88.14.6122|doi-access=free}}</ref> जो यह बताता है कि किन परिस्थितियों में एक दीर्घ अक्षर का उपयोग किया जाना चाहिए। "हम हीम संरचना को पृथक रूप में वर्णित करने के लिए दीर्घ अक्षरों के उपयोग को पसंद करते हैं। लघु अक्षरों को तब साइटोक्रोम और एंजाइमों के लिए स्वतंत्र रूप से उपयोग किया जा सकता है, साथ ही व्यक्तिगत प्रोटीन-बाध्य हीम समूहों (उदाहरण के लिए, साइटोक्रोम बीसी, और एए<sub>3</sub> कॉम्प्लेक्स, साइटोक्रोम बी<sub>5</sub>, बीसी<sub>1</sub> कॉम्प्लेक्स का हीम सी1, ए<sub>3</sub> कॉम्प्लेक्स का हीम एए<sub>3</sub>) का वर्णन करने के लिए उपयोग किया जा सकता है। दूसरे शब्दों में, रासायनिक यौगिक को एक दीर्घ अक्षर के साथ नामित किया जाएगा (लेकिन लघु वाली संरचनाओं में विशिष्ट उदाहरण)। इस प्रकार साइटोक्रोम ऑक्सीडेज, जिसमें दो ए हीम्स (हीम ए और हीम ए<sub>3</sub>) होते हैं। इसकी संरचना में, प्रति मोल प्रोटीन में हीम A के दो मोल होते हैं। साइटोक्रोम बीसी<sub>1</sub>, हेम्स बी के साथ<sub>H</sub>, बी<sub>L</sub>, और सी<sub>1</sub>, में हीम B और हीम C 2:1 के अनुपात में होते हैं। ऐसा लगता है कि यह प्रथा कॉघी और यॉर्क द्वारा एक पेपर में उत्पन्न हुई है जिसमें साइटोक्रोम एए 3 के हीम के लिए एक नई अलगाव प्रक्रिया के उत्पाद को पिछली तैयारियों से अलग करने के लिए हीम ए नामित किया गया था। हमारा उत्पाद हीम के साथ सभी तरह से समान नहीं है। पहले से पृथक (2) के रूप में हेमिन ए की कमी से अन्य श्रमिकों द्वारा समाधान में प्राप्त किया गया। इस कारण से, हम अपने उत्पाद हीम ए को तब तक नामित करेंगे जब तक कि स्पष्ट अंतरों को युक्तिसंगत नहीं बनाया जा सकता।<ref>{{cite journal | title=बीफ दिल की मांसपेशी से साइटोक्रोम ऑक्सीडेज के हरे रंग के हीम के अलगाव और कुछ गुण।|vauthors=Caughey WS, York JL| journal = J. Biol. Chem. | volume = 237 | pages = 2414–6 | year = 1962 |issue=7|doi=10.1016/S0021-9258(19)63456-3| pmid=13877421 |doi-access=free}}</ref> बाद के पेपर में,<ref>{{cite journal |title=साइटोक्रोम सी ऑक्सीडेज का हेम ए। संरचना और गुण: हेम्स बी, सी, और एस और डेरिवेटिव के साथ तुलना|vauthors=Caughey WS, Smythe GA, O'Keeffe DH, Maskasky JE, Smith ML| journal = J. Biol. Chem. | volume = 250 |issue = 19 | pages = 7602–22 | year = 1975 |doi=10.1016/S0021-9258(19)40860-0| pmid=170266|doi-access=free}}</ref> कॉघी का समूह पृथक हीम बी और सी के साथ-साथ ए के लिए दीर्घ अक्षरों का उपयोग करता है। | ||
== संश्लेषण == | == संश्लेषण == | ||
{{main| | {{main|पोर्फिरिन#संश्लेषण}} | ||
{{Further| | {{Further|कोबालिन जैवसंश्लेषण}} | ||
[[Image:Heme synthesis.svg|center|thumb|660px|साइटोप्लाज्म और माइटोकॉन्ड्रियन में हीम संश्लेषण]] | [[Image:Heme synthesis.svg|center|thumb|660px|साइटोप्लाज्म और माइटोकॉन्ड्रियन में हीम संश्लेषण]]हीम का उत्पादन करने वाली एंजाइमेटिक प्रक्रिया को पोर्फिरिन संश्लेषण कहा जाता है, क्योंकि सभी मध्यवर्ती टेट्रापाइरोल होते हैं जिन्हें रासायनिक रूप से पोर्फिरिन के रूप में वर्गीकृत किया जाता है। जीव विज्ञान में यह प्रक्रिया अत्यधिक संरक्षित है। मनुष्यों में, यह मार्ग लगभग विशेष रूप से हीम बनाने का कार्य करता है। बैक्टीरिया में, यह अधिक जटिल पदार्थ जैसे [[ कॉफ़ेक्टर F430 |कॉफ़ेक्टर F430]] और कोबालिन (विटामिन B<sub>12</sub>) भी उत्पन्न करता है।<ref>{{cite journal |doi=10.1039/B002635M |title = टेट्रापायरोल्स: जीवन के वर्णक|year = 2000|last1 = Battersby|first1 = Alan R.|journal = Natural Product Reports|volume = 17|issue = 6|pages = 507–526|pmid = 11152419}} | ||
</ref> | </ref> | ||
मार्ग | मार्ग का प्रारंभ साइट्रिक एसिड चक्र (क्रेब्स चक्र) से अमीनो एसिड ग्लाइसिन और स्यूसिनाइल-सीओए से δ-एमिनोलेवुलिनिक अम्ल (dALA या δALA) के संश्लेषण द्वारा की जाती है। इस प्रक्रिया के लिए जिम्मेदार दर-सीमित एंजाइम, एएलए सिंथेज़, ग्लूकोज और हीम एकाग्रता द्वारा नकारात्मक रूप से नियंत्रित होता है। हेम या हेमिन द्वारा एएलए का निषेध, तंत्र एमआरएनए संश्लेषण की स्थिरता को कम करके और माइटोकॉन्ड्रिया में एमआरएनए के सेवन को कम करके किया जा सकता है। यह तंत्र चिकित्सीय महत्व का तंत्र है: हीम आर्गिनेट या हेमेटिन और ग्लूकोज का आसव एएलए सिंथेज़ के प्रतिलेखन को कम करके, प्रक्रिया के चयापचय की जन्मजात त्रुटि वाले रोगियों में तीव्र आंतरायिक पोरफाइरिया के हमलों को रोक सकता है।<ref>{{cite thesis|url=http://escholarship.umassmed.edu/gsbs_diss/121/|title=ग्लूटेथिमाइड और 4,6-डाइऑक्सोहेप्टानोइक एसिड द्वारा हेम पाथवे एंजाइम एएलए सिंथेज़ -1 का अपग्रेडेशन और ग्लूकोज और हेम द्वारा डाउनरेगुलेशन: एक शोध प्रबंध|first=Kolluri|last=Sridevi|date=28 April 2018|journal=EScholarship@UMMS|access-date=28 April 2018|url-status=live|archive-url=https://web.archive.org/web/20160808080738/http://escholarship.umassmed.edu/gsbs_diss/121/|archive-date=8 August 2016|doi=10.13028/yyrz-qa79|publisher=University of Massachusetts Medical School}}</ref> | ||
हीम संश्लेषण में मुख्य रूप से | |||
हीम संश्लेषण में मुख्य रूप से सम्मिलित अंग हैं यकृत (जिसमें संश्लेषण की दर अत्यधिक परिवर्तनशील होती है, प्रणालीगत हीम निकाय पर निर्भर करती है) और अस्थि मज्जा (जिसमें हेम के संश्लेषण की दर अपेक्षाकृत स्थिर होती है और ग्लोबिन श्रृंखला के उत्पादन पर निर्भर करती है), हालांकि हर कोशिका को ठीक से काम करने के लिए हीम की आवश्यकता होती है। हालांकि, इसके जहरीले गुणों के कारण, हेमोपेक्सिन (Hx) जैसे प्रोटीन को संश्लेषण में उपयोग किए जाने के लिए लोहे के भौतिक भंडार को बनाए रखने में मदद करने की आवश्यकता होती है।<ref name="ReferenceA">{{cite journal|last1=Kumar|first1=Sanjay|last2=Bandyopadhyay|first2=Uday|title=मानव में मुक्त हीम विषाक्तता और इसकी विषहरण प्रणाली|journal=Toxicology Letters|date=July 2005|volume=157|issue=3|pages=175–188|doi=10.1016/j.toxlet.2005.03.004|pmid=15917143}}</ref> हेम को (रक्तिम पित्तवर्णकता) बिलीरुबिन चयापचय की प्रक्रिया में हीमोग्लोबिन के अपचय में एक मध्यवर्ती अणु के रूप में देखा जाता है। हीम के संश्लेषण में विभिन्न एंजाइमों में दोष पोर्फिरिया नामक विकार के समूह को जन्म दे सकता है, इनमें तीव्र आंतरायिक पोरफाइरिया, जन्मजात लोहितकोशिकाजनन पोरफाइरिया, विलंबित त्वक् पॉर्फिरीनता, अनुवांशिक कोप्रोपोर्फिरिया, वेरिगेट पोर्फिरीया, लोहितकोशिकाजनन प्रोटोपोर्फिरिया सम्मिलित हैं।<ref>{{Cite journal|last1=Puy|first1=Hervé|last2=Gouya|first2=Laurent|last3=Deybach|first3=Jean-Charles|date=March 2010|title=पोर्फाईरिया|url=https://linkinghub.elsevier.com/retrieve/pii/S0140673609619255|journal=The Lancet|language=en|volume=375|issue=9718|pages=924–937|doi=10.1016/S0140-6736(09)61925-5|pmid=20226990|s2cid=208791867}}</ref>{{Citation needed|date=December 2016}} | |||
== भोजन के लिए संश्लेषण == | == भोजन के लिए संश्लेषण == | ||
इम्पॉसिबल फूड्स, प्लांट-आधारित मीट एनालॉग्स के निर्माता, सोयाबीन रूट लेगहीमोग्लोबिन और | इम्पॉसिबल फूड्स, प्लांट-आधारित मीट एनालॉग्स के निर्माता, सोयाबीन रूट लेगहीमोग्लोबिन और यीस्ट को सम्मिलित करते हुए एक त्वरित हीम संमिश्रण प्रक्रिया का उपयोग करते हैं, जिसके परिणामस्वरूप हीम को मांसरहित (शाकाहारी) इम्पॉसिबल बर्गर पैटीज़ जैसी वस्तुओं में मिलाते हैं। लेगहीमोग्लोबिन उत्पादन के लिए डीएनए, सोयाबीन रूट ग्रंथि से निकाला गया था और मांस रहित बर्गर में उपयोग के लिए, हीम का अधिक उत्पादन करने के लिए खमीर कोशिकाओं में अभिव्यक्त किया गया था <ref>{{Cite journal|last1=Fraser|first1=Rachel Z.|last2=Shitut|first2=Mithila|last3=Agrawal|first3=Puja|last4=Mendes|first4=Odete|last5=Klapholz|first5=Sue|date=2018-04-11|title=सोया लेगहीमोग्लोबिन प्रोटीन की तैयारी का सुरक्षा मूल्यांकन पिचिया पेस्टोरिस से प्राप्त, संयंत्र-आधारित मांस में एक स्वाद उत्प्रेरक के रूप में उपयोग के लिए अभिप्रेत है|journal=International Journal of Toxicology|language=en-US|volume=37|issue=3|pages=241–262|doi=10.1177/1091581818766318|issn=1091-5818|pmc=5956568|pmid=29642729}}</ref> यह प्रक्रिया परिणामी उत्पादों में मांस का स्वाद लाने का दावा करती है।<ref>{{cite magazine|url=https://www.wired.com/story/the-impossible-burger/|title=नकली मांस के अजीब विज्ञान के अंदर 'खून'|date=2017-09-20|magazine=Wired|access-date=28 April 2018|url-status=live|archive-url=https://web.archive.org/web/20180324042337/https://www.wired.com/story/the-impossible-burger/|archive-date=24 March 2018}}</ref><ref>{{Cite news|url=https://www.economist.com/technology-quarterly/2015/03/05/silicon-valley-gets-a-taste-for-food|title=सिलिकॉन वैली को मिलता है खाने का स्वाद|date=2015-03-05|newspaper=The Economist|access-date=2019-04-08|issn=0013-0613}}</ref> | ||
== गिरावट == | == गिरावट == | ||
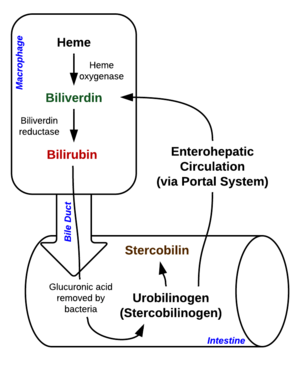
[[File:Heme Breakdown.png|thumb|हीम टूटना]] | [[File:Heme Breakdown.png|thumb|हीम टूटना]]प्लीहा के बृहत्भक्षकाणु (मैक्रोफेज) के अंदर गिरावट शुरू होती है, जो पुरानी और क्षतिग्रस्त लोहितकोशिका को परिसंचरण से हटा देती है। | ||
पहले चरण में, हीम को एंजाइम हीम ऑक्सीजनेज (HO) द्वारा | पहले चरण में, हीम को एंजाइम हीम ऑक्सीजनेज (HO) द्वारा हरित पित्तवर्णक में परिवर्तित किया जाता है।<ref>{{Cite journal|last=Maines|first=Mahin D.|date=July 1988|title=हेम ऑक्सीजनेज: कार्य, बहुलता, नियामक तंत्र, और नैदानिक अनुप्रयोग|url=https://onlinelibrary.wiley.com/doi/abs/10.1096/fasebj.2.10.3290025|journal=The FASEB Journal|language=en|volume=2|issue=10|pages=2557–2568|doi=10.1096/fasebj.2.10.3290025|pmid=3290025|s2cid=22652094 |issn=0892-6638}}</ref> एनएडीपीएच को कम करने वाले एजेंट के रूप में प्रयोग किया जाता है, आणविक ऑक्सीजन प्रतिक्रिया में प्रवेश करती है, कार्बन मोनोऑक्साइड (CO) का उत्पादन होता है और लोहे को फेरस आयन (Fe<sup>2+</sup>) के रूप में अणु से मुक्त किया जाता है।<ref>{{Cite book|title = लेहनिंगर के जैव रसायन के सिद्धांत|edition = 5th|publisher = W. H. Freeman and Company|year = 2008|isbn = 978-0-7167-7108-1|location = New York|pages = [https://archive.org/details/lehningerprincip00lehn_1/page/876 876]|url-access = registration|url = https://archive.org/details/lehningerprincip00lehn_1/page/876}}</ref> CO एक कोशिकीय संदेशवाहक के रूप में कार्य करता है व वाहिका विस्फारण के रूप में भी कार्य करता है।<ref>{{cite journal | last=Hanafy|first= K.A.| title=कार्बन मोनोऑक्साइड और मस्तिष्क: हठधर्मिता पर पुनर्विचार करने का समय।| journal= Curr. Pharm. Des.| year=2013 | volume=19 | issue=15 | pages= 2771–5 | pmid=23092321 | doi=10.2174/1381612811319150013 | pmc=3672861}}</ref> इसके अलावा, हीम की गिरावट ऑक्सीकृत तनाव के लिए एक क्रमिक रूप से संरक्षित अभिक्रिया प्रतीत होती है। संक्षेप में, जब कोशिकाओं को मुक्त कणों के संपर्क में लाया जाता है, तो तनाव-उत्तरदायी हीम ऑक्सीजनेज-1(HMOX1) समएंजाइम की अभिव्यक्ति का तेजी से समावेश होता है जो हीम को अपचयित करता है (नीचे देखें)।<ref>{{cite journal | last1=Abraham|first1=N.G.| last2=Kappas | first2=A. | title=हीम ऑक्सीजनेज के औषधीय और नैदानिक पहलू।| journal= Pharmacol. Rev. | year=2008 | volume=60 | issue=1 | pages= 79–127 | pmid=18323402 | doi=10.1124/pr.107.07104|s2cid=12792155|url=https://semanticscholar.org/paper/3b7e4405abd6e65b540c7b777a35210fe44644b8}}</ref> ऑक्सीकृत तनाव के जवाब में कोशिकाओं को हीम को नीचा दिखाने की उनकी क्षमता में तेजी से वृद्धि होने का कारण स्पष्ट नहीं है, लेकिन यह एक साइटोप्रोटेक्टिव अभिक्रिया का एक भाग प्रतीत होता है जो मुक्त हीम के हानिकारक प्रभावों से बचाता है। जब अधिक मात्रा में मुक्त हीम जमा हो जाता है, तो हीम निर्विषीकरण/अधःपतन निकाय अभिभूत हो जाते हैं, जिससे हीम इसके हानिकारक प्रभावों को लागू करने में सक्षम हो जाता है।<ref name="ReferenceA" /> | ||
इसके अलावा, हीम की गिरावट | |||
{{Enzymatic Reaction | {{Enzymatic Reaction | ||
| forward_enzyme=[[ | | forward_enzyme=[[हीम ऑक्सीजनेज-1]] | ||
| reverse_enzyme= | | reverse_enzyme= | ||
| substrate= | | substrate=हीम | ||
| product=[[ | | product=[[हरित पित्तवर्णक]] + Fe<sup>2+</sup> | ||
| reaction_direction_(forward/reversible/reverse)=forward | | reaction_direction_(forward/reversible/reverse)=forward | ||
| minor_forward_substrate(s)= H<sup>+</sup> + [[NADPH]] + O<sub>2</sub> | | minor_forward_substrate(s)= H<sup>+</sup> + [[NADPH]] + O<sub>2</sub> | ||
| Line 103: | Line 107: | ||
| product_image=Biliverdin3.svg | | product_image=Biliverdin3.svg | ||
| product_image_size=150px}} | | product_image_size=150px}} | ||
दूसरी | दूसरी अभिक्रिया में, बिलीवर्डिन रिडक्टेस (BVR) द्वारा बिलीरुबिन को बिलीरुबिन में बदल दिया जाता है:<ref name="pmid18276984">{{cite journal |last1 = Florczyk |first1=U.M. |last2=Jozkowicz |first2=A. |last3=Dulak |first3=J. | title = बिलीवर्डिन रिडक्टेस: एक पुराने एंजाइम की नई विशेषताएं और इसका संभावित चिकित्सीय महत्व| journal = Pharmacological Reports | volume = 60 | issue = 1 | pages = 38–48 | date = January–February 2008 | pmid = 18276984 | pmc = 5536200 }}</ref> | ||
{{Enzymatic Reaction | {{Enzymatic Reaction | ||
| forward_enzyme=[[ | | forward_enzyme=[[बिलीवरडीन रिडक्टेस]] | ||
| reverse_enzyme= | | reverse_enzyme= | ||
| substrate=[[ | | substrate=[[हरित पित्तवर्णक]] | ||
| product=[[ | | product=[[हरित पित्तवर्णक]] | ||
| reaction_direction_(forward/reversible/reverse)=forward | | reaction_direction_(forward/reversible/reverse)=forward | ||
| minor_forward_substrate(s)= H<sup>+</sup> + [[NADPH]] | | minor_forward_substrate(s)= H<sup>+</sup> + [[NADPH]] | ||
| Line 118: | Line 122: | ||
| product_image=Bilirubin_ZZ.png | | product_image=Bilirubin_ZZ.png | ||
| product_image_size=150px}} | | product_image_size=150px}} | ||
रक्तिम पित्तवर्णकता को एक प्रोटीन (सीरम एल्ब्यूमिन) से बंधे सुगम प्रसार द्वारा यकृत में ले जाया जाता है, जहां यह अधिक पानी में घुलनशील बनने के लिए ग्लुकुरोनिक अम्ल के साथ संयुग्मित होता है। अभिक्रिया एंजाइम यूडीपी-ग्लुकुरोनोसिलट्रांसफेरेज द्वारा उत्प्रेरित होती है।<ref>{{cite journal |doi=10.2174/1389200003339171 |title=यूडीपी-ग्लुकुरोनोसिलट्रांसफेरस|year=2000 |last1=King |first1=C. |last2=Rios |first2=G. |last3=Green |first3=M. |last4=Tephly |first4=T. |journal=Current Drug Metabolism |volume=1 |issue=2 |pages=143–161 |pmid=11465080 }}</ref> | |||
{{Enzymatic Reaction | {{Enzymatic Reaction | ||
| forward_enzyme=UDP | | forward_enzyme=UDP | ||
[[यूडीपी-ग्लुकुरोनोसिलट्रांसफेरेज]] | |||
| reverse_enzyme= | | reverse_enzyme= | ||
| substrate=[[ | | substrate=[[हरित पित्तवर्णक]] | ||
| product=[[ | | product=[[बिलीरुबिन डिग्लुकुरोनाइड]] | ||
| reaction_direction_(forward/reversible/reverse)=forward | | reaction_direction_(forward/reversible/reverse)=forward | ||
| minor_forward_substrate(s)= 2 [[Uridine diphosphate glucuronic acid|UDP-glucuronide]] | | minor_forward_substrate(s)= 2 [[Uridine diphosphate glucuronic acid|UDP-glucuronide]] | ||
| Line 134: | Line 139: | ||
| product_image=Bilirubin_diglucuronide.svg | | product_image=Bilirubin_diglucuronide.svg | ||
| product_image_size=250px}} | | product_image_size=250px}} | ||
रक्तिम पित्तवर्णकता का यह रूप यकृत से पित्त में उत्सर्जित होता है। यकृत से पित्त नलिका में रक्तिम पित्तवर्णकता का उत्सर्जन एक सक्रिय, ऊर्जा-निर्भर और सीमित-दर प्रक्रिया है। आंतों के बैक्टीरिया रक्तिम पित्तवर्णकता डिग्लुकुरोनाइड को विघटित करते हैं और रक्तिम पित्तवर्णकता को यूरोबिलिनोजेन्स में परिवर्तित करता है। कुछ यूरोबिलिनोजेन को आंतों की कोशिकाओं द्वारा अवशोषित किया जाता है और गुर्दे में ले जाया जाता है और मूत्र के साथ उत्सर्जित किया जाता है (यूरोबिलिन, जो यूरोबिलिनोजेन के ऑक्सीकरण का उत्पाद है, और मूत्र के पीले रंग के लिए जिम्मेदार है)। शेष पाचन तंत्र में जाता है और स्टर्कोबिलिनोजेन में परिवर्तित हो जाता है। यह स्टर्कोबिलिन में ऑक्सीकृत होता है और मल के भूरे रंग के लिए जिम्मेदार होता है।<ref>{{Cite web|url=https://www.thoughtco.com/why-is-urine-yellow-feces-brown-606813|title=मूत्र और मल के रंग के लिए जिम्मेदार रसायन|last=Helmenstine|first=Anne Marie |website=ThoughtCo|language=en|access-date=2020-01-24}}</ref> | |||
== स्वास्थ्य और रोग में == | == स्वास्थ्य और रोग में == | ||
धातुसाम्य के अनुसार, हीम की प्रतिक्रियाशीलता को हीमोप्रोटीन के "हीम पॉकेट्स" में डालकर नियंत्रित किया जा सकता है।{{Citation needed|date=December 2016}} ऑक्सीकृत तनाव के कारण, कुछ हीमोप्रोटीन जैसे हीमोग्लोबिन, उनके कृत्रिम हीम समूहों को मुक्त कर सकता है।<ref>{{cite journal | last1 = Bunn | first1 = H. F. | last2 = Jandl | first2 = J. H. | date = Sep 1966 | title = हीमोग्लोबिन अणुओं के बीच हीम का आदान-प्रदान| journal = Proc. Natl. Acad. Sci. USA | volume = 56 | issue = 3| pages = 974–978 | pmid = 5230192 | doi = 10.1073/pnas.56.3.974 | pmc=219955| bibcode = 1966PNAS...56..974B | doi-access = free }}</ref><ref>{{cite journal | last1 = Smith | first1 = M. L. | last2 = Paul | first2 = J. | last3 = Ohlsson | first3 = P. I. | last4 = Hjortsberg | first4 = K. | last5 = Paul | first5 = K. G. | date = Feb 1991 | title = गैर-विघटनकारी परिस्थितियों में हीम-प्रोटीन विखंडन| journal = Proc. Natl. Acad. Sci. USA | volume = 88 | issue = 3| pages = 882–886 | pmid = 1846966 | doi=10.1073/pnas.88.3.882| bibcode = 1991PNAS...88..882S | pmc=50918| doi-access = free }}</ref> इस तरह से प्राप्त गैर-प्रोटीन-बाध्य (मुक्त) हीम अत्यधिक कोशिका विषी बन जाता है, संभवतः इसकी प्रोटोपोर्फिरिन IX रिंग के अंदर निहित लौह परमाणु के कारण, जो एक मुक्त तरीके से मुक्त कणों के उत्पादन को उत्प्रेरित करने के लिए फेंटन के अभिकर्मक के रूप में कार्य कर सकता है।<ref>{{cite journal |last1=Everse |first=J. |first2=N. |last2=Hsia | title = देशी और संशोधित हीमोग्लोबिन की विषाक्तता| journal = Free Radical Biology and Medicine | volume = 22 | issue = 6 | pages = 1075–1099 |date=1197 | pmid = 9034247 | doi = 10.1016/S0891-5849(96)00499-6 }}</ref> यह प्रोटीन के ऑक्सीकरण और एकत्रीकरण को उत्प्रेरित करता है, लिपिड परॉक्सीकरण के माध्यम से कोशिका विषी लिपिड पेरोक्साइड का निर्माण करता है और ऑक्सीकृत तनाव के माध्यम से डीएनए को नुकसान पहुंचाता है। अपने '''वसारागी''' (लिपोफिलिक) गुणों के कारण, यह माइटोकॉन्ड्रिया और नाभिक जैसे जीवों में द्विपरत लिपिड को बाधित करता है।<ref>{{cite journal|last1=Kumar|first1=Sanjay|last2=Bandyopadhyay|first2=Uday|title=मनुष्यों में मुक्त हीम विषाक्तता और इसकी विषहरण प्रणाली|journal=Toxicology Letters|date=July 2005|volume=157|issue=3|pages=175–188|doi=10.1016/j.toxlet.2005.03.004|pmid=15917143}}</ref> मुक्त हीम के ये गुण मुख्य-उत्तेजक क्रियाप्रेरक के जवाब में क्रमादेशित कोशिका मृत्यु से गुजरने के लिए विभिन्न प्रकार की कोशिका को संवेदनशील बना सकते हैं, जो एक हानिकारक प्रभाव है। एक हानिकारक प्रभाव जो मलेरिया और सेप्सिस जैसे कुछ सूजन संबंधी रोगों के रोगजनन में महत्वपूर्ण भूमिका निभाता है।<ref name="pmid17496899">{{cite journal |last1=Pamplona |first1=A. |last2=Ferreira |first2=A. |last3=Balla |first3=J. |last4=Jeney |first4=V. |last5=Balla |first5=G. |last6=Epiphanio |first6=S. |last7=Chora |first7=A. |last8=Rodrigues |first8=C. D. |last9=Gregoire |first9=I. P. |last10=Cunha-Rodrigues |first10=M. |last11=Portugal |first11=S. |last12=Soares |first12=M. P. |last13=Mota |first13=M. M. | title = हेम ऑक्सीजनेज -1 और कार्बन मोनोऑक्साइड प्रायोगिक सेरेब्रल मलेरिया के रोगजनन को दबाते हैं| journal = Nature Medicine | volume = 13 | issue = 6 | pages = 703–710 |date=Jun 2007 | pmid = 17496899 | doi = 10.1038/nm1586|s2cid=20675040 }}</ref><ref>{{Cite journal | |||
| pmid = 20881280 | | pmid = 20881280 | ||
| year = 2010 | | year = 2010 | ||
| Line 182: | Line 188: | ||
===कैंसर=== | ===कैंसर=== | ||
मांस से प्राप्त हीम आयरन | मांस के अधिक सेवन से प्राप्त हीम आयरन और पेट के कैंसर के बढ़ते जोखिम के बीच एक संबंध है।<ref>{{Cite journal | journal = Cancer Prev. Res. | date = 2011 | volume = 4 | issue = 2 | pages = 177–184 | doi = 10.1158/1940-6207.CAPR-10-0113 | title = मांस से हीम आयरन और कोलोरेक्टल कैंसर का खतरा: एक मेटा-विश्लेषण और इसमें शामिल तंत्र की समीक्षा| last1 = Bastide | first1 = N. M. | last2 = Pierre | first2 = F. H. | last3 = Corpet | first3 = D. E. | pmid = 21209396 | s2cid = 4951579 | url = https://hal.archives-ouvertes.fr/file/index/docid/543808/filename/Bastide-Corpet-CAPR-2010-0113R1-Authors-V.pdf | url-status = live | archive-url = https://web.archive.org/web/20150925071420/https://hal.archives-ouvertes.fr/file/index/docid/543808/filename/Bastide-Corpet-CAPR-2010-0113R1-Authors-V.pdf | archive-date = 2015-09-25 }}</ref> लाल मांस में हीम मात्रा चिकन जैसे सफेद मांस की तुलना में 10 गुना अधिक होती है।<ref>{{cite journal|url=http://cancerpreventionresearch.aacrjournals.org/content/4/2/177|title=मांस से हेम आयरन और कोलोरेक्टल कैंसर का खतरा: एक मेटा-विश्लेषण और शामिल तंत्र की समीक्षा|first1=Nadia M.|last1=Bastide|first2=Fabrice H. F.|last2=Pierre|first3=Denis E.|last3=Corpet|date=1 February 2011|journal=Cancer Prevention Research|volume=4|issue=2|pages=177–184|access-date=28 April 2018|via=cancerpreventionresearch.aacrjournals.org|doi=10.1158/1940-6207.CAPR-10-0113|pmid=21209396|s2cid=4951579|url-status=live|archive-url=https://web.archive.org/web/20171011065331/http://cancerpreventionresearch.aacrjournals.org/content/4/2/177|archive-date=11 October 2017|doi-access=free}}</ref> 2019 की एक समीक्षा में पाया गया कि हीम आयरन का सेवन बढ़े हुए स्तन कैंसर के खतरे से जुड़ा है।<ref>{{cite journal|author=Chang, Vicky C; Cotterchio, Michelle; Khoo, Edwin|year=2019|title=आयरन का सेवन, शरीर में आयरन की स्थिति, और स्तन कैंसर का खतरा: एक व्यवस्थित समीक्षा और मेटा-विश्लेषण|journal=[[BMC Cancer]]|volume=19|issue=1|pages=543|doi=10.1186/s12885-019-5642-0|pmid=31170936|pmc=6555759}}</ref> | ||
| Line 189: | Line 195: | ||
निम्नलिखित जीन हीम बनाने के रासायनिक मार्ग का हिस्सा हैं: | निम्नलिखित जीन हीम बनाने के रासायनिक मार्ग का हिस्सा हैं: | ||
* ALAD: एमिनोलेवुलिनिक एसिड, δ-, डिहाइड्रैटेज़ (कमी से | * ALAD: एमिनोलेवुलिनिक एसिड, δ-, डिहाइड्रैटेज़ (कमी से अला-डिहाइड्रैटेज की कमी पोर्फिरीया होती है)<ref>{{cite journal|last1=Plewinska|first1=Magdalena|last2=Thunell|first2=Stig|last3=Holmberg|first3=Lars|last4=Wetmur|first4=James|last5=Desnick|first5=Robert|title=डेल्टा-एमिनोलेवुलिनेट डिहाइड्रैटेज डेफिसिट पोर्फिरीया: गंभीर रूप से प्रभावित होमोजाइगोट में आणविक घावों की पहचान|journal=American Journal of Human Genetics|date=1991|volume=49|issue=1|pages=167–174|pmid=2063868|pmc=1683193}}</ref> | ||
* ALAS1: एमिनोलेवुलिनेट, δ-, सिंथेज़ 1 | * ALAS1: एमिनोलेवुलिनेट, δ-, सिंथेज़ 1 | ||
* ALAS2: एमिनोलेवुलिनेट, δ-, सिंथेज़ 2 (कमी से साइडरोबलास्टिक/हाइपोक्रोमिक एनीमिया हो जाता है) | * ALAS2: एमिनोलेवुलिनेट, δ-, सिंथेज़ 2 (कमी से साइडरोबलास्टिक/हाइपोक्रोमिक एनीमिया हो जाता है) | ||
| Line 196: | Line 202: | ||
* HMBS (जीन): हाइड्रॉक्सीमिथाइलबिलेन सिंथेज़ (कमी के कारण तीव्र आंतरायिक पोरफाइरिया होता है)<ref>{{cite journal|last1=Bustad|first1=H. J.|last2=Vorland|first2=M.|last3=Ronneseth|first3=E.|last4=Sandberg|first4=S.|last5=Martinez|first5=A.|last6=Toska|first6=K.|title=तीव्र आंतरायिक पोरफाइरिया के साथ विभिन्न फेनोटाइपिक एसोसिएशन के साथ दो हाइड्रॉक्सीमेथाइलबिलेन सिंथेज़ म्यूटेंट, K132N और V215E का गठनात्मक स्थिरता और गतिविधि विश्लेषण|journal=Bioscience Reports|date=August 8, 2013|volume=33|issue=4|doi=10.1042/BSR20130045|pmid=23815679|pmc=3738108|pages=617–626}}</ref> | * HMBS (जीन): हाइड्रॉक्सीमिथाइलबिलेन सिंथेज़ (कमी के कारण तीव्र आंतरायिक पोरफाइरिया होता है)<ref>{{cite journal|last1=Bustad|first1=H. J.|last2=Vorland|first2=M.|last3=Ronneseth|first3=E.|last4=Sandberg|first4=S.|last5=Martinez|first5=A.|last6=Toska|first6=K.|title=तीव्र आंतरायिक पोरफाइरिया के साथ विभिन्न फेनोटाइपिक एसोसिएशन के साथ दो हाइड्रॉक्सीमेथाइलबिलेन सिंथेज़ म्यूटेंट, K132N और V215E का गठनात्मक स्थिरता और गतिविधि विश्लेषण|journal=Bioscience Reports|date=August 8, 2013|volume=33|issue=4|doi=10.1042/BSR20130045|pmid=23815679|pmc=3738108|pages=617–626}}</ref> | ||
* PPOX: प्रोटोपोर्फिरिनोजेन ऑक्सीडेज (की कमी से वेरिएगेट पोर्फिरीया होता है)<ref>{{cite journal|last1=Martinez di Montemuros|first1=F.|last2=Di Pierro|first2=E.|last3=Patti|first3=E.|last4=Tavazzi|first4=D.|last5=Danielli|first5=M. G.|last6=Biolcati|first6=G.|last7=Rocchi|first7=E.|last8=Cappllini|first8=M. D.|title=इटली में पोरफाइरिया का आणविक लक्षण वर्णन: एक नैदानिक प्रवाह-चार्ट|date=December 2002|volume=48|issue=8|pages=867–876}}</ref> | * PPOX: प्रोटोपोर्फिरिनोजेन ऑक्सीडेज (की कमी से वेरिएगेट पोर्फिरीया होता है)<ref>{{cite journal|last1=Martinez di Montemuros|first1=F.|last2=Di Pierro|first2=E.|last3=Patti|first3=E.|last4=Tavazzi|first4=D.|last5=Danielli|first5=M. G.|last6=Biolcati|first6=G.|last7=Rocchi|first7=E.|last8=Cappllini|first8=M. D.|title=इटली में पोरफाइरिया का आणविक लक्षण वर्णन: एक नैदानिक प्रवाह-चार्ट|date=December 2002|volume=48|issue=8|pages=867–876}}</ref> | ||
* UROD: | * UROD: यूरोपोर्फिरिनोजेन डीकार्बाक्सिलेज़ (कमी के कारण पोर्फिरीया कटानिया टार्डा होता है)<ref>{{cite journal|last1=Badenas|first1=C.|last2=To Figueras|first2=J.|last3=Phillips|first3=J. D.|last4=Warby|first4=C. A.|last5=Muñoz|first5=C.|last6=Herrero|first6=C.|title=पोर्फिरिया कटानिया टार्डा रोगियों और रिश्तेदारों की एक बड़ी श्रृंखला में उपन्यास यूरोपोर्फिरिनोजेन डिकार्बोक्सिलेज जीन उत्परिवर्तन की पहचान और लक्षण वर्णन|journal=Clinical Genetics|date=April 2009|volume=75|issue=4|pages=346–353|doi=10.1111/j.1399-0004.2009.01153.x|pmid=19419417|pmc=3804340}}</ref> | ||
* UROS: यूरोपोर्फिरिनोजेन III सिंथेज़ (कमी जन्मजात एरिथ्रोपोएटिक पोर्फिरीया का कारण बनती है) | * UROS: यूरोपोर्फिरिनोजेन III सिंथेज़ (कमी जन्मजात एरिथ्रोपोएटिक पोर्फिरीया का कारण बनती है) | ||
| Line 243: | Line 249: | ||
{{Enzyme cofactors}} | {{Enzyme cofactors}} | ||
{{Authority control}} | {{Authority control}} | ||
[[Category: Machine Translated Page]] | [[Category:AC with 0 elements]] | ||
[[Category: | [[Category:All articles with unsourced statements]] | ||
[[Category:Articles containing Ancient Greek (to 1453)-language text]] | |||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:Articles with short description]] | |||
[[Category:Articles with unsourced statements from December 2016]] | |||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:CS1 errors]] | |||
[[Category:CS1 maint]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:जैव-अणु]] | |||
[[Category:पोर्फिरीन]] | |||
[[Category:लोहा (द्वितीय) यौगिक]] | |||
[[Category:लौह परिसरों]] | |||
[[Category:सहकारक]] | |||
Latest revision as of 14:45, 24 November 2022
हीेम या हेम (उच्चारण HEEM), हीमोग्लोबिन का अग्रदूत है, जो रक्तप्रवाह में ऑक्सीजन को संगठित करने के लिए आवश्यक है। हीम अस्थि मज्जा और यकृत दोनों में जैवसंश्लेषित होता है।[1]
जैव रासायनिक शब्दों में, हीम एक समन्वय परिसर है जो "एक लोहे के आयन से मिलकर बना है व एक पॉरफाइरिन के लिए एक टेट्राडेंटेट लिगैंड और एक या द्वि अक्षीय लिगैंड के रूप में कार्य करता है।" [2] परिभाषा अस्पष्ट है और कई चित्रण अक्षीय लिगेंड को त्याग देते हैं।[3]मेटालोप्रोटीन द्वारा कृत्रिम समूहों के रूप में स्थित मेटालोपोर्फिरिन में, हीम सबसे व्यापक रूप से उपयोग किया जाता है।[4] जो प्रोटीन के एक परिवार को परिभाषित करता है जिसे हीमोप्रोटीन कहा जाता है। हीम को सामान्यत: हीमोग्लोबिन के घटकों के रूप में पहचाना जाता है, रक्त में लाल रंगद्रव्य, लेकिन कई अन्य जैविक रूप से महत्वपूर्ण हेमोप्रोटीन जैसे कि मायोग्लोबिन, साइटोक्रोमेस, कैटेलेज, हीम पेरोक्सीडेज और एंडोथेलियल नाइट्रिक ऑक्साइड सिंथेज़ में भी पाए जाते हैं।[5][6]
हेम शब्द ग्रीक αἷμα हाइमा से लिया गया है जिसका अर्थ है "रक्त"।
कार्य
हीमोप्रोटीन में विविध जैविक कार्य होते हैं जिनमें द्विपरमाणुक गैसों का परिवहन, रासायनिक उत्प्रेरण, द्विपरमाणुक गैस का पता लगाना और इलेक्ट्रॉन स्थानांतरण सम्मिलित हैं। हीम आयरन इलेक्ट्रॉन स्थानांतरण या रेडॉक्स रसायन के पर्यंत इलेक्ट्रॉनों के स्रोत या सिंक के रूप में कार्य करता है। परऑक्सीडेस अभिक्रिया में, पोर्फिरीन अणु एक इलेक्ट्रॉन स्रोत के रूप में भी कार्य करता है, जो संयुग्मित चक्र में मूल इलेक्ट्रॉनों को निरूपित करने में सक्षम होता है। द्विपरमाणुक गैसों के परिवहन या पता लगाने में, गैस हीम आयरन से बंध जाती है। द्विपरमाणुक गैसों का पता लगाने के पर्यंत, हीम आयरन के लिए संलग्नी गैस का बंधन आसपास के प्रोटीन में परिवर्तन को प्रेरित करता है।[7] सामान्य तौर पर, द्विपरमाणुक गैसें केवल फेरस Fe (II) के रूप में कम हीम से बंधती हैं, जबकि Fe (III) और Fe (IV) के बीच अधिकांश परआक्सीडेस चक्र और माइटोकॉन्ड्रियल रेडॉक्स व ऑक्सीकरण-कमी, Fe (II) और Fe(III) के बीच चक्र में सम्मिलित हीमोप्रोटीन है।
यह अनुमान लगाया गया है कि हीमोप्रोटीन का मूल विकासवादी कार्य आणविक ऑक्सीजन की उपस्थिति से पहले मूल साइनोबैक्टीरिया जैसे जीवों में प्राचीन सल्फर-आधारित प्रकाश संश्लेषण मार्गों में इलेक्ट्रॉन स्थानांतरण था।[8]
हीमोप्रोटीन प्रोटीन आधात्री के अंतर्गत हीम मैक्रोसायकल के वातावरण को संशोधित करके अपनी उल्लेखनीय कार्यात्मक विविधता प्राप्त करते हैं।[9] उदाहरण के लिए, हीमोग्लोबिन के ऊतक (जीव विज्ञान) को प्रभावी ढंग से ऑक्सीजन पहुंचाने की क्षमता हीम अणु के पास स्थित विशिष्ट अमीनो एसिड अवशेषों के कारण होती है।[10] जब पीएच अधिक होता है और कार्बन डाइऑक्साइड की सांद्रता कम होती है तो हीमोग्लोबिन ऊतकों में ऑक्सीजन मुक्त करता हैै। जब स्थिति विपरीत हो जाती है (कम पीएच और उच्च कार्बन डाइऑक्साइड सांद्रता), तब हीमोग्लोबिन ऊतकों में ऑक्सीजन छोड़ देता है। यह घटना, जिसमें कहा गया है कि हीमोग्लोबिन की ऑक्सीजन बाध्यकारी आत्मीयता अम्लता और कार्बन डाइऑक्साइड की सांद्रता दोनों के विपरीत आनुपातिक होती है, यह बोहर प्रभाव के रूप में जानी जाती है।[11] इस प्रभाव के पीछे आणविक तंत्र ग्लोबिन श्रृंखला का स्थैतिक संगठन है, हीम समूह के निकट स्थित एक हिस्टिडीन अवशेष, अम्लीय परिस्थितियों में सकारात्मक रूप से आवेशित हो जाता है (जो कार्यशील मांसपेशियों आदि में घुलित CO2 के कारण होता है) व हीम समूह से ऑक्सीजन मुक्त करता है।[12]
प्रकार
प्रमुख हीम्स
कई जैविक रूप से महत्वपूर्ण प्रकार के हीम हैं:
| हीम A | हीम B | हीम C | हीम O | ||
|---|---|---|---|---|---|
| पबकेम नंबर | 7888115 | 444098 | 444125 | 6323367 | |
| रासायनिक सूत्र | C49H56O6N4Fe | C34H32O4N4Fe | C34H36O4N4S2Fe | C49H58O5N4Fe | |
| C3 पर कार्यात्मक समूह | 
|
–CH(OH)CH2Far | –CH=CH2 | –CH(cystein-S-yl)CH3 | –CH(OH)CH2Far |
| C8 पर कार्यात्मक समूह | –CH=CH2 | –CH=CH2 | –CH(cystein-S-yl)CH3 | –CH=CH2 | |
| C18 पर कार्यात्मक समूह | –CH=O | –CH3 | –CH3 | –CH3 | |
सबसे सामान्य प्रकार हीम बी है, अन्य महत्वपूर्ण प्रकारों में हीम ए और हीम सी सम्मिलित हैं। पृथक हीम्स को सामान्यत: बड़े अक्षरों द्वारा नामित किया जाता है जबकि प्रोटीन से बंधे हीम्स को लघु अक्षरों द्वारा नामित किया जाता है। साइटोक्रोम ए साइटोक्रोम सी ऑक्सीडेज का एक हिस्सा बनाने वाले झिल्ली प्रोटीन के साथ विशिष्ट संयोजन में हीम ए को संदर्भित करता है।[15]
अन्य हीम्स
- पोर्फिरीन की निम्नलिखित कार्बन क्रमांकन प्रणाली जैव रसायनज्ञों द्वारा उपयोग की जाने वाली एक पुरानी संख्या है, न कि IUPAC द्वारा अनुशंसित 1-24 क्रमांकन प्रणाली जो ऊपर दी गई तालिका में दिखाई गई है।
- 'हीम एल' हीम बी का व्युत्पन्न है जो सहसंयोजक रूप से लैक्टोपरोक्सीडेज, ईोसिनोफिल पेरोक्सीडेज और थायरॉयड पेरोक्सीडेज के प्रोटीन से जुड़ा होता है। ग्लूटामाइल-375 और लैक्टोपेरॉक्सीडेज के एस्पार्टिल-225 के साथ परऑक्सीडेज़ जोड़ने से इन अमीनो एसिड अवशेषों और हीम 1- और 5-मिथाइल समूहों के बीच क्रमशः एस्टर बंध बनते हैं।[16] इन दो मिथाइल समूहों के साथ इसी तरह के एस्टर बंध ईोसिनोफिल और थायरॉयड पेरोक्सीडेस में बनते हैं। हेम एल पशु पेरोक्साइडस की एक महत्वपूर्ण विशेषता है, प्लांट पेरोक्सीडेज में हीम बी सम्मिलित होता है। लैक्टोपेरोक्सीडेज और ईोसिनोफिल पेरोक्सीडेज सुरक्षात्मक एंजाइम होते हैं जो हमलावर बैक्टीरिया और वायरस के विनाश के लिए जिम्मेदार होते हैं। थायराइड पेरोक्सीडेज महत्वपूर्ण थायराइड हार्मोन के जैवसंश्लेषण को उत्प्रेरित करने वाला एंजाइम है। चूंकि लैक्टोपरोक्सीडेज फेफड़ों और मलमूत्र में हमलावर जीवों को नष्ट कर देता है, इसलिए इसे एक महत्वपूर्ण सुरक्षात्मक एंजाइम माना जाता है।[17]
- हीम एम माइलोपरोक्सीडेज के सक्रिय स्थल पर सहसंयोजक रूप से बंधे हीम बी का व्युत्पन्न है। हीम एम में हीम 1- और 5-मिथाइल समूह में दो एस्टर बंध होते हैं जो अन्य स्तनधारी पेरोक्सीडेस, जैसे लैक्टोपरोक्सीडेज और ईोसिनोफिल पेरोक्सीडेज के हीम एल में भी उपस्थित होते हैं। इसके अतिरिक्त, मेथियोनील एमिनो-एसिड अवशेषों के सल्फर और हीम 2-विनाइल समूह के बीच एक अद्वितीय सल्फोनामाइड्स आयन संयोजन बनता है, जिससे इस एंजाइम को हाइपोक्लोराइट और हाइपोब्रोमाइट के क्लोराइड और ब्रोमाइड आयनों से ऑक्सीकरण करने की अनूठी क्षमता मिलती है। माइलोपरऑक्सिडेज स्तनधारी न्यूट्रोफिल में उपस्थित है और हमलावर बैक्टीरिया और वायरल कारकों के विनाश के लिए जिम्मेदार है। यह शायद गलती से हाइपोब्रोमाइट को संश्लेषित करता है। हाइपोक्लोराइट और हाइपोब्रोमाइट दोनों ही बहुत अभिक्रियाशील प्रजातियां हैं जो हैलोजेनेटेड न्यूक्लियोसाइड के उत्पादन के लिए जिम्मेदार हैं व उत्परिवर्तजन यौगिक हैं।[18][19]
- हीम डी हीम बी का एक अन्य व्युत्पन्न है, लेकिन इसमें प्रोपियोनिक अम्ल पार्श्व शृंखला 6 के कार्बन पर है, जो हाइड्रॉक्सिलेटेड भी है, एक γ-स्पिरोलैक्टोन बनाता है। रिंग III भी नए लैक्टोन समूह के लिए एक संरूपण ट्रांस में स्थिति 5 पर हाइड्रॉक्सिलेटेड है।[20] हीम डी कम ऑक्सीजन तनाव पर कई प्रकार के जीवाणुओं के पानी में ऑक्सीजन की कमी का स्थान है।[21]
- हीम एस 2-विनाइल समूह के स्थान पर स्थिति 2 पर फॉर्मल्डेहाइड समूह होने से हीम बी से संबंधित है। हीम एस समुद्री कृमियों की कुछ प्रजातियों के हीमोग्लोबिन में पाया जाता है। हीम बी और हीम एस की सही संरचनाओं को सबसे पहले जर्मन रसायनज्ञ हैंस फिशर ने स्पष्ट किया था।[22]
साइटोक्रोम के नाम सामान्यत: (लेकिन हमेशा नहीं) उनमें उपस्थित हीम के प्रकार को दर्शाते हैं: साइटोक्रोम ए में हीम ए होता है व साइटोक्रोम सी में हीम सी होता है। इस सम्मेलन को पहली बार हीम ए की संरचना के प्रकाशन के साथ पेश किया गया हो सकता है।
हीम के प्रकार को निर्दिष्ट करने के लिए दीर्घ अक्षरों का प्रयोग
पुस्टिनेन और विकस्ट्रॉम द्वारा एक पेपर में पाद टिप्पणी में दीर्घ अक्षरों के साथ हीम्स को नामित करने की प्रथा को औपचारिक रूप दिया गया था।[23] जो यह बताता है कि किन परिस्थितियों में एक दीर्घ अक्षर का उपयोग किया जाना चाहिए। "हम हीम संरचना को पृथक रूप में वर्णित करने के लिए दीर्घ अक्षरों के उपयोग को पसंद करते हैं। लघु अक्षरों को तब साइटोक्रोम और एंजाइमों के लिए स्वतंत्र रूप से उपयोग किया जा सकता है, साथ ही व्यक्तिगत प्रोटीन-बाध्य हीम समूहों (उदाहरण के लिए, साइटोक्रोम बीसी, और एए3 कॉम्प्लेक्स, साइटोक्रोम बी5, बीसी1 कॉम्प्लेक्स का हीम सी1, ए3 कॉम्प्लेक्स का हीम एए3) का वर्णन करने के लिए उपयोग किया जा सकता है। दूसरे शब्दों में, रासायनिक यौगिक को एक दीर्घ अक्षर के साथ नामित किया जाएगा (लेकिन लघु वाली संरचनाओं में विशिष्ट उदाहरण)। इस प्रकार साइटोक्रोम ऑक्सीडेज, जिसमें दो ए हीम्स (हीम ए और हीम ए3) होते हैं। इसकी संरचना में, प्रति मोल प्रोटीन में हीम A के दो मोल होते हैं। साइटोक्रोम बीसी1, हेम्स बी के साथH, बीL, और सी1, में हीम B और हीम C 2:1 के अनुपात में होते हैं। ऐसा लगता है कि यह प्रथा कॉघी और यॉर्क द्वारा एक पेपर में उत्पन्न हुई है जिसमें साइटोक्रोम एए 3 के हीम के लिए एक नई अलगाव प्रक्रिया के उत्पाद को पिछली तैयारियों से अलग करने के लिए हीम ए नामित किया गया था। हमारा उत्पाद हीम के साथ सभी तरह से समान नहीं है। पहले से पृथक (2) के रूप में हेमिन ए की कमी से अन्य श्रमिकों द्वारा समाधान में प्राप्त किया गया। इस कारण से, हम अपने उत्पाद हीम ए को तब तक नामित करेंगे जब तक कि स्पष्ट अंतरों को युक्तिसंगत नहीं बनाया जा सकता।[24] बाद के पेपर में,[25] कॉघी का समूह पृथक हीम बी और सी के साथ-साथ ए के लिए दीर्घ अक्षरों का उपयोग करता है।
संश्लेषण
हीम का उत्पादन करने वाली एंजाइमेटिक प्रक्रिया को पोर्फिरिन संश्लेषण कहा जाता है, क्योंकि सभी मध्यवर्ती टेट्रापाइरोल होते हैं जिन्हें रासायनिक रूप से पोर्फिरिन के रूप में वर्गीकृत किया जाता है। जीव विज्ञान में यह प्रक्रिया अत्यधिक संरक्षित है। मनुष्यों में, यह मार्ग लगभग विशेष रूप से हीम बनाने का कार्य करता है। बैक्टीरिया में, यह अधिक जटिल पदार्थ जैसे कॉफ़ेक्टर F430 और कोबालिन (विटामिन B12) भी उत्पन्न करता है।[26]
मार्ग का प्रारंभ साइट्रिक एसिड चक्र (क्रेब्स चक्र) से अमीनो एसिड ग्लाइसिन और स्यूसिनाइल-सीओए से δ-एमिनोलेवुलिनिक अम्ल (dALA या δALA) के संश्लेषण द्वारा की जाती है। इस प्रक्रिया के लिए जिम्मेदार दर-सीमित एंजाइम, एएलए सिंथेज़, ग्लूकोज और हीम एकाग्रता द्वारा नकारात्मक रूप से नियंत्रित होता है। हेम या हेमिन द्वारा एएलए का निषेध, तंत्र एमआरएनए संश्लेषण की स्थिरता को कम करके और माइटोकॉन्ड्रिया में एमआरएनए के सेवन को कम करके किया जा सकता है। यह तंत्र चिकित्सीय महत्व का तंत्र है: हीम आर्गिनेट या हेमेटिन और ग्लूकोज का आसव एएलए सिंथेज़ के प्रतिलेखन को कम करके, प्रक्रिया के चयापचय की जन्मजात त्रुटि वाले रोगियों में तीव्र आंतरायिक पोरफाइरिया के हमलों को रोक सकता है।[27]
हीम संश्लेषण में मुख्य रूप से सम्मिलित अंग हैं यकृत (जिसमें संश्लेषण की दर अत्यधिक परिवर्तनशील होती है, प्रणालीगत हीम निकाय पर निर्भर करती है) और अस्थि मज्जा (जिसमें हेम के संश्लेषण की दर अपेक्षाकृत स्थिर होती है और ग्लोबिन श्रृंखला के उत्पादन पर निर्भर करती है), हालांकि हर कोशिका को ठीक से काम करने के लिए हीम की आवश्यकता होती है। हालांकि, इसके जहरीले गुणों के कारण, हेमोपेक्सिन (Hx) जैसे प्रोटीन को संश्लेषण में उपयोग किए जाने के लिए लोहे के भौतिक भंडार को बनाए रखने में मदद करने की आवश्यकता होती है।[28] हेम को (रक्तिम पित्तवर्णकता) बिलीरुबिन चयापचय की प्रक्रिया में हीमोग्लोबिन के अपचय में एक मध्यवर्ती अणु के रूप में देखा जाता है। हीम के संश्लेषण में विभिन्न एंजाइमों में दोष पोर्फिरिया नामक विकार के समूह को जन्म दे सकता है, इनमें तीव्र आंतरायिक पोरफाइरिया, जन्मजात लोहितकोशिकाजनन पोरफाइरिया, विलंबित त्वक् पॉर्फिरीनता, अनुवांशिक कोप्रोपोर्फिरिया, वेरिगेट पोर्फिरीया, लोहितकोशिकाजनन प्रोटोपोर्फिरिया सम्मिलित हैं।[29][citation needed]
भोजन के लिए संश्लेषण
इम्पॉसिबल फूड्स, प्लांट-आधारित मीट एनालॉग्स के निर्माता, सोयाबीन रूट लेगहीमोग्लोबिन और यीस्ट को सम्मिलित करते हुए एक त्वरित हीम संमिश्रण प्रक्रिया का उपयोग करते हैं, जिसके परिणामस्वरूप हीम को मांसरहित (शाकाहारी) इम्पॉसिबल बर्गर पैटीज़ जैसी वस्तुओं में मिलाते हैं। लेगहीमोग्लोबिन उत्पादन के लिए डीएनए, सोयाबीन रूट ग्रंथि से निकाला गया था और मांस रहित बर्गर में उपयोग के लिए, हीम का अधिक उत्पादन करने के लिए खमीर कोशिकाओं में अभिव्यक्त किया गया था [30] यह प्रक्रिया परिणामी उत्पादों में मांस का स्वाद लाने का दावा करती है।[31][32]
गिरावट
प्लीहा के बृहत्भक्षकाणु (मैक्रोफेज) के अंदर गिरावट शुरू होती है, जो पुरानी और क्षतिग्रस्त लोहितकोशिका को परिसंचरण से हटा देती है।
पहले चरण में, हीम को एंजाइम हीम ऑक्सीजनेज (HO) द्वारा हरित पित्तवर्णक में परिवर्तित किया जाता है।[33] एनएडीपीएच को कम करने वाले एजेंट के रूप में प्रयोग किया जाता है, आणविक ऑक्सीजन प्रतिक्रिया में प्रवेश करती है, कार्बन मोनोऑक्साइड (CO) का उत्पादन होता है और लोहे को फेरस आयन (Fe2+) के रूप में अणु से मुक्त किया जाता है।[34] CO एक कोशिकीय संदेशवाहक के रूप में कार्य करता है व वाहिका विस्फारण के रूप में भी कार्य करता है।[35] इसके अलावा, हीम की गिरावट ऑक्सीकृत तनाव के लिए एक क्रमिक रूप से संरक्षित अभिक्रिया प्रतीत होती है। संक्षेप में, जब कोशिकाओं को मुक्त कणों के संपर्क में लाया जाता है, तो तनाव-उत्तरदायी हीम ऑक्सीजनेज-1(HMOX1) समएंजाइम की अभिव्यक्ति का तेजी से समावेश होता है जो हीम को अपचयित करता है (नीचे देखें)।[36] ऑक्सीकृत तनाव के जवाब में कोशिकाओं को हीम को नीचा दिखाने की उनकी क्षमता में तेजी से वृद्धि होने का कारण स्पष्ट नहीं है, लेकिन यह एक साइटोप्रोटेक्टिव अभिक्रिया का एक भाग प्रतीत होता है जो मुक्त हीम के हानिकारक प्रभावों से बचाता है। जब अधिक मात्रा में मुक्त हीम जमा हो जाता है, तो हीम निर्विषीकरण/अधःपतन निकाय अभिभूत हो जाते हैं, जिससे हीम इसके हानिकारक प्रभावों को लागू करने में सक्षम हो जाता है।[28]
| हीम | हीम ऑक्सीजनेज-1 | हरित पित्तवर्णक + Fe2+ | |

|

| ||
| H+ + NADPH + O2 | NADP+ + CO | ||

| |||
दूसरी अभिक्रिया में, बिलीवर्डिन रिडक्टेस (BVR) द्वारा बिलीरुबिन को बिलीरुबिन में बदल दिया जाता है:[37]
| हरित पित्तवर्णक | बिलीवरडीन रिडक्टेस | हरित पित्तवर्णक | |

|

| ||
| H+ + NADPH | NADP+ | ||

| |||
रक्तिम पित्तवर्णकता को एक प्रोटीन (सीरम एल्ब्यूमिन) से बंधे सुगम प्रसार द्वारा यकृत में ले जाया जाता है, जहां यह अधिक पानी में घुलनशील बनने के लिए ग्लुकुरोनिक अम्ल के साथ संयुग्मित होता है। अभिक्रिया एंजाइम यूडीपी-ग्लुकुरोनोसिलट्रांसफेरेज द्वारा उत्प्रेरित होती है।[38]
| हरित पित्तवर्णक | UDP | बिलीरुबिन डिग्लुकुरोनाइड | |

|

| ||
| 2 UDP-glucuronide | 2 UMP + 2 Pi | ||

| |||
रक्तिम पित्तवर्णकता का यह रूप यकृत से पित्त में उत्सर्जित होता है। यकृत से पित्त नलिका में रक्तिम पित्तवर्णकता का उत्सर्जन एक सक्रिय, ऊर्जा-निर्भर और सीमित-दर प्रक्रिया है। आंतों के बैक्टीरिया रक्तिम पित्तवर्णकता डिग्लुकुरोनाइड को विघटित करते हैं और रक्तिम पित्तवर्णकता को यूरोबिलिनोजेन्स में परिवर्तित करता है। कुछ यूरोबिलिनोजेन को आंतों की कोशिकाओं द्वारा अवशोषित किया जाता है और गुर्दे में ले जाया जाता है और मूत्र के साथ उत्सर्जित किया जाता है (यूरोबिलिन, जो यूरोबिलिनोजेन के ऑक्सीकरण का उत्पाद है, और मूत्र के पीले रंग के लिए जिम्मेदार है)। शेष पाचन तंत्र में जाता है और स्टर्कोबिलिनोजेन में परिवर्तित हो जाता है। यह स्टर्कोबिलिन में ऑक्सीकृत होता है और मल के भूरे रंग के लिए जिम्मेदार होता है।[39]
स्वास्थ्य और रोग में
धातुसाम्य के अनुसार, हीम की प्रतिक्रियाशीलता को हीमोप्रोटीन के "हीम पॉकेट्स" में डालकर नियंत्रित किया जा सकता है।[citation needed] ऑक्सीकृत तनाव के कारण, कुछ हीमोप्रोटीन जैसे हीमोग्लोबिन, उनके कृत्रिम हीम समूहों को मुक्त कर सकता है।[40][41] इस तरह से प्राप्त गैर-प्रोटीन-बाध्य (मुक्त) हीम अत्यधिक कोशिका विषी बन जाता है, संभवतः इसकी प्रोटोपोर्फिरिन IX रिंग के अंदर निहित लौह परमाणु के कारण, जो एक मुक्त तरीके से मुक्त कणों के उत्पादन को उत्प्रेरित करने के लिए फेंटन के अभिकर्मक के रूप में कार्य कर सकता है।[42] यह प्रोटीन के ऑक्सीकरण और एकत्रीकरण को उत्प्रेरित करता है, लिपिड परॉक्सीकरण के माध्यम से कोशिका विषी लिपिड पेरोक्साइड का निर्माण करता है और ऑक्सीकृत तनाव के माध्यम से डीएनए को नुकसान पहुंचाता है। अपने वसारागी (लिपोफिलिक) गुणों के कारण, यह माइटोकॉन्ड्रिया और नाभिक जैसे जीवों में द्विपरत लिपिड को बाधित करता है।[43] मुक्त हीम के ये गुण मुख्य-उत्तेजक क्रियाप्रेरक के जवाब में क्रमादेशित कोशिका मृत्यु से गुजरने के लिए विभिन्न प्रकार की कोशिका को संवेदनशील बना सकते हैं, जो एक हानिकारक प्रभाव है। एक हानिकारक प्रभाव जो मलेरिया और सेप्सिस जैसे कुछ सूजन संबंधी रोगों के रोगजनन में महत्वपूर्ण भूमिका निभाता है।[44][45]
कैंसर
मांस के अधिक सेवन से प्राप्त हीम आयरन और पेट के कैंसर के बढ़ते जोखिम के बीच एक संबंध है।[46] लाल मांस में हीम मात्रा चिकन जैसे सफेद मांस की तुलना में 10 गुना अधिक होती है।[47] 2019 की एक समीक्षा में पाया गया कि हीम आयरन का सेवन बढ़े हुए स्तन कैंसर के खतरे से जुड़ा है।[48]
जीन
निम्नलिखित जीन हीम बनाने के रासायनिक मार्ग का हिस्सा हैं:
- ALAD: एमिनोलेवुलिनिक एसिड, δ-, डिहाइड्रैटेज़ (कमी से अला-डिहाइड्रैटेज की कमी पोर्फिरीया होती है)[49]
- ALAS1: एमिनोलेवुलिनेट, δ-, सिंथेज़ 1
- ALAS2: एमिनोलेवुलिनेट, δ-, सिंथेज़ 2 (कमी से साइडरोबलास्टिक/हाइपोक्रोमिक एनीमिया हो जाता है)
- कोप्रोपोर्फिरिनोजेन III ऑक्सीडेज: कोप्रोपोर्फिरिनोजेन ऑक्सीडेज (कमी वंशानुगत कोप्रोपोर्फिरिया का कारण बनती है)[50]
- फेरोकेलाटेज: फेरोकेलेटेज (कमी के कारण एरिथ्रोपोएटिक प्रोटोपोर्फिरिया हो जाता है)
- HMBS (जीन): हाइड्रॉक्सीमिथाइलबिलेन सिंथेज़ (कमी के कारण तीव्र आंतरायिक पोरफाइरिया होता है)[51]
- PPOX: प्रोटोपोर्फिरिनोजेन ऑक्सीडेज (की कमी से वेरिएगेट पोर्फिरीया होता है)[52]
- UROD: यूरोपोर्फिरिनोजेन डीकार्बाक्सिलेज़ (कमी के कारण पोर्फिरीया कटानिया टार्डा होता है)[53]
- UROS: यूरोपोर्फिरिनोजेन III सिंथेज़ (कमी जन्मजात एरिथ्रोपोएटिक पोर्फिरीया का कारण बनती है)
नोट्स और संदर्भ
- ↑ Bloomer, Joseph R. (1998). "पोर्फिरीन और हीम का जिगर चयापचय". Journal of Gastroenterology and Hepatology. 13 (3): 324–329. doi:10.1111/j.1440-1746.1998.01548.x. PMID 9570250. S2CID 25224821.
- ↑ Chemistry, International Union of Pure and Applied (2009). "Hemes (heme derivatives)". रासायनिक शब्दावली का IUPAC संग्रह:. doi:10.1351/goldbook.H02773. ISBN 978-0-9678550-9-7. Archived from the original on 22 August 2017. Retrieved 28 April 2018.
{{cite book}}:|website=ignored (help) - ↑ A standard biochemistry text defines heme as the "iron-porphyrin prosthetic group of heme proteins"(Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.)
- ↑ Poulos, Thomas L. (2014-04-09). "हीम एंजाइम संरचना और कार्य". Chemical Reviews (in English). 114 (7): 3919–3962. doi:10.1021/cr400415k. ISSN 0009-2665. PMC 3981943. PMID 24400737.
- ↑ Paoli, M. (2002). "हीम-प्रोटीन में संरचना-कार्य संबंध।" (PDF). DNA Cell Biol. 21 (4): 271–280. doi:10.1089/104454902753759690. hdl:20.500.11820/67200894-eb9f-47a2-9542-02877d41fdd7. PMID 12042067.
- ↑ Alderton, W.K. (2001). "नाइट्रिक ऑक्साइड सिंथेज़: संरचना, कार्य और निषेध।". Biochem. J. 357 (3): 593–615. doi:10.1042/bj3570593. PMC 1221991. PMID 11463332.
- ↑ Milani, M. (2005). "काटे गए हीमोग्लोबिन में हीम बाइंडिंग और डायटोमिक लिगैंड रिकग्निशन के लिए स्ट्रक्चरल बेस।". J. Inorg. Biochem. 99 (1): 97–109. doi:10.1016/j.jinorgbio.2004.10.035. PMID 15598494.
- ↑ Hardison, R. (1999). "हीमोग्लोबिन का विकास: एक बहुत प्राचीन प्रोटीन के अध्ययन से पता चलता है कि जीन विनियमन में परिवर्तन विकासवादी कहानी का एक महत्वपूर्ण हिस्सा है।". American Scientist. 87 (2): 126. doi:10.1511/1999.20.809.
- ↑ Poulos, T. (2014). "हीम एंजाइम संरचना और कार्य।". Chem. Rev. 114 (7): 3919–3962. doi:10.1021/cr400415k. PMC 3981943. PMID 24400737.
- ↑ Thom, C. S. (2013). "हीमोग्लोबिन वेरिएंट: जैव रासायनिक गुण और नैदानिक सहसंबंध।". Cold Spring Harbor Perspectives in Medicine. 3 (3): a011858. doi:10.1101/cshperspect.a011858. PMC 3579210. PMID 23388674.
{{cite journal}}: zero width space character in|title=at position 50 (help) - ↑ Bohr; Hasselbalch, Krogh. "एक जैविक रूप से महत्वपूर्ण संबंध के संबंध में - इसके ऑक्सीजन बंधन पर रक्त की कार्बन डाइऑक्साइड सामग्री का प्रभाव". Archived from the original on 2017-04-18.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Ackers, G. K.; Holt, J. M. (2006). "एक सममित टेट्रामर में असममित सहकारिता: मानव हीमोग्लोबिन।". J. Biol. Chem. 281 (17): 11441–3. doi:10.1074/jbc.r500019200. PMID 16423822. S2CID 6696041.
- ↑ Caughey, W. S.; Smythe, G. E.; O'Keeffe, D. H.; Maskasky, J. E.; Smith, M. L. (1975). "साइटोक्रोम सी ऑक्सीडेज का हेम ए: संरचना और गुण: हेम्स बी, सी, और एस और डेरिवेटिव के साथ तुलना". J. Biol. Chem. 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Hegg, Eric L. (2004). "हेम एक सिंथेज़ हेम ए के फॉर्मिल समूह में आणविक ऑक्सीजन को शामिल नहीं करता है". Biochemistry. 43 (27): 8616–8624. doi:10.1021/bi049056m. PMID 15236569.
- ↑ Yoshikawa, S. (2012). "गोजातीय हृदय साइटोक्रोम सी ऑक्सीडेज पर संरचनात्मक अध्ययन". Biochim. Biophys. Acta. 1817 (4): 579–589. doi:10.1016/j.bbabio.2011.12.012. PMID 22236806.
- ↑ Rae, T.; Goff, H. (1998). "The heme prosthetic group of lactoperoxidase. Structural characteristics of heme l and heme l-peptides". The Journal of Biological Chemistry. 273 (43): 27968–27977. doi:10.1074/jbc.273.43.27968. PMID 9774411. S2CID 25780396.
- ↑ Purdy, M.A. (1983). "लैक्टोपरोक्सीडेज-थियोसाइनेट-हाइड्रोजन पेरोक्साइड प्रणाली के लिए साल्मोनेला विजयी की संवेदनशीलता पर विकास चरण और सेल लिफाफा संरचना का प्रभाव". Infect. Immun. 39 (3): 1187–95. doi:10.1128/IAI.39.3.1187-1195.1983. PMC 348082. PMID 6341231.
- ↑ Ohshima, H. (2003). "सूजन-प्रेरित कार्सिनोजेनेसिस का रासायनिक आधार". Arch. Biochem. Biophys. 417 (1): 3–11. doi:10.1016/s0003-9861(03)00283-2. PMID 12921773.
- ↑ Henderson, J.P. (2003). "फागोसाइट्स मानव भड़काऊ ऊतक में 5-क्लोरोरासिल और 5-ब्रोमोरासिल, मायलोपरोक्सीडेज के दो उत्परिवर्तजन उत्पाद उत्पन्न करते हैं". J. Biol. Chem. 278 (26): 23522–8. doi:10.1074/jbc.m303928200. PMID 12707270. S2CID 19631565.
- ↑ Murshudov, G.; Grebenko, A.; Barynin, V.; Dauter, Z.; Wilson, K.; Vainshtein, B.; Melik-Adamyan, W.; Bravo, J.; Ferrán, J.; Ferrer, J. C.; Switala, J.; Loewen, P. C.; Fita, I. (1996). "Structure of the heme d of Penicillium vitale and Escherichia coli catalases" (PDF). The Journal of Biological Chemistry. 271 (15): 8863–8868. doi:10.1074/jbc.271.15.8863. PMID 8621527.
- ↑ Belevich, I. (2005). "एस्चेरिचिया कोलाई से साइटोक्रोम बीडी का ऑक्सीजन युक्त परिसर: स्थिरता और फोटोलेबिलिटी". FEBS Letters. 579 (21): 4567–70. doi:10.1016/j.febslet.2005.07.011. PMID 16087180. S2CID 36465802.
- ↑ Fischer, H.; Orth, H. (1934). पाइरोल की केमिस्ट्री. Liepzig: Ischemia Verlagsgesellschaft.
- ↑ Puustinen A, Wikström M. (1991). "Escherichia coli . से साइटोक्रोम ओ के हीम समूह". Proc. Natl. Acad. Sci. U.S.A. 88 (14): 6122–6. Bibcode:1991PNAS...88.6122P. doi:10.1073/pnas.88.14.6122. PMC 52034. PMID 2068092.
- ↑ Caughey WS, York JL (1962). "बीफ दिल की मांसपेशी से साइटोक्रोम ऑक्सीडेज के हरे रंग के हीम के अलगाव और कुछ गुण।". J. Biol. Chem. 237 (7): 2414–6. doi:10.1016/S0021-9258(19)63456-3. PMID 13877421.
- ↑ Caughey WS, Smythe GA, O'Keeffe DH, Maskasky JE, Smith ML (1975). "साइटोक्रोम सी ऑक्सीडेज का हेम ए। संरचना और गुण: हेम्स बी, सी, और एस और डेरिवेटिव के साथ तुलना". J. Biol. Chem. 250 (19): 7602–22. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Battersby, Alan R. (2000). "टेट्रापायरोल्स: जीवन के वर्णक". Natural Product Reports. 17 (6): 507–526. doi:10.1039/B002635M. PMID 11152419.
- ↑ Sridevi, Kolluri (28 April 2018). ग्लूटेथिमाइड और 4,6-डाइऑक्सोहेप्टानोइक एसिड द्वारा हेम पाथवे एंजाइम एएलए सिंथेज़ -1 का अपग्रेडेशन और ग्लूकोज और हेम द्वारा डाउनरेगुलेशन: एक शोध प्रबंध. EScholarship@UMMS (Thesis). University of Massachusetts Medical School. doi:10.13028/yyrz-qa79. Archived from the original on 8 August 2016. Retrieved 28 April 2018.
- ↑ 28.0 28.1 Kumar, Sanjay; Bandyopadhyay, Uday (July 2005). "मानव में मुक्त हीम विषाक्तता और इसकी विषहरण प्रणाली". Toxicology Letters. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ↑ Puy, Hervé; Gouya, Laurent; Deybach, Jean-Charles (March 2010). "पोर्फाईरिया". The Lancet (in English). 375 (9718): 924–937. doi:10.1016/S0140-6736(09)61925-5. PMID 20226990. S2CID 208791867.
- ↑ Fraser, Rachel Z.; Shitut, Mithila; Agrawal, Puja; Mendes, Odete; Klapholz, Sue (2018-04-11). "सोया लेगहीमोग्लोबिन प्रोटीन की तैयारी का सुरक्षा मूल्यांकन पिचिया पेस्टोरिस से प्राप्त, संयंत्र-आधारित मांस में एक स्वाद उत्प्रेरक के रूप में उपयोग के लिए अभिप्रेत है". International Journal of Toxicology (in English). 37 (3): 241–262. doi:10.1177/1091581818766318. ISSN 1091-5818. PMC 5956568. PMID 29642729.
- ↑ "नकली मांस के अजीब विज्ञान के अंदर 'खून'". Wired. 2017-09-20. Archived from the original on 24 March 2018. Retrieved 28 April 2018.
- ↑ "सिलिकॉन वैली को मिलता है खाने का स्वाद". The Economist. 2015-03-05. ISSN 0013-0613. Retrieved 2019-04-08.
- ↑ Maines, Mahin D. (July 1988). "हेम ऑक्सीजनेज: कार्य, बहुलता, नियामक तंत्र, और नैदानिक अनुप्रयोग". The FASEB Journal (in English). 2 (10): 2557–2568. doi:10.1096/fasebj.2.10.3290025. ISSN 0892-6638. PMID 3290025. S2CID 22652094.
{{cite journal}}: zero width space character in|title=at position 56 (help) - ↑ लेहनिंगर के जैव रसायन के सिद्धांत (5th ed.). New York: W. H. Freeman and Company. 2008. pp. 876. ISBN 978-0-7167-7108-1.
- ↑ Hanafy, K.A. (2013). "कार्बन मोनोऑक्साइड और मस्तिष्क: हठधर्मिता पर पुनर्विचार करने का समय।". Curr. Pharm. Des. 19 (15): 2771–5. doi:10.2174/1381612811319150013. PMC 3672861. PMID 23092321.
- ↑ Abraham, N.G.; Kappas, A. (2008). "हीम ऑक्सीजनेज के औषधीय और नैदानिक पहलू।". Pharmacol. Rev. 60 (1): 79–127. doi:10.1124/pr.107.07104. PMID 18323402. S2CID 12792155.
{{cite journal}}: zero width space character in|title=at position 35 (help) - ↑ Florczyk, U.M.; Jozkowicz, A.; Dulak, J. (January–February 2008). "बिलीवर्डिन रिडक्टेस: एक पुराने एंजाइम की नई विशेषताएं और इसका संभावित चिकित्सीय महत्व". Pharmacological Reports. 60 (1): 38–48. PMC 5536200. PMID 18276984.
- ↑ King, C.; Rios, G.; Green, M.; Tephly, T. (2000). "यूडीपी-ग्लुकुरोनोसिलट्रांसफेरस". Current Drug Metabolism. 1 (2): 143–161. doi:10.2174/1389200003339171. PMID 11465080.
- ↑ Helmenstine, Anne Marie. "मूत्र और मल के रंग के लिए जिम्मेदार रसायन". ThoughtCo (in English). Retrieved 2020-01-24.
- ↑ Bunn, H. F.; Jandl, J. H. (Sep 1966). "हीमोग्लोबिन अणुओं के बीच हीम का आदान-प्रदान". Proc. Natl. Acad. Sci. USA. 56 (3): 974–978. Bibcode:1966PNAS...56..974B. doi:10.1073/pnas.56.3.974. PMC 219955. PMID 5230192.
- ↑ Smith, M. L.; Paul, J.; Ohlsson, P. I.; Hjortsberg, K.; Paul, K. G. (Feb 1991). "गैर-विघटनकारी परिस्थितियों में हीम-प्रोटीन विखंडन". Proc. Natl. Acad. Sci. USA. 88 (3): 882–886. Bibcode:1991PNAS...88..882S. doi:10.1073/pnas.88.3.882. PMC 50918. PMID 1846966.
- ↑ Everse, J.; Hsia, N. (1197). "देशी और संशोधित हीमोग्लोबिन की विषाक्तता". Free Radical Biology and Medicine. 22 (6): 1075–1099. doi:10.1016/S0891-5849(96)00499-6. PMID 9034247.
- ↑ Kumar, Sanjay; Bandyopadhyay, Uday (July 2005). "मनुष्यों में मुक्त हीम विषाक्तता और इसकी विषहरण प्रणाली". Toxicology Letters. 157 (3): 175–188. doi:10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ↑ Pamplona, A.; Ferreira, A.; Balla, J.; Jeney, V.; Balla, G.; Epiphanio, S.; Chora, A.; Rodrigues, C. D.; Gregoire, I. P.; Cunha-Rodrigues, M.; Portugal, S.; Soares, M. P.; Mota, M. M. (Jun 2007). "हेम ऑक्सीजनेज -1 और कार्बन मोनोऑक्साइड प्रायोगिक सेरेब्रल मलेरिया के रोगजनन को दबाते हैं". Nature Medicine. 13 (6): 703–710. doi:10.1038/nm1586. PMID 17496899. S2CID 20675040.
- ↑ Larsen, R.; Gozzelino, R.; Jeney, V.; Tokaji, L.; Bozza, F. A.; Japiassú, A. M.; Bonaparte, D.; Cavalcante, M. M.; Chora, A.; Ferreira, A.; Marguti, I.; Cardoso, S.; Sepúlveda, N.; Smith, A.; Soares, M. P. (2010). "गंभीर पूति के रोगजनन में मुक्त हीम के लिए एक केंद्रीय भूमिका". Science Translational Medicine. 2 (51): 51ra71. doi:10.1126/scitranslmed.3001118. PMID 20881280. S2CID 423446.
- ↑ Bastide, N. M.; Pierre, F. H.; Corpet, D. E. (2011). "मांस से हीम आयरन और कोलोरेक्टल कैंसर का खतरा: एक मेटा-विश्लेषण और इसमें शामिल तंत्र की समीक्षा" (PDF). Cancer Prev. Res. 4 (2): 177–184. doi:10.1158/1940-6207.CAPR-10-0113. PMID 21209396. S2CID 4951579. Archived (PDF) from the original on 2015-09-25.
- ↑ Bastide, Nadia M.; Pierre, Fabrice H. F.; Corpet, Denis E. (1 February 2011). "मांस से हेम आयरन और कोलोरेक्टल कैंसर का खतरा: एक मेटा-विश्लेषण और शामिल तंत्र की समीक्षा". Cancer Prevention Research. 4 (2): 177–184. doi:10.1158/1940-6207.CAPR-10-0113. PMID 21209396. S2CID 4951579. Archived from the original on 11 October 2017. Retrieved 28 April 2018 – via cancerpreventionresearch.aacrjournals.org.
- ↑ Chang, Vicky C; Cotterchio, Michelle; Khoo, Edwin (2019). "आयरन का सेवन, शरीर में आयरन की स्थिति, और स्तन कैंसर का खतरा: एक व्यवस्थित समीक्षा और मेटा-विश्लेषण". BMC Cancer. 19 (1): 543. doi:10.1186/s12885-019-5642-0. PMC 6555759. PMID 31170936.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Plewinska, Magdalena; Thunell, Stig; Holmberg, Lars; Wetmur, James; Desnick, Robert (1991). "डेल्टा-एमिनोलेवुलिनेट डिहाइड्रैटेज डेफिसिट पोर्फिरीया: गंभीर रूप से प्रभावित होमोजाइगोट में आणविक घावों की पहचान". American Journal of Human Genetics. 49 (1): 167–174. PMC 1683193. PMID 2063868.
- ↑ Aurizi, C.; Lupia Palmieri, G.; Barbieri, L.; Macri, A.; Sorge, F.; Usai, G.; Biolcati, G. (February 2009). "कोप्रोपोर्फिरिनोजेन III ऑक्सीडेज जीन के चार उपन्यास उत्परिवर्तन". Cellular and Molecular Biology. 55 (1): 8–15. PMID 19267996.
- ↑ Bustad, H. J.; Vorland, M.; Ronneseth, E.; Sandberg, S.; Martinez, A.; Toska, K. (August 8, 2013). "तीव्र आंतरायिक पोरफाइरिया के साथ विभिन्न फेनोटाइपिक एसोसिएशन के साथ दो हाइड्रॉक्सीमेथाइलबिलेन सिंथेज़ म्यूटेंट, K132N और V215E का गठनात्मक स्थिरता और गतिविधि विश्लेषण". Bioscience Reports. 33 (4): 617–626. doi:10.1042/BSR20130045. PMC 3738108. PMID 23815679.
- ↑ Martinez di Montemuros, F.; Di Pierro, E.; Patti, E.; Tavazzi, D.; Danielli, M. G.; Biolcati, G.; Rocchi, E.; Cappllini, M. D. (December 2002). "इटली में पोरफाइरिया का आणविक लक्षण वर्णन: एक नैदानिक प्रवाह-चार्ट". 48 (8): 867–876.
{{cite journal}}: Cite journal requires|journal=(help); zero width space character in|title=at position 54 (help) - ↑ Badenas, C.; To Figueras, J.; Phillips, J. D.; Warby, C. A.; Muñoz, C.; Herrero, C. (April 2009). "पोर्फिरिया कटानिया टार्डा रोगियों और रिश्तेदारों की एक बड़ी श्रृंखला में उपन्यास यूरोपोर्फिरिनोजेन डिकार्बोक्सिलेज जीन उत्परिवर्तन की पहचान और लक्षण वर्णन". Clinical Genetics. 75 (4): 346–353. doi:10.1111/j.1399-0004.2009.01153.x. PMC 3804340. PMID 19419417.