हीलियम हाइड्राइड आयन: Difference between revisions
No edit summary |
No edit summary |
||
| Line 35: | Line 35: | ||
'''हीलियम हाइड्राइड [[आयन]]''' या '''हाइड्रिडोहेलियम(1+) आयन''' या '''हेलोनियम''' आयन और धनायन (धनावेशित आयन) है जिसका [[रासायनिक सूत्र]] HeH<sup>+</sup> है। इसमें [[हाइड्रोजन]] परमाणु के साथ [[हीलियम]] परमाणु [[सहसंयोजक बंधन|सहसंयोजक बंध]] होता है, जिसमें [[इलेक्ट्रॉन]] हटा दिया जाता है। इसे प्रोटोनेटेड हीलियम के रूप में भी देखा जा सकता है। यह सबसे हल्का हेटेरोन्यूक्लियर अणु आयन है, और माना जाता है कि यह [[महा विस्फोट]] के पश्चात ब्रह्मांड में बना पहला यौगिक है।<ref name="EngelEtAl"/> | '''हीलियम हाइड्राइड [[आयन]]''' या '''हाइड्रिडोहेलियम(1+) आयन''' या '''हेलोनियम''' आयन और धनायन (धनावेशित आयन) है जिसका [[रासायनिक सूत्र]] HeH<sup>+</sup> है। इसमें [[हाइड्रोजन]] परमाणु के साथ [[हीलियम]] परमाणु [[सहसंयोजक बंधन|सहसंयोजक बंध]] होता है, जिसमें [[इलेक्ट्रॉन]] हटा दिया जाता है। इसे प्रोटोनेटेड हीलियम के रूप में भी देखा जा सकता है। यह सबसे हल्का हेटेरोन्यूक्लियर अणु आयन है, और माना जाता है कि यह [[महा विस्फोट]] के पश्चात ब्रह्मांड में बना पहला यौगिक है।<ref name="EngelEtAl"/> | ||
इस प्रकार आयन पहली बार 1925 में प्रयोगशाला में उत्पादित किया गया था। यह पृथक्करण में स्थिर है, किन्तु अत्यधिक प्रतिक्रियाशील है, और इसे थोक में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी अन्य अणु के साथ प्रतिक्रिया करेगा जिसके साथ यह संपर्क में आता है। सबसे सशक्त ज्ञात [[ अम्ल |अम्ल]] के रूप में जाना जाता है - [[फ्लोरोएन्टिमोनिक एसिड|फ्लोरोएन्टिमोनिक अम्ल]] से भी अधिक सशक्त | इस प्रकार आयन पहली बार 1925 में प्रयोगशाला में उत्पादित किया गया था। यह पृथक्करण में स्थिर है, किन्तु अत्यधिक प्रतिक्रियाशील है, और इसे थोक में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी अन्य अणु के साथ प्रतिक्रिया करेगा जिसके साथ यह संपर्क में आता है। सबसे सशक्त ज्ञात [[ अम्ल |अम्ल]] के रूप में जाना जाता है - इस प्रकार [[फ्लोरोएन्टिमोनिक एसिड|फ्लोरोएन्टिमोनिक अम्ल]] से भी अधिक सशक्त [[अंतरतारकीय माध्यम]] में इसकी घटना का अनुमान 1970 के दशक से लगाया गया था,<ref name=chebi33689>{{cite web |title= Hydridohelium (CHEBI:33689)| work=Chemical Entities of Biological Interest (ChEBI)|publisher = European Bioinformatics Institute|url=https://www.ebi.ac.uk/chebi/searchId.do?chebiId=CHEBI%3A33689}}</ref> और अंततः अप्रैल 2019 में इन्फ्रारेड खगोल विज्ञान के लिए एयरबोर्न स्ट्रैटोस्फेरिक टेलीस्कोप का उपयोग करके इसका पता लगाया गया था।<ref name="stut2019">{{Cite journal|last10=Stutzki|first10=Jürgen|last9=Risacher|first9=Christophe|last8=Ricken|first8=Oliver|last7=Klein|first7=Bernd|first6=Karl|last6=Jacobs|last5=Graf|first5=Urs U.|last4=Menten|first4=Karl M.|last3=Neufeld|first3=David|last2=Wiesemeyer|first2=Helmut|last1=Güsten|first1=Rolf | ||
|date=April 2019|title=Astrophysical detection of the helium hydride ion HeH<sup>+</sup> |journal=Nature|volume=568|issue=7752|pages=357–359|doi=10.1038/s41586-019-1090-x|pmid=30996316|arxiv=1904.09581|bibcode=2019Natur.568..357G|s2cid=119548024}} | |date=April 2019|title=Astrophysical detection of the helium hydride ion HeH<sup>+</sup> |journal=Nature|volume=568|issue=7752|pages=357–359|doi=10.1038/s41586-019-1090-x|pmid=30996316|arxiv=1904.09581|bibcode=2019Natur.568..357G|s2cid=119548024}} | ||
</ref><ref name="DSCVR-20191222">{{cite news |last=Andrews |first=Bill |title=वैज्ञानिकों ने ब्रह्मांड का पहला अणु खोजा|url=https://www.discovermagazine.com/the-sciences/scientists-find-the-universes-first-molecule |date=22 December 2019 |work=[[Discover (magazine)|Discover]] |access-date=22 December 2019 }}</ref> | |||
== भौतिक गुण == | == भौतिक गुण == | ||
हीलियम हाइड्रोजन आयन आणविक हाइड्रोजन ({{chem|H|2}}) के साथ [[ आइसोइलेक्ट्रॉनिकिटी |आइसोइलेक्ट्रॉनिकिटी]] है.<ref name=hogn1925>{{cite journal |first1=T. R. |last1=Hogness |first2=E. G. |last2=Lunn |title = सकारात्मक किरण विश्लेषण द्वारा व्याख्या के अनुसार इलेक्ट्रॉन प्रभाव द्वारा हाइड्रोजन का आयनीकरण|journal = [[Physical Review]]|year = 1925|volume = 26|issue = 1|pages = 44–55|doi = 10.1103/PhysRev.26.44 |bibcode=1925PhRv...26...44H}}</ref> इस प्रकार [[डाइहाइड्रोजन धनायन]] के विपरीत {{chem|H|2|+}}, हीलियम हाइड्राइड आयन में स्थायी द्विध्रुव या आणविक द्विध्रुव होता है, जो इसके स्पेक्ट्रोस्कोपिक लक्षण वर्णन को सरल बनाता है।<ref name=coxo1999>{{cite journal|doi = 10.1006/jmsp.1998.7740|title = Experimental Born–Oppenheimer Potential for the X<sub>1</sub>Σ<sup>+</sup> Ground State of HeH<sup>+</sup>: Comparison with the ''Ab Initio'' Potential|year = 1999|last1= Coxon |first1=J.|journal = Journal of Molecular Spectroscopy|volume = 193|pages = 306–318|pmid = 9920707|last2 = Hajigeorgiou|first2 = P. G.|issue = 2|bibcode = 1999JMoSp.193..306C }}</ref> HeH<sup>+</sup> का परिकलित द्विध्रुव आघूर्ण 2.26 या 2.84 D है।<ref name=dias2019>{{Cite journal|url=https://ned.unifenas.br/amdias/wp-admin/apostilas/hf1s.pdf|title=Dipole Moment Calculation to Small Diatomic Molecules: Implementation on a Two-Electron Self-Consistent-Field ''ab initio'' Program|last=Dias|first=A. M.|journal=Rev da Univ de Alfenas|volume=5|issue=1|pages=77–79|year=1999|access-date=2019-02-23|archive-date=2019-04-19|archive-url=https://web.archive.org/web/20190419182230/https://ned.unifenas.br/amdias/wp-admin/apostilas/hf1s.pdf|url-status=dead}}</ref> आयन में इलेक्ट्रॉन घनत्व हाइड्रोजन की तुलना में हीलियम नाभिक के आसपास अधिक होता है। 80% इलेक्ट्रॉन आवेश हाइड्रोजन नाभिक की तुलना में हीलियम नाभिक के अधिक निकट होता है।<ref>{{cite journal |last1=Dey |first1=Bijoy Kr. |last2=Deb |first2=B. M. |title=समय-निर्भर एकल हाइड्रोडायनामिकल समीकरण के माध्यम से परमाणुओं और अणुओं के लिए जमीनी-स्थिति इलेक्ट्रॉनिक ऊर्जा और घनत्व की प्रत्यक्ष प्रारंभिक गणना|journal=The Journal of Chemical Physics |date=April 1999 |volume=110 |issue=13 |pages=6229–6239 |doi=10.1063/1.478527|bibcode=1999JChPh.110.6229D }}</ref> स्पेक्ट्रोस्कोपिक पहचान में बाधा आती है, क्योंकि इसकी सबसे प्रमुख वर्णक्रमीय रेखाओं में से एक, 149.14 माइक्रोमीटर या μm पर, [[मिथाइलिडाइन रेडिकल]] ⫶ CH से संबंधित वर्णक्रमीय रेखाओं के दोहरे से मेल खाती है।<ref name="EngelEtAl">{{Cite journal|last1=Engel|first1=Elodie A.|last2=Doss|first2=Natasha|last3=Harris|first3=Gregory J.|last4=Tennyson|first4=Jonathan|year=2005|title=Calculated spectra for HeH<sup>+</sup> and its effect on the opacity of cool metal-poor stars|journal=Monthly Notices of the Royal Astronomical Society|volume=357|issue=2|pages=471–477|arxiv=astro-ph/0411267|bibcode=2005MNRAS.357..471E|doi=10.1111/j.1365-2966.2005.08611.x|s2cid=17507960}}</ref> आयन में सहसंयोजक बंधन की लंबाई 0.772 एंग्स्ट्रॉम या Å है।<ref name="Coyne">{{cite journal |last1 = Coyne |first1 = John P. |last2 = Ball |first2 = David W. |title = Alpha particle chemistry. On the formation of stable complexes between He<sup>2+</sup> and other simple species: implications for atmospheric and interstellar chemistry| journal = Journal of Molecular Modeling |volume = 15 |issue = 1 |pages = 35–40 |year = 2009 |doi = 10.1007/s00894-008-0371-3 |pmid = 18936986 |s2cid = 7163073 }}</ref> | हीलियम हाइड्रोजन आयन आणविक हाइड्रोजन ({{chem|H|2}}) के साथ [[ आइसोइलेक्ट्रॉनिकिटी |आइसोइलेक्ट्रॉनिकिटी]] है.<ref name=hogn1925>{{cite journal |first1=T. R. |last1=Hogness |first2=E. G. |last2=Lunn |title = सकारात्मक किरण विश्लेषण द्वारा व्याख्या के अनुसार इलेक्ट्रॉन प्रभाव द्वारा हाइड्रोजन का आयनीकरण|journal = [[Physical Review]]|year = 1925|volume = 26|issue = 1|pages = 44–55|doi = 10.1103/PhysRev.26.44 |bibcode=1925PhRv...26...44H}}</ref> इस प्रकार [[डाइहाइड्रोजन धनायन]] के विपरीत {{chem|H|2|+}}, हीलियम हाइड्राइड आयन में स्थायी द्विध्रुव या आणविक द्विध्रुव होता है, जो इसके स्पेक्ट्रोस्कोपिक लक्षण वर्णन को सरल बनाता है।<ref name=coxo1999>{{cite journal|doi = 10.1006/jmsp.1998.7740|title = Experimental Born–Oppenheimer Potential for the X<sub>1</sub>Σ<sup>+</sup> Ground State of HeH<sup>+</sup>: Comparison with the ''Ab Initio'' Potential|year = 1999|last1= Coxon |first1=J.|journal = Journal of Molecular Spectroscopy|volume = 193|pages = 306–318|pmid = 9920707|last2 = Hajigeorgiou|first2 = P. G.|issue = 2|bibcode = 1999JMoSp.193..306C }}</ref> HeH<sup>+</sup> का परिकलित द्विध्रुव आघूर्ण 2.26 या 2.84 D है।<ref name=dias2019>{{Cite journal|url=https://ned.unifenas.br/amdias/wp-admin/apostilas/hf1s.pdf|title=Dipole Moment Calculation to Small Diatomic Molecules: Implementation on a Two-Electron Self-Consistent-Field ''ab initio'' Program|last=Dias|first=A. M.|journal=Rev da Univ de Alfenas|volume=5|issue=1|pages=77–79|year=1999|access-date=2019-02-23|archive-date=2019-04-19|archive-url=https://web.archive.org/web/20190419182230/https://ned.unifenas.br/amdias/wp-admin/apostilas/hf1s.pdf|url-status=dead}}</ref> इस प्रकार आयन में इलेक्ट्रॉन घनत्व हाइड्रोजन की तुलना में हीलियम नाभिक के आसपास अधिक होता है। 80% इलेक्ट्रॉन आवेश हाइड्रोजन नाभिक की तुलना में हीलियम नाभिक के अधिक निकट होता है।<ref>{{cite journal |last1=Dey |first1=Bijoy Kr. |last2=Deb |first2=B. M. |title=समय-निर्भर एकल हाइड्रोडायनामिकल समीकरण के माध्यम से परमाणुओं और अणुओं के लिए जमीनी-स्थिति इलेक्ट्रॉनिक ऊर्जा और घनत्व की प्रत्यक्ष प्रारंभिक गणना|journal=The Journal of Chemical Physics |date=April 1999 |volume=110 |issue=13 |pages=6229–6239 |doi=10.1063/1.478527|bibcode=1999JChPh.110.6229D }}</ref> स्पेक्ट्रोस्कोपिक पहचान में बाधा आती है, क्योंकि इसकी सबसे प्रमुख वर्णक्रमीय रेखाओं में से एक, 149.14 माइक्रोमीटर या μm पर, [[मिथाइलिडाइन रेडिकल]] ⫶ CH से संबंधित वर्णक्रमीय रेखाओं के दोहरे से मेल खाती है।<ref name="EngelEtAl">{{Cite journal|last1=Engel|first1=Elodie A.|last2=Doss|first2=Natasha|last3=Harris|first3=Gregory J.|last4=Tennyson|first4=Jonathan|year=2005|title=Calculated spectra for HeH<sup>+</sup> and its effect on the opacity of cool metal-poor stars|journal=Monthly Notices of the Royal Astronomical Society|volume=357|issue=2|pages=471–477|arxiv=astro-ph/0411267|bibcode=2005MNRAS.357..471E|doi=10.1111/j.1365-2966.2005.08611.x|s2cid=17507960}}</ref> आयन में सहसंयोजक बंधन की लंबाई 0.772 एंग्स्ट्रॉम या Å है।<ref name="Coyne">{{cite journal |last1 = Coyne |first1 = John P. |last2 = Ball |first2 = David W. |title = Alpha particle chemistry. On the formation of stable complexes between He<sup>2+</sup> and other simple species: implications for atmospheric and interstellar chemistry| journal = Journal of Molecular Modeling |volume = 15 |issue = 1 |pages = 35–40 |year = 2009 |doi = 10.1007/s00894-008-0371-3 |pmid = 18936986 |s2cid = 7163073 }}</ref> | ||
===आइसोटोपोलोग्स=== | ===आइसोटोपोलोग्स=== | ||
हीलियम हाइड्राइड आयन में छह अपेक्षाकृत स्थिर [[आइसोटोपोलॉग]] होते हैं, जो दो तत्वों के आइसोटोप में भिन्न होते हैं, और इसलिए कुल परमाणु द्रव्यमान संख्या (A) और दो नाभिकों में [[न्यूट्रॉन]] (N) की कुल संख्या में भिन्न होते हैं: | हीलियम हाइड्राइड आयन में छह अपेक्षाकृत स्थिर [[आइसोटोपोलॉग]] होते हैं, जो दो तत्वों के आइसोटोप में भिन्न होते हैं, और इसलिए कुल परमाणु द्रव्यमान संख्या (A) और दो नाभिकों में [[न्यूट्रॉन]] (N) की कुल संख्या में भिन्न होते हैं: | ||
| Line 51: | Line 49: | ||
*{{chem2|[^{4}He^{2}H](+)}} या {{chem2|[^{4}HeD](+)}} (A = 6, N = 3)<ref name="bain1933" /><ref name="tung2012" /> | *{{chem2|[^{4}He^{2}H](+)}} या {{chem2|[^{4}HeD](+)}} (A = 6, N = 3)<ref name="bain1933" /><ref name="tung2012" /> | ||
*{{chem2|[^{4}He^{3}H](+)}} या {{chem2|[^{4}HeT](+)}} (A = 7, N = 4; रेडियोधर्मी) | *{{chem2|[^{4}He^{3}H](+)}} या {{chem2|[^{4}HeT](+)}} (A = 7, N = 4; रेडियोधर्मी) | ||
इन सभी में तीन प्रोटॉन और दो इलेक्ट्रॉन होते हैं। पहले तीन अणु क्रमशः HT = {{chem2|^{1}H^{3}H}} DT= {{chem2|^{2}H^{3}H}}, और T2 = {{chem2|^{3}H2}} में ट्रिटियम के रेडियोधर्मी क्षय से उत्पन्न होते हैं। अंतिम तीन को हीलियम-4 की उपस्थिति में H2 के उपयुक्त समस्थानिक को आयनित करके उत्पन्न किया जा सकता है।<ref name="hogn1925" /> | इन सभी में तीन प्रोटॉन और दो इलेक्ट्रॉन होते हैं। पहले तीन अणु क्रमशः HT = {{chem2|^{1}H^{3}H}} DT= {{chem2|^{2}H^{3}H}}, और T2 = {{chem2|^{3}H2}} में ट्रिटियम के रेडियोधर्मी क्षय से उत्पन्न होते हैं। अंतिम तीन को हीलियम-4 की उपस्थिति में H2 के उपयुक्त समस्थानिक को आयनित करके उत्पन्न किया जा सकता है।<ref name="hogn1925" /> | ||
| Line 62: | Line 59: | ||
चूंकि, उपरोक्त प्रत्येक पंक्ति में द्रव्यमान समान नहीं हैं, क्योंकि नाभिक में बंधन ऊर्जाएँ भिन्न हैं।<ref name=bain1933/> | चूंकि, उपरोक्त प्रत्येक पंक्ति में द्रव्यमान समान नहीं हैं, क्योंकि नाभिक में बंधन ऊर्जाएँ भिन्न हैं।<ref name=bain1933/> | ||
===सामान्य अणु=== | ===सामान्य अणु=== | ||
हीलियम हाइड्राइड आयन के विपरीत, सामान्य हीलियम हाइड्राइड अणु HeH ग्राउंडेड अवस्था में स्थिर नहीं है। चूंकि, यह [[ उत्तेजक |उत्तेजक]] (HeH*) के रूप में उत्तेजित अवस्था में उपस्थित होता है, और इसका स्पेक्ट्रम पहली बार 1980 के दशक के मध्य में देखा गया था।<ref name=mull1985>{{cite journal|title = HeH अणु की प्रतिदीप्ति का अवलोकन|first1=Thomas |last1=Möller |first2=Michael |last2=Beland |first3=Georg |last3=Zimmerer |journal = Physical Review Letters|volume = 55|pages = 2145–2148|year = 1985|doi = 10.1103/PhysRevLett.55.2145|pmid = 10032060|issue = 20|bibcode=1985PhRvL..55.2145M|url=https://bib-pubdb1.desy.de/search?p=id:%22PUBDB-2017-04706%22 }}</ref><ref name=nobe2001>{{Cite web|url=http://nobelprize.org/nobel_prizes/physics/laureates/2001/ketterle-autobio.html|title=Wolfgang Ketterle: The Nobel Prize in Physics 2001|publisher=nobelprize.org}}</ref><ref name=kette1985>{{cite journal|title = बाध्य हीलियम हाइड्राइड का उत्सर्जन स्पेक्ट्रा|first1=W. |last1=Ketterle |first2=H. |last2=Figger |first3=H. |last3=Walther |journal = Physical Review Letters|volume = 55|pages = 2941–2944|year = 1985|doi = 10.1103/PhysRevLett.55.2941|pmid = 10032281|issue = 27|bibcode=1985PhRvL..55.2941K}}</ref> सामान्य अणु [[गमेलिन डेटाबेस]] में पहली प्रविष्टि है।<ref name=chebi33689/> | हीलियम हाइड्राइड आयन के विपरीत, सामान्य हीलियम हाइड्राइड अणु HeH ग्राउंडेड अवस्था में स्थिर नहीं है। चूंकि, यह [[ उत्तेजक |उत्तेजक]] (HeH*) के रूप में उत्तेजित अवस्था में उपस्थित होता है, और इसका स्पेक्ट्रम पहली बार 1980 के दशक के मध्य में देखा गया था।<ref name=mull1985>{{cite journal|title = HeH अणु की प्रतिदीप्ति का अवलोकन|first1=Thomas |last1=Möller |first2=Michael |last2=Beland |first3=Georg |last3=Zimmerer |journal = Physical Review Letters|volume = 55|pages = 2145–2148|year = 1985|doi = 10.1103/PhysRevLett.55.2145|pmid = 10032060|issue = 20|bibcode=1985PhRvL..55.2145M|url=https://bib-pubdb1.desy.de/search?p=id:%22PUBDB-2017-04706%22 }}</ref><ref name=nobe2001>{{Cite web|url=http://nobelprize.org/nobel_prizes/physics/laureates/2001/ketterle-autobio.html|title=Wolfgang Ketterle: The Nobel Prize in Physics 2001|publisher=nobelprize.org}}</ref><ref name=kette1985>{{cite journal|title = बाध्य हीलियम हाइड्राइड का उत्सर्जन स्पेक्ट्रा|first1=W. |last1=Ketterle |first2=H. |last2=Figger |first3=H. |last3=Walther |journal = Physical Review Letters|volume = 55|pages = 2941–2944|year = 1985|doi = 10.1103/PhysRevLett.55.2941|pmid = 10032281|issue = 27|bibcode=1985PhRvL..55.2941K}}</ref> सामान्य अणु [[गमेलिन डेटाबेस]] में पहली प्रविष्टि है।<ref name=chebi33689/> | ||
==रासायनिक गुण और प्रतिक्रियाएँ== | ==रासायनिक गुण और प्रतिक्रियाएँ== | ||
| Line 75: | Line 68: | ||
उदाहरण के लिए, कार्बनिक पदार्थों के साथ प्रतिक्रियाओं का अध्ययन वांछित कार्बनिक यौगिक का ट्रिटियम व्युत्पन्न बनाकर किया जा सकता है। इस प्रकार ट्रिटियम के <sup>3</sup>He<sup>+</sup> तक क्षय होने के पश्चात् हाइड्रोजन परमाणु के निष्कर्षण से <sup>3</sup>HeH<sup>+</sup> प्राप्त होता है जो फिर कार्बनिक पदार्थ से घिरा होता है और इसके स्थान में प्रतिक्रिया करता है।<ref name="Gran004" /><ref name="fulv1970">{{cite book|doi=10.1016/S0065-3160(08)60321-4|title=ट्रिटिएटेड अणुओं के क्षय से गैसीय कार्बोनियम आयन|volume=8|pages=79–149|series=Advances in Physical Organic Chemistry|year=1970|last1=Cacace|first1=Fulvio|isbn=9780120335084}}</ref> | उदाहरण के लिए, कार्बनिक पदार्थों के साथ प्रतिक्रियाओं का अध्ययन वांछित कार्बनिक यौगिक का ट्रिटियम व्युत्पन्न बनाकर किया जा सकता है। इस प्रकार ट्रिटियम के <sup>3</sup>He<sup>+</sup> तक क्षय होने के पश्चात् हाइड्रोजन परमाणु के निष्कर्षण से <sup>3</sup>HeH<sup>+</sup> प्राप्त होता है जो फिर कार्बनिक पदार्थ से घिरा होता है और इसके स्थान में प्रतिक्रिया करता है।<ref name="Gran004" /><ref name="fulv1970">{{cite book|doi=10.1016/S0065-3160(08)60321-4|title=ट्रिटिएटेड अणुओं के क्षय से गैसीय कार्बोनियम आयन|volume=8|pages=79–149|series=Advances in Physical Organic Chemistry|year=1970|last1=Cacace|first1=Fulvio|isbn=9780120335084}}</ref> | ||
===अम्लता=== | ===अम्लता=== | ||
इस प्रकार HeH<sup>+</sup> को [[संघनित चरण]] में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी आयन, अणु या परमाणु के संपर्क में आने पर [[प्रोटोनेशन]] करता है। इसे ऑक्सीजन या O<sub>2</sub> को प्रोटोनेट करते हुए दिखाया गया है, अमोनिया या NH<sub>3</sub>, सल्फर डाइऑक्साइड या SO<sub>2</sub>, जल या H<sub>2</sub>O, और कार्बन डाइऑक्साइड या CO<sub>2</sub>,डाइऑक्सीडेनिलियम या {{chem|HO|2|+}}, अमोनियम या {{chem|NH|4|+}}, सल्फैनेट्रियमडायोन या {{chem|HSO|2|+}}, हाइड्रोनियम या H<sub>3</sub>O<sup>+</sup>, और मिथाइलियमडायोन या {{chem|HCO|2|+}} | इस प्रकार HeH<sup>+</sup> को [[संघनित चरण]] में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी आयन, अणु या परमाणु के संपर्क में आने पर [[प्रोटोनेशन]] करता है। इसे ऑक्सीजन या O<sub>2</sub> को प्रोटोनेट करते हुए दिखाया गया है, अमोनिया या NH<sub>3</sub>, सल्फर डाइऑक्साइड या SO<sub>2</sub>, जल या H<sub>2</sub>O, और कार्बन डाइऑक्साइड या CO<sub>2</sub>,डाइऑक्सीडेनिलियम या {{chem|HO|2|+}}, अमोनियम या {{chem|NH|4|+}}, सल्फैनेट्रियमडायोन या {{chem|HSO|2|+}}, हाइड्रोनियम या H<sub>3</sub>O<sup>+</sup>, और मिथाइलियमडायोन या {{chem|HCO|2|+}} क्रमशः <ref name=Gran004/> अन्य अणु जैसे [[नाइट्रिक ऑक्साइड]], [[नाइट्रोजन डाइऑक्साइड]], [[नाइट्रस ऑक्साइड]], [[हाइड्रोजन सल्फाइड]], [[मीथेन]], [[एसिटिलीन]], [[ईथीलीन]], [[एटैन]], [[मेथनॉल]] और [[acetonitrile|एसीटोनिट्राइल]] प्रतिक्रिया करते हैं किन्तु बड़ी मात्रा में ऊर्जा उत्पन्न होने के कारण टूट जाते हैं।<ref name=Gran004/> | ||
वास्तव में, HeH<sup>+</sup> सबसे सशक्त ज्ञात अम्ल है, जिसकी प्रोटॉन बन्धुता 177.8 kJ/mol है।<ref name="Epa">{{cite journal|doi = 10.1063/1.555719|last1= Lias |first1=S. G. |last2=Liebman |first2=J. F. |last3=Levin |first3=R. D. |year = 1984|title = Evaluated Gas Phase Basicities and Proton Affinities of Molecules; Heats of Formation of Protonated Molecules|journal =Journal of Physical and Chemical Reference Data |volume = 13|issue = 3|pages = 695|bibcode = 1984JPCRD..13..695L}}</ref> हेस के नियम का उपयोग करके काल्पनिक जलीय अम्लता का अनुमान लगाया जा सकता है: | वास्तव में, HeH<sup>+</sup> सबसे सशक्त ज्ञात अम्ल है, जिसकी प्रोटॉन बन्धुता 177.8 kJ/mol है।<ref name="Epa">{{cite journal|doi = 10.1063/1.555719|last1= Lias |first1=S. G. |last2=Liebman |first2=J. F. |last3=Levin |first3=R. D. |year = 1984|title = Evaluated Gas Phase Basicities and Proton Affinities of Molecules; Heats of Formation of Protonated Molecules|journal =Journal of Physical and Chemical Reference Data |volume = 13|issue = 3|pages = 695|bibcode = 1984JPCRD..13..695L}}</ref> हेस के नियम का उपयोग करके काल्पनिक जलीय अम्लता का अनुमान लगाया जा सकता है: | ||
| Line 148: | Line 141: | ||
1956 में, एम. केंटवेल ने सैद्धांतिक रूप से पूर्वानुमान किया था कि उस आयन के कंपन का स्पेक्ट्रम अवरक्त में देखने योग्य होना चाहिए; और ड्यूटेरियम और सामान्य हाइड्रोजन आइसोटोपोलॉग्स ({{chem2|[^{3}HeD](+)}} और {{chem2|[^{3}He^{1}H](+)}}) का स्पेक्ट्रा दृश्य प्रकाश के निकट होना चाहिए और इसलिए निरीक्षण करना सरल होना चाहिए। <ref name="cant1956" /> इस प्रकार {{chem2|[^{4}He^{1}H](+)}} के स्पेक्ट्रम का संसूचन 1979 में डी. टॉलिवर और अन्य लोगों द्वारा 1,700 और 1,900 सेमी<sup>−1</sup> के मध्य तरंग संख्या पर लगाया गया था।<ref name="toll1979">{{cite journal | last1=Tolliver | first1=David E. | last2=Kyrala | first2=George A. | last3=Wing | first3=William H. | title=Observation of the Infrared Spectrum of the Helium-Hydride Molecular Ion [<sup>4</sup>HeH]<sup>+</sup> | journal=Physical Review Letters | publisher=American Physical Society (APS) | volume=43 | issue=23 | date=1979-12-03 | issn=0031-9007 | doi=10.1103/physrevlett.43.1719 | pages=1719–1722| bibcode=1979PhRvL..43.1719T }}<!--Note: first vibrational-rotational spectrum--></ref> 1982 में, पी. बर्नथ और टी. अमानो ने 2,164 और 3,158 तरंगों प्रति सेमी के मध्य नौ अवरक्त रेखाओं का पता लगाया था। | 1956 में, एम. केंटवेल ने सैद्धांतिक रूप से पूर्वानुमान किया था कि उस आयन के कंपन का स्पेक्ट्रम अवरक्त में देखने योग्य होना चाहिए; और ड्यूटेरियम और सामान्य हाइड्रोजन आइसोटोपोलॉग्स ({{chem2|[^{3}HeD](+)}} और {{chem2|[^{3}He^{1}H](+)}}) का स्पेक्ट्रा दृश्य प्रकाश के निकट होना चाहिए और इसलिए निरीक्षण करना सरल होना चाहिए। <ref name="cant1956" /> इस प्रकार {{chem2|[^{4}He^{1}H](+)}} के स्पेक्ट्रम का संसूचन 1979 में डी. टॉलिवर और अन्य लोगों द्वारा 1,700 और 1,900 सेमी<sup>−1</sup> के मध्य तरंग संख्या पर लगाया गया था।<ref name="toll1979">{{cite journal | last1=Tolliver | first1=David E. | last2=Kyrala | first2=George A. | last3=Wing | first3=William H. | title=Observation of the Infrared Spectrum of the Helium-Hydride Molecular Ion [<sup>4</sup>HeH]<sup>+</sup> | journal=Physical Review Letters | publisher=American Physical Society (APS) | volume=43 | issue=23 | date=1979-12-03 | issn=0031-9007 | doi=10.1103/physrevlett.43.1719 | pages=1719–1722| bibcode=1979PhRvL..43.1719T }}<!--Note: first vibrational-rotational spectrum--></ref> 1982 में, पी. बर्नथ और टी. अमानो ने 2,164 और 3,158 तरंगों प्रति सेमी के मध्य नौ अवरक्त रेखाओं का पता लगाया था। | ||
=== | ===अंतरतारकीय अंतरिक्ष=== | ||
इस प्रकार HeH<sup>+</sup> के बारे में 1970 के दशक से लंबे समय से अनुमान लगाया जाता रहा है कि वह अंतरतारकीय माध्यम में उपस्थित है।<ref name=fern2007>{{cite journal |first1= J. |last1=Fernández |first2=F. |last2=Martín |title = Photoionization of the HeH<sup>+</sup> molecular ion|journal = Journal of Physics B|year = 2007|volume = 40|issue = 12 |pages = 2471–2480|doi = 10.1088/0953-4075/40/12/020|bibcode = 2007JPhB...40.2471F|s2cid=120284828 }}</ref> नेबुला एनजीसी 7027 में इसका पहला पता अप्रैल 2019 में नेचर जर्नल में प्रकाशित लेख में बताया गया था।<ref name="stut2019" /> | इस प्रकार HeH<sup>+</sup> के बारे में 1970 के दशक से लंबे समय से अनुमान लगाया जाता रहा है कि वह अंतरतारकीय माध्यम में उपस्थित है।<ref name=fern2007>{{cite journal |first1= J. |last1=Fernández |first2=F. |last2=Martín |title = Photoionization of the HeH<sup>+</sup> molecular ion|journal = Journal of Physics B|year = 2007|volume = 40|issue = 12 |pages = 2471–2480|doi = 10.1088/0953-4075/40/12/020|bibcode = 2007JPhB...40.2471F|s2cid=120284828 }}</ref> नेबुला एनजीसी 7027 में इसका पहला पता अप्रैल 2019 में नेचर जर्नल में प्रकाशित लेख में बताया गया था।<ref name="stut2019" /> | ||
==प्राकृतिक घटना== | ==प्राकृतिक घटना== | ||
| Line 173: | Line 166: | ||
| last13= Clegg | first13= P. E. | | last13= Clegg | first13= P. E. | ||
| doi=10.1093/mnras/290.4.l71}}</ref> ऐसा इसलिए है क्योंकि [[बिग बैंग न्यूक्लियोसिंथेसिस]] में हाइड्रोजन और हीलियम लगभग एकमात्र प्रकार के परमाणु बने थे। मौलिक पदार्थ से बने तारों में HeH<sup>+</sup> होना चाहिए, जो उनके गठन और उसके पश्चात के विकास को प्रभावित कर सकता है। विशेष रूप से, इसका सशक्त आणविक द्विध्रुवीय क्षण इसे धात्विकता या सितारे या शून्य-धात्विकता तारों की अपारदर्शिता के लिए प्रासंगिक बनाता है।<ref name="EngelEtAl"/> इस प्रकार HeH<sup>+</sup> को हीलियम युक्त सफेद बौनों के वायुमंडल का महत्वपूर्ण घटक भी माना जाता है, जहां यह गैस की अपारदर्शिता को बढ़ाता है और तारे को अधिक धीरे-धीरे ठंडा करने का कारण बनता है।<ref name="HarrisEtAl">{{Cite journal| last1 = Harris| first1 = G. J. |last2=Lynas-Gray |first2=A. E. | last3=Miller |first3=S. |last4=Tennyson |first4=J. | title = The Role of HeH<sup>+</sup> in Cool Helium-rich White Dwarfs| journal = [[The Astrophysical Journal]]|volume = 617| issue = 2| pages = L143–L146|year = 2004|doi = 10.1086/427391| bibcode=2004ApJ...617L.143H|arxiv = astro-ph/0411331 | s2cid = 18993175 }}</ref> | | doi=10.1093/mnras/290.4.l71}}</ref> ऐसा इसलिए है क्योंकि [[बिग बैंग न्यूक्लियोसिंथेसिस]] में हाइड्रोजन और हीलियम लगभग एकमात्र प्रकार के परमाणु बने थे। मौलिक पदार्थ से बने तारों में HeH<sup>+</sup> होना चाहिए, जो उनके गठन और उसके पश्चात के विकास को प्रभावित कर सकता है। विशेष रूप से, इसका सशक्त आणविक द्विध्रुवीय क्षण इसे धात्विकता या सितारे या शून्य-धात्विकता तारों की अपारदर्शिता के लिए प्रासंगिक बनाता है।<ref name="EngelEtAl"/> इस प्रकार HeH<sup>+</sup> को हीलियम युक्त सफेद बौनों के वायुमंडल का महत्वपूर्ण घटक भी माना जाता है, जहां यह गैस की अपारदर्शिता को बढ़ाता है और तारे को अधिक धीरे-धीरे ठंडा करने का कारण बनता है।<ref name="HarrisEtAl">{{Cite journal| last1 = Harris| first1 = G. J. |last2=Lynas-Gray |first2=A. E. | last3=Miller |first3=S. |last4=Tennyson |first4=J. | title = The Role of HeH<sup>+</sup> in Cool Helium-rich White Dwarfs| journal = [[The Astrophysical Journal]]|volume = 617| issue = 2| pages = L143–L146|year = 2004|doi = 10.1086/427391| bibcode=2004ApJ...617L.143H|arxiv = astro-ph/0411331 | s2cid = 18993175 }}</ref> | ||
घने अंतरतारकीय बादलों में विघटनकारी झटकों के पीछे ठंडी गैस में HeH<sup>+</sup> का निर्माण हो सकता है, जैसे कि तारकीय वायु, सुपरनोवा और युवा सितारों से बाहर निकलने वाली पदार्थ के कारण होने वाले झटके है। यदि झटके की गति लगभग {{convert|90|km/s}} से अधिक है तो पता लगाने के लिए पर्याप्त मात्रा में झटका लगाया जा सकता है। यदि HeH<sup>+</sup> से उत्सर्जन का पता लगाया जाता है तो यह झटके का उपयोगी पता लगाने वाला होता है।[37] | घने अंतरतारकीय बादलों में विघटनकारी झटकों के पीछे ठंडी गैस में HeH<sup>+</sup> का निर्माण हो सकता है, जैसे कि तारकीय वायु, सुपरनोवा और युवा सितारों से बाहर निकलने वाली पदार्थ के कारण होने वाले झटके है। यदि झटके की गति लगभग {{convert|90|km/s}} से अधिक है तो पता लगाने के लिए पर्याप्त मात्रा में झटका लगाया जा सकता है। यदि HeH<sup>+</sup> से उत्सर्जन का पता लगाया जाता है तो यह झटके का उपयोगी पता लगाने वाला होता है।[37] | ||
Revision as of 08:32, 27 September 2023

| |
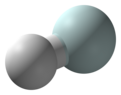
| |
| Names | |
|---|---|
| Systematic IUPAC name
Hydridohelium(1+)[1] | |
| Other names
हेलोनियम
हीलियम हाइड्राइड | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI |
|
| ChemSpider | |
| 2 | |
| |
| |
| Properties | |
| HeH+ | |
| Molar mass | 5.01054 g·mol−1 |
| Conjugate base | Helium |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
हीलियम हाइड्राइड आयन या हाइड्रिडोहेलियम(1+) आयन या हेलोनियम आयन और धनायन (धनावेशित आयन) है जिसका रासायनिक सूत्र HeH+ है। इसमें हाइड्रोजन परमाणु के साथ हीलियम परमाणु सहसंयोजक बंध होता है, जिसमें इलेक्ट्रॉन हटा दिया जाता है। इसे प्रोटोनेटेड हीलियम के रूप में भी देखा जा सकता है। यह सबसे हल्का हेटेरोन्यूक्लियर अणु आयन है, और माना जाता है कि यह महा विस्फोट के पश्चात ब्रह्मांड में बना पहला यौगिक है।[2]
इस प्रकार आयन पहली बार 1925 में प्रयोगशाला में उत्पादित किया गया था। यह पृथक्करण में स्थिर है, किन्तु अत्यधिक प्रतिक्रियाशील है, और इसे थोक में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी अन्य अणु के साथ प्रतिक्रिया करेगा जिसके साथ यह संपर्क में आता है। सबसे सशक्त ज्ञात अम्ल के रूप में जाना जाता है - इस प्रकार फ्लोरोएन्टिमोनिक अम्ल से भी अधिक सशक्त अंतरतारकीय माध्यम में इसकी घटना का अनुमान 1970 के दशक से लगाया गया था,[3] और अंततः अप्रैल 2019 में इन्फ्रारेड खगोल विज्ञान के लिए एयरबोर्न स्ट्रैटोस्फेरिक टेलीस्कोप का उपयोग करके इसका पता लगाया गया था।[4][5]
भौतिक गुण
हीलियम हाइड्रोजन आयन आणविक हाइड्रोजन (H
2) के साथ आइसोइलेक्ट्रॉनिकिटी है.[6] इस प्रकार डाइहाइड्रोजन धनायन के विपरीत H+
2, हीलियम हाइड्राइड आयन में स्थायी द्विध्रुव या आणविक द्विध्रुव होता है, जो इसके स्पेक्ट्रोस्कोपिक लक्षण वर्णन को सरल बनाता है।[7] HeH+ का परिकलित द्विध्रुव आघूर्ण 2.26 या 2.84 D है।[8] इस प्रकार आयन में इलेक्ट्रॉन घनत्व हाइड्रोजन की तुलना में हीलियम नाभिक के आसपास अधिक होता है। 80% इलेक्ट्रॉन आवेश हाइड्रोजन नाभिक की तुलना में हीलियम नाभिक के अधिक निकट होता है।[9] स्पेक्ट्रोस्कोपिक पहचान में बाधा आती है, क्योंकि इसकी सबसे प्रमुख वर्णक्रमीय रेखाओं में से एक, 149.14 माइक्रोमीटर या μm पर, मिथाइलिडाइन रेडिकल ⫶ CH से संबंधित वर्णक्रमीय रेखाओं के दोहरे से मेल खाती है।[2] आयन में सहसंयोजक बंधन की लंबाई 0.772 एंग्स्ट्रॉम या Å है।[10]
आइसोटोपोलोग्स
हीलियम हाइड्राइड आयन में छह अपेक्षाकृत स्थिर आइसोटोपोलॉग होते हैं, जो दो तत्वों के आइसोटोप में भिन्न होते हैं, और इसलिए कुल परमाणु द्रव्यमान संख्या (A) और दो नाभिकों में न्यूट्रॉन (N) की कुल संख्या में भिन्न होते हैं:
- [3He1H]+ या [3HeH]+ (A = 4, N = 1) [11][12]
- [3He2H]+ या [3HeD]+ (A = 5, N = 2) [11][12]
- [3He3H]+ या [3HeT]+ (A = 6, N = 3; रेडियोधर्मी) [13][11][14]
- [4He1H]+ या [4HeH]+ (A = 5, N = 2) [6][15][16][17][12]
- [4He2H]+ या [4HeD]+ (A = 6, N = 3)[15][12]
- [4He3H]+ या [4HeT]+ (A = 7, N = 4; रेडियोधर्मी)
इन सभी में तीन प्रोटॉन और दो इलेक्ट्रॉन होते हैं। पहले तीन अणु क्रमशः HT = 1H3H DT= 2H3H, और T2 = 3H2 में ट्रिटियम के रेडियोधर्मी क्षय से उत्पन्न होते हैं। अंतिम तीन को हीलियम-4 की उपस्थिति में H2 के उपयुक्त समस्थानिक को आयनित करके उत्पन्न किया जा सकता है।[6]
हीलियम हाइड्राइड आयन, डाइहाइड्रोजन आयन के निम्नलिखित समस्थानिक H+2, और ट्राइहाइड्रोजन धनायन का H+3 समान कुल परमाणु द्रव्यमान संख्या A है:
- [3HeH]+, [D2]+, [TH]+, [DH2]+ (A = 4)
- [3HeD]+, [4HeH]+, [DT]+, [TH2]+, [D2H]+ (A = 5)
- [3HeT]+, [4HeD]+, [T2]+, [TDH]+, [D3]+ (A = 6)
- [4HeT]+, [TD2]+, [T2H]+ (A = 7)
चूंकि, उपरोक्त प्रत्येक पंक्ति में द्रव्यमान समान नहीं हैं, क्योंकि नाभिक में बंधन ऊर्जाएँ भिन्न हैं।[15]
सामान्य अणु
हीलियम हाइड्राइड आयन के विपरीत, सामान्य हीलियम हाइड्राइड अणु HeH ग्राउंडेड अवस्था में स्थिर नहीं है। चूंकि, यह उत्तेजक (HeH*) के रूप में उत्तेजित अवस्था में उपस्थित होता है, और इसका स्पेक्ट्रम पहली बार 1980 के दशक के मध्य में देखा गया था।[18][19][20] सामान्य अणु गमेलिन डेटाबेस में पहली प्रविष्टि है।[3]
रासायनिक गुण और प्रतिक्रियाएँ
तैयारी
चूँकि HeH+ को किसी भी उपयोगी रूप में संग्रहीत नहीं किया जा सकता है, इसलिए इसे यथास्थान बनाकर इसके रसायन विज्ञान का अध्ययन किया जाना चाहिए।
उदाहरण के लिए, कार्बनिक पदार्थों के साथ प्रतिक्रियाओं का अध्ययन वांछित कार्बनिक यौगिक का ट्रिटियम व्युत्पन्न बनाकर किया जा सकता है। इस प्रकार ट्रिटियम के 3He+ तक क्षय होने के पश्चात् हाइड्रोजन परमाणु के निष्कर्षण से 3HeH+ प्राप्त होता है जो फिर कार्बनिक पदार्थ से घिरा होता है और इसके स्थान में प्रतिक्रिया करता है।[21][22]
अम्लता
इस प्रकार HeH+ को संघनित चरण में तैयार नहीं किया जा सकता है, क्योंकि यह किसी भी आयन, अणु या परमाणु के संपर्क में आने पर प्रोटोनेशन करता है। इसे ऑक्सीजन या O2 को प्रोटोनेट करते हुए दिखाया गया है, अमोनिया या NH3, सल्फर डाइऑक्साइड या SO2, जल या H2O, और कार्बन डाइऑक्साइड या CO2,डाइऑक्सीडेनिलियम या HO+
2, अमोनियम या NH+
4, सल्फैनेट्रियमडायोन या HSO+
2, हाइड्रोनियम या H3O+, और मिथाइलियमडायोन या HCO+
2 क्रमशः [21] अन्य अणु जैसे नाइट्रिक ऑक्साइड, नाइट्रोजन डाइऑक्साइड, नाइट्रस ऑक्साइड, हाइड्रोजन सल्फाइड, मीथेन, एसिटिलीन, ईथीलीन, एटैन, मेथनॉल और एसीटोनिट्राइल प्रतिक्रिया करते हैं किन्तु बड़ी मात्रा में ऊर्जा उत्पन्न होने के कारण टूट जाते हैं।[21]
वास्तव में, HeH+ सबसे सशक्त ज्ञात अम्ल है, जिसकी प्रोटॉन बन्धुता 177.8 kJ/mol है।[23] हेस के नियम का उपयोग करके काल्पनिक जलीय अम्लता का अनुमान लगाया जा सकता है:
HeH+(g) → H+(g) + He(g) +178 kJ/mol [23] HeH+(aq) → HeH+(g) +973 kJ/mol (a) H+(g) → H+(aq) −1530 kJ/mol He(g) → He(aq) +19 kJ/mol (b) HeH+(aq) → H+(aq) + He(aq) −360 kJ/mol
(a) Li+(aq) → Li+(g) के समान होने का अनुमान है।
(b) घुलनशीलता डेटा से अनुमानित है।
−360 kJ/mol के पृथक्करण का एक मुक्त ऊर्जा परिवर्तन 298 K पर −63 के pKa के समान है।
अन्य हीलियम-हाइड्रोजन आयन
अतिरिक्त हीलियम परमाणु HeH+ से जुड़कर He2H+, He3H+, He4H+, He5H+ और He6H+ जैसे बड़े समूह बना सकते हैं।[21]
डाइहेलियम हाइड्राइड धनायन He2H+ आणविक हाइड्रोजन के साथ डाइहीलियम धनायन की प्रतिक्रिया से बनता है:
- HO+
2 + H2 → He2H+ + H
यह केंद्र में हाइड्रोजन के साथ रैखिक आयन है।[21] हेक्साहेलियम हाइड्राइड आयन, He6H+, विशेष रूप से स्थिर है।[21]
इस प्रकार अन्य हीलियम हाइड्राइड आयन ज्ञात हैं या सैद्धांतिक रूप से उनका अध्ययन किया गया है। हीलियम डाइहाइड्राइड आयन, या डाइहाइड्रिडोहेलियम (1+), HeH+
2, माइक्रोवेव स्पेक्ट्रोस्कोपी का उपयोग करके देखा गया है।[24] इसकी परिकलित बंधन ऊर्जा 25.1 kJ/mol है, जबकि ट्राइहाइड्रिडोहेलियम(1+), HeH+
3, की गणना की गई बाइंडिंग ऊर्जा 0.42 kJ/mol है।[25]
इतिहास
आयनीकरण प्रयोगों में खोज
हाइड्रिडोहेलियम (1+), विशेष रूप से [4He1H]+, का पहली बार अप्रत्यक्ष रूप से 1925 में टी. आर. हॉगनेस और ई. जी. लून द्वारा पता लगाया गया था। वह H+
, H+
2 और H+
3 जैसे हाइड्रोजन आयनों के निर्माण का अध्ययन करने के लिए, ज्ञात ऊर्जा के प्रोटॉन को हाइड्रोजन और हीलियम के एक विरल मिश्रण में इंजेक्ट कर रहे थे। उन्होंने देखा कि H+
3 H+
2 के समान बीम ऊर्जा (16 eV) पर दिखाई दिया था, और इसकी सांद्रता अन्य दो आयनों की तुलना में दाब के साथ बहुत अधिक बढ़ गई थी। इन आंकड़ों से, उन्होंने निष्कर्ष निकाला कि H+
2 आयन एक प्रोटॉन को उन अणुओं में स्थानांतरित कर रहे थे जिनसे वह टकराए थे, जिसमें हीलियम भी सम्मिलित था।[6]
इस प्रकार 1933 में, के. बैनब्रिज ने ड्यूटेरियम के परमाणु द्रव्यमान का स्पष्ट माप प्राप्त करने के लिए आयनों [4He1H]+ (हीलियम हाइड्राइड आयन) और [2H21H]+ (दो बार-ड्यूटेरेटेड ट्राइहाइड्रोजन आयन) के द्रव्यमान की तुलना करने के लिए मास स्पेक्ट्रोमेट्री का उपयोग किया था। इस प्रकार हीलियम के सापेक्ष दोनों आयनों में 3 प्रोटॉन, 2 न्यूट्रॉन और 2 इलेक्ट्रॉन हैं। उन्होंने [4He2H]+ (हीलियम ड्यूटेराइड आयन) की तुलना [2H3]+ (ट्राइड्यूटेरियम आयन) दोनों 3 प्रोटॉन और 3 न्यूट्रॉन से की थी।
प्रारंभिक सैद्धांतिक अध्ययन
क्वांटम मैकेनिकल सिद्धांत द्वारा HeH+ आयन (विशेष रूप से [4He1H]+) की संरचना की गणना करने का पहला प्रयास 1936 में जे. मध्य द्वारा किया गया था।[26] इस प्रकार अगले दशकों में उत्तम संगणनाएँ विकीर्ण रूप से प्रकाशित हुईं थी।[27][28]
रसायन विज्ञान में ट्रिटियम क्षय विधियाँ
एच. श्वार्ट्ज ने 1955 में देखा कि ट्रिटियम अणु T2 = 3H2 के क्षय से उच्च संभावना के साथ हीलियम हाइड्राइड आयन [3HeT]+ उत्पन्न होना चाहिए।
इस प्रकार 1963 में, फुल्वियो कैकेस या एफ. रोम के सैपिएन्ज़ा विश्वविद्यालय में कैकेस ने कार्बनिक रेडिकल (रसायन विज्ञान) और कार्बेनियम आयनों को तैयार करने और अध्ययन करने के लिए क्षय तकनीक की कल्पना की थी।[29] उस तकनीक के एक प्रकार में, मेथोनियम केशन जैसी विदेशी प्रजातियाँ कार्बनिक यौगिकों [3HeT]+ के साथ प्रतिक्रिया करके उत्पन्न की जाती हैं जो T2 के क्षय से उत्पन्न होता है जिसे वांछित अभिकर्मकों के साथ मिलाया जाता है। इस प्रकार [HeH]+ के रसायन विज्ञान के बारे में हम जो कुछ भी जानते हैं वह इस तकनीक के माध्यम से आया है। [30]
न्युट्रीनो द्रव्यमान प्रयोगों के लिए निहितार्थ
1980 में, मॉस्को में सैद्धांतिक और प्रायोगिक भौतिकी संस्थान प्रयोगशाला में वी. लुबिमोव (हुबिमोव) ने ट्रिटियम के β क्षय के ऊर्जा स्पेक्ट्रम का विश्लेषण करके, न्यूट्रिनो के लिए हल्के महत्वपूर्ण रेस्ट द्रव्यमान (30 ± 16) ईवी का पता लगाने का प्रमाणित किया था। [31] यह प्रमाणित विवादित था, और विभिन्न अन्य समूहों ने आणविक ट्रिटियम T
2 के क्षय का अध्ययन करके इसकी जांच की थी यह ज्ञात था कि उस क्षय से निकलने वाली कुछ ऊर्जा [3HeT]+ को क्षय उत्पादों के उत्तेजना में परिवर्तित कर दिया जाता है ; और यह घटना उस प्रयोग में त्रुटि का महत्वपूर्ण स्रोत हो सकती है। इस अवलोकन ने उन मापों की अनिश्चितता को कम करने के लिए उस आयन की अपेक्षित ऊर्जा स्थितियों की स्पष्ट गणना करने के लिए विभिन्न प्रयासों को प्रेरित किया था। तब से विभिन्न लोगों ने गणनाओं में सुधार किया है, और अब गणना और प्रयोगात्मक गुणों के मध्य अधिक अच्छा समझौता है; आइसोटोपोलॉग्स सहित [4He2H]+, [3He1H]+, और [3He2H]+ है.[17][12]
वर्णक्रमीय पूर्वानुमान और संसूचन
1956 में, एम. केंटवेल ने सैद्धांतिक रूप से पूर्वानुमान किया था कि उस आयन के कंपन का स्पेक्ट्रम अवरक्त में देखने योग्य होना चाहिए; और ड्यूटेरियम और सामान्य हाइड्रोजन आइसोटोपोलॉग्स ([3HeD]+ और [3He1H]+) का स्पेक्ट्रा दृश्य प्रकाश के निकट होना चाहिए और इसलिए निरीक्षण करना सरल होना चाहिए। [11] इस प्रकार [4He1H]+ के स्पेक्ट्रम का संसूचन 1979 में डी. टॉलिवर और अन्य लोगों द्वारा 1,700 और 1,900 सेमी−1 के मध्य तरंग संख्या पर लगाया गया था।[32] 1982 में, पी. बर्नथ और टी. अमानो ने 2,164 और 3,158 तरंगों प्रति सेमी के मध्य नौ अवरक्त रेखाओं का पता लगाया था।
अंतरतारकीय अंतरिक्ष
इस प्रकार HeH+ के बारे में 1970 के दशक से लंबे समय से अनुमान लगाया जाता रहा है कि वह अंतरतारकीय माध्यम में उपस्थित है।[33] नेबुला एनजीसी 7027 में इसका पहला पता अप्रैल 2019 में नेचर जर्नल में प्रकाशित लेख में बताया गया था।[4]
प्राकृतिक घटना
ट्रिटियम के क्षय से
हीलियम हाइड्राइड आयन एचटी अणु या ट्रिटियम अणु T2 में ट्रिटियम के क्षय के समय बनता है। यद्यपि बीटा क्षय से पुनरावृत्ति से उत्साहित होकर, अणु साथ बंधे रहते हैं।[34]
अंतरतारकीय माध्यम
ऐसा माना जाता है कि यह ब्रह्मांड में बनने वाला पहला यौगिक है,[2] और प्रारंभिक ब्रह्मांड के रसायन विज्ञान को समझने में मौलिक महत्व रखता है।[35] ऐसा इसलिए है क्योंकि बिग बैंग न्यूक्लियोसिंथेसिस में हाइड्रोजन और हीलियम लगभग एकमात्र प्रकार के परमाणु बने थे। मौलिक पदार्थ से बने तारों में HeH+ होना चाहिए, जो उनके गठन और उसके पश्चात के विकास को प्रभावित कर सकता है। विशेष रूप से, इसका सशक्त आणविक द्विध्रुवीय क्षण इसे धात्विकता या सितारे या शून्य-धात्विकता तारों की अपारदर्शिता के लिए प्रासंगिक बनाता है।[2] इस प्रकार HeH+ को हीलियम युक्त सफेद बौनों के वायुमंडल का महत्वपूर्ण घटक भी माना जाता है, जहां यह गैस की अपारदर्शिता को बढ़ाता है और तारे को अधिक धीरे-धीरे ठंडा करने का कारण बनता है।[36]
घने अंतरतारकीय बादलों में विघटनकारी झटकों के पीछे ठंडी गैस में HeH+ का निर्माण हो सकता है, जैसे कि तारकीय वायु, सुपरनोवा और युवा सितारों से बाहर निकलने वाली पदार्थ के कारण होने वाले झटके है। यदि झटके की गति लगभग 90 kilometres per second (56 mi/s) से अधिक है तो पता लगाने के लिए पर्याप्त मात्रा में झटका लगाया जा सकता है। यदि HeH+ से उत्सर्जन का पता लगाया जाता है तो यह झटके का उपयोगी पता लगाने वाला होता है।[37]
इस प्रकार संभावित स्थानों के रूप में विभिन्न स्थानों का सुझाव दिया गया था जहां HeH+ का पता लगाया जा सकता है। इनमें ठंडे हीलियम तारे, [2] एच II क्षेत्र, [37] और घने ग्रह नीहारिकाएं, [37] जैसे एनजीसी 7027, [35] सम्मिलित हैं, जहां, अप्रैल 2019 में, HeH+ का पता चलने की सूचना मिली थी।[4]
यह भी देखें
- डाइहाइड्रोजन धनायन
- ट्राइहाइड्रोजन धनायन
संदर्भ
- ↑ "hydridohelium(1+) (CHEBI:33688)". Chemical Entities of Biological Interest (ChEBI). European Bioinformatics Institute.
- ↑ 2.0 2.1 2.2 2.3 2.4 Engel, Elodie A.; Doss, Natasha; Harris, Gregory J.; Tennyson, Jonathan (2005). "Calculated spectra for HeH+ and its effect on the opacity of cool metal-poor stars". Monthly Notices of the Royal Astronomical Society. 357 (2): 471–477. arXiv:astro-ph/0411267. Bibcode:2005MNRAS.357..471E. doi:10.1111/j.1365-2966.2005.08611.x. S2CID 17507960.
- ↑ 3.0 3.1 "Hydridohelium (CHEBI:33689)". Chemical Entities of Biological Interest (ChEBI). European Bioinformatics Institute.
- ↑ 4.0 4.1 4.2 Güsten, Rolf; Wiesemeyer, Helmut; Neufeld, David; Menten, Karl M.; Graf, Urs U.; Jacobs, Karl; Klein, Bernd; Ricken, Oliver; Risacher, Christophe; Stutzki, Jürgen (April 2019). "Astrophysical detection of the helium hydride ion HeH+". Nature. 568 (7752): 357–359. arXiv:1904.09581. Bibcode:2019Natur.568..357G. doi:10.1038/s41586-019-1090-x. PMID 30996316. S2CID 119548024.
- ↑ Andrews, Bill (22 December 2019). "वैज्ञानिकों ने ब्रह्मांड का पहला अणु खोजा". Discover. Retrieved 22 December 2019.
- ↑ 6.0 6.1 6.2 6.3 Hogness, T. R.; Lunn, E. G. (1925). "सकारात्मक किरण विश्लेषण द्वारा व्याख्या के अनुसार इलेक्ट्रॉन प्रभाव द्वारा हाइड्रोजन का आयनीकरण". Physical Review. 26 (1): 44–55. Bibcode:1925PhRv...26...44H. doi:10.1103/PhysRev.26.44.
- ↑ Coxon, J.; Hajigeorgiou, P. G. (1999). "Experimental Born–Oppenheimer Potential for the X1Σ+ Ground State of HeH+: Comparison with the Ab Initio Potential". Journal of Molecular Spectroscopy. 193 (2): 306–318. Bibcode:1999JMoSp.193..306C. doi:10.1006/jmsp.1998.7740. PMID 9920707.
- ↑ Dias, A. M. (1999). "Dipole Moment Calculation to Small Diatomic Molecules: Implementation on a Two-Electron Self-Consistent-Field ab initio Program" (PDF). Rev da Univ de Alfenas. 5 (1): 77–79. Archived from the original (PDF) on 2019-04-19. Retrieved 2019-02-23.
- ↑ Dey, Bijoy Kr.; Deb, B. M. (April 1999). "समय-निर्भर एकल हाइड्रोडायनामिकल समीकरण के माध्यम से परमाणुओं और अणुओं के लिए जमीनी-स्थिति इलेक्ट्रॉनिक ऊर्जा और घनत्व की प्रत्यक्ष प्रारंभिक गणना". The Journal of Chemical Physics. 110 (13): 6229–6239. Bibcode:1999JChPh.110.6229D. doi:10.1063/1.478527.
- ↑ Coyne, John P.; Ball, David W. (2009). "Alpha particle chemistry. On the formation of stable complexes between He2+ and other simple species: implications for atmospheric and interstellar chemistry". Journal of Molecular Modeling. 15 (1): 35–40. doi:10.1007/s00894-008-0371-3. PMID 18936986. S2CID 7163073.
- ↑ 11.0 11.1 11.2 11.3 Cantwell, Murray (1956). "बीटा क्षय में आणविक उत्तेजना". Physical Review. 101 (6): 1747–1756. Bibcode:1956PhRv..101.1747C. doi:10.1103/PhysRev.101.1747..
- ↑ 12.0 12.1 12.2 12.3 12.4 Tung, Wei-Cheng; Pavanello, Michele; Adamowicz, Ludwik (2012-10-28). "Accurate potential energy curves for HeH+ isotopologues". The Journal of Chemical Physics. AIP Publishing. 137 (16): 164305. Bibcode:2012JChPh.137p4305T. doi:10.1063/1.4759077. ISSN 0021-9606. PMID 23126708.
- ↑ Schwartz, H. M. (1955). "घटक परमाणु के बीटा क्षय में अणुओं का उत्तेजना". Journal of Chemical Physics. 23 (2): 400–401. Bibcode:1955JChPh..23R.400S. doi:10.1063/1.1741982.
- ↑ Snell, Arthur H.; Pleasonton, Frances; Leming, H. E. (1957). "Molecular dissociation following radioactive decay: Tritium hydride". Journal of Inorganic and Nuclear Chemistry. 5 (2): 112–117. doi:10.1016/0022-1902(57)80051-7.
- ↑ 15.0 15.1 15.2 Bainbridge, Kenneth T. (1933). "Comparison of the Masses of H2 and Helium". Physical Review. 44 (1): 57. Bibcode:1933PhRv...44...57B. doi:10.1103/PhysRev.44.57.
- ↑ Bernath, P.; Amano, T. (1982). "Detection of the Infrared Fundamental Band of HeH+". Physical Review Letters. 48 (1): 20–22. Bibcode:1982PhRvL..48...20B. doi:10.1103/PhysRevLett.48.20.
- ↑ 17.0 17.1 Pachucki, Krzysztof; Komasa, Jacek (2012). "हीलियम हाइड्राइड आयन का रोवाइब्रेशनल स्तर". The Journal of Chemical Physics. 137 (20): 204314. Bibcode:2012JChPh.137t4314P. doi:10.1063/1.4768169. PMID 23206010.
- ↑ Möller, Thomas; Beland, Michael; Zimmerer, Georg (1985). "HeH अणु की प्रतिदीप्ति का अवलोकन". Physical Review Letters. 55 (20): 2145–2148. Bibcode:1985PhRvL..55.2145M. doi:10.1103/PhysRevLett.55.2145. PMID 10032060.
- ↑ "Wolfgang Ketterle: The Nobel Prize in Physics 2001". nobelprize.org.
- ↑ Ketterle, W.; Figger, H.; Walther, H. (1985). "बाध्य हीलियम हाइड्राइड का उत्सर्जन स्पेक्ट्रा". Physical Review Letters. 55 (27): 2941–2944. Bibcode:1985PhRvL..55.2941K. doi:10.1103/PhysRevLett.55.2941. PMID 10032281.
- ↑ 21.0 21.1 21.2 21.3 21.4 21.5 Grandinetti, Felice (October 2004). "Helium chemistry: a survey of the role of the ionic species". International Journal of Mass Spectrometry. 237 (2–3): 243–267. Bibcode:2004IJMSp.237..243G. doi:10.1016/j.ijms.2004.07.012.
- ↑ Cacace, Fulvio (1970). ट्रिटिएटेड अणुओं के क्षय से गैसीय कार्बोनियम आयन. Advances in Physical Organic Chemistry. Vol. 8. pp. 79–149. doi:10.1016/S0065-3160(08)60321-4. ISBN 9780120335084.
- ↑ 23.0 23.1 Lias, S. G.; Liebman, J. F.; Levin, R. D. (1984). "Evaluated Gas Phase Basicities and Proton Affinities of Molecules; Heats of Formation of Protonated Molecules". Journal of Physical and Chemical Reference Data. 13 (3): 695. Bibcode:1984JPCRD..13..695L. doi:10.1063/1.555719.
- ↑ Carrington, Alan; Gammie, David I.; Shaw, Andrew M.; Taylor, Susie M.; Hutson, Jeremy M. (1996). "Observation of a microwave spectrum of the long-range He⋯H+
2 complex". Chemical Physics Letters. 260 (3–4): 395–405. Bibcode:1996CPL...260..395C. doi:10.1016/0009-2614(96)00860-3. - ↑ Pauzat, F.; Ellinger, Y. (2005). "Where do noble gases hide in space?". In Markwick-Kemper, A. J. (ed.). Astrochemistry: Recent Successes and Current Challenges (PDF). Poster Book IAU Symposium No. 231. Vol. 231. Bibcode:2005IAUS..231.....L. Archived from the original (PDF) on 2007-02-02.
- ↑ Beach, J. Y. (1936). "Quantum‐Mechanical Treatment of Helium Hydride Molecule‐Ion HeH+". Journal of Chemical Physics. 4 (6): 353–357. Bibcode:1936JChPh...4..353B. doi:10.1063/1.1749857.
- ↑ Toh, Sôroku (1940). "Quantum-Mechanical Treatment of Helium-Hydride Molecule Ion HeH+". Proceedings of the Physico-Mathematical Society of Japan. 3rd Series. 22 (2): 119–126. doi:10.11429/ppmsj1919.22.2_119.
- ↑ Evett, Arthur A. (1956). "Ground State of the Helium‐Hydride Ion". Journal of Chemical Physics. 24 (1): 150–152. Bibcode:1956JChPh..24..150E. doi:10.1063/1.1700818.
- ↑ Cacace, Fulvio (1990). "आयन रसायन विज्ञान में परमाणु क्षय तकनीक". Science. 250 (4979): 392–399. Bibcode:1990Sci...250..392C. doi:10.1126/science.250.4979.392. PMID 17793014. S2CID 22603080.
- ↑ Speranza, Maurizio (1993). "कार्बोकेशन उत्पन्न करने के लिए ट्रिटियम". Chemical Reviews. 93 (8): 2933–2980. doi:10.1021/cr00024a010.
- ↑ Lubimov, V.A.; Novikov, E.G.; Nozik, V.Z.; Tretyakov, E.F.; Kosik, V.S. (1980). "An estimate of the νe mass from the β-spectrum of tritium in the valine molecule". Physics Letters B. 94 (2): 266–268. Bibcode:1980PhLB...94..266L. doi:10.1016/0370-2693(80)90873-4..
- ↑ Tolliver, David E.; Kyrala, George A.; Wing, William H. (1979-12-03). "Observation of the Infrared Spectrum of the Helium-Hydride Molecular Ion [4HeH]+". Physical Review Letters. American Physical Society (APS). 43 (23): 1719–1722. Bibcode:1979PhRvL..43.1719T. doi:10.1103/physrevlett.43.1719. ISSN 0031-9007.
- ↑ Fernández, J.; Martín, F. (2007). "Photoionization of the HeH+ molecular ion". Journal of Physics B. 40 (12): 2471–2480. Bibcode:2007JPhB...40.2471F. doi:10.1088/0953-4075/40/12/020. S2CID 120284828.
- ↑ Mannone, F., ed. (1993). ट्रिटियम हैंडलिंग प्रौद्योगिकी में सुरक्षा. Springer. p. 92. doi:10.1007/978-94-011-1910-8_4. ISBN 978-94-011-1910-8.
- ↑ 35.0 35.1 Liu, X.-W.; Barlow, M. J.; Dalgarno, A.; Tennyson, J.; Lim, T.; Swinyard, B. M.; Cernicharo, J.; Cox, P.; Baluteau, J.-P.; Pequignot, D.; Nguyen, Q. R.; Emery, R. J.; Clegg, P. E. (1997). "An ISO Long Wavelength Spectrometer detection of CH in NGC 7027 and an HeH+ upper limit". Monthly Notices of the Royal Astronomical Society. 290 (4): L71–L75. Bibcode:1997MNRAS.290L..71L. doi:10.1093/mnras/290.4.l71.
- ↑ Harris, G. J.; Lynas-Gray, A. E.; Miller, S.; Tennyson, J. (2004). "The Role of HeH+ in Cool Helium-rich White Dwarfs". The Astrophysical Journal. 617 (2): L143–L146. arXiv:astro-ph/0411331. Bibcode:2004ApJ...617L.143H. doi:10.1086/427391. S2CID 18993175.
- ↑ 37.0 37.1 Roberge, W.; Delgarno, A. (1982). "The formation and destruction of HeH+ in astrophysical plasmas". The Astrophysical Journal. 255: 489–496. Bibcode:1982ApJ...255..489R. doi:10.1086/159849.