काइनेज: Difference between revisions
No edit summary |
No edit summary |
||
| (4 intermediate revisions by 4 users not shown) | |||
| Line 1: | Line 1: | ||
[[File:Active site of Dihydroxyacetone Kinase.png|thumb|upright=1.25|एक गैर-हाइड्रोलाइज़ेबल [[एडेनोसाइन ट्रायफ़ोस्फेट|एटीपी]] अनुरूप (एएमपी-पीएनपी) के साथ भीति में [[डायहाइड्रॉक्सीसिटोन]] काइनेज है। पीडीबी आईडी से निर्देशांक:1UN9 है।<ref>{{cite journal | vauthors = Siebold C, Arnold I, Garcia-Alles LF, Baumann U, HErnia B | title = Citrobacter freundii dihydroxyacetone kinase की क्रिस्टल संरचना से आठ-फंसे हुए अल्फा-हेलिकल बैरल AKTP-बाइंडिंग डोमेन का पता चलता है| journal = The Journal of Biological Chemistry | volume = 278 | issue = 48 | pages = 48236–48244 | date = November 2003 | pmid = 12966101 | doi = 10.1074/jbc.M305942200 | doi-access = free }}</ref>]]जैव रसायन में, '''काइनेज''' ({{IPAc-en|ˈ|k|aɪ|n|eɪ|s|,_|ˈ|k|ɪ|n|eɪ|s|,_|-|eɪ|z}})<ref>{{cite Dictionary.com|kinase|access-date=2022-06-18}}</ref> एक [[एंजाइम|किण्वक]] है जो उच्च-ऊर्जा[[ फास्फेट ]]दान करने वाले अणुओं से विशिष्ट [[सब्सट्रेट (जैव रसायन)|अवस्तरों]] तक फॉस्फेट समूहों के स्थानान्तरण को उत्प्रेरित करता है। इस प्रक्रिया को [[फास्फारिलीकरण]] के रूप में जाना जाता है, जहां उच्च-ऊर्जा एडेनोसिन ट्राइफॉस्फेट अणु [[सब्सट्रेट (जीव विज्ञान)|अवस्तर]] अणुओं को फॉस्फेट समूह दान करता है। यह [[ट्रान्सएस्टरीफिकेशन]] एक फॉस्फोराइलेटेड अवस्तर और [[एडेनोसिन डिपोस्फेट|एडीपी]] का उत्पादन करता है। इसके विपरीत, इसे [[dephosphorylation|विफॉस्फोरिलन]] के रूप में संदर्भित किया जाता है जब फॉस्फोराइलेटेड अवस्तर एक फॉस्फेट समूह दान करता है और एडीपी एक फॉस्फेट समूह प्राप्त करता है (डीफॉस्फोराइलेटेड अवस्तर और एटीपी के उच्च ऊर्जा अणु का उत्पादन करता है)। ये दो प्रक्रियाएं, फॉस्फोरिलीकरण और विफॉस्फोरिलन [[ग्लाइकोलाइसिस|ग्लाइकोलिसिस]] के पर्यन्त चार बार होती हैं।<ref name="pmid12471243">{{cite journal | vauthors = Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S | title = प्रोटीन किनेज मानव जीनोम का पूरक है| journal = Science | volume = 298 | issue = 5600 | pages = 1912–1934 | date = December 2002 | pmid = 12471243 | doi = 10.1126/science.1075762 | s2cid = 26554314 | bibcode = 2002Sci...298.1912M }}</ref><ref>{{cite web|title=काइनेज|url=http://www.thefreedictionary.com/काइनेजs}} TheFreeDictionary.com</ref><ref>{{cite web |url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1997/illpres/history.html |title=एटीपी से संबंधित रसायन विज्ञान से एटीपी अनुसंधान मील के पत्थर का इतिहास|publisher= Nobelprize.org}}</ref> | |||
काइनेज [[फॉस्फोट्रांसफेरेज]]़ के बड़े समूह का हिस्सा हैं। काइनेज को [[phosphorylase|फ़ॉस्फ़ोरिलेज़]] के साथ भ्रमित नहीं होना चाहिए, जो एक स्वीकर्ता को अकार्बनिक [[फॉस्फेट]] समूहों को जोड़ने के लिए उत्प्रेरित करता है, न ही फॉस्फेटेज़ के साथ, जो फॉस्फेट समूहों (विफॉस्फोरिलन) को हटाते हैं। एक अणु की फास्फारिलीकरण अवस्था, चाहे वह [[प्रोटीन]], [[लिपिड|वसा]] या [[कार्बोहाइड्रेट]] हो, उसकी गतिविधि, प्रतिक्रियाशीलता और अन्य अणुओं को बांधने की क्षमता को प्रभावित कर सकती है। इसलिए, काइनेज चयापचय, [[सेल सिग्नलिंग|कोशिका संकेतन]], प्रोटीन विनियमन, कोशिकीय मार्ग, स्रावी प्रक्रियाओं और कई अन्य कोशिकीय मार्गों में महत्वपूर्ण हैं, जो उन्हें शरीर विज्ञान के लिए बहुत महत्वपूर्ण बनाता है। | |||
[[File:Active site of Dihydroxyacetone Kinase.png|thumb|upright=1.25|एक गैर-हाइड्रोलाइज़ेबल [[एडेनोसाइन ट्रायफ़ोस्फेट]] | |||
== जैव रसायन और कार्यात्मक प्रासंगिकता == | == जैव रसायन और कार्यात्मक प्रासंगिकता == | ||
[[File:Basic phosphorylation reaction.png|thumb|upright=3|सामान्य प्रतिक्रिया जो काइनेज द्वारा उत्प्रेरित होती | [[File:Basic phosphorylation reaction.png|thumb|upright=3|सामान्य प्रतिक्रिया जो काइनेज द्वारा उत्प्रेरित होती है।]]काइनेज एक उच्च ऊर्जा अणु (जैसे एटीपी) से फॉस्फेट की मात्रा को उनके अवस्तर अणुओं में स्थानांतरित करने में मध्यस्थता करते हैं, जैसा कि नीचे दिए गए चित्र में देखा गया है। इस प्रतिक्रिया को स्थिर करने के लिए काइनेज की आवश्यकता होती है क्योंकि [[ फॉस्फॉनहाइड्राइड |फॉस्फॉनहाइड्राइड]] बंधन में उच्च स्तर की ऊर्जा होती है। काइनेज अपने सक्रिय स्थलों के भीतर अपने अवस्तरों और फॉस्फोरिल समूहों को ठीक से उन्मुख करते हैं, जिससे प्रतिक्रिया की दर बढ़ जाती है। इसके अतिरिक्त, वे सामान्यतः धन आवेशित किए गए [[ एमिनो एसिड |अमीनो अम्ल]] अवशेषों का उपयोग करते हैं, जो ऋणआवेशित किए गए फॉस्फेट समूहों के साथ अन्योन्यक्रिया करके इलेक्ट्रोस्टैटिक रूप से संक्रमण की स्थिति को स्थिर करते हैं। वैकल्पिक रूप से, कुछ काइनेज फॉस्फेट समूहों को समन्वयित करने के लिए अपनी सक्रिय स्थलों में बाध्य धातु सहकारकों का उपयोग करते हैं। प्रोटीन काइनेज को उत्प्रेरक रूप से सक्रिय (विहित) या स्यूडोकाइनेज के रूप में वर्गीकृत किया जा सकता है, जो एक या अधिक उत्प्रेरक अमीनो अम्ल के विकासवादी हानि को दर्शाता है जो एटीपी को स्थिति या हाइड्रोलाइज करता है।<ref name="pmid24818526">{{cite journal | vauthors = Reiterer V, Eyers PA, Farhan H | title = Day of the dead: pseudokinases and pseudophosphatases in physiology and disease | journal = Trends in Cell Biology | volume = 24 | issue = 9 | pages = 489–505 | date = September 2014 | pmid = 24818526 | doi = 10.1016/j.tcb.2014.03.008 }}</ref> हालांकि, संकेतन बहिर्गत और रोग प्रासंगिकता के संदर्भ में, काइनेज और स्यूडोकाइनेज दोनों ही मानव कोशिकाओं में महत्वपूर्ण संकेतन मॉड्यूलेटर हैं, जो काइनेज को बहुत महत्वपूर्ण औषधि लक्ष्य बनाते हैं।<ref>Foulkes DM, Byrne DP and Eyers PA (2017) Pseudokinases: update on their functions and evaluation as new drug targets. Future Med Chem. 9(2):245-265</ref> | ||
संकेतों को प्रसारित करने और कोशिकाओं में जटिल प्रक्रियाओं को विनियमित करने के लिए काइनेज का बड़े पैमाने पर उपयोग किया जाता है। अणुओं का फॉस्फोरिलीकरण उनकी गतिविधि को बढ़ा या बाधित कर सकता है और अन्य अणुओं के साथ अन्योन्यक्रिया करने की उनकी क्षमता को नियंत्रित कर सकता है। फॉस्फोरिल समूहों को जोड़ने और हटाने से कोशिका को नियंत्रण का साधन मिलता है क्योंकि विभिन्न काइनेज विभिन्न स्थितियों या संकेतों पर प्रतिक्रिया कर सकते हैं। काइनेज में उत्परिवर्तन जो कार्य में हानि या कार्य में लाभ का कारण बनते हैं, कैंसर का कारण बन सकते हैं<ref>{{cite news| vauthors = Samarasinghe B |title=कैंसर के लक्षण 1|url=http://blogs.scientificamerican.com/guest-blog/2013/09/18/hallmarks-of-cancer-1-self-sufficiency-in-growth-signals|newspaper=Scientific American}}</ref> और मनुष्यों में रोग, जिनमें कुछ प्रकार के [[ लेकिमिया | श्वेतरक्तता]] और [[न्यूरोब्लास्टोमा|तंत्रिका कोशिकाप्रसू अर्बुद]], [[ ग्लयोब्लास्टोमा |तंत्रीबंधप्रसू अर्बुद]],<ref>{{cite journal | vauthors = Bleeker FE, Lamba S, Zanon C, Molenaar RJ, Hulsebos TJ, Troost D, van Tilborg AA, Vandertop WP, Leenstra S, van Noorden CJ, Bardelli A | display-authors = 6 | title = ग्लियोब्लास्टोमा में किनेसेस की पारस्परिक रूपरेखा| journal = BMC Cancer | volume = 14 | pages = 718 | date = September 2014 | pmid = 25256166 | pmc = 4192443 | doi = 10.1186/1471-2407-14-718 }}</ref> [[स्पिनोसेरेबेलर गतिभंग|सुषुम्ना अनुमस्तिष्क गतिविभ्रम]] (प्रकार 14), [[एग्माग्लोबुलिनमिया|अगामाग्लोबुलिनरक्तता]] के रूप और कई अन्य सम्मिलित हैं।<ref>{{cite journal | vauthors = Lahiry P, Torkamani A, Schork NJ, Hegele RA | title = Kinase mutations in human disease: interpreting genotype-phenotype relationships | journal = Nature Reviews. Genetics | volume = 11 | issue = 1 | pages = 60–74 | date = January 2010 | pmid = 20019687 | doi = 10.1038/nrg2707 | s2cid = 37398118 }}</ref> | |||
== इतिहास और वर्गीकरण == | == इतिहास और वर्गीकरण == | ||
<!-- Commented out: [[File:Edwin G. Krebs.jpg|thumb|Edwin Krebs won the Nobel prize in physiology or medicine in 1992 for his contributions to enzymology. He described how phosphorylation is reversible and acts a switch to regulate metabolic processes as well as other cellular pathways.]] --> | <!-- Commented out: [[File:Edwin G. Krebs.jpg|thumb|Edwin Krebs won the Nobel prize in physiology or medicine in 1992 for his contributions to enzymology. He described how phosphorylation is reversible and acts a switch to regulate metabolic processes as well as other cellular pathways.]] --> | ||
एटीपी का उपयोग करके किसी अन्य प्रोटीन के फास्फारिलीकरण को उत्प्रेरित करने वाले पहले प्रोटीन को 1954 में | एटीपी का उपयोग करके किसी अन्य प्रोटीन के फास्फारिलीकरण को उत्प्रेरित करने वाले पहले प्रोटीन को 1954 में यूजीन पी. कैनेडी द्वारा देखा गया था, उस समय उन्होंने एक यकृत किण्वक का वर्णन किया था जो कैसीन के फास्फारिलीकरण को उत्प्रेरित करता था।{{cn|date=March 2023}} 1956 में, एडमंड एच. फिशर और एडविन जी. क्रेब्स ने पाया कि फॉस्फोरिलेज़ a और फॉस्फोरिलेज़ b के मध्य अंतर-रूपांतरण फास्फारिलीकरण और विफॉस्फोरिलन द्वारा मध्यस्थ था।<ref>{{cite journal | vauthors = Krebs EG | title = प्रोटीन फास्फारिलीकरण पर ऐतिहासिक दृष्टिकोण और प्रोटीन किनेसेस के लिए एक वर्गीकरण प्रणाली| journal = Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences | volume = 302 | issue = 1108 | pages = 3–11 | date = July 1983 | pmid = 6137005 | doi = 10.1098/rstb.1983.0033 | doi-access = free | bibcode = 1983RSPTB.302....3K }}</ref> जिस काइनेज ने फॉस्फोरिल समूह को फॉस्फोरिलेज़ b में स्थानांतरित कर दिया, उसे फॉस्फोरिलेज़ a में परिवर्तित कर दिया, उसे फॉस्फोरिलेज़ काइनेज नाम दिया गया। वर्षों बाद, काइनेज कैस्केड के पहले उदाहरण की पहचान की गई, जिससे प्रोटीन काइनेज a (PKA) फॉस्फोराइलेट फॉस्फोराइलेज काइनेज होता है। उसी समय, यह पाया गया कि पीकेए ने [[ग्लाइकोजन]] सिंथेज़ को बाधित किया, जो फास्फारिलीकरण घटना का पहला उदाहरण था जिसके परिणामस्वरूप अवरोध हुआ। 1969 में, लेस्टर रीड ने पाया कि फॉस्फोराइलेशन द्वारा [[पाइरूवेट डिहाइड्रोजनेज]] को निष्क्रिय कर दिया गया था, और यह खोज पहला संकेत था कि फास्फारिलीकरण ग्लाइकोजन चयापचय के अतिरिक्त अन्य अन्य चयापचय मार्गों में विनियमन के साधन के रूप में कार्य कर सकता है। उसी वर्ष, टॉम लैंगन ने पाया कि पीकेए फॉस्फोराइलेट्स हिस्टोन एच1, जिसने सुझाव दिया कि फास्फारिलीकरण नॉनजाइमेटिक प्रोटीन को नियंत्रित कर सकता है। 1970 के दशक में Ca2+/शांतोडुलिन-आश्रित प्रोटीन काइनेज की खोज और यह पता लगाना सम्मिलित था कि प्रोटीन को एक से अधिक अमीनो अम्ल अवशेषों पर फास्फोराइलेट किया जा सकता है। 1990 के दशक को "प्रोटीन काइनेज कैस्केड का दशक" के रूप में वर्णित किया जा सकता है। इस समय के पर्यन्त, एमएपीके/ईआरके मार्ग, जेएके, [[janus kinase|काइनेज]] (प्रोटीन टाइरोसिन काइनेज का एक समूह) और पीआईपी3-आश्रित काइनेज कैस्केड की खोज की गई।<ref name="origins">{{cite journal | vauthors = Corbellino M, Poirel L, Aubin JT, Paulli M, Magrini U, Bestetti G, Galli M, Parravicini C | display-authors = 6 | title = The role of human herpesvirus 8 and Epstein-Barr virus in the pathogenesis of giant lymph node hyperplasia (Castleman's disease) | journal = Clinical Infectious Diseases | volume = 22 | issue = 6 | pages = 1120–1121 | date = June 1996 | pmid = 8783733 | doi = 10.1093/clinids/22.6.1120 | doi-access = free }}</ref> | ||
काइनेज को उन अवस्तरों के आधार पर व्यापक समूहों में वर्गीकृत किया जाता है जिन पर वे कार्य करते हैं: प्रोटीन काइनेज, वसा काइनेज, कार्बोहाइड्रेट काइनेज है। काइनेज विभिन्न प्रकार की प्रजातियों में पाए जा सकते हैं, जीवाणु से लेकर फफूंद तक, कीड़े से लेकर स्तनधारी तक है।<ref>{{cite journal | vauthors = Scheeff ED, Bourne PE | title = प्रोटीन किनेज-जैसे सुपरफैमिली का संरचनात्मक विकास| journal = PLOS Computational Biology | volume = 1 | issue = 5 | pages = e49 | date = October 2005 | pmid = 16244704 | pmc = 1261164 | doi = 10.1371/journal.pcbi.0010049 | bibcode = 2005PLSCB...1...49S }}</ref> मनुष्यों में पाँच सौ से अधिक विभिन्न काइनेज की पहचान की गई है।<ref name="pmid12471243" />उनकी विविधता और संकेतन में उनकी भूमिका उन्हें अध्ययन का एक रोचक उद्देश्य बनाती है। कई अन्य काइनेज छोटे अणुओं जैसे कि वसा, कार्बोहाइड्रेट, अमीनो अम्ल और [[न्यूक्लियोटाइड]] पर या तो संकेत देने के लिए या उन्हें चयापचय मार्गों के लिए तैयार करने के लिए कार्य करते हैं। विशिष्ट काइनेज का नाम प्रायः उनके अवस्तरों के नाम पर रखा जाता है। प्रोटीन काइनेज में प्रायः कई अवस्तर होते हैं और प्रोटीन एक से अधिक विशिष्ट काइनेज के लिए अवस्तरों के रूप में कार्य कर सकते हैं। इस कारण से प्रोटीन काइनेज का नाम उनकी गतिविधि को नियंत्रित करने के आधार पर रखा गया है (अर्थात शांतोडुलिन-आश्रित प्रोटीन काइनेज)। कभी-कभी उन्हें आगे श्रेणियों में विभाजित किया जाता है क्योंकि कई आइसोएंजाइमेटिक रूप होते हैं। उदाहरण के लिए, प्रकार I और प्रकार II चक्रीय-एएमपी आश्रित प्रोटीन काइनेज में समान उत्प्रेरक उप-इकाई होते हैं लेकिन अलग-अलग नियामक उप-इकाई होते हैं जो चक्रीय एएमपी को बांधते हैं।<ref name="krebs lec">{{cite journal | vauthors = Krebs EG | title = The phosphorylation of proteins: a major mechanism for biological regulation. Fourteenth Sir Frederick Gowland Hopkins memorial lecture | journal = Biochemical Society Transactions | volume = 13 | issue = 5 | pages = 813–820 | date = October 1985 | pmid = 2998902 | doi = 10.1042/bst0130813 }}</ref> | |||
== प्रोटीन काइनेज == | == प्रोटीन काइनेज == | ||
[[File:signal transduction pathways.png|thumb|upright=2|right|सिग्नल ट्रांसडक्शन पाथवे का अवलोकन। इसमें सम्मिलित कई प्रोटीन काइनेज हैं, जिनमें प्रोटीन काइनेज (जैसे [[MAPK]] और जानूस काइनेज) और | [[File:signal transduction pathways.png|thumb|upright=2|right|सिग्नल ट्रांसडक्शन पाथवे का अवलोकन। इसमें सम्मिलित कई प्रोटीन काइनेज हैं, जिनमें प्रोटीन काइनेज (जैसे [[MAPK|एमएपीके]] और जानूस काइनेज) और वसा काइनेज (जैसे [[PI3K|पीआई3के]]) सम्मिलित हैं।]] | ||
{{main|प्रोटीन काइनेज}} | {{main|प्रोटीन काइनेज}} | ||
प्रोटीन काइनेज प्रोटीन पर उनके सेरीन, | प्रोटीन काइनेज प्रोटीन पर उनके सेरीन, थ्रियोनीन, टायरोसीन या हिस्टडीन अवशेषों पर फॉस्फेटन करके कार्य करते हैं। फास्फारिलीकरण प्रोटीन के कार्य को कई तरह से संशोधित कर सकता है। यह एक प्रोटीन की गतिविधि को बढ़ा या घटा सकता है, इसे स्थिर कर सकता है या इसे विनाश के लिए चिह्नित कर सकता है, इसे एक विशिष्ट कोशिकीय कोष्ठ के भीतर स्थानीयकृत कर सकता है और यह अन्य प्रोटीनों के साथ अपनी अन्योन्यक्रिया प्रारंभ या बाधित कर सकता है। प्रोटीन काइनेज सभी काइनेज का बहुमत बनाते हैं और इनका व्यापक रूप से अध्ययन किया जाता है।<ref>{{cite journal | vauthors = Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S | title = प्रोटीन किनेज मानव जीनोम का पूरक है| journal = Science | volume = 298 | issue = 5600 | pages = 1912–1934 | date = December 2002 | pmid = 12471243 | doi = 10.1126/science.1075762 | s2cid = 26554314 | bibcode = 2002Sci...298.1912M }}</ref> ये काइनेज, फॉस्फेटेस के संयोजन के साथ, प्रोटीन और किण्वक विनियमन के साथ-साथ कोशिका में संकेतन में एक प्रमुख भूमिका निभाते हैं। | ||
जब एक कोशिका जैविक विनियमन प्राप्त करने के विभिन्न तरीकों के विषय में विचार करती है तो भ्रम की एक सामान्य स्थिति उत्पन्न होती है। सहसंयोजक संशोधनों के अनगिनत उदाहरण हैं जो कोशिकीय प्रोटीन से गुजर सकते हैं; हालाँकि, फास्फारिलीकरण कुछ प्रतिवर्ती सहसंयोजक संशोधनों में से एक है। इससे यह तर्क मिला कि प्रोटीन का फास्फारिलीकरण नियामक है। प्रोटीन कार्य को विनियमित करने की क्षमता बहुत अधिक है, क्योंकि एलोस्टेरिक नियंत्रण द्वारा प्रदान किए गए विनियमन के अतिरिक्त प्रोटीन को सहसंयोजक रूप से संशोधित करने के कई तरीके हैं। अपने हॉपकिंस स्मारक व्याख्यान में, [[एडविन क्रेब्स]] ने जोर देकर कहा कि एलोस्टेरिक नियंत्रण कोशिका के भीतर से उत्पन्न होने वाले संकेतों पर प्रतिक्रिया करने के लिए विकसित हुआ, जबकि फास्फारिलीकरण कोशिका के बाहर संकेतों पर प्रतिक्रिया करने के लिए विकसित हुआ। यह विचार इस तथ्य के अनुरूप है कि प्रोटीन का फास्फारिलीकरण प्राकेंद्रकी कोशिकाओं की तुलना में सुकेंद्रकी कोशिकाओं में अधिक बार होता है क्योंकि अधिक जटिल कोशिका प्रकार संकेतों की एक विस्तृत श्रृंखला पर प्रतिक्रिया करने के लिए विकसित हुआ है।<ref name="krebs lec"/> | |||
=== | === साइक्लिनआश्रित काइनेज === | ||
साइक्लिन आश्रित काइनेज ( | साइक्लिन आश्रित काइनेज (CDK) [[कोशिका चक्र]] के नियमन में सम्मिलित कई अलग-अलग काइनेज का एक समूह है। वे अपने सेरीन या थ्रेओनीन अवशेषों पर अन्य प्रोटीनों को फास्फोराइलेट करते हैं, लेकिन सक्रिय होने के लिए सीडीके को पहले साइक्लिन प्रोटीन से बांधना होगा।<ref name="cdk review">{{cite journal | vauthors = Harper JW, Adams PD | title = साइक्लिन-आश्रित किनेसेस| journal = Chemical Reviews | volume = 101 | issue = 8 | pages = 2511–2526 | date = August 2001 | pmid = 11749386 | doi = 10.1021/cr0001030 }}</ref> विशिष्ट सीडीके और साइक्लिन के विभिन्न संयोजन कोशिका चक्र के विभिन्न भागों को चिन्हित करते हैं। इसके अतिरिक्त, सीडीके की फास्फारिलीकरण स्थिति भी उनकी गतिविधि के लिए महत्वपूर्ण है, क्योंकि वे अन्य काइनेज (जैसे [[सीडीके-सक्रिय करने वाले किनेज|सीडीके-सक्रिय करने वाले काइनेज]]) और [[ फास्फेटेजों |फॉस्फेटेस]] (जैसे [[सीडीसी25]]) द्वारा विनियमन के अधीन हैं।<ref>{{cite book| vauthors = Karp G |title=Cell and molecular biology : concepts and experiments|year=2010|publisher=John Wiley|location=Hoboken, NJ|isbn=9780470483374|edition=6th}}</ref> एक बार जब सीडीके सक्रिय हो जाते हैं, तो वे अपनी गतिविधि को बदलने के लिए अन्य प्रोटीनों को फॉस्फोराइलेट करते हैं, जिससे कोशिका चक्र के अगले चरण के लिए आवश्यक घटनाएं होती हैं। जबकि वे कोशिका चक्र नियंत्रण में अपने कार्य के लिए सबसे अधिक जाने जाते हैं, सीडीके की प्रतिलेखन, चयापचय और अन्य कोशिकीय घटनाओं में भी भूमिका होती है।<ref>{{cite journal | vauthors = Lim S, Kaldis P | title = Cdks, cyclins and CKIs: roles beyond cell cycle regulation | journal = Development | volume = 140 | issue = 15 | pages = 3079–3093 | date = August 2013 | pmid = 23861057 | doi = 10.1242/dev.091744 | doi-access = free }}</ref> | ||
कोशिका विभाजन को नियंत्रित करने में उनकी महत्वपूर्ण भूमिका के कारण, सीडीके में उत्परिवर्तन प्रायः | कोशिका विभाजन को नियंत्रित करने में उनकी महत्वपूर्ण भूमिका के कारण, सीडीके में उत्परिवर्तन प्रायः कैंसरयुक्त कोशिकाओं में पाए जाते हैं। इन उत्परिवर्तनों से कोशिकाओं की अनियंत्रित वृद्धि होती है, जहां वे तीव्रता से सम्पूर्ण कोशिका चक्र से बार-बार गुजरती हैं।<ref name="can">{{cite journal | vauthors = Canavese M, Santo L, Raje N | title = Cyclin dependent kinases in cancer: potential for therapeutic intervention | journal = Cancer Biology & Therapy | volume = 13 | issue = 7 | pages = 451–457 | date = May 2012 | pmid = 22361734 | doi = 10.4161/cbt.19589 | doi-access = free }}</ref> सीडीके उत्परिवर्तन [[ लिंफोमा | लिंफोमा]], [[स्तन कैंसर]], [[अग्न्याशय]] [[ फोडा |ट्यूमर]] और फेफड़ों के कैंसर में पाए जा सकते हैं। इसलिए, सीडीके के अवरोधकों को कुछ प्रकार के कैंसर के उपचार के रूप में विकसित किया गया है।<ref name="can" /> | ||
=== माइटोजेन-सक्रिय प्रोटीन काइनेज === | === माइटोजेन-सक्रिय प्रोटीन काइनेज === | ||
{{main| | {{main|माइटोजेन-सक्रिय प्रोटीन काइनेज}} | ||
एमएपी काइनेज (MAPK) सेरीन/थ्रेओनीन काइनेज का एक समूह है जो विभिन्न प्रकार के बाह्य विकास संकेतों पर प्रतिक्रिया करता है। उदाहरण के लिए, वृद्धि हार्मोन, अधिचर्मी वृद्धि कारक, पट्टिकाणु-व्युत्पन्न वृद्धि कारक और इंसुलिन सभी को माइटोजेनिक उत्तेजनाएं माना जाता है जो एमएपीके मार्ग को संलग्न कर सकते हैं। ग्राही के स्तर पर इस मार्ग का सक्रियण एक संकेतन कैस्केड प्रारंभ करता है जिससे जीडीपी के लिए [[ग्वानोसिन डाइफॉस्फेट|जीटी पेस जीटीपी]] का आदान-प्रदान करता है। इसके बाद, रास [[रफ किनसे|रफ काइनेज]] (जिसे एमएपीकेकेके के रूप में भी जाना जाता है) को सक्रिय करता है, जो एमईके (MAPKK) को सक्रिय करता है। एमईके एमएपीके (ईआरके भी कहा जाता है) को सक्रिय करता है, जो प्रतिलेखन और अनुवाद को विनियमित कर सकता है। जबकि आरएएफ और एमएपीके दोनों सेरीन/थ्रेओनीन काइनेज हैं, एमएपीकेके एक टायरोसिन/थ्रेओनीन काइनेज है। | |||
[[File:Components of the MAPK Pathway.png|thumb|upright=2|विभिन्न प्रकार के माइटोजेनिक सिग्नल एमएपीके मार्ग को संलग्न करते हैं और काइनेज कैस्केड के माध्यम से कोशिका के विकास और भेदभाव को बढ़ावा देते हैं।]] | [[File:Components of the MAPK Pathway.png|thumb|upright=2|विभिन्न प्रकार के माइटोजेनिक सिग्नल एमएपीके मार्ग को संलग्न करते हैं और काइनेज कैस्केड के माध्यम से कोशिका के विकास और भेदभाव को बढ़ावा देते हैं।]]एएमएपीके प्रत्यक्ष या अप्रत्यक्ष रूप से प्रतिलेखन कारकों को विनियमित कर सकता है। इसके प्रमुख प्रतिलेखन लक्ष्यों में एटीएफ-2, चॉप, सी-जून, सी-माइसी, डीपीसी4, एल्क-1, ईटीएस1, मैक्स, एमईएफ2सी, एनएफएटी4, एसएपी1ए, एसटीएटी, टैल, पी53, सीआरईबी, और माइसी सम्मिलित हैं। एमएपीके बड़े राइबोसोमल उप-इकाई में एस6 काइनेज को फॉस्फोराइलेट करके अनुवाद को भी नियंत्रित कर सकता है। यह रास, एसओएस और [[ईजीएफ रिसेप्टर|ईजीएफ ग्राही]] सहित एमएपीके संकेतन कैस्केड ऊर्ध्वप्रवाह हिस्से में घटकों को फॉस्फोराइलेट भी कर सकता है।<ref name="MAPK">{{cite journal | vauthors = Garrington TP, Johnson GL | title = माइटोजेन-एक्टिवेटेड प्रोटीन किनेज सिग्नलिंग पाथवे का संगठन और विनियमन| journal = Current Opinion in Cell Biology | volume = 11 | issue = 2 | pages = 211–218 | date = April 1999 | pmid = 10209154 | doi = 10.1016/s0955-0674(99)80028-3 }}</ref> | ||
एमएपीके मार्ग की | एमएपीके मार्ग की कैंसरजन्य क्षमता इसे चिकित्सकीय रूप से महत्वपूर्ण बनाती है। यह कोशिका प्रक्रियाओं में सम्मिलित होता है जो अनियंत्रित वृद्धि और बाद में ट्यूमर के गठन का कारण बन सकता है। इस मार्ग के भीतर उत्परिवर्तन कोशिका विभेदन, प्रसार, अस्तित्व और एपोप्टोसिस पर इसके नियामक प्रभावों को बदल देते हैं, जो सभी कैंसर के विभिन्न रूपों में सम्मिलित होते हैं।<ref name=MAPK /> | ||
== | == वसा काइनेज == | ||
वसा काइनेज कोशिका में वसा को प्लाज्मा झिल्ली के साथ-साथ कोशिकांग की झिल्लियों पर भी फास्फोराइलेट करता है। फॉस्फेट समूहों को जोड़ने से वसा की प्रतिक्रियाशीलता और स्थानीयकरण बदल सकता है और इसका उपयोग संकेत संचारण में किया जा सकता है। | |||
=== फॉस्फेटिडिलिनोसिटॉल काइनेज === | === फॉस्फेटिडिलिनोसिटॉल काइनेज === | ||
{{See also|फॉस्फेटिडिलिनोसिटॉल फॉस्फेट काइनेज}} | {{See also|फॉस्फेटिडिलिनोसिटॉल फॉस्फेट काइनेज}} | ||
[[phosphatidylinositol|फॉस्फेटिडिलिनोसिटॉल]] काइनेज फॉस्फोराइलेट फॉस्फेटिडिलिनोसिटोल | [[phosphatidylinositol|फॉस्फेटिडिलिनोसिटॉल]] काइनेज फॉस्फोराइलेट फॉस्फेटिडिलिनोसिटोल प्रजाति, फॉस्फेटिडिलिनोसोल 3,4-बिस्फोस्फेट (PI(3,4)P<sub>2</sub>), फॉस्फेटिडिलिनोसोल 3,4,5-ट्राइसफॉस्फेट (PIP<sub>3</sub>) और [[फॉस्फेटिडिलिनोसिटोल 3-फॉस्फेट]] (PI3P) जैसी प्रजातियां बनाने के लिए है। काइनेज में [[फॉस्फॉइनोसाइटाइड 3-किनासे|फॉस्फॉइनोसाइटाइड 3-काइनेज]] (PI3K), [[फॉस्फेटिडिलिनोसिटोल-4-फॉस्फेट 3-किनेज|फॉस्फेटिडिलिनोसिटोल-4-फॉस्फेट 3-काइनेज]], और फॉस्फेटिडिलिनोसिटोल-4,5-बिस्फोस्फेट 3-काइनेज सम्मिलित हैं। फॉस्फेटिडिलिनोसोलिटोल का फास्फारिलीकरण स्थिति [[सेलुलर सिग्नलिंग|कोशिकीय संकेतन]] में एक प्रमुख भूमिका निभाती है, जैसे इंसुलिन संकेतन मार्ग में, और [[एंडोसाइटोसिस]], [[एक्सोसाइटोसिस]] और अन्य तस्करी की घटनाओं में भी भूमिका निभाती है।<ref>{{cite journal | vauthors = Sun Y, Thapa N, Hedman AC, Anderson RA | title = Phosphatidylinositol 4,5-bisphosphate: targeted production and signaling | journal = BioEssays | volume = 35 | issue = 6 | pages = 513–522 | date = June 2013 | pmid = 23575577 | pmc = 3882169 | doi = 10.1002/bies.201200171 }}</ref><ref>{{cite journal | vauthors = Heath CM, Stahl PD, Barbieri MA | title = लिपिड कीनेज झिल्ली की तस्करी और सिग्नलिंग में महत्वपूर्ण और कई भूमिकाएँ निभाते हैं| journal = Histology and Histopathology | volume = 18 | issue = 3 | pages = 989–998 | date = July 2003 | pmid = 12792909 | doi = 10.14670/HH-18.989 }}</ref> इन काइनेज में उत्परिवर्तन, जैसे कि पीआई3के, कैंसर या [[इंसुलिन प्रतिरोध]] का कारण बन सकता है।<ref>{{cite journal| vauthors = Cantley LC |title=PI 3-kinase and disease|journal=BMC Proceedings|year=2012|volume=6|issue=Suppl 3|pages=O2|doi=10.1186/1753-6561-6-S3-O2 |pmc=3395034 |doi-access=free}}</ref> | ||
काइनेज़ किण्वक इनोसिटोल हाइड्रॉक्सिल समूह को अधिक न्यूक्लियोफिलिक बनाकर प्रतिक्रियाओं की दर में वृद्धि करते हैं, प्रायः एक सामान्य आधार के रूप में कार्य करने और हाइड्रॉक्सिल को डीप्रोटोनेट करने के लिए अमीनो अम्ल अवशेषों की ओर श्रृंखला का उपयोग करते हैं, जैसा कि नीचे क्रियाविधि में देखा गया है।<ref name="PI" />यहां, एडेनोसिन ट्राइफॉस्फेट (ATP) और फॉस्फेटिडिलिनोसिटोल के मध्य एक प्रतिक्रिया समन्वित होती है। अंतिम परिणाम एक फॉस्फेटिडिलिनोसिटोल-3-फॉस्फेट और साथ ही एडेनोसिन डिफॉस्फेट (ADP) है। प्रतिक्रिया को तीव्रता से आगे बढ़ाने के लिए किण्वक एटीपी अणु के साथ-साथ इनोसिटोल समूह को ठीक से उन्मुख करने में भी सहायता कर सकते हैं। इस उद्देश्य के लिए प्रायः धातु आयनों का समन्वय किया जाता है।<ref name="PI" /> | |||
=== | [[File:PI3kinase mechanism.png|thumb|upright=2.7|center|फॉस्फेटिडिलिनोसोल -3 काइनेज का क्रियातंत्र। एटीपी और फॉस्फेटिडिलिनोसिटोल सामान्य आधार B की सहायता से फॉस्फेटिडाइलिनोसिटॉल-3-फॉस्फेट और एडीपी बनाने के लिए प्रतिक्रिया करते हैं।।<ref name="PI">{{cite journal | vauthors = Miller S, Tavshanjian B, Oleksy A, Perisic O, Houseman BT, Shokat KM, Williams RL | title = Shaping development of autophagy inhibitors with the structure of the lipid kinase Vps34 | journal = Science | volume = 327 | issue = 5973 | pages = 1638–1642 | date = March 2010 | pmid = 20339072 | pmc = 2860105 | doi = 10.1126/science.1184429 | bibcode = 2010Sci...327.1638M }}</ref>]] | ||
स्फिंगोसिन काइनेज ( | |||
=== स्फिंगोसिन काइनेज === | |||
स्फिंगोसिन काइनेज (SK) एक वसा काइनेज है जो स्फिंगोसिन को [[स्फिंगोसिन-1-फॉस्फेट]] (S1P) में बदलने को उत्प्रेरित करता है। स्फिंगोलिपिड सर्वव्यापी झिल्ली झिल्लीदार वसा हैं। सक्रिय होने पर, स्फिंगोसिन काइनेज साइटोसोल से प्लाज्मा झिल्ली में स्थानांतरित हो जाता है जहां यह एटीपी या जीटीपी से γ फॉस्फेट (जो अंतिम या टर्मिनल फॉस्फेट है) को स्फिंगोसिन में स्थानांतरित करता है। एस1पी ग्राही एक [[GPCR|जीपीसीआर]] ग्राही है, इसलिए एस1पी में G प्रोटीन संकेतन को विनियमित करने की क्षमता है। परिणामी संकेत ईआरके, आरएचओ [[ग्वानोसिन डाइफॉस्फेट|जीटीपेस]], आरएसी [[ग्वानोसिन डाइफॉस्फेट|जीटीपेस]], पीएलसी और एकेटी/पीआई3के आंतरकोशिकीय प्रभावकों को सक्रिय कर सकता है। यह कोशिका के भीतर लक्षित अणुओं पर भी अपना प्रभाव डाल सकता है। एस1पी को एचडीएसी की हिस्टोन डीएसेटाइलेज़ गतिविधि को सीधे बाधित करने के लिए दर्शाया गया है। इसके विपरीत, डिफॉस्फोराइलेटेड स्फिंगोसिन कोशिका एपोप्टोसिस को बढ़ावा देता है, और इसलिए कोशिका भाग्य निर्धारित करने में इसकी भूमिका के कारण एसके के विनियमन को समझना महत्वपूर्ण है। पिछले शोध से पता चलता है कि एसके कैंसर कोशिका वृद्धि को बनाए रख सकते हैं क्योंकि वे कोशिकीय-प्रसार को बढ़ावा देते हैं और एसके1 (एसके का एक विशिष्ट प्रकार) कुछ प्रकार के कैंसर में उच्च सांद्रता में उपस्थित होता है। | |||
स्तनधारी कोशिकाओं, एसके1 और एसके2 में दो काइनेज उपस्थित हैं। एसके2 की तुलना में एसके1 अधिक विशिष्ट है और उनके अभिव्यक्ति प्रतिरूप भी भिन्न होते हैं। एसके1 को फेफड़े, प्लीहा और श्वेताणु कोशिकाओं में व्यक्त किया जाता है, जबकि एसके2 को गुर्दे और यकृत कोशिकाओं में व्यक्त किया जाता है। कोशिका अस्तित्व, प्रसार, विभेदन और [[सूजन|शोथ]] में इन दो काइनेज की भागीदारी उन्हें [[ कीमोथेरपी |रसोचिकित्सीय]] उपचारों के लिए व्यवहार्य पदान्वेषी बनाती है।<ref>{{cite journal | vauthors = Neubauer HA, Pitson SM | title = Roles, regulation and inhibitors of sphingosine kinase 2 | journal = The FEBS Journal | volume = 280 | issue = 21 | pages = 5317–5336 | date = November 2013 | pmid = 23638983 | doi = 10.1111/febs.12314 | doi-access = free }}</ref> | |||
== कार्बोहाइड्रेट काइनेज == | == कार्बोहाइड्रेट काइनेज == | ||
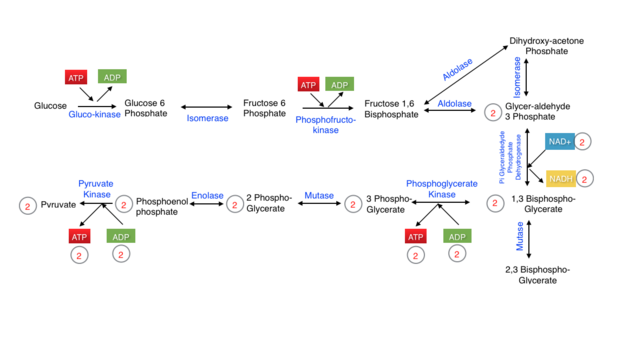
[[File:Glycolysis including irreversible steps.png | [[File:Glycolysis including irreversible steps.png| ग्लाइकोलाइसिस में चार फास्फारिलीकरण शामिल हैं, दो जो एडीपी से एटीपी बनाते हैं और दो जो एटीपी का उपयोग करते हैं और इसे एडीपी में परिवर्तित करते हैं। ग्लाइकोलाइसिस चयापचय का पहला चरण है और इसमें दस प्रतिक्रियाएँ शामिल हैं जिसके परिणामस्वरूप एक ग्लूकोज अणु दो पाइरूवेट अणुओं का उत्पादन करता है|635x635px]] | ||
कई स्तनधारियों के लिए, कार्बोहाइड्रेट दैनिक [[कैलोरी]] आवश्यकता का एक बड़ा हिस्सा प्रदान करते हैं। [[oligosaccharide|ओलिगोसैकेराइड]] से ऊर्जा प्राप्त करने के लिए, उन्हें पहले [[मोनोसैकराइड]] में तोड़ा जाना चाहिए ताकि वे चयापचय में प्रवेश कर सकें। काइनेज लगभग सभी उपापचयी मार्गों में एक महत्वपूर्ण भूमिका निभाते हैं। बाईं ओर का आंकड़ा ग्लाइकोलाइसिस के दूसरे चरण को दर्शाता है, जिसमें काइनेज द्वारा उत्प्रेरित दो महत्वपूर्ण प्रतिक्रियाएं सम्मिलित हैं। 1,3 बिसफ़ॉस्फ़ोग्लिसरेट में [[एनहाइड्राइड]] संयोजन अस्थिर है और इसमें उच्च ऊर्जा है। 1,3-बिसफ़ॉस्फ़ोग्लिसरेट काइनेज को 3-फ़ॉस्फ़ोग्लिसरेट और एटीपी देने वाली अपनी प्रतिक्रिया को पूर्ण करने के लिए एडीपी की आवश्यकता होती है। ग्लाइकोलाइसिस के अंतिम चरण में, पाइरूवेट काइनेज एक फॉस्फोरिल समूह को [[फ़ॉस्फ़ोनिओलपाइरूवेट]] से एडीपी में स्थानांतरित करता है, जिससे एटीपी और पाइरूवेट उत्पन्न होता है। | |||
[[Hexokinase|हेक्सोकाइनेज]] सबसे सामान्य किण्वक है जो पहली बार कोशिका में प्रवेश करने पर ग्लूकोज का उपयोग करता है। यह एटीपी के गामा फॉस्फेट को C6 स्थिति में स्थानांतरित करके डी-ग्लूकोज को ग्लूकोज-6-फॉस्फेट में परिवर्तित करता है। यह ग्लाइकोलाइसिस में एक महत्वपूर्ण चरण है क्योंकि यह ऋणात्मक आवेश के कारण ग्लूकोज को कोशिका के भीतर फंसा लेता है। अपने डीफॉस्फोराइलेटेड रूप में, ग्लूकोज बहुत सरलता से झिल्ली में आगे और पीछे जा सकता है।<ref name="Carb">{{cite journal | vauthors = Holzer H, Duntze W | title = एंजाइमों के रासायनिक संशोधन द्वारा चयापचय विनियमन| journal = Annual Review of Biochemistry | volume = 40 | pages = 345–374 | year = 1971 | pmid = 4399446 | doi = 10.1146/annurev.bi.40.070171.002021 }}</ref> हेक्सोकाइनेज वंशाणु में उत्परिवर्तन से [[हेक्सोकाइनेज की कमी|हेक्सोकाइनेज]] की कमी हो सकती है जो नॉनफेरोसाइटिक हेमोलिटिक [[ रक्ताल्पता |रक्ताल्पता]] का कारण बन सकती है।<ref>{{cite web|title=हेक्सोकाइनेज की कमी के कारण नॉनफेरोसाइटिक हेमोलिटिक एनीमिया|url=http://rarediseases.info.nih.gov/gard/3672/nonspherocytic-hemolytic-anemia-due-to-hexokinase-deficiency/resources/1|access-date=2014-02-24|archive-date=2015-09-05|archive-url=https://web.archive.org/web/20150905121422/https://rarediseases.info.nih.gov/gard/3672/nonspherocytic-hemolytic-anemia-due-to-hexokinase-deficiency/resources/1|url-status=dead}}</ref> | |||
[[फॉस्फोफ्रक्टोकिनेज|फॉस्फोफ्रक्टोकाइनेज]], या पीएफके, फ्रुक्टोज-6-फॉस्फेट को फ्रुक्टोज-1,6-बिस्फोस्फेट में परिवर्तित करने को उत्प्रेरित करता है और ग्लाइकोलाइसिस के नियमन में एक महत्वपूर्ण बिंदु है। एटीपी, एच+ और साइट्रेट का उच्च स्तर पीएफके को रोकता है। यदि साइट्रेट का स्तर ऊंचा है, तो इसका अर्थ है कि ग्लाइकोलाइसिस इष्टतम दर पर कार्य कर रहा है। एएमपी का उच्च स्तर पीएफके को उत्तेजित करता है। तारुई रोग, एक ग्लाइकोजन भंडारण रोग जो व्यायाम असहिष्णुता की ओर ले जाता है, पीएफके वंशाणु में उत्परिवर्तन के कारण होता है जो इसकी गतिविधि को कम कर देता है।<ref>{{cite web|title=फॉस्फोफ्रक्टोकिनेज की कमी ग्लाइकोजन भंडारण रोग|url=http://www.patient.co.uk/doctor/phosphofructokinase-deficiency-glycogen-storage-disease}}</ref> | |||
== अन्य काइनेज == | == अन्य काइनेज == | ||
[[File:Riboflavin kinase.png|thumb|राइबोफ्लेविन काइनेज की सक्रिय | [[File:Riboflavin kinase.png|thumb|राइबोफ्लेविन काइनेज की सक्रिय स्थिति इसके उत्पादों - एफएमएन (बाईं ओर) और एडीपी (दाहिनी ओर) से जुड़ी हुई है। पीडीबी आईडी से निर्देशांक: 1N07 है।<ref>{{cite journal | vauthors = Bauer S, Kemter K, Bacher A, Huber R, Fischer M, Steinbacher S | title = शिज़ोसैक्रोमाइसेस पोम्बे राइबोफ्लेविन किनेज की क्रिस्टल संरचना एक उपन्यास एटीपी और राइबोफ्लेविन-बाइंडिंग फोल्ड का खुलासा करती है| journal = Journal of Molecular Biology | volume = 326 | issue = 5 | pages = 1463–1473 | date = March 2003 | pmid = 12595258 | doi = 10.1016/s0022-2836(03)00059-7 }}</ref>]]काइनेज प्रोटीन, वसा और कार्बोहाइड्रेट के अतिरिक्त कई अन्य अणुओं पर कार्य करता है। ऐसे कई हैं जो न्यूक्लियोटाइड (डीएनए और आरएनए) पर कार्य करते हैं, जिनमें न्यूक्लियोटाइड अंतर्रूपांतरण, जैसे [[न्यूक्लियोसाइड-डिफॉस्फेट किनेज|न्यूक्लियोसाइड-डिफॉस्फेट काइनेज]] और न्यूक्लियोसाइड-डिफॉस्फेट काइनेज में सम्मिलित हैं।<ref>{{cite book | vauthors = Voet D, Voet JC, Pratt CW |title=Fundamentals of biochemistry : life at the molecular level|year=2008|publisher=Wiley|location=Hoboken, NJ|isbn=9780470129302|edition=3rd}}</ref> अन्य छोटे अणु जो काइनेज के अवस्तर हैं, उनमें [[ creatine |क्रिएटिन]], [[फॉस्फोग्लाइसेरेट]], [[राइबोफ्लेविन]], डायहाइड्रोक्सीसिटोन, शिकिमेट और कई अन्य सम्मिलित हैं। | ||
=== राइबोफ्लेविन काइनेज === | === राइबोफ्लेविन काइनेज === | ||
राइबोफ्लेविन काइनेज | राइबोफ्लेविन काइनेज, फ्लेविन मोनोन्यूक्लियोटाइड (FMN) बनाने के लिए राइबोफ्लेविन के फास्फारिलीकरण को उत्प्रेरित करता है। इसमें एक व्यवस्थित बंधन क्रियातंत्र है जहां राइबोफ्लेविन को एटीपी अणु से जुड़ने से पहले काइनेज से जुड़ना चाहिए।<ref name="sdf">{{cite journal | vauthors = Karthikeyan S, Zhou Q, Osterman AL, Zhang H | title = Ligand binding-induced conformational changes in riboflavin kinase: structural basis for the ordered mechanism | journal = Biochemistry | volume = 42 | issue = 43 | pages = 12532–12538 | date = November 2003 | pmid = 14580199 | doi = 10.1021/bi035450t }}</ref> [[द्विसंयोजक]] धनायन न्यूक्लियोटाइड के समन्वय में सहायता करते हैं।<ref name="sdf" /> सामान्य तंत्र नीचे दिए गए चित्र में दर्शाया गया है।[[File:Riboflavin mechanism.png|thumb|upright=2.5|center|राइबोफ्लेविन काइनेज का क्रियातंत्र।]]राइबोफ्लेविन काइनेज कोशिकाओं में एक महत्वपूर्ण भूमिका निभाता है, क्योंकि फ्लेविन एफएमएन एक महत्वपूर्ण सहकारक है। एफएमएन फ्लेविन एडेनिन डायन्यूक्लियोटाइड (FAD) का अग्रदूत भी है, जो चयापचय में कई किण्वकों सहित कई किण्वकों द्वारा उपयोग किया जाने वाला एक [[रिडॉक्स कॉफ़ेक्टर|अपोपचयन सहकारक]] है। वास्तव में, कुछ किण्वक हैं जो राइबोफ्लेविन के फास्फारिलीकरण से एफएमएन और एफएमएन से एफएडी प्रतिक्रिया दोनों को पूर्ण करने में सक्षम हैं।<ref>{{cite journal | vauthors = Galluccio M, Brizio C, Torchetti EM, Ferranti P, Gianazza E, Indiveri C, Barile M | title = Over-expression in Escherichia coli, purification and characterization of isoform 2 of human FAD synthetase | journal = Protein Expression and Purification | volume = 52 | issue = 1 | pages = 175–181 | date = March 2007 | pmid = 17049878 | doi = 10.1016/j.pep.2006.09.002 }}</ref> राइबोफ्लेविन काइनेज प्रकुंचन को रोकने में सहायता कर सकता है और संभवतः भविष्य में इसका उपयोग उपचार के रूप में किया जा सकता है।<ref>{{cite journal | vauthors = Zou YX, Zhang XH, Su FY, Liu X | title = स्ट्रोक के रोगजनन में राइबोफ्लेविन किनेज का महत्व| journal = CNS Neuroscience & Therapeutics | volume = 18 | issue = 10 | pages = 834–840 | date = October 2012 | pmid = 22925047 | pmc = 6493343 | doi = 10.1111/j.1755-5949.2012.00379.x }}</ref> जब चूहों पर इसका अध्ययन किया गया तो इसे संक्रमण में भी सम्मिलित पाया गया है।<ref>{{cite journal | vauthors = Brijlal S, Lakshmi AV, Bamji MS, Suresh P | title = चूहों में श्वसन संक्रमण के दौरान फ्लेविन चयापचय| journal = The British Journal of Nutrition | volume = 76 | issue = 3 | pages = 453–462 | date = September 1996 | pmid = 8881717 | doi = 10.1079/BJN19960050 | doi-access = free }}</ref> | ||
=== थाइमिडीन काइनेज़ === | === थाइमिडीन काइनेज़ === | ||
{{main|थाइमिडीन काइनेज़}} | {{main|थाइमिडीन काइनेज़}} | ||
[[थाइमिडिन किनेज|थाइमिडीन काइनेज़]] कई न्यूक्लियोसाइड काइनेज में से एक है जो न्यूक्लियोसाइड फास्फारिलीकरण के लिए उत्तरदायी हैं। यह [[थाइमिडीन]] को फॉस्फोराइलेट करके थाइमिडीन मोनोफॉस्फेट (dTMP) बनाता है। जैसा कि नीचे दर्शाया गया है, यह काइनेज थाइमिडीन को फॉस्फेट की आपूर्ति करने के लिए एटीपी अणु का उपयोग करता है। थाइमिडीन काइनेज, साथ ही अन्य न्यूक्लियोसाइड और न्यूक्लियोटाइड | [[थाइमिडिन किनेज|थाइमिडीन काइनेज़]] कई न्यूक्लियोसाइड काइनेज में से एक है जो न्यूक्लियोसाइड फास्फारिलीकरण के लिए उत्तरदायी हैं। यह [[थाइमिडीन]] को फॉस्फोराइलेट करके थाइमिडीन मोनोफॉस्फेट (dTMP) बनाता है। जैसा कि नीचे दर्शाया गया है, यह काइनेज थाइमिडीन को फॉस्फेट की आपूर्ति करने के लिए एटीपी अणु का उपयोग करता है। थाइमिडीन काइनेज, साथ ही अन्य न्यूक्लियोसाइड और न्यूक्लियोटाइड काइनेजेस द्वारा एक न्यूक्लियोटाइड से दूसरे में फॉस्फेट का स्थानांतरण, विभिन्न न्यूक्लियोटाइडों में से प्रत्येक के स्तर को नियंत्रित करने में सहायता करने के लिए कार्य करता है। | ||
[[File:Thymidine kinase.png|thumb|center|upright=2.5|थाइमिडिन काइनेज द्वारा उत्प्रेरित समग्र प्रतिक्रिया।]]डीटीएमपी अणु के निर्माण के बाद, एक अन्य काइनेज, [[थाइमिडाइलेट काइनेज]], डीटीएमपी पर कार्य करके [[थाइमिडिन डाइफॉस्फेट|डाइफॉस्फेट]] | [[File:Thymidine kinase.png|thumb|center|upright=2.5|थाइमिडिन काइनेज द्वारा उत्प्रेरित समग्र प्रतिक्रिया।]]डीटीएमपी अणु के निर्माण के बाद, एक अन्य काइनेज, [[थाइमिडाइलेट काइनेज]], डीटीएमपी पर कार्य करके [[थाइमिडिन डाइफॉस्फेट|डाइफॉस्फेट]] प्रकार, डीटीडीपी बना सकता है। न्यूक्लियोसाइड-डाइफॉस्फेट काइनेज, [[थाइमिडीन ट्राइफॉस्फेट]], डीटीटीपी के उत्पादन को उत्प्रेरित करता है, जिसका उपयोग [[डीएनए संश्लेषण]] में किया जाता है। इस कारण से, थाइमिडिन काइनेज गतिविधि कोशिका चक्र के साथ घनिष्ठ रूप से संबंधित है और नैदानिक रसायन विज्ञान में थाइमिडिन काइनेज में [[ट्यूमर मार्कर|अर्बुद लक्षक]] के रूप में उपयोग किया जाता है।<ref>{{cite journal | vauthors = Aufderklamm S, Todenhöfer T, Gakis G, Kruck S, Hennenlotter J, Stenzl A, Schwentner C | title = थाइमिडिन किनेज और कैंसर की निगरानी| journal = Cancer Letters | volume = 316 | issue = 1 | pages = 6–10 | date = March 2012 | pmid = 22068047 | doi = 10.1016/j.canlet.2011.10.025 }}</ref> इसलिए, इसका उपयोग कभी-कभी रोगी पूर्वानुमान की भविष्यवाणी करने के लिए किया जा सकता है।<ref>{{cite journal | vauthors = Topolcan O, Holubec L | title = कैंसर रोगों में थाइमिडिन किनेज की भूमिका| journal = Expert Opinion on Medical Diagnostics | volume = 2 | issue = 2 | pages = 129–141 | date = February 2008 | pmid = 23485133 | doi = 10.1517/17530059.2.2.129 }}</ref> थाइमिडिन काइनेज [[जीन|वंशाणु]] में उत्परिवर्तन वाले रोगियों में एक निश्चित प्रकार का [[माइटोकॉन्ड्रियल डीएनए]] रिक्तीकरण [[सिंड्रोम|लक्षण]] हो सकता है, यह एक ऐसी बीमारी जो बचपन में ही मृत्यु का कारण बनती है।<ref>{{cite journal | vauthors = Götz A, Isohanni P, Pihko H, Paetau A, Herva R, Saarenpää-Heikkilä O, Valanne L, Marjavaara S, Suomalainen A | display-authors = 6 | title = Thymidine kinase 2 defects can cause multi-tissue mtDNA depletion syndrome | journal = Brain | volume = 131 | issue = Pt 11 | pages = 2841–2850 | date = November 2008 | pmid = 18819985 | doi = 10.1093/brain/awn236 | doi-access = free }}</ref> | ||
== यह भी देखें == | == यह भी देखें == | ||
* [[एक्टिवेशन लूप|सक्रियण पाश]] | * [[एक्टिवेशन लूप|सक्रियण पाश]] | ||
* [[ autophosphorylation | | * [[ autophosphorylation | ऑटोफास्फारिलीकरण]] | ||
* Ca2+/शांतोडुलिन-आश्रित प्रोटीन काइनेज | * Ca2+/शांतोडुलिन-आश्रित प्रोटीन काइनेज | ||
* [[सेल सिग्नलिंग|कोशिका संकेतन]] | * [[सेल सिग्नलिंग|कोशिका संकेतन]] | ||
| Line 91: | Line 97: | ||
* फॉस्फेटस | * फॉस्फेटस | ||
* [[फॉस्फेटिडिलिनोसिटोल फॉस्फेट किनेसेस|फॉस्फेटिडिलिनोसिटोल फॉस्फेट काइनेज]] | * [[फॉस्फेटिडिलिनोसिटोल फॉस्फेट किनेसेस|फॉस्फेटिडिलिनोसिटोल फॉस्फेट काइनेज]] | ||
* [[फास्फोलिपिड]] | * [[फास्फोलिपिड|फास्फोवसा]] | ||
* [[ फॉसफ़ोप्रोटीन ]] | * [[ फॉसफ़ोप्रोटीन | फॉसफ़ोप्रोटीन]] | ||
* फास्फारिलीकरण | * फास्फारिलीकरण | ||
* फॉस्फोट्रांसफेरेज़ | * फॉस्फोट्रांसफेरेज़ | ||
| Line 104: | Line 110: | ||
{{Reflist|30em}} | {{Reflist|30em}} | ||
{{Portal bar|Biology|border=no}} | {{Portal bar|Biology|border=no}} | ||
[[Category: | [[Category:All articles with unsourced statements]] | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Articles with unsourced statements from March 2023]] | |||
[[Category:Collapse templates]] | |||
[[Category:Commons category link is locally defined]] | |||
[[Category:Created On 09/06/2023]] | [[Category:Created On 09/06/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with empty portal template]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Portal templates with redlinked portals]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:ईसी 2.7.1]] | |||
Latest revision as of 12:22, 8 November 2023

जैव रसायन में, काइनेज (/ˈkaɪneɪs, ˈkɪneɪs, -eɪz/)[2] एक किण्वक है जो उच्च-ऊर्जाफास्फेट दान करने वाले अणुओं से विशिष्ट अवस्तरों तक फॉस्फेट समूहों के स्थानान्तरण को उत्प्रेरित करता है। इस प्रक्रिया को फास्फारिलीकरण के रूप में जाना जाता है, जहां उच्च-ऊर्जा एडेनोसिन ट्राइफॉस्फेट अणु अवस्तर अणुओं को फॉस्फेट समूह दान करता है। यह ट्रान्सएस्टरीफिकेशन एक फॉस्फोराइलेटेड अवस्तर और एडीपी का उत्पादन करता है। इसके विपरीत, इसे विफॉस्फोरिलन के रूप में संदर्भित किया जाता है जब फॉस्फोराइलेटेड अवस्तर एक फॉस्फेट समूह दान करता है और एडीपी एक फॉस्फेट समूह प्राप्त करता है (डीफॉस्फोराइलेटेड अवस्तर और एटीपी के उच्च ऊर्जा अणु का उत्पादन करता है)। ये दो प्रक्रियाएं, फॉस्फोरिलीकरण और विफॉस्फोरिलन ग्लाइकोलिसिस के पर्यन्त चार बार होती हैं।[3][4][5]
काइनेज फॉस्फोट्रांसफेरेज़ के बड़े समूह का हिस्सा हैं। काइनेज को फ़ॉस्फ़ोरिलेज़ के साथ भ्रमित नहीं होना चाहिए, जो एक स्वीकर्ता को अकार्बनिक फॉस्फेट समूहों को जोड़ने के लिए उत्प्रेरित करता है, न ही फॉस्फेटेज़ के साथ, जो फॉस्फेट समूहों (विफॉस्फोरिलन) को हटाते हैं। एक अणु की फास्फारिलीकरण अवस्था, चाहे वह प्रोटीन, वसा या कार्बोहाइड्रेट हो, उसकी गतिविधि, प्रतिक्रियाशीलता और अन्य अणुओं को बांधने की क्षमता को प्रभावित कर सकती है। इसलिए, काइनेज चयापचय, कोशिका संकेतन, प्रोटीन विनियमन, कोशिकीय मार्ग, स्रावी प्रक्रियाओं और कई अन्य कोशिकीय मार्गों में महत्वपूर्ण हैं, जो उन्हें शरीर विज्ञान के लिए बहुत महत्वपूर्ण बनाता है।
जैव रसायन और कार्यात्मक प्रासंगिकता
काइनेज एक उच्च ऊर्जा अणु (जैसे एटीपी) से फॉस्फेट की मात्रा को उनके अवस्तर अणुओं में स्थानांतरित करने में मध्यस्थता करते हैं, जैसा कि नीचे दिए गए चित्र में देखा गया है। इस प्रतिक्रिया को स्थिर करने के लिए काइनेज की आवश्यकता होती है क्योंकि फॉस्फॉनहाइड्राइड बंधन में उच्च स्तर की ऊर्जा होती है। काइनेज अपने सक्रिय स्थलों के भीतर अपने अवस्तरों और फॉस्फोरिल समूहों को ठीक से उन्मुख करते हैं, जिससे प्रतिक्रिया की दर बढ़ जाती है। इसके अतिरिक्त, वे सामान्यतः धन आवेशित किए गए अमीनो अम्ल अवशेषों का उपयोग करते हैं, जो ऋणआवेशित किए गए फॉस्फेट समूहों के साथ अन्योन्यक्रिया करके इलेक्ट्रोस्टैटिक रूप से संक्रमण की स्थिति को स्थिर करते हैं। वैकल्पिक रूप से, कुछ काइनेज फॉस्फेट समूहों को समन्वयित करने के लिए अपनी सक्रिय स्थलों में बाध्य धातु सहकारकों का उपयोग करते हैं। प्रोटीन काइनेज को उत्प्रेरक रूप से सक्रिय (विहित) या स्यूडोकाइनेज के रूप में वर्गीकृत किया जा सकता है, जो एक या अधिक उत्प्रेरक अमीनो अम्ल के विकासवादी हानि को दर्शाता है जो एटीपी को स्थिति या हाइड्रोलाइज करता है।[6] हालांकि, संकेतन बहिर्गत और रोग प्रासंगिकता के संदर्भ में, काइनेज और स्यूडोकाइनेज दोनों ही मानव कोशिकाओं में महत्वपूर्ण संकेतन मॉड्यूलेटर हैं, जो काइनेज को बहुत महत्वपूर्ण औषधि लक्ष्य बनाते हैं।[7]
संकेतों को प्रसारित करने और कोशिकाओं में जटिल प्रक्रियाओं को विनियमित करने के लिए काइनेज का बड़े पैमाने पर उपयोग किया जाता है। अणुओं का फॉस्फोरिलीकरण उनकी गतिविधि को बढ़ा या बाधित कर सकता है और अन्य अणुओं के साथ अन्योन्यक्रिया करने की उनकी क्षमता को नियंत्रित कर सकता है। फॉस्फोरिल समूहों को जोड़ने और हटाने से कोशिका को नियंत्रण का साधन मिलता है क्योंकि विभिन्न काइनेज विभिन्न स्थितियों या संकेतों पर प्रतिक्रिया कर सकते हैं। काइनेज में उत्परिवर्तन जो कार्य में हानि या कार्य में लाभ का कारण बनते हैं, कैंसर का कारण बन सकते हैं[8] और मनुष्यों में रोग, जिनमें कुछ प्रकार के श्वेतरक्तता और तंत्रिका कोशिकाप्रसू अर्बुद, तंत्रीबंधप्रसू अर्बुद,[9] सुषुम्ना अनुमस्तिष्क गतिविभ्रम (प्रकार 14), अगामाग्लोबुलिनरक्तता के रूप और कई अन्य सम्मिलित हैं।[10]
इतिहास और वर्गीकरण
एटीपी का उपयोग करके किसी अन्य प्रोटीन के फास्फारिलीकरण को उत्प्रेरित करने वाले पहले प्रोटीन को 1954 में यूजीन पी. कैनेडी द्वारा देखा गया था, उस समय उन्होंने एक यकृत किण्वक का वर्णन किया था जो कैसीन के फास्फारिलीकरण को उत्प्रेरित करता था।[citation needed] 1956 में, एडमंड एच. फिशर और एडविन जी. क्रेब्स ने पाया कि फॉस्फोरिलेज़ a और फॉस्फोरिलेज़ b के मध्य अंतर-रूपांतरण फास्फारिलीकरण और विफॉस्फोरिलन द्वारा मध्यस्थ था।[11] जिस काइनेज ने फॉस्फोरिल समूह को फॉस्फोरिलेज़ b में स्थानांतरित कर दिया, उसे फॉस्फोरिलेज़ a में परिवर्तित कर दिया, उसे फॉस्फोरिलेज़ काइनेज नाम दिया गया। वर्षों बाद, काइनेज कैस्केड के पहले उदाहरण की पहचान की गई, जिससे प्रोटीन काइनेज a (PKA) फॉस्फोराइलेट फॉस्फोराइलेज काइनेज होता है। उसी समय, यह पाया गया कि पीकेए ने ग्लाइकोजन सिंथेज़ को बाधित किया, जो फास्फारिलीकरण घटना का पहला उदाहरण था जिसके परिणामस्वरूप अवरोध हुआ। 1969 में, लेस्टर रीड ने पाया कि फॉस्फोराइलेशन द्वारा पाइरूवेट डिहाइड्रोजनेज को निष्क्रिय कर दिया गया था, और यह खोज पहला संकेत था कि फास्फारिलीकरण ग्लाइकोजन चयापचय के अतिरिक्त अन्य अन्य चयापचय मार्गों में विनियमन के साधन के रूप में कार्य कर सकता है। उसी वर्ष, टॉम लैंगन ने पाया कि पीकेए फॉस्फोराइलेट्स हिस्टोन एच1, जिसने सुझाव दिया कि फास्फारिलीकरण नॉनजाइमेटिक प्रोटीन को नियंत्रित कर सकता है। 1970 के दशक में Ca2+/शांतोडुलिन-आश्रित प्रोटीन काइनेज की खोज और यह पता लगाना सम्मिलित था कि प्रोटीन को एक से अधिक अमीनो अम्ल अवशेषों पर फास्फोराइलेट किया जा सकता है। 1990 के दशक को "प्रोटीन काइनेज कैस्केड का दशक" के रूप में वर्णित किया जा सकता है। इस समय के पर्यन्त, एमएपीके/ईआरके मार्ग, जेएके, काइनेज (प्रोटीन टाइरोसिन काइनेज का एक समूह) और पीआईपी3-आश्रित काइनेज कैस्केड की खोज की गई।[12]
काइनेज को उन अवस्तरों के आधार पर व्यापक समूहों में वर्गीकृत किया जाता है जिन पर वे कार्य करते हैं: प्रोटीन काइनेज, वसा काइनेज, कार्बोहाइड्रेट काइनेज है। काइनेज विभिन्न प्रकार की प्रजातियों में पाए जा सकते हैं, जीवाणु से लेकर फफूंद तक, कीड़े से लेकर स्तनधारी तक है।[13] मनुष्यों में पाँच सौ से अधिक विभिन्न काइनेज की पहचान की गई है।[3]उनकी विविधता और संकेतन में उनकी भूमिका उन्हें अध्ययन का एक रोचक उद्देश्य बनाती है। कई अन्य काइनेज छोटे अणुओं जैसे कि वसा, कार्बोहाइड्रेट, अमीनो अम्ल और न्यूक्लियोटाइड पर या तो संकेत देने के लिए या उन्हें चयापचय मार्गों के लिए तैयार करने के लिए कार्य करते हैं। विशिष्ट काइनेज का नाम प्रायः उनके अवस्तरों के नाम पर रखा जाता है। प्रोटीन काइनेज में प्रायः कई अवस्तर होते हैं और प्रोटीन एक से अधिक विशिष्ट काइनेज के लिए अवस्तरों के रूप में कार्य कर सकते हैं। इस कारण से प्रोटीन काइनेज का नाम उनकी गतिविधि को नियंत्रित करने के आधार पर रखा गया है (अर्थात शांतोडुलिन-आश्रित प्रोटीन काइनेज)। कभी-कभी उन्हें आगे श्रेणियों में विभाजित किया जाता है क्योंकि कई आइसोएंजाइमेटिक रूप होते हैं। उदाहरण के लिए, प्रकार I और प्रकार II चक्रीय-एएमपी आश्रित प्रोटीन काइनेज में समान उत्प्रेरक उप-इकाई होते हैं लेकिन अलग-अलग नियामक उप-इकाई होते हैं जो चक्रीय एएमपी को बांधते हैं।[14]
प्रोटीन काइनेज
प्रोटीन काइनेज प्रोटीन पर उनके सेरीन, थ्रियोनीन, टायरोसीन या हिस्टडीन अवशेषों पर फॉस्फेटन करके कार्य करते हैं। फास्फारिलीकरण प्रोटीन के कार्य को कई तरह से संशोधित कर सकता है। यह एक प्रोटीन की गतिविधि को बढ़ा या घटा सकता है, इसे स्थिर कर सकता है या इसे विनाश के लिए चिह्नित कर सकता है, इसे एक विशिष्ट कोशिकीय कोष्ठ के भीतर स्थानीयकृत कर सकता है और यह अन्य प्रोटीनों के साथ अपनी अन्योन्यक्रिया प्रारंभ या बाधित कर सकता है। प्रोटीन काइनेज सभी काइनेज का बहुमत बनाते हैं और इनका व्यापक रूप से अध्ययन किया जाता है।[15] ये काइनेज, फॉस्फेटेस के संयोजन के साथ, प्रोटीन और किण्वक विनियमन के साथ-साथ कोशिका में संकेतन में एक प्रमुख भूमिका निभाते हैं।
जब एक कोशिका जैविक विनियमन प्राप्त करने के विभिन्न तरीकों के विषय में विचार करती है तो भ्रम की एक सामान्य स्थिति उत्पन्न होती है। सहसंयोजक संशोधनों के अनगिनत उदाहरण हैं जो कोशिकीय प्रोटीन से गुजर सकते हैं; हालाँकि, फास्फारिलीकरण कुछ प्रतिवर्ती सहसंयोजक संशोधनों में से एक है। इससे यह तर्क मिला कि प्रोटीन का फास्फारिलीकरण नियामक है। प्रोटीन कार्य को विनियमित करने की क्षमता बहुत अधिक है, क्योंकि एलोस्टेरिक नियंत्रण द्वारा प्रदान किए गए विनियमन के अतिरिक्त प्रोटीन को सहसंयोजक रूप से संशोधित करने के कई तरीके हैं। अपने हॉपकिंस स्मारक व्याख्यान में, एडविन क्रेब्स ने जोर देकर कहा कि एलोस्टेरिक नियंत्रण कोशिका के भीतर से उत्पन्न होने वाले संकेतों पर प्रतिक्रिया करने के लिए विकसित हुआ, जबकि फास्फारिलीकरण कोशिका के बाहर संकेतों पर प्रतिक्रिया करने के लिए विकसित हुआ। यह विचार इस तथ्य के अनुरूप है कि प्रोटीन का फास्फारिलीकरण प्राकेंद्रकी कोशिकाओं की तुलना में सुकेंद्रकी कोशिकाओं में अधिक बार होता है क्योंकि अधिक जटिल कोशिका प्रकार संकेतों की एक विस्तृत श्रृंखला पर प्रतिक्रिया करने के लिए विकसित हुआ है।[14]
साइक्लिनआश्रित काइनेज
साइक्लिन आश्रित काइनेज (CDK) कोशिका चक्र के नियमन में सम्मिलित कई अलग-अलग काइनेज का एक समूह है। वे अपने सेरीन या थ्रेओनीन अवशेषों पर अन्य प्रोटीनों को फास्फोराइलेट करते हैं, लेकिन सक्रिय होने के लिए सीडीके को पहले साइक्लिन प्रोटीन से बांधना होगा।[16] विशिष्ट सीडीके और साइक्लिन के विभिन्न संयोजन कोशिका चक्र के विभिन्न भागों को चिन्हित करते हैं। इसके अतिरिक्त, सीडीके की फास्फारिलीकरण स्थिति भी उनकी गतिविधि के लिए महत्वपूर्ण है, क्योंकि वे अन्य काइनेज (जैसे सीडीके-सक्रिय करने वाले काइनेज) और फॉस्फेटेस (जैसे सीडीसी25) द्वारा विनियमन के अधीन हैं।[17] एक बार जब सीडीके सक्रिय हो जाते हैं, तो वे अपनी गतिविधि को बदलने के लिए अन्य प्रोटीनों को फॉस्फोराइलेट करते हैं, जिससे कोशिका चक्र के अगले चरण के लिए आवश्यक घटनाएं होती हैं। जबकि वे कोशिका चक्र नियंत्रण में अपने कार्य के लिए सबसे अधिक जाने जाते हैं, सीडीके की प्रतिलेखन, चयापचय और अन्य कोशिकीय घटनाओं में भी भूमिका होती है।[18]
कोशिका विभाजन को नियंत्रित करने में उनकी महत्वपूर्ण भूमिका के कारण, सीडीके में उत्परिवर्तन प्रायः कैंसरयुक्त कोशिकाओं में पाए जाते हैं। इन उत्परिवर्तनों से कोशिकाओं की अनियंत्रित वृद्धि होती है, जहां वे तीव्रता से सम्पूर्ण कोशिका चक्र से बार-बार गुजरती हैं।[19] सीडीके उत्परिवर्तन लिंफोमा, स्तन कैंसर, अग्न्याशय ट्यूमर और फेफड़ों के कैंसर में पाए जा सकते हैं। इसलिए, सीडीके के अवरोधकों को कुछ प्रकार के कैंसर के उपचार के रूप में विकसित किया गया है।[19]
माइटोजेन-सक्रिय प्रोटीन काइनेज
एमएपी काइनेज (MAPK) सेरीन/थ्रेओनीन काइनेज का एक समूह है जो विभिन्न प्रकार के बाह्य विकास संकेतों पर प्रतिक्रिया करता है। उदाहरण के लिए, वृद्धि हार्मोन, अधिचर्मी वृद्धि कारक, पट्टिकाणु-व्युत्पन्न वृद्धि कारक और इंसुलिन सभी को माइटोजेनिक उत्तेजनाएं माना जाता है जो एमएपीके मार्ग को संलग्न कर सकते हैं। ग्राही के स्तर पर इस मार्ग का सक्रियण एक संकेतन कैस्केड प्रारंभ करता है जिससे जीडीपी के लिए जीटी पेस जीटीपी का आदान-प्रदान करता है। इसके बाद, रास रफ काइनेज (जिसे एमएपीकेकेके के रूप में भी जाना जाता है) को सक्रिय करता है, जो एमईके (MAPKK) को सक्रिय करता है। एमईके एमएपीके (ईआरके भी कहा जाता है) को सक्रिय करता है, जो प्रतिलेखन और अनुवाद को विनियमित कर सकता है। जबकि आरएएफ और एमएपीके दोनों सेरीन/थ्रेओनीन काइनेज हैं, एमएपीकेके एक टायरोसिन/थ्रेओनीन काइनेज है।
एएमएपीके प्रत्यक्ष या अप्रत्यक्ष रूप से प्रतिलेखन कारकों को विनियमित कर सकता है। इसके प्रमुख प्रतिलेखन लक्ष्यों में एटीएफ-2, चॉप, सी-जून, सी-माइसी, डीपीसी4, एल्क-1, ईटीएस1, मैक्स, एमईएफ2सी, एनएफएटी4, एसएपी1ए, एसटीएटी, टैल, पी53, सीआरईबी, और माइसी सम्मिलित हैं। एमएपीके बड़े राइबोसोमल उप-इकाई में एस6 काइनेज को फॉस्फोराइलेट करके अनुवाद को भी नियंत्रित कर सकता है। यह रास, एसओएस और ईजीएफ ग्राही सहित एमएपीके संकेतन कैस्केड ऊर्ध्वप्रवाह हिस्से में घटकों को फॉस्फोराइलेट भी कर सकता है।[20]
एमएपीके मार्ग की कैंसरजन्य क्षमता इसे चिकित्सकीय रूप से महत्वपूर्ण बनाती है। यह कोशिका प्रक्रियाओं में सम्मिलित होता है जो अनियंत्रित वृद्धि और बाद में ट्यूमर के गठन का कारण बन सकता है। इस मार्ग के भीतर उत्परिवर्तन कोशिका विभेदन, प्रसार, अस्तित्व और एपोप्टोसिस पर इसके नियामक प्रभावों को बदल देते हैं, जो सभी कैंसर के विभिन्न रूपों में सम्मिलित होते हैं।[20]
वसा काइनेज
वसा काइनेज कोशिका में वसा को प्लाज्मा झिल्ली के साथ-साथ कोशिकांग की झिल्लियों पर भी फास्फोराइलेट करता है। फॉस्फेट समूहों को जोड़ने से वसा की प्रतिक्रियाशीलता और स्थानीयकरण बदल सकता है और इसका उपयोग संकेत संचारण में किया जा सकता है।
फॉस्फेटिडिलिनोसिटॉल काइनेज
फॉस्फेटिडिलिनोसिटॉल काइनेज फॉस्फोराइलेट फॉस्फेटिडिलिनोसिटोल प्रजाति, फॉस्फेटिडिलिनोसोल 3,4-बिस्फोस्फेट (PI(3,4)P2), फॉस्फेटिडिलिनोसोल 3,4,5-ट्राइसफॉस्फेट (PIP3) और फॉस्फेटिडिलिनोसिटोल 3-फॉस्फेट (PI3P) जैसी प्रजातियां बनाने के लिए है। काइनेज में फॉस्फॉइनोसाइटाइड 3-काइनेज (PI3K), फॉस्फेटिडिलिनोसिटोल-4-फॉस्फेट 3-काइनेज, और फॉस्फेटिडिलिनोसिटोल-4,5-बिस्फोस्फेट 3-काइनेज सम्मिलित हैं। फॉस्फेटिडिलिनोसोलिटोल का फास्फारिलीकरण स्थिति कोशिकीय संकेतन में एक प्रमुख भूमिका निभाती है, जैसे इंसुलिन संकेतन मार्ग में, और एंडोसाइटोसिस, एक्सोसाइटोसिस और अन्य तस्करी की घटनाओं में भी भूमिका निभाती है।[21][22] इन काइनेज में उत्परिवर्तन, जैसे कि पीआई3के, कैंसर या इंसुलिन प्रतिरोध का कारण बन सकता है।[23]
काइनेज़ किण्वक इनोसिटोल हाइड्रॉक्सिल समूह को अधिक न्यूक्लियोफिलिक बनाकर प्रतिक्रियाओं की दर में वृद्धि करते हैं, प्रायः एक सामान्य आधार के रूप में कार्य करने और हाइड्रॉक्सिल को डीप्रोटोनेट करने के लिए अमीनो अम्ल अवशेषों की ओर श्रृंखला का उपयोग करते हैं, जैसा कि नीचे क्रियाविधि में देखा गया है।[24]यहां, एडेनोसिन ट्राइफॉस्फेट (ATP) और फॉस्फेटिडिलिनोसिटोल के मध्य एक प्रतिक्रिया समन्वित होती है। अंतिम परिणाम एक फॉस्फेटिडिलिनोसिटोल-3-फॉस्फेट और साथ ही एडेनोसिन डिफॉस्फेट (ADP) है। प्रतिक्रिया को तीव्रता से आगे बढ़ाने के लिए किण्वक एटीपी अणु के साथ-साथ इनोसिटोल समूह को ठीक से उन्मुख करने में भी सहायता कर सकते हैं। इस उद्देश्य के लिए प्रायः धातु आयनों का समन्वय किया जाता है।[24]

स्फिंगोसिन काइनेज
स्फिंगोसिन काइनेज (SK) एक वसा काइनेज है जो स्फिंगोसिन को स्फिंगोसिन-1-फॉस्फेट (S1P) में बदलने को उत्प्रेरित करता है। स्फिंगोलिपिड सर्वव्यापी झिल्ली झिल्लीदार वसा हैं। सक्रिय होने पर, स्फिंगोसिन काइनेज साइटोसोल से प्लाज्मा झिल्ली में स्थानांतरित हो जाता है जहां यह एटीपी या जीटीपी से γ फॉस्फेट (जो अंतिम या टर्मिनल फॉस्फेट है) को स्फिंगोसिन में स्थानांतरित करता है। एस1पी ग्राही एक जीपीसीआर ग्राही है, इसलिए एस1पी में G प्रोटीन संकेतन को विनियमित करने की क्षमता है। परिणामी संकेत ईआरके, आरएचओ जीटीपेस, आरएसी जीटीपेस, पीएलसी और एकेटी/पीआई3के आंतरकोशिकीय प्रभावकों को सक्रिय कर सकता है। यह कोशिका के भीतर लक्षित अणुओं पर भी अपना प्रभाव डाल सकता है। एस1पी को एचडीएसी की हिस्टोन डीएसेटाइलेज़ गतिविधि को सीधे बाधित करने के लिए दर्शाया गया है। इसके विपरीत, डिफॉस्फोराइलेटेड स्फिंगोसिन कोशिका एपोप्टोसिस को बढ़ावा देता है, और इसलिए कोशिका भाग्य निर्धारित करने में इसकी भूमिका के कारण एसके के विनियमन को समझना महत्वपूर्ण है। पिछले शोध से पता चलता है कि एसके कैंसर कोशिका वृद्धि को बनाए रख सकते हैं क्योंकि वे कोशिकीय-प्रसार को बढ़ावा देते हैं और एसके1 (एसके का एक विशिष्ट प्रकार) कुछ प्रकार के कैंसर में उच्च सांद्रता में उपस्थित होता है।
स्तनधारी कोशिकाओं, एसके1 और एसके2 में दो काइनेज उपस्थित हैं। एसके2 की तुलना में एसके1 अधिक विशिष्ट है और उनके अभिव्यक्ति प्रतिरूप भी भिन्न होते हैं। एसके1 को फेफड़े, प्लीहा और श्वेताणु कोशिकाओं में व्यक्त किया जाता है, जबकि एसके2 को गुर्दे और यकृत कोशिकाओं में व्यक्त किया जाता है। कोशिका अस्तित्व, प्रसार, विभेदन और शोथ में इन दो काइनेज की भागीदारी उन्हें रसोचिकित्सीय उपचारों के लिए व्यवहार्य पदान्वेषी बनाती है।[25]
कार्बोहाइड्रेट काइनेज
कई स्तनधारियों के लिए, कार्बोहाइड्रेट दैनिक कैलोरी आवश्यकता का एक बड़ा हिस्सा प्रदान करते हैं। ओलिगोसैकेराइड से ऊर्जा प्राप्त करने के लिए, उन्हें पहले मोनोसैकराइड में तोड़ा जाना चाहिए ताकि वे चयापचय में प्रवेश कर सकें। काइनेज लगभग सभी उपापचयी मार्गों में एक महत्वपूर्ण भूमिका निभाते हैं। बाईं ओर का आंकड़ा ग्लाइकोलाइसिस के दूसरे चरण को दर्शाता है, जिसमें काइनेज द्वारा उत्प्रेरित दो महत्वपूर्ण प्रतिक्रियाएं सम्मिलित हैं। 1,3 बिसफ़ॉस्फ़ोग्लिसरेट में एनहाइड्राइड संयोजन अस्थिर है और इसमें उच्च ऊर्जा है। 1,3-बिसफ़ॉस्फ़ोग्लिसरेट काइनेज को 3-फ़ॉस्फ़ोग्लिसरेट और एटीपी देने वाली अपनी प्रतिक्रिया को पूर्ण करने के लिए एडीपी की आवश्यकता होती है। ग्लाइकोलाइसिस के अंतिम चरण में, पाइरूवेट काइनेज एक फॉस्फोरिल समूह को फ़ॉस्फ़ोनिओलपाइरूवेट से एडीपी में स्थानांतरित करता है, जिससे एटीपी और पाइरूवेट उत्पन्न होता है।
हेक्सोकाइनेज सबसे सामान्य किण्वक है जो पहली बार कोशिका में प्रवेश करने पर ग्लूकोज का उपयोग करता है। यह एटीपी के गामा फॉस्फेट को C6 स्थिति में स्थानांतरित करके डी-ग्लूकोज को ग्लूकोज-6-फॉस्फेट में परिवर्तित करता है। यह ग्लाइकोलाइसिस में एक महत्वपूर्ण चरण है क्योंकि यह ऋणात्मक आवेश के कारण ग्लूकोज को कोशिका के भीतर फंसा लेता है। अपने डीफॉस्फोराइलेटेड रूप में, ग्लूकोज बहुत सरलता से झिल्ली में आगे और पीछे जा सकता है।[26] हेक्सोकाइनेज वंशाणु में उत्परिवर्तन से हेक्सोकाइनेज की कमी हो सकती है जो नॉनफेरोसाइटिक हेमोलिटिक रक्ताल्पता का कारण बन सकती है।[27]
फॉस्फोफ्रक्टोकाइनेज, या पीएफके, फ्रुक्टोज-6-फॉस्फेट को फ्रुक्टोज-1,6-बिस्फोस्फेट में परिवर्तित करने को उत्प्रेरित करता है और ग्लाइकोलाइसिस के नियमन में एक महत्वपूर्ण बिंदु है। एटीपी, एच+ और साइट्रेट का उच्च स्तर पीएफके को रोकता है। यदि साइट्रेट का स्तर ऊंचा है, तो इसका अर्थ है कि ग्लाइकोलाइसिस इष्टतम दर पर कार्य कर रहा है। एएमपी का उच्च स्तर पीएफके को उत्तेजित करता है। तारुई रोग, एक ग्लाइकोजन भंडारण रोग जो व्यायाम असहिष्णुता की ओर ले जाता है, पीएफके वंशाणु में उत्परिवर्तन के कारण होता है जो इसकी गतिविधि को कम कर देता है।[28]
अन्य काइनेज
काइनेज प्रोटीन, वसा और कार्बोहाइड्रेट के अतिरिक्त कई अन्य अणुओं पर कार्य करता है। ऐसे कई हैं जो न्यूक्लियोटाइड (डीएनए और आरएनए) पर कार्य करते हैं, जिनमें न्यूक्लियोटाइड अंतर्रूपांतरण, जैसे न्यूक्लियोसाइड-डिफॉस्फेट काइनेज और न्यूक्लियोसाइड-डिफॉस्फेट काइनेज में सम्मिलित हैं।[30] अन्य छोटे अणु जो काइनेज के अवस्तर हैं, उनमें क्रिएटिन, फॉस्फोग्लाइसेरेट, राइबोफ्लेविन, डायहाइड्रोक्सीसिटोन, शिकिमेट और कई अन्य सम्मिलित हैं।
राइबोफ्लेविन काइनेज
राइबोफ्लेविन काइनेज, फ्लेविन मोनोन्यूक्लियोटाइड (FMN) बनाने के लिए राइबोफ्लेविन के फास्फारिलीकरण को उत्प्रेरित करता है। इसमें एक व्यवस्थित बंधन क्रियातंत्र है जहां राइबोफ्लेविन को एटीपी अणु से जुड़ने से पहले काइनेज से जुड़ना चाहिए।[31] द्विसंयोजक धनायन न्यूक्लियोटाइड के समन्वय में सहायता करते हैं।[31] सामान्य तंत्र नीचे दिए गए चित्र में दर्शाया गया है।
राइबोफ्लेविन काइनेज कोशिकाओं में एक महत्वपूर्ण भूमिका निभाता है, क्योंकि फ्लेविन एफएमएन एक महत्वपूर्ण सहकारक है। एफएमएन फ्लेविन एडेनिन डायन्यूक्लियोटाइड (FAD) का अग्रदूत भी है, जो चयापचय में कई किण्वकों सहित कई किण्वकों द्वारा उपयोग किया जाने वाला एक अपोपचयन सहकारक है। वास्तव में, कुछ किण्वक हैं जो राइबोफ्लेविन के फास्फारिलीकरण से एफएमएन और एफएमएन से एफएडी प्रतिक्रिया दोनों को पूर्ण करने में सक्षम हैं।[32] राइबोफ्लेविन काइनेज प्रकुंचन को रोकने में सहायता कर सकता है और संभवतः भविष्य में इसका उपयोग उपचार के रूप में किया जा सकता है।[33] जब चूहों पर इसका अध्ययन किया गया तो इसे संक्रमण में भी सम्मिलित पाया गया है।[34]
थाइमिडीन काइनेज़
थाइमिडीन काइनेज़ कई न्यूक्लियोसाइड काइनेज में से एक है जो न्यूक्लियोसाइड फास्फारिलीकरण के लिए उत्तरदायी हैं। यह थाइमिडीन को फॉस्फोराइलेट करके थाइमिडीन मोनोफॉस्फेट (dTMP) बनाता है। जैसा कि नीचे दर्शाया गया है, यह काइनेज थाइमिडीन को फॉस्फेट की आपूर्ति करने के लिए एटीपी अणु का उपयोग करता है। थाइमिडीन काइनेज, साथ ही अन्य न्यूक्लियोसाइड और न्यूक्लियोटाइड काइनेजेस द्वारा एक न्यूक्लियोटाइड से दूसरे में फॉस्फेट का स्थानांतरण, विभिन्न न्यूक्लियोटाइडों में से प्रत्येक के स्तर को नियंत्रित करने में सहायता करने के लिए कार्य करता है।
डीटीएमपी अणु के निर्माण के बाद, एक अन्य काइनेज, थाइमिडाइलेट काइनेज, डीटीएमपी पर कार्य करके डाइफॉस्फेट प्रकार, डीटीडीपी बना सकता है। न्यूक्लियोसाइड-डाइफॉस्फेट काइनेज, थाइमिडीन ट्राइफॉस्फेट, डीटीटीपी के उत्पादन को उत्प्रेरित करता है, जिसका उपयोग डीएनए संश्लेषण में किया जाता है। इस कारण से, थाइमिडिन काइनेज गतिविधि कोशिका चक्र के साथ घनिष्ठ रूप से संबंधित है और नैदानिक रसायन विज्ञान में थाइमिडिन काइनेज में अर्बुद लक्षक के रूप में उपयोग किया जाता है।[35] इसलिए, इसका उपयोग कभी-कभी रोगी पूर्वानुमान की भविष्यवाणी करने के लिए किया जा सकता है।[36] थाइमिडिन काइनेज वंशाणु में उत्परिवर्तन वाले रोगियों में एक निश्चित प्रकार का माइटोकॉन्ड्रियल डीएनए रिक्तीकरण लक्षण हो सकता है, यह एक ऐसी बीमारी जो बचपन में ही मृत्यु का कारण बनती है।[37]
यह भी देखें
- सक्रियण पाश
- ऑटोफास्फारिलीकरण
- Ca2+/शांतोडुलिन-आश्रित प्रोटीन काइनेज
- कोशिका संकेतन
- साइक्लिन-आश्रित काइनेज
- G प्रोटीन-युग्मित ग्राही
- न्यूक्लियोसाइड-डिफॉस्फेट काइनेज
- फॉस्फेटस
- फॉस्फेटिडिलिनोसिटोल फॉस्फेट काइनेज
- फास्फोवसा
- फॉसफ़ोप्रोटीन
- फास्फारिलीकरण
- फॉस्फोट्रांसफेरेज़
- संकेत पारक्रमण
- थाइमिडिन काइनेज
- नैदानिक रसायन विज्ञान में थाइमिडीन काइनेज
- थाइमिडिलेट काइनेज
- भित्ति से सम्बंधित काइनेज
संदर्भ
- ↑ Siebold C, Arnold I, Garcia-Alles LF, Baumann U, HErnia B (November 2003). "Citrobacter freundii dihydroxyacetone kinase की क्रिस्टल संरचना से आठ-फंसे हुए अल्फा-हेलिकल बैरल AKTP-बाइंडिंग डोमेन का पता चलता है". The Journal of Biological Chemistry. 278 (48): 48236–48244. doi:10.1074/jbc.M305942200. PMID 12966101.
- ↑ "kinase". Dictionary.com Unabridged (Online). n.d. Retrieved 2022-06-18.
- ↑ 3.0 3.1 Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (December 2002). "प्रोटीन किनेज मानव जीनोम का पूरक है". Science. 298 (5600): 1912–1934. Bibcode:2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243. S2CID 26554314.
- ↑ "काइनेज". TheFreeDictionary.com
- ↑ "एटीपी से संबंधित रसायन विज्ञान से एटीपी अनुसंधान मील के पत्थर का इतिहास". Nobelprize.org.
- ↑ Reiterer V, Eyers PA, Farhan H (September 2014). "Day of the dead: pseudokinases and pseudophosphatases in physiology and disease". Trends in Cell Biology. 24 (9): 489–505. doi:10.1016/j.tcb.2014.03.008. PMID 24818526.
- ↑ Foulkes DM, Byrne DP and Eyers PA (2017) Pseudokinases: update on their functions and evaluation as new drug targets. Future Med Chem. 9(2):245-265
- ↑ Samarasinghe B. "कैंसर के लक्षण 1". Scientific American.
- ↑ Bleeker FE, Lamba S, Zanon C, Molenaar RJ, Hulsebos TJ, Troost D, et al. (September 2014). "ग्लियोब्लास्टोमा में किनेसेस की पारस्परिक रूपरेखा". BMC Cancer. 14: 718. doi:10.1186/1471-2407-14-718. PMC 4192443. PMID 25256166.
- ↑ Lahiry P, Torkamani A, Schork NJ, Hegele RA (January 2010). "Kinase mutations in human disease: interpreting genotype-phenotype relationships". Nature Reviews. Genetics. 11 (1): 60–74. doi:10.1038/nrg2707. PMID 20019687. S2CID 37398118.
- ↑ Krebs EG (July 1983). "प्रोटीन फास्फारिलीकरण पर ऐतिहासिक दृष्टिकोण और प्रोटीन किनेसेस के लिए एक वर्गीकरण प्रणाली". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 302 (1108): 3–11. Bibcode:1983RSPTB.302....3K. doi:10.1098/rstb.1983.0033. PMID 6137005.
- ↑ Corbellino M, Poirel L, Aubin JT, Paulli M, Magrini U, Bestetti G, et al. (June 1996). "The role of human herpesvirus 8 and Epstein-Barr virus in the pathogenesis of giant lymph node hyperplasia (Castleman's disease)". Clinical Infectious Diseases. 22 (6): 1120–1121. doi:10.1093/clinids/22.6.1120. PMID 8783733.
- ↑ Scheeff ED, Bourne PE (October 2005). "प्रोटीन किनेज-जैसे सुपरफैमिली का संरचनात्मक विकास". PLOS Computational Biology. 1 (5): e49. Bibcode:2005PLSCB...1...49S. doi:10.1371/journal.pcbi.0010049. PMC 1261164. PMID 16244704.
- ↑ 14.0 14.1 Krebs EG (October 1985). "The phosphorylation of proteins: a major mechanism for biological regulation. Fourteenth Sir Frederick Gowland Hopkins memorial lecture". Biochemical Society Transactions. 13 (5): 813–820. doi:10.1042/bst0130813. PMID 2998902.
- ↑ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (December 2002). "प्रोटीन किनेज मानव जीनोम का पूरक है". Science. 298 (5600): 1912–1934. Bibcode:2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243. S2CID 26554314.
- ↑ Harper JW, Adams PD (August 2001). "साइक्लिन-आश्रित किनेसेस". Chemical Reviews. 101 (8): 2511–2526. doi:10.1021/cr0001030. PMID 11749386.
- ↑ Karp G (2010). Cell and molecular biology : concepts and experiments (6th ed.). Hoboken, NJ: John Wiley. ISBN 9780470483374.
- ↑ Lim S, Kaldis P (August 2013). "Cdks, cyclins and CKIs: roles beyond cell cycle regulation". Development. 140 (15): 3079–3093. doi:10.1242/dev.091744. PMID 23861057.
- ↑ 19.0 19.1 Canavese M, Santo L, Raje N (May 2012). "Cyclin dependent kinases in cancer: potential for therapeutic intervention". Cancer Biology & Therapy. 13 (7): 451–457. doi:10.4161/cbt.19589. PMID 22361734.
- ↑ 20.0 20.1 Garrington TP, Johnson GL (April 1999). "माइटोजेन-एक्टिवेटेड प्रोटीन किनेज सिग्नलिंग पाथवे का संगठन और विनियमन". Current Opinion in Cell Biology. 11 (2): 211–218. doi:10.1016/s0955-0674(99)80028-3. PMID 10209154.
- ↑ Sun Y, Thapa N, Hedman AC, Anderson RA (June 2013). "Phosphatidylinositol 4,5-bisphosphate: targeted production and signaling". BioEssays. 35 (6): 513–522. doi:10.1002/bies.201200171. PMC 3882169. PMID 23575577.
- ↑ Heath CM, Stahl PD, Barbieri MA (July 2003). "लिपिड कीनेज झिल्ली की तस्करी और सिग्नलिंग में महत्वपूर्ण और कई भूमिकाएँ निभाते हैं". Histology and Histopathology. 18 (3): 989–998. doi:10.14670/HH-18.989. PMID 12792909.
- ↑ Cantley LC (2012). "PI 3-kinase and disease". BMC Proceedings. 6 (Suppl 3): O2. doi:10.1186/1753-6561-6-S3-O2. PMC 3395034.
- ↑ 24.0 24.1 24.2 Miller S, Tavshanjian B, Oleksy A, Perisic O, Houseman BT, Shokat KM, Williams RL (March 2010). "Shaping development of autophagy inhibitors with the structure of the lipid kinase Vps34". Science. 327 (5973): 1638–1642. Bibcode:2010Sci...327.1638M. doi:10.1126/science.1184429. PMC 2860105. PMID 20339072.
- ↑ Neubauer HA, Pitson SM (November 2013). "Roles, regulation and inhibitors of sphingosine kinase 2". The FEBS Journal. 280 (21): 5317–5336. doi:10.1111/febs.12314. PMID 23638983.
- ↑ Holzer H, Duntze W (1971). "एंजाइमों के रासायनिक संशोधन द्वारा चयापचय विनियमन". Annual Review of Biochemistry. 40: 345–374. doi:10.1146/annurev.bi.40.070171.002021. PMID 4399446.
- ↑ "हेक्सोकाइनेज की कमी के कारण नॉनफेरोसाइटिक हेमोलिटिक एनीमिया". Archived from the original on 2015-09-05. Retrieved 2014-02-24.
- ↑ "फॉस्फोफ्रक्टोकिनेज की कमी ग्लाइकोजन भंडारण रोग".
- ↑ Bauer S, Kemter K, Bacher A, Huber R, Fischer M, Steinbacher S (March 2003). "शिज़ोसैक्रोमाइसेस पोम्बे राइबोफ्लेविन किनेज की क्रिस्टल संरचना एक उपन्यास एटीपी और राइबोफ्लेविन-बाइंडिंग फोल्ड का खुलासा करती है". Journal of Molecular Biology. 326 (5): 1463–1473. doi:10.1016/s0022-2836(03)00059-7. PMID 12595258.
- ↑ Voet D, Voet JC, Pratt CW (2008). Fundamentals of biochemistry : life at the molecular level (3rd ed.). Hoboken, NJ: Wiley. ISBN 9780470129302.
- ↑ 31.0 31.1 Karthikeyan S, Zhou Q, Osterman AL, Zhang H (November 2003). "Ligand binding-induced conformational changes in riboflavin kinase: structural basis for the ordered mechanism". Biochemistry. 42 (43): 12532–12538. doi:10.1021/bi035450t. PMID 14580199.
- ↑ Galluccio M, Brizio C, Torchetti EM, Ferranti P, Gianazza E, Indiveri C, Barile M (March 2007). "Over-expression in Escherichia coli, purification and characterization of isoform 2 of human FAD synthetase". Protein Expression and Purification. 52 (1): 175–181. doi:10.1016/j.pep.2006.09.002. PMID 17049878.
- ↑ Zou YX, Zhang XH, Su FY, Liu X (October 2012). "स्ट्रोक के रोगजनन में राइबोफ्लेविन किनेज का महत्व". CNS Neuroscience & Therapeutics. 18 (10): 834–840. doi:10.1111/j.1755-5949.2012.00379.x. PMC 6493343. PMID 22925047.
- ↑ Brijlal S, Lakshmi AV, Bamji MS, Suresh P (September 1996). "चूहों में श्वसन संक्रमण के दौरान फ्लेविन चयापचय". The British Journal of Nutrition. 76 (3): 453–462. doi:10.1079/BJN19960050. PMID 8881717.
- ↑ Aufderklamm S, Todenhöfer T, Gakis G, Kruck S, Hennenlotter J, Stenzl A, Schwentner C (March 2012). "थाइमिडिन किनेज और कैंसर की निगरानी". Cancer Letters. 316 (1): 6–10. doi:10.1016/j.canlet.2011.10.025. PMID 22068047.
- ↑ Topolcan O, Holubec L (February 2008). "कैंसर रोगों में थाइमिडिन किनेज की भूमिका". Expert Opinion on Medical Diagnostics. 2 (2): 129–141. doi:10.1517/17530059.2.2.129. PMID 23485133.
- ↑ Götz A, Isohanni P, Pihko H, Paetau A, Herva R, Saarenpää-Heikkilä O, et al. (November 2008). "Thymidine kinase 2 defects can cause multi-tissue mtDNA depletion syndrome". Brain. 131 (Pt 11): 2841–2850. doi:10.1093/brain/awn236. PMID 18819985.