इलेक्ट्रोलीज़: Difference between revisions
mNo edit summary |
|||
| Line 213: | Line 213: | ||
{{commons|Electrolysis}} | {{commons|Electrolysis}} | ||
{{div col|colwidth=22em}} | {{div col|colwidth=22em}} | ||
* [[ क्षारीय जल | * [[ क्षारीय जल विद्युत्अपघटन ]] | ||
* कास्टनर -केलेनर प्रक्रिया | * कास्टनर -केलेनर प्रक्रिया | ||
* | * विद्युतअपघट्य सेल | ||
* [[ | * [[ विद्युत् रासायनिक इंजीनियरिंग ]] | ||
* | *विद्युत्अपघटन का फैराडे का नियम | ||
* [[ प्रचुरता ]] | * [[ प्रचुरता ]] | ||
* [[ फैराडे दक्षता ]] | * [[ फैराडे दक्षता ]] | ||
* [[ | * [[ विद्युत् उत्पन्न करने वाली जंग ]] | ||
* [[ गैल्वेनोलुमिनेशन ]] | * [[ गैल्वेनोलुमिनेशन ]] | ||
* [[ गैस पटाखा ]] | * [[ गैस पटाखा ]] | ||
* हॉल -हेरोल्ट प्रक्रिया | * हॉल -हेरोल्ट प्रक्रिया | ||
* उच्च दबाव वाले | * उच्च दबाव वाले विद्युत्अपघटन | ||
* | * अतिरिक्त विभव | ||
* [[ पैटरसन | * [[ पैटरसन शक्ति सेल ]] | ||
* [[ ऊष्मीय चक्र ]] | * [[ ऊष्मीय चक्र ]] | ||
* हाइड्रोजन प्रौद्योगिकियों की समयरेखा | * हाइड्रोजन प्रौद्योगिकियों की समयरेखा | ||
* [[ उच्च दबाव | * [[ उच्च दबाव विद्युत्अपघटन ]] | ||
{{div col end}} | {{div col end}} | ||
Revision as of 12:46, 23 December 2022
यह लेख रासायनिक प्रक्रिया के विषय में है। सौन्दर्य-प्रसाधन द्वारा बालों को हटाने की प्रक्रिया के लिए, विद्युत् विज्ञान के अन्य लेख देखें।
| Articles about |
| Electromagnetism |
|---|
 |
रसायन विज्ञान और विनिर्माण में, विद्युतअपघटन एक तकनीक है जो अन्यथा जटिल रासायनिक प्रतिक्रिया को चलाने के लिए प्रत्यक्ष वर्तमान (डीसी) का उपयोग करती है।विद्युतअपघटन एक विद्युत् अपघटनीय कोशिका का उपयोग करके अयस्कों जैसे प्राकृतिक रूप से होने वाले स्रोतों से रासायनिक तत्व के पृथक्करण में एक चरण के रूप में व्यावसायिक रूप से महत्वपूर्ण है। विद्युतअपघटन के होने के लिए आवश्यक विभव को अपघटन क्षमता कहा जाता है।शब्द lysis का अर्थ अलग या टूटना है, इसलिए शब्दों में, विद्युतअपघटन का मतलब बिजली के माध्यम से टूटना होगा।
व्युत्पत्ति
विद्युतअपघटन शब्द माइकल फैराडे द्वारा 1834 में प्रस्तुत किया गया था,[1] ग्रीक भाषा शब्दों का उपयोग करना ἤλεκτρον [ɛ̌ːlektron]एम्बर, जो 17 वीं शताब्दी के बाद से विद्युत घटनाओं से जुड़ा था, और λύσις [lýsis] का अर्थ विघटन है। फिर भी,फैराडे के औपचारिक विवरण के शब्द के संयोग से पहले, विद्युतअपघटन , रासायनिक प्रतिक्रियाओं का अध्ययन करने और शुद्ध रासायनिक तत्व प्राप्त करने के लिए एक उपकरण के रूप में है ।
इतिहास
उन्नीसवीं शताब्दी की शुरुआत में, विलियम निकोलसन (केमिस्ट) और एंथनी कार्लिसल ने एलेसेंड्रो वोल्टा के प्रयोगों को और अधिक बढ़ाने की मांग की।उन्होंने एक वोल्टिक ढेर के दोनों ओर दो तारों को संलग्न किया और दूसरे छोर को जल से भरी नलिका में रखा।उन्होंने देखा कि जब तारों को एक साथ लाया गया तो प्रत्येक तार ने बुलबुले का उत्पादन किया।जिसमे पहला हाइड्रोजन था, दूसरा ऑक्सीजन था।[2]1785 में मार्टिन वैन मारुम नामक एक डच वैज्ञानिक ने एक विद्युत् जनित्र बनाया, जिसका उपयोग उन्होंने अपने लवण से टिन, जस्ता और एंटीमनी को कम करने के लिए किया, जिसे बाद में विद्युतअपघटन के रूप में जाना जाता है।हालांकि उन्होंने अनजाने में विद्युतअपघटन का उत्पादन किया, यह 1800 तक नहीं था जब विलियम निकोलसन और एंथोनी कार्लिसल ने पता लगाया कि विद्युतअपघटन कैसे काम करता है।[3]1791 में लुइगी गालवानी ने मेंढक के पैरों के साथ प्रयोग किया। उन्होंने दावा किया कि दो असमान धातु की चादरों के बीच जानवरों की मांसप्रस्तुतियों को रखने से बिजली उत्पन्न हुई। इन तर्कों का उत्तर देते हुए, एलेसेंड्रो वोल्टा ने अपने परीक्षण किए।[4][5] यह विद्युतअपघटन पर हम्फ्री डेवी के विचारों को अंतर्दृष्टि देगा। प्रारंभिक प्रयोगों के समय, हम्फ्री डेवी ने परिकल्पना की कि जब दो तत्व एक यौगिक बनाने के लिए एक साथ गठबंधन करते हैं, तो विद्युत ऊर्जा जारी की जाती है।हम्फ्री डेवी विद्युतअपघटन पर अपने प्रारंभिक प्रयोगों से अपघटन तालिकाएं बनाने के लिए आगे बढ़ेंगे।अपघटन तालिकाएं कुछ यौगिकों को तोड़ने के लिए आवश्यक ऊर्जाओं पर अंतर्दृष्टि देती हैं।[6]1817 में जोहान अगस्त अरफवेडसन ने निर्धारित किया कि उनके कुछ प्रतिरूप में एक और तत्व, लिथियम था;हालांकि, वह घटक को अलग नहीं कर सका।यह 1821 तक नहीं था कि विलियम थॉमस ब्रैंड ने इसे एकल करने के लिए विद्युतअपघटन का उपयोग किया।दो साल बाद, उन्होंने लिथियम और लिथियम हाइड्रॉक्साइड का उत्पादन करने के लिए विद्युतअपघटन के साथ लिथियम क्लोराइड और पोटेशियम क्लोराइड का उपयोग करके प्रक्रिया को सुव्यवस्थित किया।[7][8]हम्फ्री डेवी के शोध के बाद के वर्षों के दौरान, माइकल फैराडे उनके सहायक बन गए।हम्फ्री डेवी विद्युतअपघटन नियम की प्रक्रिया का अध्ययन करते हुए, माइकल फैराडे ने विद्युतअपघटन के दो नियमों की खोज की।[5]
मैक्सवेल और फैराडे के समय के धनावेशित और ऋणावेशित गतिविधियों के लिए परेशानियाँ आईं[vague]।[9]नवंबर 1875 में, पॉल एमिल लेकोक डी बोइसबॉडरन ने गैलियम हाइड्रॉक्साइड के विद्युतअपघटन का उपयोग करते हुए गैलियम की खोज की, जो 3.4 mg का उत्पादन करता है; विगत दिसंबर में, उन्होंने पेरिस में एकेडमी डेस साइंसेज को गैलियम की अपनी खोज प्रस्तुत की।[10]26 जून, 1886 को, फर्डिनेंड फ्रेडरिक हेनरी मोइसान ने अंततः एक गैसीय फ्लोरीन शुद्ध तत्व बनाने के लिए निर्जल हाइड्रोजन फ्लोराइड पर विद्युतअपघटन का प्रदर्शन करने में सहजता का एहसास किया ।इससे पहले कि वह हाइड्रोजन फ्लोराइड का उपयोग करता, हेनरी मोइसान ने विद्युतअपघटन के साथ फ्लोराइड लवण का इस्तेमाल किया। इस प्रकार 28 जून, 1886 को, उन्होंने नए तत्व फ्लोरीन की अपनी खोज को दिखाने के लिए एकेडमी डेस साइंसेज के सामने अपना प्रयोग किया।[11] फ्लोराइड लवण के विद्युतअपघटन के माध्यम से मौलिक फ्लोरीन को खोजने की कोशिश करते हुए, कई रसायनज्ञों ने पॉलिन लुईत और जेरेम निकलेस सहित कई रासयनिक प्रयोग किए।[12]1886 में अमेरिका से चार्ल्स मार्टिन हॉल और फ्रांस से पॉल हेरोल्ट दोनों ने एल्यूमीनियम के विद्युतअपघटन के लिए अमेरिकी सनद दिया, जिसमें हेरोल्ट ने मई में, और हॉल में जुलाई में चस्पा किया।[13] हॉल अपने भाई और पारिवारिक प्रमाणों को पत्रों के माध्यम से प्रमाणित करके अपना आविष्कार जनक पत्र प्राप्त करने में सक्षम था कि फ्रांसीसी अविष्कार सम्बंधित कागजात चस्पा होने से पहले उसकी विधि की खोज की गई थी।[14] यह हॉल-हेरेल्ट प्रक्रिया के रूप में जाना जाने लगा, जिससे कई उद्योगों को लाभ हुआ क्योंकि एल्यूमीनियम की कीमत फिर चार डॉलर से गिरकर तीस सेंट प्रति पाउंड हो गई।[15]
समयावधि
- 1785 - मार्टिन स वैन मारुम के इलेक्ट्रोस्टैटिक जनित्र का उपयोग विद्युतअपघटन का उपयोग करके उनके लवण से टिन, जस्ता और सुरमा को कम करने के लिए किया गया था।[16]
- 1800 - विलियम निकोलसन (केमिस्ट) और एंथोनी कार्लिसल (और जोहान रिटर भी), हाइड्रोजन और ऑक्सीजन में जल को विघटित कर दिया।
- 1808 - पोटैशियम (1807), सोडियम (1807), बेरियम , कैल्शियम और मैग्नीशियम को विद्युतअपघटन का उपयोग करके हम्फ्री डेवी के नए तत्वों की खोज द्वारा खोजा गया था।
- 1821 - लिथियम को अंग्रेजी रसायनज्ञ विलियम थॉमस ब्रैंड द्वारा खोजा गया था, जिन्होंने इसे लिथियम ऑक्साइड के विद्युतअपघटन द्वारा प्राप्त किया था।
- 1834 - माइकल फैराडे ने अपने फैराडे के विद्युतअपघटन के नियमों को प्रकाशित किया, उनके लिए एक गणितीय स्पष्टीकरण प्रदान किया, और इलेक्ट्रोड, विद्युतपघट्य, एनोड, कैथोड, एनियन और सेशन जैसी शब्दावली शुरू की।
- 1875 - पॉल एमिल लेकोक डी बोइसबॉडरन ने विद्युतअपघटन का उपयोग करके गैलियम की खोज की।[17]
- 1886 - हेनरी मोइसान द्वारा विद्युतअपघटन का उपयोग करके एक अधातु तत्त्व की खोज की गई थी।
- 1886 - अल्युमीनियम बनाने के लिए हॉल -हेरोल्ट प्रक्रिया विकसित हुई।
- 1890 - सोडियम हाइड्रॉक्साइड बनाने के लिए कैस्टनर -केलेनर प्रक्रिया विकसित हुई।
अवलोकन
विद्युतअपघटन विद्युतपघट्य के माध्यम से एक प्रत्यक्ष धारा गुजरता है जो विद्युतपघट्य और सामग्री के रासायनिक अपघटन पर रासायनिक प्रतिक्रियाओं का उत्पादन करता है।
विद्युतअपघटन प्राप्त करने के लिए आवश्यक मुख्य घटक एक विद्युतपघट्य, इलेक्ट्रोड और एक बाहरी शक्ति स्रोत हैं। एक विभाजन (जैसे एक आयन -विनिमय झिल्ली या एक नमक सेतु ) उत्पादों को विपरीत इलेक्ट्रोड के आसपास के क्षेत्र में फैलाने से रोकने के लिए वैकल्पिक है।
विद्युतपघट्य एक रासायनिक पदार्थ है जिसमें आयन होता है और विद्युत प्रवाह होता है (जैसे कि एक आयन-चालक बहुलक, विलयन, या एक आयनिक तरल यौगिक)।यदि आयन चलायमान नहीं हैं, जैसा कि अधिकांश ठोस नमक (रसायन विज्ञान) में है, तो विद्युतअपघटन नहीं हो सकता है।
एक तरल विद्युतपघट्य का उत्पादन किया जाता है:
- चलायमान आयनों का उत्पादन करने के लिए एक विलायक (जैसे जल) के साथ एक आयनिक यौगिक की सॉल्वेशन या प्रतिक्रिया
- एक आयनिक यौगिक ऊष्मा द्वारा पिघलाया जाना
इलेक्ट्रोड को एक दूरी से अलग कर दिया जाता है जिससे कि विद्युतपघट्य के माध्यम से उनके बीच एक धारा बहती है और बिजली स्रोत से जुड़ा होता है जो विद्युत परिपथ को पूरा करता है। शक्ति स्त्रोत द्वारा आपूर्ति की गई एक सीधी धारा विद्युतपघट्य में आयनों के कारण होने वाली प्रतिक्रिया को संचालित करती है, जो संबंधित रूप से आवेशित किए गए इलेक्ट्रोड की ओर आकर्षित होती है।
धातु , सीसा और अर्धचालक सामग्री के इलेक्ट्रोड का व्यापक रूप से उपयोग किया जाता है। उपयुक्त इलेक्ट्रोड का विकल्प इलेक्ट्रोड और विद्युतपघट्य और विनिर्माण लागत के बीच रासायनिक प्रतिक्रिया पर निर्भर करता है। ऐतिहासिक रूप से, जब अक्रियाशील एनोड् विद्युतअपघटन के लिए वांछित थे, ग्रेफाइट (जिसे फैराडे के समय में प्लंबागो कहा जाता है) या प्लैटिनम को चुना गया था।[18] वे एनोड के लिए कुछ कम से कम प्रतिक्रियाशील सामग्रियों में से कुछ पाए गए। प्लैटिनम अन्य सामग्रियों की तुलना में बहुत धीरे -धीरे घुलता है, और ग्रेफाइट जाती रहती है और जलीय विलयन में कार्बन डाइऑक्साइड का उत्पादन करती है, अन्यथा प्लैटिनम प्रतिक्रिया में भाग नहीं लेता है।कैथोड एक ही सामग्री से बने हो सकते हैं, या वे अधिक प्रतिक्रियाशील से बनाए जा सकते हैं क्योंकि एनोड पर ऑक्सीकरण के कारण एनोड ज्यादा एकत्रित होता है
विद्युतअपघटन की प्रक्रिया
इलेक्ट्रोलिसिस की प्रमुख प्रक्रिया लागू धारा के कारण इलेक्ट्रॉनों को हटाने या जोड़ने के द्वारा परमाणुओं और आयनों का आदान-प्रदान है। विद्युतअपघटन के वांछित उत्पाद सामान्यता विद्युतपघट्य से एक अलग भौतिक स्थिति में होते हैं और इसे यांत्रिक प्रक्रियाओं द्वारा हटाया जा सकता है (उदाहरण के लिए, एक इलेक्ट्रोड के ऊपर गैस इकट्ठा करके या विद्युतपघट्य से बाहर किसी उत्पाद को बाहर निकालकर)।
उत्पादों की मात्रा वर्तमान के लिए आनुपातिक है, और जब दो या अधिक विद्युतपघट्यिक कोशिकाएं श्रृंखला में एक ही शक्ति स्रोत से जुड़ी होती हैं, तो कोशिकाओं में उत्पादित उत्पाद उनके समकक्ष वजन के आनुपातिक होते हैं।इन्हें फैराडे के विद्युतअपघटन के नियमों के रूप में जाना जाता है।
प्रत्येक इलेक्ट्रोड उन आयनों को आकर्षित करता है जो विपरीत विद्युत आवेश के होते हैं।सकारात्मक रूप से आवेशित किए गए आयन (उद्धरण) इलेक्ट्रॉन-प्रदान करने वाले (ऋणात्मक) कैथोड की ओर बढ़ते हैं।ऋणात्मक रूप से आवेशित किए गए आयन (आयनों) इलेक्ट्रॉन-निकालने वाले (धनवेशित) एनोड की ओर बढ़ते हैं।इस प्रक्रिया में इलेक्ट्रॉनों को प्रभावी रूप से कैथोड में एक अभिकर्मक के रूप में प्रस्तुत किया जाता है और एक उत्पाद (रसायन विज्ञान) के रूप में एनोड पर हटा दिया जाता है।रसायन विज्ञान में, इलेक्ट्रॉनों के नुकसान को ऑक्सीकरण कहा जाता है, जबकि इलेक्ट्रॉन लाभ को अपचयन (रसायन विज्ञान) कहा जाता है।
जब तटस्थ परमाणु या अणु, जैसे कि एक इलेक्ट्रोड की सतह पर, जो इलेक्ट्रॉनों को प्राप्त करते हैं या खो देते हैं, वे आयन बन जाते हैं और विद्युतपघट्य में भंग हो सकते हैं और अन्य आयनों के साथ प्रतिक्रिया कर सकते हैं।
जब आयन इलेक्ट्रॉनों को प्राप्त करते हैं या खो देते हैं और तटस्थ हो जाते हैं, तो वे उन यौगिकों का निर्माण करेंगे जो विद्युतपघट्य से अलग होते हैं।Cu2+ जैसे सकारात्मक धातु आयनों एक परत में कैथोड पर जमा करें।इसके लिए शर्तें विद्युत लेपन , वैद्युत प्रापण और वैद्युत् परिष्करण हैं।
जब एक आयन तटस्थ हो जाने के बिना इलेक्ट्रॉनों को प्राप्त करता है या खो देता है, तो इसके इलेक्ट्रॉनिक आवेशित को प्रक्रिया में बदल दिया जाता है।
उदाहरण के लिए, क्लोराल्कली प्रक्रिया हाइड्रोजन और क्लोरीन गैसों का उत्पादन करती है जो विद्युतपघट्य से बुलबुला होती है और एकत्र की जाती है।प्रारंभिक समग्र प्रतिक्रिया इस प्रकार है:[19]
- 2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
क्लोरीन आयनों से क्लोरीन गैस में एनोड पर प्रतिक्रिया होती है:
- 2 Cl− → Cl2 + 2 e−
कैथोड पर प्रतिक्रिया हाइड्रोजन गैस और हाइड्रॉक्साइड आयनों में होती है:
- 2 H2O + 2 e− → H2 + 2 OH−
इलेक्ट्रोड के बीच एक विभाजन के बिना, OH− कैथोड में उत्पादित आयन पूरे विद्युतपघट्य में एनोड में फैलने के लिए स्वतंत्र हैं।जैसे कि विद्युतपघट्य ओएच के उत्पादन के कारण अधिक आधार (रसायन विज्ञान) हो जाता है- , कम Cl2 विलयन से उभरता है क्योंकि यह हाइपोक्लोराइट का उत्पादन करने वाले हाइड्रॉक्साइड के साथ प्रतिक्रिया करना शुरू करता है
एनोड पर -
- Cl2 + 2 NaOH → NaCl + NaClO + H2O
अधिक अवसर पर Cl2 की NaOH के साथ अभिक्रिया करने की सम्भावना रहती है, कम Cl2 विलयन की सतह पर उभरता है और हाइपोक्लोराइट का उत्पादन तेजी से बढ़ता है।यह विलयन तापमान, समय की मात्रा जैसे कारकों पर निर्भर करता है2 इस समय पर अणु विलयन के संपर्क में है, और NaOH सांद्र है।
इसी तरह, जैसे -जैसे हाइपोक्लोराइट विलयन में बढ़ता है, उनसे क्लोरेट का उत्पादन होता है:
- 3 NaClO → NaClO3 + 2 NaCl
अन्य प्रतिक्रियाएं होती हैं, जैसे कि जल का स्व-आयोजन और कैथोड में हाइपोक्लोराइट का अपघटन, उत्तरार्द्ध की दर, विद्युतपघट्य के संपर्क में प्रसार और कैथोड के सतह क्षेत्र जैसे कारकों पर निर्भर करती है।[20]
विघटन क्षमता
अपघटन क्षमता या अपघटन विभव एक विद्युतपघट्यिक सेल के एनोड और कैथोड के बीच न्यूनतम विभव(इलेक्ट्रोड क्षमता में अंतर) को संदर्भित करता है जो विद्युतअपघटन के लिए आवश्यक है।[21]विभव जिस पर विद्युतअपघटन ऊष्मागतिकी रूप से पसंद किया जाता है, वह इलेक्ट्रोड क्षमता का अंतर है जैसा कि नर्नस्ट समीकरण का उपयोग करके गणना की जाती है। अतिरिक्त विभव को लागू करना, जिसे अतिरिक्त विभव के रूप में संदर्भित किया गया है, प्रतिक्रिया की दर को बढ़ा सकता है और सामान्यता ऊष्मागतिकी मूल्य से ऊपर की आवश्यकता होती है। यह विशेष रूप से गैसों से जुड़े विद्युतअपघटन प्रतिक्रियाओं के लिए आवश्यक है, जैसे ऑक्सीजन, हाइड्रोजन या क्लोरीन ।
ऑक्सीकरण और इलेक्ट्रोड पर कमी
आयनों या तटस्थ अणुओं का ऑक्सीकरण एनोड पर होता है।उदाहरण के लिए, एनोड पर फेरिक आयनों के लिए लौह आयनों को ऑक्सीकरण करना संभव है:
- Fe2+(aq) → Fe3+(aq) + e−
कैथोड में आयनों या तटस्थ अणुओं का रेडोक्स होता है।कैथोड में फेरिसेनाइड आयनों को फेरिसेनाइड आयनों को कम करना संभव है:
- Fe (CN)3-
6 + e− → Fe (cn)4-
6
तटस्थ अणु भी इलेक्ट्रोड में से किसी एक पर प्रतिक्रिया कर सकते हैं।उदाहरण के लिए: पी-बेंजोक्विनोन को कैथोड में हाइड्रोक्विनोन में कम किया जा सकता है:
H+ आयन (हाइड्रोजन आयन) भी प्रतिक्रिया में भाग लेते हैं और विलयन में अम्ल द्वारा, या विलायक (जल, मेथनॉल, आदि) द्वारा प्रदान किए जाते हैं। H+ आयन से जुड़े विद्युतअपघटन प्रतिक्रियाएं अम्लीय विलयनों में काफी सामान्य हैं।जलीय क्षारीय विलयनों में, OH− (हाइड्रॉक्साइड आयन) से जुड़ी प्रतिक्रियाएं सामान्य हैं।
कभी -कभी विलायक स्वयं (सामान्य रूप से पर जल) इलेक्ट्रोड पर ऑक्सीकरण या कम हो जाते हैं। यहां तक कि गैसों को सम्मिलित करने वाले विद्युतअपघटन होना भी संभव है, उदहारण - गैस प्रसार इलेक्ट्रोड का उपयोग करके।
विद्युतअपघटन के दौरान ऊर्जा परिवर्तन
विद्युत ऊर्जा की मात्रा जिसे जोड़ा जाना चाहिए, प्रतिक्रिया की गिब्स मुक्त ऊर्जा में परिवर्तन के साथ -साथ निकाय में ह्यस के बराबर होता है। ह्यस (सिद्धांत रूप में) मनमाने तरीके से शून्य के समीप हो सकता है, इसलिए अधिकतम ऊष्मप्रवैगिकी दक्षता प्रतिक्रिया के मुक्त ऊर्जा परिवर्तन द्वारा विभाजित थैलेपी परिवर्तन के बराबर होती है।ज्यादातर विषयों में, इलेक्ट्रिक निवेशी प्रतिक्रिया के थैलेपी परिवर्तन से बड़ा होता है, इसलिए कुछ ऊर्जा गर्मी के रूप में जारी की जाती है।कुछ मामलों में, उदाहरण के लिए, उच्च तापमान पर हाइड्रोजन और ऑक्सीजन में भाप के विद्युतअपघटन में, विपरीत सच है और उष्मीय ऊर्जा अवशोषित होती है। यह ऊष्मापरिवेश से अवशोषित होती है, और उत्पादित हाइड्रोजन का उष्णता मान विद्युत् निवेशी से अधिक होता है।
विविधताएं
डीसी से अलग उत्पादों में स्पंदित डीसी परिणाम।उदाहरण के लिए, पल्सिंग एक जलीय अम्लीय विलयन जैसे पतला सल्फ्यूरिक अम्ल के विद्युतअपघटन में एनोड पर उत्पादित ऑक्सीजन के ओजोन के अनुपात को बढ़ाता है।[22] स्पंदित वर्तमान के साथ इथेनॉल का विद्युतअपघटन मुख्य रूप से एक अम्ल के स्थान पर एक एल्डिहाइड विकसित करता है।[23]
संबंधित प्रक्रियाएं
गैल्वेनिक कोशिकाएं और विद्युत् बैटरी एक विद्युत क्षमता उत्पन्न करने के लिए सहज, ऊर्जा-उत्सर्जित करने वाली रेडॉक्स प्रतिक्रियाओं का उपयोग करती हैं जो उपयोगी शक्ति प्रदान करती है।जब एक विद्युत् बैटरी को इस प्रकार आवेशित किया जाता है, तो इसकी रेडॉक्स प्रतिक्रिया उल्टी चलाई जाती है और निकाय को विद्युतपघट्यिक सेल के रूप में माना जा सकता है।
औद्योगिक उपयोग
* एल्यूमीनियम, लिथियम, सोडियम, पोटेशियम, मैग्नीशियम, कैल्शियम और कुछ मामलों में तांबे के इलेक्ट्रोमीनियम।
- क्लोरीन उत्पादन और सोडियम हाइड्रॉक्साइड, जिसे क्लोरलाल्ली प्रक्रिया कहा जाता है।
- सोडियम क्लोरेट और पोटेशियम क्लोरेट का उत्पादन।
- इलेक्ट्रोफ्लुओरिनेशन की प्रक्रिया द्वारा ट्री फ्लुओरो असेटिक अमल जैसे परफ्लोरिनेटेड कार्बनिक यौगिकों का उत्पादन।
- ताँबा एक्सट्रैक्शन तकनीक#परिष्कृत तांबे से इलेक्ट्रोफाइनिंग।
- अंतरिक्ष यान , परमाणु पनडुब्बियों और FCEV के लिए हाइड्रोजन जैसे ईंधन का उत्पादन।
- जंग उपचार और पुराने सिक्कों और अन्य धातु वस्तुओं की सफाई।
विनिर्माण प्रक्रियाएं
विनिर्माण में, विद्युतअपघटन के लिए उपयोग किया जा सकता है:
- विद्युत लेपन , जहां धातु की एक पतली पट्टी एक क्रियाधार सामग्री पर एकत्रित की जाती है। विद्युत लेपन का उपयोग कई उद्योगों में या तो कार्यात्मक या सजावटी उद्देश्यों के लिए किया जाता है, इन-वाहन निकायों और निकल सिक्कों के रूप में।
- विद्युत रासायनिक मशीनिंग (ईसीएम), जहां एक विद्युतपघट्यिक कैथोड का उपयोग एक कार्यवाही हिस्से से एनोडिक ऑक्सीकरण द्वारा सामग्री को हटाने के लिए एक आकार के उपकरण के रूप में किया जाता है।ईसीएम को अक्सर बूर (एज) के लिए एक तकनीक के रूप में या एक स्थायी निशान या चिन्ह युक्त उपकरण या चाकू जैसे धातु की सतहों के लिए एक तकनीक के रूप में उपयोग किया जाता है।
विलयन विद्युतअपघटन में अर्ध अभिक्रिया को पूर्ण करना
अक्रिय प्लैटिनम इलेक्ट्रोड युक्त एक सेल का उपयोग करते हुए, कुछ लवणों के जलीय विलयनों के विद्युतअपघटन से उद्धरणों की कमी होती है (जैसे कि धातु के जमाव के साथ, उदाहरण के लिए, जस्ता लवण) और आयनों के ऑक्सीकरण (जैसे कि ब्रोमाइड के साथ ब्रोमिन का विकास)। हालांकि, कुछ धातुओं (जैसे सोडियम) के लवण के साथ कैथोड में हाइड्रोजन विकसित किया जाता है, और कुछ आयनों वाले लवण के लिए (जैसे सल्फेट SO2−
4) एनोड पर ऑक्सीजन विकसित की जाती है।दोनों ही मामलों में, यह जल को कम करने के लिए हाइड्रोजन बनाने या ऑक्सीजन बनाने के लिए ऑक्सीकरण करने के कारण होता है। सिद्धांत रूप में, एक लवणीय विलयन को विद्युतपघटित करने के लिए आवश्यक विभव को एनोड और कैथोड पर प्रतिक्रियाओं के लिए मानक इलेक्ट्रोड क्षमता से प्राप्त किया जा सकता है।मानक इलेक्ट्रोड क्षमता प्रत्येक इलेक्ट्रोड पर प्रतिक्रियाओं के लिए सीधे गिब्स स्वतंत्र ऊर्जा GFE से संबंधित है, और बिना किसी प्रवाह के एक इलेक्ट्रोड को संदर्भित करता है।मानक इलेक्ट्रोड क्षमता की तालिका से एक अर्क नीचे दिखाया गया है।
Half-reaction E° (V) Ref. Na+ + e− ⇌ Na(s) −2.71 [24] Zn2+ + 2 e− ⇌ Zn(s) −0.7618 [25] 2 H+ + 2 e− ⇌ H2(g) ≡ 0 [25] Br2(aq) + 2 e− ⇌ 2 Br− +1.0873 [25] O2(g) + 4 H+ + 4 e− ⇌ 2 H2O +1.23 [24] Cl2(g) + 2 e− ⇌ 2 Cl− +1.36 [24] S
2O2−
8 + 2 e− ⇌ 2 SO2−
4+2.07 [24]
विद्युतअपघटन के संदर्भ में, इस तालिका की व्याख्या निम्नानुसार की जानी चाहिए:
- तालिका के नीचे जाने पर, E° अधिक धनात्मक हो जाता है, और बाईं ओर प्रजातियों को कम होने की संभावना अधिक होती है: उदाहरण के लिए, जस्ता आयनों को सोडियम आयन की तुलना में जिंक धातु में कम होने की संभावना अधिक होती है, सोडियम धातु में कम होने की संभावना है।
- तालिका को आगे बढ़ने पर, E° अधिक ऋणात्मक हो जाता है, और दाईं ओर प्रजातियों को ऑक्सीकरण करने की अधिक संभावना होती है: उदाहरण के लिए, सोडियम धातु को सोडियम आयनों के लिए ऑक्सीकरण होने की संभावना है, जस्ता धातु की तुलना में जस्ता आयनों के लिए ऑक्सीकरण किया जाना है।
नर्न्स्ट समीकरण का उपयोग करके इलेक्ट्रोड क्षमता की गणना आयनों, तापमान और सम्मिलित इलेक्ट्रॉनों की एक विशिष्ट विलयन के लिए की जा सकती है।शुद्ध जल के लिए (ph 7):
- अपचयित उत्पादन हाइड्रोजन के लिए इलेक्ट्रोड क्षमता −0.41 v है,
- ऑक्सीकरण के उत्पादन के लिए इलेक्ट्रोड क्षमता ऑक्सीजन का उत्पादन +0.82 v है।
इसी प्रकार प्राप्त किये गए और तुलनीय आकड़े , 1m जस्ता ब्रोमाइड ZnBr2 के लिए , Zn धातु के अपचयन के लिए ,और ब्रोमीन के ऑक्सीकरण के लिए +1.10v। इन आंकड़ों से निष्कर्ष यह है कि जल के विद्युतअपघटन से एनोड पर कैथोड और ऑक्सीजन पर हाइड्रोजन का उत्पादन किया जाना चाहिए - जो कि प्रयोगात्मक अवलोकन के साथ विचार पर है कि जिंक धातु जमा है और ब्रोमीन का उत्पादन किया जाता है।[26]स्पष्टीकरण यह है कि ये गणना की गई क्षमता केवल ऊष्मप्रवैगिकी रूप से पसंदीदा प्रतिक्रिया को इंगित करती है।व्यवहार में, कई अन्य कारकों को ध्यान में रखा जाना चाहिए जैसे कि कुछ प्रतिक्रिया कदमों के कैनेटीक्स सम्मिलित हैं।इन कारकों का एक साथ मतलब है कि भविष्यवाणी की तुलना में जल की कमी और ऑक्सीकरण के लिए एक उच्च क्षमता की आवश्यकता होती है, और इन्हें ओवरपोटेंशियल कहा जाता है।प्रयोगात्मक रूप से यह ज्ञात है कि ओवरपोटेंशियल सेल के डिजाइन और इलेक्ट्रोड की प्रकृति पर निर्भर करता है।
एक तटस्थ (ph 7) सोडियम क्लोराइड विलयन के विद्युतअपघटन के लिए, सोडियम आयन की कमी थर्मोडायनामिक रूप से बहुत मुश्किल होती है और जल को कम किया जाता है जो हाइड्रोजन को हाइड्रॉक्साइड आयन ों को छोड़कर विकसित होता है।एनोड पर क्लोरीन के ऑक्सीकरण को जल के ऑक्सीकरण के बजाय देखा जाता है क्योंकि क्लोरीन से क्लोरीन के ऑक्सीकरण के लिए ओवरपोटेंशियल ऑक्सीजन के लिए जल के ऑक्सीकरण के लिए ओवरपोटेंशियल से कम होता है।हाइड्रॉक्साइड आयनों और भंग क्लोरीन गैस हाइपोक्लोरस तेजाब बनाने के लिए आगे प्रतिक्रिया करते हैं।इस प्रक्रिया से उत्पन्न जलीय विलयनों को इलेक्ट्रोलाइज्ड जल कहा जाता है और इसका उपयोग एक कीटाणुनाशक और सफाई एजेंट के रूप में किया जाता है।
अनुसंधान रुझान
कार्बन डाइऑक्साइड का विद्युतअपघटन
कार्बन डाइऑक्साइड का विद्युत् अपघटन या विद्युत् अपघटनीय रूपांतरण ,मूल्य वर्धित रसायन जैसे मीथेन , ईथीलीन , इथेनॉल , आदि का उत्पादन कर सकते हैं।[27][28][29] कार्बन डाइऑक्साइड का विद्युतअपघटन फॉर्मेट या कार्बन मोनोऑक्साइड देता है, लेकिन कभी -कभी एथिलीन जैसे अधिक विस्तृत कार्बनिक यौगिक भी प्रदान करता है।[30] यह तकनीक कार्बनिक यौगिकों के लिए कार्बन-तटस्थ मार्ग के रूप में अनुसंधान के अधीन है।[31][32]
अम्लीय जल का विद्युतअपघटन
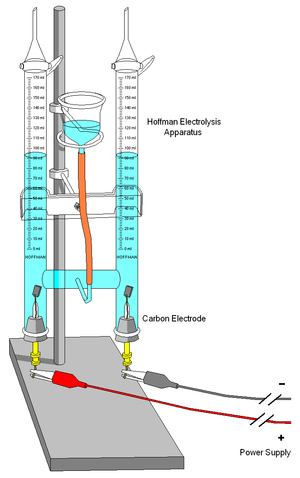
जल का विद्युतअपघटन क्रमशः 2 से 1 के अनुपात में हाइड्रोजन और ऑक्सीजन का उत्पादन करता है।
- 2 H2O(l) → 2 H2(g) + O2(g) E ° = +1.229 v
जल के विद्युतअपघटन की ऊर्जा रूपांतरण दक्षता व्यापक रूप से भिन्न होती है।एक इलेक्ट्रोलाइज़र की दक्षता निवेशी विद्युत ऊर्जा के साथ तुलना में हाइड्रोजन में निहित थैलेपी (ऑक्सीजन या कुछ अन्य बाद की प्रतिक्रिया के साथ दहन से गुजरने के लिए) का एक उपाय है।हाइड्रोजन के लिए ऊष्मा/थैलेपी मान विज्ञान और इंजीनियरिंग ग्रंथों में अच्छी तरह से प्रकाशित होते हैं, 144 mj/kg के रूप में।ध्यान दें कि ईंधन कोशिकाएं (विद्युतअपघट्य नहीं) ऊष्मा/थैलेपी की इस पूरी मात्रा का उपयोग नहीं कर सकती हैं, जिससे दोनों प्रकार की प्रौद्योगिकी के लिए दक्षता मूल्यों की गणना करते समय कुछ भ्रम पैदा हुआ है।प्रतिक्रिया में, कुछ ऊर्जा ऊष्मा के रूप में खो जाती है।कुछ विवरण क्षारीय विद्युतअपघट्य के लिए 50% और 70% के बीच क्षमता को उद्धृत करती हैं;हालांकि, बहुत अधिक व्यावहारिक क्षमता बहुलक विद्युतअपघट्य झिल्ली विद्युतअपघटन और उत्प्रेरक प्रौद्योगिकी के उपयोग के साथ उपलब्ध हैं, जैसे कि 95% दक्षता।[33][34] 2006 में राष्ट्रीय अक्षय ऊर्जा प्रयोगशाला का अनुमान है कि 1 हाइड्रोजन का किलो (लगभग 3 kg, या 4 लीटर, ऊर्जा की शर्तों में पेट्रोलियम के बराबर) का उत्पादन किया जा सकता है।लंबी अवधि में।[35] दुनिया भर में उत्पादित हाइड्रोजन गैस का लगभग 4% विद्युतअपघटन द्वारा उत्पन्न होता है, और सामान्य रूप से ऑनसाइट का उपयोग किया जाता है।हाइड्रोजन का उपयोग हैबर प्रक्रिया के माध्यम से उर्वरक के लिए अमोनिया के निर्माण के लिए किया जाता है, और भारी पेट्रोलियम स्रोतों को जल विखंडन के माध्यम से हल्के अंशों में परिवर्तित किया जाता है।कुछ समय पूर्व ही, हाइड्रोजन वाहन में हाइड्रोजन ईंधन-कोशिकाओं के लिए हाइड्रोजन को प्राप्त करने के लिए ऑनसाइट विद्युतअपघटन का उपयोग किया गया है।
कार्बन/हाइड्रोकार्बन की सहायता से जल विद्युतअपघटन
कुछ समय पूर्व में ही, निवेशी ऊर्जा को कम करने के लिए, कार्बन (कोयला ), अल्कोहल (रसायन विज्ञान) एस (हाइड्रोकार्बन विलयन), और कार्बनिक विलयन (ग्लिसरॉल , फॉर्मिक अम्ल, इथाइलीन ग्लाइकॉल , आदि) का उपयोग जल के सह-विद्युतअपघटन के साथ प्रस्तावित किया गया है एक व्यवहार्य विकल्प के रूप में।[36][37] हाइड्रोजन पीढ़ी के लिए कार्बन/हाइड्रोकार्बन की सहायता से जल विद्युतअपघटन (तथाकथित CAWE) प्रक्रिया एक एकल विद्युत रिएक्टर में इस संचालन का प्रदर्शन करेगी।इस प्रणाली की ऊर्जा संतुलन को कार्बन या हाइड्रोकार्बन की रासायनिक ऊर्जा से 60% के साथ केवल 40% इलेक्ट्रिक निवेश की आवश्यकता हो सकती है।[38] यह प्रक्रिया ठोस कोयला/कार्बन कणों या चूर्ण का उपयोग करती है क्योंकि ईंधन को स्लरी के रूप में अम्ल/क्षारीय विद्युतपघट्य में फैलाया जाता है और कार्बन समग्र समग्र प्रतिक्रियाओं के बाद विद्युतअपघटन प्रक्रिया में स्रोत सह-सहायता प्राप्त होता है:[39]
- कार्बन/कोयला घोल (C + 2H2O) → क्या2 +2 E ′ = 0.21 v (प्रतिवर्ती विभव) / e and = 0.46 v (उष्मीय निरावेश विभव)
या
- कार्बन/कोयला घोल (सी + एच)2O) → CO + H2 E ′ = 0.52 v (प्रतिवर्ती विभव) / e ′ = 0.91 v (उष्मीय निरावेश विभव)
इस प्रकार, यह CAWE दृष्टिकोण यह है कि वास्तविक सेल अतिरिक्त विभव को 1.0 & nbsp; v से कम किया जा सकता है, जबकि पारंपरिक जल विद्युतअपघटन के लिए 1.5 v की तुलना में।
विद्युत् क्रिस्टलीकरण
विद्युतअपघटन के एक विशेष अनुप्रयोग में ऑक्सीकरण या कम प्रजातियों से इलेक्ट्रोड में से एक पर प्रवाहकीय क्रिस्टल का विकास सम्मिलित होता है जो सीटू में उत्पन्न होते हैं।तकनीक का उपयोग कम-आयामी विद्युत सुचालको के एकल क्रिस्टल को प्राप्त करने के लिए किया गया है, जैसे कि आवेश वाहक लवण और रैखिक श्रृंखला यौगिक [40][41]
लौह अयस्क का विद्युतअपघटन
लौह अयस्क से स्टील के उत्पादन की वर्तमान विधि बहुत कार्बन से सम्बंधित है, जिससे वात्या भट्टी में सीधा CO2 प्रवाहित हो जाती है ।जर्मनी में स्टील बनाने के एक अध्ययन में पाया गया कि 1 टन स्टील का उत्पादन वात्या भट्टी में 2.1 टन 22% ग्लोबल वार्मिंग क्षमता उत्सर्जित करता है। [42] 2022 तक, स्टील का उत्पादन 7 से 9% वैश्विक उत्सर्जन में योगदान देता है।[43] लोहे का विद्युतअपघटन प्रत्यक्ष उत्सर्जन को समाप्त कर सकता है और यदि बिजली हरित ऊर्जा से बिजली बनाई जाती है तो उत्सर्जन को और कम कर सकता है।
लोहे के छोटे पैमाने पर विद्युतअपघटन को पिघले हुए ऑक्साइड लवण में इसे भंग करके और एक प्लैटिनम एनोड का उपयोग करके सफलतापूर्वक सूचित किया गया है।[44] ऑक्सीजन आयनों एनोड पर ऑक्सीजन गैस और इलेक्ट्रॉनों का निर्माण करते हैं।लोहे के उद्धरण इलेक्ट्रॉनों को अवशोषित करते हैं और कैथोड में लोहे की धातु बनाते हैं।इस विधि को 1550 डिग्री सेल्सियस का तापमान किया गया था जो प्रतिक्रिया को बनाए रखने के लिए एक महत्वपूर्ण चुनौती प्रस्तुत करता है।विशेष रूप से, एनोड संक्षारण इन तापमानों पर एक चिंता का विषय है।
इसके अतिरिक्त, क्षारीय जल में इसे भंग करके लोहे के ऑक्साइड के कम तापमान में कमी की सूचना दी गई है।[45] तापमान 114 डिग्री सेल्सियस पर पारंपरिक लोहे के उत्पादन की तुलना में बहुत कम है।कम तापमान भी उच्च वर्तमान क्षमता के साथ सहसंबंधित होता है, जिसमें 95% की दक्षता की सूचना दी जाती है।जबकि ये विधियां आशाजनक हैं, वे वात्या भट्टी से प्राप्त लोहे की कम कीमत को ध्यान में रखते हुए पैमाने की बड़ी अर्थव्यवस्थाओं के कारण प्रतिस्पर्धी होने के लिए संघर्ष करते हैं।
यह भी देखें
- क्षारीय जल विद्युत्अपघटन
- कास्टनर -केलेनर प्रक्रिया
- विद्युतअपघट्य सेल
- विद्युत् रासायनिक इंजीनियरिंग
- विद्युत्अपघटन का फैराडे का नियम
- प्रचुरता
- फैराडे दक्षता
- विद्युत् उत्पन्न करने वाली जंग
- गैल्वेनोलुमिनेशन
- गैस पटाखा
- हॉल -हेरोल्ट प्रक्रिया
- उच्च दबाव वाले विद्युत्अपघटन
- अतिरिक्त विभव
- पैटरसन शक्ति सेल
- ऊष्मीय चक्र
- हाइड्रोजन प्रौद्योगिकियों की समयरेखा
- उच्च दबाव विद्युत्अपघटन
संदर्भ
- ↑ Oesper, Ralph; Speter, Max (1937). "विद्युत-रासायनिक शब्दों से संबंधित फैराडे-व्हीवेल पत्राचार". The Scientific Monthly. 45 (6): 535–546. Bibcode:1937SciMo..45..535O.
- ↑ Fabbri, Emiliana; Schmidt, Thomas J. (5 October 2018). "ऑक्सीजन विकास प्रतिक्रिया - पानी के इलेक्ट्रोलिसिस में पहेली". ACS Catalysis (in English). 8 (10): 9765–9774. doi:10.1021/acscatal.8b02712.
- ↑ Ashworth, William (20 March 2015). "मार्टिनस वैन मारुम - दिन के वैज्ञानिक". Linda Hall Library.
- ↑ Ihde, Aaron J. (1964). आधुनिक रसायन विज्ञान का विकास. Harper & Row. pp. 125–127.
- ↑ 5.0 5.1 "इलेक्ट्रोकेमिस्ट्री का इतिहास: वोल्टा से एडिसन तक". ECS (in English). Retrieved 11 October 2019.
- ↑ Thorpe, Thomas (1896). हम्फ्री डेवी, कवि और दार्शनिक. New York: Macmillan & Co., Limited.
- ↑ "लिथियम - आवधिकस्टैट्स.कॉम". www.periodicstats.com. Archived from the original on 15 April 2021.
- ↑ Helmenstine, Todd (11 January 2018). "आज विज्ञान इतिहास में - 12 जनवरी - जोहान अगस्त अरफेडसन और लिथियम". Science Notes and Projects.
- ↑ Ede, Andrew (2017). समाज में विज्ञान का इतिहास (3rd ed.). Toronto, Canada: University of Toronto Press. p. 251. ISBN 978-1-4426-3499-2.
- ↑ Marshall, James and Virginia. "तत्वों की पुनर्वितरण - गैलियम" (PDF). University of North Texas. Archived (PDF) from the original on 9 October 2022.
- ↑ Wisniak, Jaime (26 August 2018). "हेनरी मोइसान: फ्लोरीन के खोजकर्ता". Educación Química. 13 (4): 267. doi:10.22201/fq.18708404e.2002.4.66285. ISSN 1870-8404. S2CID 92299077.
- ↑ Marshall, James and Virginia. "तत्वों की पुनर्वितरण- फ्लोरीन और हेनरी मोइसान" (PDF). University of North Texas. Archived (PDF) from the original on 9 October 2022.
- ↑ Beck, Theodore R. (21 August 2015). "ईसीएस क्लासिक्स: हॉल और हेरोल्ट और एल्यूमीनियम इलेक्ट्रोलिसिस की खोज". ECS. Interface.
- ↑ हॉल प्रक्रिया उत्पादन और एल्यूमीनियम का व्यावसायीकरण - राष्ट्रीय ऐतिहासिक रासायनिक लैंडमार्क (in English). Oberlin, Ohio: American Chemical Society. 1997.
- ↑ "पॉल हेरोल्ट और चार्ल्स एम। हॉल". Science History Institute (in English). 1 June 2016.
- ↑ The Supplement (1803 edition) to Encyclopædia Britannica 3rd edition (1797), volume 1, page 225, "Mister Van Marum, by means of his great electrical machine, decomposed the calces of tin, zinc, and antimony, and resolved them into their respective metals and oxygen" and gives as a reference Journal de Physiques, 1785.
- ↑ Lecoq de Boisbaudran P-E (1875). "गैलियम के कुछ गुणों पर". The Chemical News and Journal of Industrial Science. 32: 294.
- ↑ Faraday, Michael (1849). बिजली में प्रायोगिक शोध. Vol. 1. London: The University of London.
- ↑ Tilley, R.J.D. (2004). ठोस समझ: सामग्री का विज्ञान. pp. 281–. Bibcode:2004usts.book.....T. ISBN 978-0-470-85276-7. Retrieved 22 October 2011.
{{cite book}}:|journal=ignored (help) - ↑ Thompson, M. de Kay (1911). लागू विद्युत -विज्ञान. The MacMillan Company. pp. 84-88.
- ↑ Blum, W.; Vinal, G. W. (1934). "ध्रुवीकरण, ओवरवोल्टेज और अपघटन क्षमता की परिभाषा". Transactions of the Electrochemical Society. 66: 359. doi:10.1149/1.3498105.
- ↑ Kremann, R. (1903). "ओजोन गठन पर इलेक्ट्रोलाइट की प्रकृति और इलेक्ट्रोड सामग्री के प्रभाव के बारे में।". Zeitschrift für anorganische Chemie. Metzger & Wittig. 36: 403–. doi:10.1002/zaac.19030360152. Retrieved 12 September 2019.
- ↑ Hale, Arthur J. (1919). इलेक्ट्रोलिसिस द्वारा रसायनों का निर्माण. D. Van Nostrand Co. pp. 16, 73. Retrieved 12 September 2019.
- ↑ 24.0 24.1 24.2 24.3 Atkins, Peter (1997). Physical Chemistry (6 ed.). New York: W.H. Freeman and Company.
- ↑ 25.0 25.1 25.2 Vanýsek, Petr (2007). "Electrochemical Series". Handbook of Chemistry and Physics (88 ed.). Chemical Rubber Company. Archived from the original (PDF) on 24 July 2017.
- ↑ Hall, Norris F. (1952). "मात्रात्मक अकार्बनिक विश्लेषण की एक पाठ्यपुस्तक (वोगेल, आर्थर आई)". Journal of Chemical Education. 29 (6): 319. Bibcode:1952JChEd..29..319H. doi:10.1021/ed029p319.1.
- ↑ Lee, Seunghwa; Ju, Hyungkuk; Machunda, Revocatus; Uhm, Sunghyun; Lee, Jae Kwang; Lee, Hye Jin; Lee, Jaeyoung (2015). "गैसीय कार्बन डाइऑक्साइड के इलेक्ट्रोलाइटिक कमी द्वारा फॉर्मिक एसिड का सतत उत्पादन". J. Mater. Chem. A. 3 (6): 3029. doi:10.1039/C4TA03893B. S2CID 98110035.
- ↑ Whipple, Devin T.; Kenis, Paul J.A. (2010). "सीओ <उप> 2 </उप> की संभावनाएं प्रत्यक्ष विषम विद्युत रासायनिक कमी के माध्यम से उपयोग". The Journal of Physical Chemistry Letters. 1 (24): 3451. doi:10.1021/jz1012627. S2CID 101946630.
- ↑ Machunda, Revocatus L.; Ju, Hyungkuk; Lee, Jaeyoung (2011). "एसएन आधारित गैस प्रसार इलेक्ट्रोड में सीओ <उप> 2 गैस का इलेक्ट्रोकैटलिटिक कमी". Current Applied Physics. 11 (4): 986. Bibcode:2011CAP....11..986M. doi:10.1016/j.cap.2011.01.003.
- ↑ Hori, Y (2008). "Electrochemical CO2 Reduction on Metal Electrodes". In C.G. Vayeanas, R. White and M.E. Gamboa-Aldeco (ed.). इलेक्ट्रोकेमिस्ट्री के आधुनिक पहलू. Vol. 42 (42 ed.). New York: Springer. pp. 141–153. doi:10.1007/978-0-387-49489-0_3. ISBN 978-0-387-49488-3..
- ↑ Appel, Aaron M.; Bercaw, John E.; Bocarsly, Andrew B.; Dobbek, Holger; Dubois, Daniel L.; Dupuis, Michel; Ferry, James G.; Fujita, Etsuko; Hille, Russ; Kenis, Paul J.A.; Kerfeld, Cheryl A.; Morris, Robert H.; Peden, Charles H.F.; Portis, Archie R.; Ragsdale, Stephen W.; Rauchfuss, Thomas B.; Reek, Joost N.H.; Seefeldt, Lance C.; Thauer, Rudolf K.; Waldrop, Grover L. (2013). "सीओ <उप> 2 फिक्सेशन के जैव रासायनिक और रासायनिक कटैलिसीस में फ्रंटियर्स, अवसर और चुनौतियां". Chemical Reviews. 113 (8): 6621–6658. doi:10.1021/cr300463y. PMC 3895110. PMID 23767781.
- ↑ Qiao, Jinli; Liu, Yuyu; Hong, Feng; Zhang, Jiujun (2014). "कम कार्बन ईंधन का उत्पादन करने के लिए कार्बन डाइऑक्साइड के विद्युत के लिए उत्प्रेरक की समीक्षा". Chem. Soc. Rev. 43 (2): 631–675. doi:10.1039/C3CS60323G. PMID 24186433.
- ↑ Carmo, M; Fritz D; Mergel J; Stolten D (2013). "PEM वाटर इलेक्ट्रोलिसिस पर एक व्यापक समीक्षा". Journal of Hydrogen Energy. 38 (12): 4901. doi:10.1016/j.ijhydene.2013.01.151.
- ↑ Zittel, Werner; Wurster, Reinhold (8 July 1996). "अध्याय 3: हाइड्रोजन का उत्पादन।भाग 4: इलेक्ट्रोलिसिस के माध्यम से बिजली से उत्पादन". HyWeb: Knowledge – Hydrogen in the Energy Sector. Ludwig-Bölkow-Systemtechnik GmbH. Archived from the original on 7 February 2007.
- ↑ Levene, J.; Kroposki, B.; Sverdrup, G. (March 2006). "पवन ऊर्जा और हाइड्रोजन और बिजली का उत्पादन - नवीकरणीय हाइड्रोजन के लिए अवसर - प्रीप्रिंट" (PDF). National Renewable Energy Laboratory. Archived (PDF) from the original on 9 October 2022. Retrieved 20 October 2008.
- ↑ Ju, Hyungkuk; Badwal, Sukhvinder; Giddey, Sarbjit (2018). "हाइड्रोजन उत्पादन के लिए कार्बन और हाइड्रोकार्बन सहायक जल इलेक्ट्रोलिसिस की एक व्यापक समीक्षा". Applied Energy. 231: 502–533. doi:10.1016/j.apenergy.2018.09.125. S2CID 117669840.
- ↑ Ju, Hyungkuk; Giddey, Sarbjit; Badwal, Sukhvinder P.S.; Mulder, Roger J. (2016). "वितरित हाइड्रोजन पीढ़ी के लिए ठोस इलेक्ट्रोलाइट कोशिकाओं में इथेनॉल का इलेक्ट्रो-कैटालिटिक रूपांतरण". Electrochimica Acta. 212: 744–757. doi:10.1016/j.electacta.2016.07.062.
- ↑ Giddey, S.; Kulkarni, A.; Badwal, S.P.S. (2015). "कार्बन असिस्टेड इलेक्ट्रोलिसिस के माध्यम से कम उत्सर्जन हाइड्रोजन पीढ़ी". International Journal of Hydrogen Energy. 40: 70–74. doi:10.1016/j.ijhydene.2014.11.033.
- ↑ Ju, Hyungkuk; Giddey, Sarbjit; Badwal, Sukhvinder P.S. (2018). "लागत प्रभावी हाइड्रोजन उत्पादन के लिए एक पीईएम आधारित कार्बन-पानी सह-इलेक्ट्रोलिसिस में मध्यस्थ के रूप में लोहे की प्रजातियों की भूमिका". International Journal of Hydrogen Energy. 43 (19): 9144–9152. doi:10.1016/j.ijhydene.2018.03.195.
- ↑ Bechgaard, K.; Carneiro, K.; Rasmussen, F. B.; Olsen, M.; Rindorf, G.; Jacobsen, C.S.; Pedersen, H.J.; Scott, J.C. (1981). "एक कार्बनिक ठोस में सुपरकंडक्टिविटी।BIS (Tetramethyltetraselenafulvalenium) Perchlorate, (TMTSF) <सब> 2 CLO <सब> 4 ". Journal of the American Chemical Society. 103 (9): 2440. doi:10.1021/ja00399a065.
- ↑ Williams, Jack M. (2007). "Highly Conducting and Superconducting Synthetic Metals". अकार्बनिक संश्लेषण. अकार्बनिक संश्लेषण. Vol. 26. pp. 386–394. doi:10.1002/9780470132579.ch70. ISBN 978-0-470-13257-9.
- ↑ Backes, Jana Gerta; Suer, Julian; Pauliks, Nils; Neugebauer, Sabrina; Traverso, Marzia (19 March 2021). "प्राथमिक विनिर्माण डेटा का उपयोग करके एक एकीकृत स्टील मिल का जीवन चक्र मूल्यांकन: वास्तविक पर्यावरण प्रोफ़ाइल". Sustainability (in English). 13 (6): 3443. doi:10.3390/su13063443. ISSN 2071-1050.
- ↑ Lopes, Daniela V.; Quina, Margarida J.; Frade, Jorge R.; Kovalevsky, Andrei V. (2022). "स्टील उत्पादन के लिए क्षारीय मीडिया में लोहे के ऑक्साइड की विद्युत रासायनिक कमी की संभावनाएं और चुनौतियां". Frontiers in Materials. 9. Bibcode:2022FrMat...910156L. doi:10.3389/fmats.2022.1010156. ISSN 2296-8016.
- ↑ Wiencke, Jan; Lavelaine, Hervé; Panteix, Pierre-Jean; Petitjean, Carine; Rapin, Christophe (1 January 2018). "एक पिघला हुआ ऑक्साइड इलेक्ट्रोलाइट में लोहे का इलेक्ट्रोलिसिस". Journal of Applied Electrochemistry (in English). 48 (1): 115–126. doi:10.1007/s10800-017-1143-5. ISSN 1572-8838. S2CID 102871146.
- ↑ Yuan, Boyan; Haarberg, Geir Martin (20 March 2009). "जलीय क्षारीय समाधान में लोहे का इलेक्ट्रोडोज़िशन: कार्बोथर्मिक कमी के लिए एक विकल्प". ECS Transactions (in English). 16 (36): 31. Bibcode:2009ECSTr..16J..31Y. doi:10.1149/1.3114006. ISSN 1938-5862. S2CID 96771590.