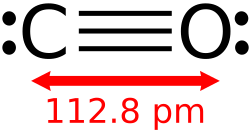ऑक्साइड
एक ऑक्साइड (/ˈɒksaɪd/) एक रासायनिक यौगिक है जिसमें कम से कम एक ऑक्सीजन परमाणु और एक अन्य तत्व [1] इसके रासायनिक सूत्र में होता है। "ऑक्साइड" स्वयं ऑक्सीजन का डियानियन है, एक O2– (आणविक) आयन जिसमें ऑक्सीजन -2 की ऑक्सीकरण अवस्था में है। पृथ्वी की परत का अधिकांश भाग आक्साइड से बना है। यहां तक कि शुद्ध तत्व माने जाने वाले पदार्थों में भी अक्सर ऑक्साइड की परत बन जाती है। उदाहरण के लिए, एल्युमिनियम फॉयल Al2O3 (जिसे पैसिवेशन लेयर कहा जाता है) की एक पतली परत विकसित करता है जो फ़ॉइल को और जंग से बचाता है।[2]
रससमीकरणमिति (एक समीकरण या प्रतिक्रिया के अभिकारकों और रासायनिक समीकरणों के बीच मापने योग्य संबंध)
स्टोइकोमेट्री के संदर्भ में और प्रत्येक स्टोइकोमेट्री की संरचनाओं के संदर्भ में ऑक्साइड असाधारण रूप से विविध हैं। अधिकांश तत्व एक से अधिक स्टोइकोमेट्री के ऑक्साइड बनाते हैं। कार्बन मोनोऑक्साइड और कार्बन डाइऑक्साइड एक प्रसिद्ध उदाहरण है।[2] यह बाइनरी ऑक्साइड पर लागू होता है, यानी केवल ऑक्साइड और अन्य तत्व वाले यौगिक। बाइनरी ऑक्साइड्स की तुलना में कहीं अधिक सामान्य अधिक जटिल स्टोइकोमेट्रीज के ऑक्साइड हैं। इस तरह की जटिलता अन्य धनायनों (एक धनात्मक रूप से आवेशित आयन, यानी एक जो इलेक्ट्रोलिसिस में कैथोड की ओर आकर्षित होगी) या अन्य आयनों (एकऋणात्मक आवेशित आयन) की शुरूआत से उत्पन्न हो सकती है। आयरन सिलिकेट, Fe2SiO4, खनिज फायलाइट, एक त्रिअक्षीय ऑक्साइड के कई उदाहरणों में से एक है। कई धातु आक्साइडों के लिए, बहुरूपता और गैर-स्टोइकोमेट्री की संभावनाएं भी मौजूद हैं।[3]
उदाहरण के लिए, व्यावसायिक रूप से महत्वपूर्ण टाइटेनियम डाइऑक्साइड तीन अलग-अलग संरचनाओं में मौजूद हैं। कई धातु ऑक्साइड कई गैर-स्टोइकियोमेट्रिक अवस्थाओं में मौजूद हैं। कई आणविक आक्साइड भी विभिन्न प्रकार के लिगेंड के साथ मौजूद हैं।[4]
सरलता के लिए, इस लेख का अधिकांश भाग बाइनरी ऑक्साइड्स पर केंद्रित है।
निर्माण
कुछ अक्रिय गैसों को छोड़कर ऑक्साइड सभी तत्वों से जुड़े होते हैं। यौगिकों के इस विविध परिवार के गठन के रास्ते इसी तरह कई हैं।
धातु ऑक्साइड
अन्य धातु यौगिकों के अपघटन से कई धातु ऑक्साइड उत्पन्न होते हैं, उदा कार्बोनेट्स, हाइड्रोक्साइड्स और नाइट्रेट्स। कैल्शियम ऑक्साइड के निर्माण में, कैल्शियम कार्बोनेट (चूना पत्थर) गरम करने पर टूट जाता है, कार्बन डाइऑक्साइड मुक्त करता है:
- CaCO3 -> CaO + CO2
हवा में ऑक्सीजन के साथ तत्वों की प्रतिक्रिया विशेष रूप से लोहे के व्यावसायिक उपयोग के लिए प्रासंगिक संक्षारण में एक महत्वपूर्ण कदम है। लगभग सभी तत्व ऑक्सीजन के वातावरण के साथ गर्म करने पर ऑक्साइड बनाते हैं। उदाहरण के लिए, जिंक पाउडर हवा में जलकर जिंक ऑक्साइड प्रदान करेगा:x[5]
- 2 Zn + O2 -> 2 ZnO
अयस्कों से धातुओं के उत्पादन में अक्सर हवा में धातु सल्फाइड खनिजों को भूनने (गर्म करने) द्वारा ऑक्साइड का उत्पादन सम्मिलितहोता है। इस तरह, MoS2 (मोलिब्डेनाईट) को मोलिब्डेनम ट्रायऑक्साइड में परिवर्तित कर दिया जाता है, जो वस्तुतः सभी मोलिब्डेनम यौगिकों का अग्रदूत है:[6]
- 2 MoS2 + 7 O2 -> 2MoO3 + 4 SO2
- नोबल धातुएं (जैसे सोना और प्लैटिनम ) बेशकीमती हैं क्योंकि वे ऑक्सीजन के साथ सीधे रासायनिक संयोजन का विरोध करती हैं। [2]नोबल धातुएं (जैसे सोना और प्लेटिनम) बेशकीमती हैं क्योंकि वे ऑक्सीजन के साथ सीधे रासायनिक संयोजन का विरोध करती हैं।
NiS + 3/2 O2 -> NiO + SO2
अधातु ऑक्साइड
कार्बन डाइआक्साइड और कार्बन मोनोआक्साइड महत्वपूर्ण और प्रचलित गैर-धातु ऑक्साइड हैं। ये प्रजातियाँ कार्बन या हाइड्रोकार्बन के पूर्ण या आंशिक ऑक्सीकरण से बनती हैं। ऑक्सीजन की कमी से मोनोऑक्साइड का उत्पादन होता है:[2]
CH4 + 3/2 O2 -> CO + 2 H2O
C + 1/2 O2 -> CO
अतिरिक्त ऑक्सीजन के साथ, डाइऑक्साइड उत्पाद है, जिसमें कार्बन मोनोऑक्साइड मार्ग द्वारा मध्यस्थ है:
CH4 + 2 O2 -> CO2 + 2 H2O
C + O2 -> CO2
एलिमेंटल नाइट्रोजन (N2) को ऑक्साइड में परिवर्तित करना मुश्किल है, लेकिन अमोनिया के दहन से नाइट्रिक ऑक्साइड बनता है, जो आगे ऑक्सीजन के साथ प्रतिक्रिया करता है:
- 4 NH3 + 5 O2 -> 4 NO + 6 H2O
- NO + 1/2 O2 -> NO2
इन प्रतिक्रियाओं का अभ्यास नाइट्रिक एसिड के उत्पादन में किया जाता है, जो कि एक उपयोगी रसायन है।[7]
औद्योगिक रूप से सबसे बड़े पैमाने पर उत्पादित रसायन सल्फ्यूरिक एसिड है। यह सल्फर के सल्फर डाइऑक्साइड के ऑक्सीकरण द्वारा निर्मित होता है, जिसे अलग से सल्फर ट्रायऑक्साइड में ऑक्सीकृत किया जाता है:[8] :
S+ O2 -> SO2
SO2 + 1/2 O2 -> SO3
अंततः ट्राइऑक्साइड को सल्फ्यूरिक एसिड में हाइड्रेशन रिएक्शन द्वारा परिवर्तित किया जाता है:
SO3 + H2O -> H2SO4
संरचना
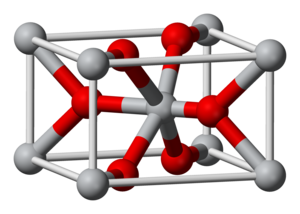
ऑक्साइड में अलग-अलग अणुओं से लेकर बहुलक और क्रिस्टलीय संरचनाओं की एक श्रृंखला होती है। मानक परिस्थितियों में, ऑक्साइड ठोस से लेकर गैस तक हो सकते हैं। ठोस धातु आक्साइड में आमतौर पर परिवेशी परिस्थितियों में बहुलक संरचनाएं होती हैं।[9]
आणविक ऑक्साइड
- Some important gaseous oxides
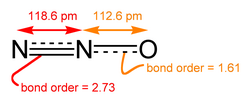
यद्यपि अधिकांश धातु ऑक्साइड क्रिस्टलीय ठोस होते हैं, कुछ ऑक्साइड अणु होते हैं। कार्बन डाइऑक्साइड और कार्बन मोनोऑक्साइड आण्विक ऑक्साइड के उदाहरण हैं। नाइट्रोजन के सभी सरल ऑक्साइड आणविक होते हैं, जैसे, NO, N2O, NO2 और N2O4.। फॉस्फोरस पेंटोक्साइड भ्रामक नाम वाला एक अधिक जटिल आणविक ऑक्साइड है, वास्तविक सूत्र P4O10 है। टेट्रोक्साइड दुर्लभ हैं, रूथेनियम टेट्रोक्साइड, आज़मियम टेट्रोक्साइड और क्सीनन टेट्रोक्साइड होने के कुछ अधिक सामान्य उदाहरण हैं।[2]
प्रतिक्रियाएं
कमी
कुछ धातुओं के उत्पादन में धातु ऑक्साइड का धातु में अपचयन बड़े पैमाने पर किया जाता है। कई धातु आक्साइड को धातुओं में परिवर्तित किया जा सकता है, बस गर्म करके (थर्मल अपघटन देखें)। उदाहरण के लिए, सिल्वर ऑक्साइड 200 डिग्री सेल्सियस पर विघटित होता है:[10]
- 2 Ag2O -> 4 Ag + O2
हालांकि, अक्सर धातु ऑक्साइड एक रासायनिक अभिकर्मक द्वारा कम हो जाते हैं। कोक (ईंधन) के रूप में एक आम और सस्ता कम करने वाला एजेंट कार्बन है। सबसे प्रमुख उदाहरण लौह अयस्क प्रगलन है। कई प्रतिक्रियाएं सम्मिलितहैं, लेकिन सरलीकृत समीकरण को आमतौर पर के रूप में दिखाया जाता है [2]:
2 Fe2O3 + 3 C -> 4 Fe + 3 CO2
कुछ धातु ऑक्साइड कम करने वाले एजेंटों की उपस्थिति में घुलते हैं, जिनमें कार्बनिक यौगिक सम्मिलितहो सकते हैं। फेरिक ऑक्साइड का रिडक्टिव ब्रेकडाउन भू-रासायनिक परिघटनाओं जैसे कि लौह चक्र का अभिन्न अंग है।[11]
हाइड्रोलिसिस और विघटन
क्योंकि M-O बांड आमतौर पर मजबूत होते हैं, धातु ऑक्साइड सॉल्वैंट्स में अघुलनशील होते हैं, हालांकि उन पर जलीय एसिड और क्षार द्वारा हमला किया जा सकता है। [2]
आक्साइड का विघटन अक्सर ऑक्सीजन देता है। P4O10 में जलीय क्षार मिलाने से विभिन्न फास्फेट प्राप्त होते हैं। MoO3 में एक जलीय आधार जोड़ने से पॉलीऑक्सोमेटालेट्स मिलते हैं। ऑक्सीकरण दुर्लभ हैं, कुछ उदाहरण नाइट्रोसोनियम हैं (NO+), वैनाडील (VO2+), और यूरेनिल (UO2+2) हैं। बेशक, कई यौगिकों को ऑक्साइड और अन्य समूहों दोनों के साथ जाना जाता है। कार्बनिक रसायन विज्ञान में, इनमें केटोन्स और कई संबंधित कार्बोनिल यौगिक सम्मिलितहैं। संक्रमण धातुओं के लिए, कई ऑक्सो कॉम्प्लेक्स के साथ-साथ ऑक्सीहैलाइड्स भी जाने जाते हैं।[2]
नामावली और सूत्र
रासायनिक तत्वों के ऑक्साइड के उनके उच्चतम ऑक्सीकरण अवस्था में रासायनिक सूत्र अनुमानित हैं और उस तत्व के वैलेंस इलेक्ट्रॉनों की संख्या से प्राप्त होते हैं। यहां तक कि रासायनिक सूत्र O4, टेट्राऑक्सीजन , को समूह 16 तत्व के रूप में भविष्यवाणी की गई है। एक अपवाद ताँबा है, जिसके लिए उच्चतम ऑक्सीकरण अवस्था ऑक्साइड कॉपर (II) ऑक्साइड है न कि कॉपर (I) ऑक्साइड। एक और अपवाद फ्लोराइड है, जो मौजूद नहीं है जैसा कि कोई उम्मीद कर सकता है F2O7 के रूप में-लेकिन OF2 के रूप में।[12]
यह भी देखें
- अन्य ऑक्सीजन आयन ओजोन का ,O−3, सुपरऑक्साइड , O−2पेरोक्साइड , O2−2 और डाइअॉॉक्सिनिल , O+2.
- उपऑक्साइड
- ऑक्सोहैलाइड
- आक्सीयन
- जटिल ऑक्साइड
- देखें: श्रेणी: ऑक्साइड की सूची के लिए ऑक्साइड।
- गीला इलेक्ट्रॉन *
संदर्भ
- ↑ Hein, Morris; Arena, Susan (2006). कॉलेज रसायन विज्ञान की नींव (12th ed.). Wiley. ISBN 9780471741534.
- ↑ Jump up to: 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ C. N. R. Rao, B. Raveau (1995). संक्रमण धातु आक्साइड. New York: VCH. ISBN 1-56081-647-3.
- ↑ Herbert W. Roesky, Ionel Haiduc, and Narayan S. Hosmane (2003). "मुख्य समूह और संक्रमण तत्वों के ऑर्गेनोमेटेलिक ऑक्साइड अकार्बनिक ठोस को छोटे आणविक टुकड़ों में घटाते हैं". Chem. Rev. 103: 2579–2596. doi:10.1021/cr020376q.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Graf, Günter G. (2000). "Zinc". उलमन का औद्योगिक रसायन विज्ञान का विश्वकोश. doi:10.1002/14356007.a28_509. ISBN 3527306730.
- ↑ Roger F. Sebenik et al. (2005). "Molybdenum and Molybdenum Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_655.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ↑ Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm. "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293.
- ↑ Müller, Hermann (2000). "Sulfuric Acid and Sulfur Trioxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_635.
- ↑ P.A. Cox (2010). संक्रमण धातु आक्साइड। उनकी इलेक्ट्रॉनिक संरचना और गुणों का परिचय. Oxford University Press. ISBN 9780199588947.
{{cite book}}: CS1 maint: uses authors parameter (link) - ↑ "सिल्वर ऑक्साइड".
- ↑ Cornell, R. M.; Schwertmann, U. (2003). आयरन ऑक्साइड: संरचना, गुण, प्रतिक्रियाएं, घटनाएं और उपयोग, दूसरा संस्करण. p. 323. doi:10.1002/3527602097. ISBN 9783527302741.
- ↑ Schultz, Emeric (2005). "पैटर्न पहचान के माध्यम से आवर्त सारणी की क्षमता का पूरी तरह से दोहन". J. Chem. Educ. 82 (11): 1649. Bibcode:2005JChEd..82.1649S. doi:10.1021/ed082p1649.