ट्रांसमेम्ब्रेन प्रोटीन: Difference between revisions
No edit summary |
No edit summary |
||
| (12 intermediate revisions by 3 users not shown) | |||
| Line 1: | Line 1: | ||
[[Image:Polytopic membrane protein.png|thumb|right|400px|ट्रांसमेम्ब्रेन प्रोटीन का योजनाबद्ध प्रतिनिधित्व: 1) एक एकल ट्रांसमेम्ब्रेन α-हेलिक्स (बिटोपिक मेम्ब्रेन प्रोटीन)। 2) एक पॉलीटॉपिक ट्रांसमेम्ब्रेन α-हेलिकल प्रोटीन। 3) एक पॉलीटोपिक ट्रांसमेम्ब्रेन β-शीट प्रोटीन। झिल्ली को हल्के पीले रंग में दर्शाया गया है।]]एक '''ट्रांसमेम्ब्रेन प्रोटीन''' (टीपी) एक प्रकार | [[Image:Polytopic membrane protein.png|thumb|right|400px|ट्रांसमेम्ब्रेन प्रोटीन का योजनाबद्ध प्रतिनिधित्व: 1) एक एकल ट्रांसमेम्ब्रेन α-हेलिक्स (बिटोपिक मेम्ब्रेन प्रोटीन)। 2) एक पॉलीटॉपिक ट्रांसमेम्ब्रेन α-हेलिकल प्रोटीन। 3) एक पॉलीटोपिक ट्रांसमेम्ब्रेन β-शीट प्रोटीन। झिल्ली को हल्के पीले रंग में दर्शाया गया है।]]एक '''ट्रांसमेम्ब्रेन प्रोटीन''' (टीपी) एक प्रकार की [[अभिन्न झिल्ली प्रोटीन]] है। जो [[कोशिका झिल्ली]] की संपूर्णता को प्रसारित करता है। कई '''ट्रांसमेम्ब्रेन प्रोटीन''' झिल्ली के पार विशिष्ट पदार्थों के [[झिल्ली परिवहन प्रोटीन]] के रूप में कार्य करते हैं। झिल्ली के माध्यम से पदार्थ को स्थानांतरित करने के लिए वे प्रायः महत्वपूर्ण [[प्रोटीन गतिकी]] से निकलते हैं। वे सामान्यतः अत्यधिक [[जल विरोधी]] होते हैं और जल में एकत्र और अवक्षेपित होते हैं। इनके निष्कर्षण के लिए उन्हें [[डिटर्जेंट|अपमार्जक]] या गैर-ध्रुवीय सॉल्वैंट्स की आवश्यकता होती है। चूंकि उनमें से कुछ [[बीटा बैरल]] को [[विकृतीकरण (जैव रसायन)|अभिकर्मकों (जैव रसायन)]] का उपयोग करके भी निकाला जा सकता है। | ||
[[प्राथमिक प्रोटीन संरचना]] जो झिल्ली या [[ट्रांसमेम्ब्रेन डोमेन]] को फैलाती है। ये अत्यधिक हाइड्रोफोबिक होते हैं और [[हाइड्रोपेथी प्लॉट]] का उपयोग करके इसकी कल्पना की जा सकती है।<ref>{{Cite journal|last1=Manor|first1=Joshua|last2=Feldblum|first2=Esther S.|last3=Arkin|first3=Isaiah T.|date=2012|title=Environment Polarity in Proteins Mapped Noninvasively by FTIR Spectroscopy|journal=The Journal of Physical Chemistry Letters|volume=3|issue=7|pages=939–944|doi=10.1021/jz300150v|pmid=22563521|pmc=3341589}}</ref> ट्रांसमेम्ब्रेन सेगमेंट की संख्या के आधार पर ट्रांसमेम्ब्रेन प्रोटीन को सिंगल-स्पैन या [[बाइटोपिक प्रोटीन]] या मल्टी-स्पैन (पॉलीटोपिक) के रूप में वर्गीकृत किया जा सकता है। कुछ अन्य इंटीग्रल मेम्ब्रेन प्रोटीन को [[अभिन्न मोनोटोपिक प्रोटीन]] कहा जाता है। जिसका अर्थ है कि वे सभी स्थायी रूप से मेम्ब्रेन से जुड़े होते हैं। किन्तु इससे निकलते नहीं हैं।<ref name="Goodman2008">{{cite book|author=Steven R. Goodman|title=Medical cell biology|url=https://books.google.com/books?id=WO6EVUgWw7AC&pg=PA37|access-date=24 November 2010|year=2008|publisher=Academic Press|isbn=978-0-12-370458-0|pages=37–}}</ref> | [[प्राथमिक प्रोटीन संरचना]] जो झिल्ली या [[ट्रांसमेम्ब्रेन डोमेन]] को फैलाती है। ये अत्यधिक हाइड्रोफोबिक होते हैं और [[हाइड्रोपेथी प्लॉट]] का उपयोग करके इसकी कल्पना की जा सकती है।<ref>{{Cite journal|last1=Manor|first1=Joshua|last2=Feldblum|first2=Esther S.|last3=Arkin|first3=Isaiah T.|date=2012|title=Environment Polarity in Proteins Mapped Noninvasively by FTIR Spectroscopy|journal=The Journal of Physical Chemistry Letters|volume=3|issue=7|pages=939–944|doi=10.1021/jz300150v|pmid=22563521|pmc=3341589}}</ref> ट्रांसमेम्ब्रेन सेगमेंट की संख्या के आधार पर ट्रांसमेम्ब्रेन प्रोटीन को सिंगल-स्पैन या [[बाइटोपिक प्रोटीन]] या मल्टी-स्पैन (पॉलीटोपिक) के रूप में वर्गीकृत किया जा सकता है। कुछ अन्य इंटीग्रल मेम्ब्रेन प्रोटीन को [[अभिन्न मोनोटोपिक प्रोटीन]] कहा जाता है। जिसका अर्थ है कि वे सभी स्थायी रूप से मेम्ब्रेन से जुड़े होते हैं। किन्तु इससे निकलते नहीं हैं।<ref name="Goodman2008">{{cite book|author=Steven R. Goodman|title=Medical cell biology|url=https://books.google.com/books?id=WO6EVUgWw7AC&pg=PA37|access-date=24 November 2010|year=2008|publisher=Academic Press|isbn=978-0-12-370458-0|pages=37–}}</ref> | ||
| Line 7: | Line 7: | ||
=== संरचना द्वारा वर्गीकरण === | === संरचना द्वारा वर्गीकरण === | ||
ट्रांसमेम्ब्रेन प्रोटीन के दो मूल प्रकार हैं:<ref name="Xiong2006">{{cite book|author=Jin Xiong|title=Essential bioinformatics|url=https://books.google.com/books?id=AFsu7_goA8kC&pg=PA208|access-date=13 November 2010|year=2006|publisher=Cambridge University Press|isbn=978-0-521-84098-9|pages=208–}}</ref> [[अल्फा हेलिक्स]] और [[बीटा बैरल]]। अल्फा-हेलीकल प्रोटीन जीवाणु कोशिकाओं के आंतरिक झिल्ली या यूकेरियोटिक कोशिकाओं के प्लाज्मा झिल्ली में और कभी-कभी जीवाणु बाहरी झिल्ली में उपस्थित होते हैं।<ref>alpha-helical proteins in outer membranes include [[Stannin]] and certain [[lipoproteins]], and others</ref> यह ट्रांसमेम्ब्रेन प्रोटीन की प्रमुख श्रेणी है। मनुष्यों में सभी प्रोटीनों का 27% अल्फा-हेलिकल मेम्ब्रेन प्रोटीन होने का अनुमान लगाया गया है।<ref>{{cite journal |vauthors=Almén MS, Nordström KJ, Fredriksson R, Schiöth HB |title=Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin |journal=BMC Biol. |volume=7 |pages=50 |year=2009 |pmid=19678920 |pmc=2739160 |doi=10.1186/1741-7007-7-50 }}</ref> बीटा-बैरल प्रोटीन अब तक केवल [[ग्राम-नकारात्मक बैक्टीरिया]] की बाहरी झिल्लियों, [[ग्राम पॉजिटिव बैक्टीरिया]] की [[कोशिका भित्ति]], [[माइटोकॉन्ड्रिया]] और [[क्लोरोप्लास्ट]] के [[बाहरी माइटोकॉन्ड्रियल झिल्ली]] में पाए जाते हैं या छिद्र बनाने वाले विषाक्त पदार्थों के रूप में स्रावित हो सकते हैं। सभी बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन में सरलतम अप-एंड-डाउन टोपोलॉजी होती है। जो उनके सामान्य | ट्रांसमेम्ब्रेन प्रोटीन के दो मूल प्रकार हैं:<ref name="Xiong2006">{{cite book|author=Jin Xiong|title=Essential bioinformatics|url=https://books.google.com/books?id=AFsu7_goA8kC&pg=PA208|access-date=13 November 2010|year=2006|publisher=Cambridge University Press|isbn=978-0-521-84098-9|pages=208–}}</ref> [[अल्फा हेलिक्स]] और [[बीटा बैरल]]। अल्फा-हेलीकल प्रोटीन जीवाणु कोशिकाओं के आंतरिक झिल्ली या यूकेरियोटिक कोशिकाओं के प्लाज्मा झिल्ली में और कभी-कभी जीवाणु बाहरी झिल्ली में उपस्थित होते हैं।<ref>alpha-helical proteins in outer membranes include [[Stannin]] and certain [[lipoproteins]], and others</ref> यह ट्रांसमेम्ब्रेन प्रोटीन की प्रमुख श्रेणी है। मनुष्यों में सभी प्रोटीनों का 27% अल्फा-हेलिकल मेम्ब्रेन प्रोटीन होने का अनुमान लगाया गया है।<ref>{{cite journal |vauthors=Almén MS, Nordström KJ, Fredriksson R, Schiöth HB |title=Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin |journal=BMC Biol. |volume=7 |pages=50 |year=2009 |pmid=19678920 |pmc=2739160 |doi=10.1186/1741-7007-7-50 }}</ref> बीटा-बैरल प्रोटीन अब तक केवल [[ग्राम-नकारात्मक बैक्टीरिया]] की बाहरी झिल्लियों, [[ग्राम पॉजिटिव बैक्टीरिया]] की [[कोशिका भित्ति]], [[माइटोकॉन्ड्रिया]] और [[क्लोरोप्लास्ट]] के [[बाहरी माइटोकॉन्ड्रियल झिल्ली]] में पाए जाते हैं या छिद्र बनाने वाले विषाक्त पदार्थों के रूप में स्रावित हो सकते हैं। सभी बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन में सरलतम अप-एंड-डाउन टोपोलॉजी होती है। जो उनके सामान्य उत्पन्नता और समान सतह तंत्र को प्रदर्शित कर सकती है। | ||
प्रोटीन डोमेन के अतिरिक्त पेप्टाइड्स द्वारा गठित असामान्य ट्रांसमेम्ब्रेन तत्व भी हैं। एक विशिष्ट उदाहरण [[ग्रामिसिडिन ए]] है। एक पेप्टाइड जो एक डिमेरिक ट्रांसमेम्ब्रेन β-हेलिक्स बनाता है।<ref>{{Cite journal|last1=Nicholson|first1=L. K.|last2=Cross|first2=T. A.|date=1989|title=Gramicidin cation channel: an experimental determination of the right-handed helix sense and verification of .beta.-type hydrogen bonding|journal=Biochemistry|volume=28|issue=24|pages=9379–9385|language=en|doi=10.1021/bi00450a019|pmid=2482072}}</ref> यह पेप्टाइड ग्राम पॉजिटिव बैक्टीरिया द्वारा [[रोगाणुरोधी पेप्टाइड्स]] के रूप में स्रावित होता है। प्राकृतिक प्रोटीन में एक ट्रांसमेम्ब्रेन [[पॉलीप्रोलाइन हेलिक्स]] पॉलीप्रोलाइन- II हेलिक्स की सूची नहीं की गई है। यद्यपि इस संरचना को विशेष रूप से प्रारूपित किए गए कृत्रिम पेप्टाइड्स में प्रयोगात्मक रूप से देखा गया था।<ref>{{Cite journal|last1=Kubyshkin|first1=Vladimir|last2=Grage|first2=Stephan L.|last3=Ulrich|first3=Anne S.|last4=Budisa|first4=Nediljko|date=2019|title=Bilayer thickness determines the alignment of model polyproline helices in lipid membranes|journal=Physical Chemistry Chemical Physics|volume=21|issue=40|pages=22396–22408|language=en|doi=10.1039/c9cp02996f|pmid=31577299|bibcode=2019PCCP...2122396K|doi-access=free}}</ref> | प्रोटीन डोमेन के अतिरिक्त पेप्टाइड्स द्वारा गठित असामान्य ट्रांसमेम्ब्रेन तत्व भी हैं। एक विशिष्ट उदाहरण [[ग्रामिसिडिन ए]] है। एक पेप्टाइड जो एक डिमेरिक ट्रांसमेम्ब्रेन β-हेलिक्स बनाता है।<ref>{{Cite journal|last1=Nicholson|first1=L. K.|last2=Cross|first2=T. A.|date=1989|title=Gramicidin cation channel: an experimental determination of the right-handed helix sense and verification of .beta.-type hydrogen bonding|journal=Biochemistry|volume=28|issue=24|pages=9379–9385|language=en|doi=10.1021/bi00450a019|pmid=2482072}}</ref> यह पेप्टाइड ग्राम पॉजिटिव बैक्टीरिया द्वारा [[रोगाणुरोधी पेप्टाइड्स]] के रूप में स्रावित होता है। प्राकृतिक प्रोटीन में एक ट्रांसमेम्ब्रेन [[पॉलीप्रोलाइन हेलिक्स]] पॉलीप्रोलाइन- II हेलिक्स की सूची नहीं की गई है। यद्यपि इस संरचना को विशेष रूप से प्रारूपित किए गए कृत्रिम पेप्टाइड्स में प्रयोगात्मक रूप से देखा गया था।<ref>{{Cite journal|last1=Kubyshkin|first1=Vladimir|last2=Grage|first2=Stephan L.|last3=Ulrich|first3=Anne S.|last4=Budisa|first4=Nediljko|date=2019|title=Bilayer thickness determines the alignment of model polyproline helices in lipid membranes|journal=Physical Chemistry Chemical Physics|volume=21|issue=40|pages=22396–22408|language=en|doi=10.1039/c9cp02996f|pmid=31577299|bibcode=2019PCCP...2122396K|doi-access=free}}</ref> | ||
=== टोपोलॉजी द्वारा वर्गीकरण === | === टोपोलॉजी द्वारा वर्गीकरण === | ||
यह वर्गीकरण [[प्रोटीन टोपोलॉजी]] को संदर्भित करता है। [[लिपिड बिलेयर]] के विभिन्न पक्षों पर प्रोटीन एन और सी-टर्मिनी की स्थिति टाइप I, II, III और IV बिटोपिक प्रोटीन हैं। | यह वर्गीकरण [[प्रोटीन टोपोलॉजी]] को संदर्भित करता है। [[लिपिड बिलेयर]] के विभिन्न पक्षों पर प्रोटीन एन और सी-टर्मिनी की स्थिति टाइप I, II, III और IV बिटोपिक प्रोटीन हैं। सिंगल-पास अणु टाइप ट्रांसमेम्ब्रेन प्रोटीन एक स्टॉप-ट्रांसफर एंकर अनुक्रम के साथ लिपिड झिल्ली से जुडे रहते हैं और उनके N-टर्मिनल डोमेन संश्लेषण के समय [[अन्तः प्रदव्ययी जलिका]] (ER) [[लुमेन (एनाटॉमी)|लुमेन एनाटॉमी]] को लक्षित होते हैं और बाह्य स्थान, (यदि परिपक्व रूप स्थित हैं) [[कोशिका की झिल्लियाँ]] टाइप II और III को सिग्नल-एंकर अनुक्रम के साथ एंकर किया गया है, टाइप II को इसके C-टर्मिनल डोमेन के साथ ER लुमेन को लक्षित किया गया है। जबकि टाइप III में उनके N-टर्मिनल डोमेन ER लुमेन को लक्षित हैं। टाइप IV को IV-A में विभाजित किया गया है। उनके N-टर्मिनल डोमेन को साइटोसोल और IV-B को लक्षित किया गया है। जिसमें N-टर्मिनल डोमेन लुमेन को लक्षित है।<ref>Harvey Lodish etc.; ''Molecular Cell Biology'', Sixth edition, p.546</ref> चार प्रकारों में विभाजन के निहितार्थ विशेष रूप से ट्रांसलोकेशन और ER-बाउंड ट्रांसलेशन के समय प्रकट होते हैं। जब प्रोटीन को ER झिल्ली के माध्यम से टाइप पर निर्भर दिशा में निकालना होता है। | ||
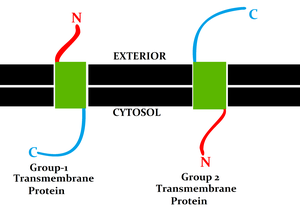
[[File:Group 1 and 2 transmembrane protein.png|thumb|समूह I और II ट्रांसमेम्ब्रेन प्रोटीन में विपरीत अंतिम टोपोलॉजी होती है। समूह I प्रोटीन में दूर की तरफ N टर्मिनस और साइटोसोलिक साइड पर C टर्मिनस होता है। समूह II प्रोटीन में दूर की ओर C टर्मिनस और साइटोसोल में N टर्मिनस होता है। चूंकि ट्रांसमेम्ब्रेन प्रोटीन समूहों को परिभाषित करने के लिए अंतिम टोपोलॉजी एकमात्र मानदंड नहीं है। परन्तु टॉपोजेनिक निर्धारकों के स्थान और विधानसभा के तंत्र को वर्गीकरण में माना जाता है।<ref>{{cite journal |last1=Goder |first1=Veit |last2=Spiess |first2=Martin |title=Topogenesis of membrane proteins: determinants and dynamics |journal=FEBS Letters |date=31 August 2001 |volume=504 |issue=3 |pages=87–93 |doi=10.1016/S0014-5793(01)02712-0 |pmid=11532438 |doi-access=free }}</ref>]] | [[File:Group 1 and 2 transmembrane protein.png|thumb|समूह I और II ट्रांसमेम्ब्रेन प्रोटीन में विपरीत अंतिम टोपोलॉजी होती है। समूह I प्रोटीन में दूर की तरफ N टर्मिनस और साइटोसोलिक साइड पर C टर्मिनस होता है। समूह II प्रोटीन में दूर की ओर C टर्मिनस और साइटोसोल में N टर्मिनस होता है। चूंकि ट्रांसमेम्ब्रेन प्रोटीन समूहों को परिभाषित करने के लिए अंतिम टोपोलॉजी एकमात्र मानदंड नहीं है। परन्तु टॉपोजेनिक निर्धारकों के स्थान और विधानसभा के तंत्र को वर्गीकरण में माना जाता है।<ref>{{cite journal |last1=Goder |first1=Veit |last2=Spiess |first2=Martin |title=Topogenesis of membrane proteins: determinants and dynamics |journal=FEBS Letters |date=31 August 2001 |volume=504 |issue=3 |pages=87–93 |doi=10.1016/S0014-5793(01)02712-0 |pmid=11532438 |doi-access=free }}</ref>]] | ||
| Line 23: | Line 23: | ||
=== अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता === | === अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता === | ||
ट्रांसमेम्ब्रेन डोमेन [[अल्फा हेलिक्स]] | ट्रांसमेम्ब्रेन डोमेन [[अल्फा हेलिक्स]] (α-हेलिकल) प्रोटीन असामान्य रूप से थर्मल डेनेचुरेशन (बायोकेमिस्ट्री) अध्ययनों से देखते हुए स्थिर हैं क्योंकि वे झिल्ली के अन्दर पूर्णतयः से प्रकट नहीं होते हैं (पूर्णरूप से खोलने के लिए बहुत सारे α-हेलिकल H-बन्धों को तोड़ने की आवश्यकता होगी)। गैर-ध्रुवीय मीडिया में बंधन दूसरी ओर झिल्लियों में बिना एकत्रीकरण, पिघली हुई गोलाकार अवस्थाओं में संक्रमण, बिना डाइसल्फ़ाइड बांडों के निर्माण या परिधीय क्षेत्रों और गैर-नियमित छोरों के प्रकट होने के कारण ये प्रोटीन सरलता से मिसफॉल्ड हो जाते हैं। जो स्थानीय रूप से कम स्थिर होते हैं। अनफोल्डेड स्टेट को ठीक से परिभाषित करना भी महत्वपूर्ण है। अपमार्जक मिसेल में झिल्ली प्रोटीन की [[प्रकट अवस्था]] थर्मल मिश्रण (जैव रसायन) प्रयोगों से भिन्न होती है। यह अवस्था मुड़े हुए हाइड्रोफोबिक α-हेलिकॉप्टरों के संयोजन का प्रतिनिधित्व करता है और अपमार्जक द्वारा कवर किए गए आंशिक रूप से सामने आए खंडों का प्रतिनिधित्व करता है। उदाहरण के लिए [[सोडियम डोडेसिल सल्फेट]] मिसेल्स में अनफोल्डेड [[बैक्टीरियोहोडोप्सिन]] में चार ट्रांसमेम्ब्रेन α-हेलीकॉप्स मुड़े होते हैं। जबकि बचे हुए प्रोटीन मिसेल-वाटर इंटरफेस पर स्थित होता है और विभिन्न प्रकार की बिना [[amphiphilic|एम्फीफिलिक]] संरचनाओं को ग्रहण कर सकता है। ऐसे अपमार्जक-अभिकर्मक और उनकी अवस्थाओं के बीच मुक्त ऊर्जा अंतर जल में घुलनशील प्रोटीन (<10 किलो कैलोरी/मोल) की स्थिरता के समान हैं। | ||
अनफोल्डेड स्टेट को ठीक से परिभाषित करना भी महत्वपूर्ण है। | |||
=== α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की | |||
इन विट्रो में α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की रीफोल्डिंग | === α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की सतह === | ||
इन विट्रो में α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की रीफोल्डिंग तन्त्र रूप से कठिन है। सफल रीफोल्डिंग प्रयोगों के अपेक्षाकृत कुछ उदाहरण हैं। जैसा कि बैक्टीरियोरोडोप्सिन के लिए है। अन्तर्जीव में ऐसे सभी प्रोटीन सामान्य रूप से बड़े ट्रांसमेम्ब्रेन ट्रांसलोकन के अन्दर सह-अनुवादिक रूप से मुड़े होते हैं। [[translocon|ट्रांसलोकॉन]] चैनल नये ट्रांसमेम्ब्रेन α-हेलिक्स के लिए अत्यधिक विषम वातावरण प्रदान करता है। अपेक्षाकृत ध्रुवीय एम्फीफिलिक α-हेलिक्स ट्रांसलोकन में एक ट्रांसमेम्ब्रेन ओरिएंटेशन को अपना सकता है। (चूंकि यह झिल्ली की सतह पर होगा या इन विट्रो में सामने आएगा।) क्योंकि इसके ध्रुवीय अवशेष ट्रांसलोकॉन के केंद्रीय जल से भरे चैनल का सामना कर सकते हैं। ट्रांसमेम्ब्रेन प्रोटीन की संरचनाओं में ध्रुवीय α-हेलिक्स को सम्मिलित करने के लिए ऐसा तंत्र आवश्यक है, जब तक प्रोटीन पूर्णतयः संश्लेषित और मुड़ा हुआ नहीं हो जाता। तब तक एम्फीफिलिक हेलिक्स ट्रांसलोकन से जुड़े रहते हैं। यदि प्रोटीन खुला रहता है और बहुत लंबे समय तक ट्रांसलोकन से जुड़ा रहता है। तो यह विशिष्ट गुणवत्ता नियंत्रण सेलुलर तन्त्र द्वारा अवक्रमित होता है। | |||
===बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता और तह === | ===बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता और तह === | ||
बीटा बैरल (β-बैरल) ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता रासायनिक | बीटा बैरल (β-बैरल) ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता रासायनिक मिश्रण अध्ययनों के आधार पर पानी में घुलनशील प्रोटीन की स्थिरता के समान है। उनमें से कुछ चॉट्रोपिक एजेंटों और उच्च तापमान में भी बहुत स्थिर हैं। अन्तर्जीव में उनकी सतह को पानी में घुलनशील [[चैपरोन (प्रोटीन)]] जैसे प्रोटीन एसकेपी द्वारा सरल बनाया जाता है। ऐसा माना जाता है कि β-बैरल झिल्ली प्रोटीन अनुवांशिकता से आते हैं। यहां तक कि अलग-अलग संख्या में सतहें होती हैं। जिन्हें विकास के समय जोड़ा या दोगुना किया जा सकता है। कुछ अध्ययन विभिन्न जीवों के बीच विशाल अनुक्रम संरक्षण और संरक्षित अमीनो एसिड भी प्रदर्शित करते हैं। जो संरचना को धारण करते हैं और मोड़ने में सहायता करते हैं।<ref>{{cite journal |last1=Michalik |first1=Marcin |last2=Orwick-Rydmark |first2=Marcella |last3=Habeck |first3=Michael |last4=Alva |first4=Vikram |last5=Arnold |first5=Thomas |last6=Linke |first6=Dirk |last7=Permyakov |first7=Eugene A. |title=An evolutionarily conserved glycine-tyrosine motif forms a folding core in outer membrane proteins |journal=PLOS ONE |date=3 August 2017 |volume=12 |issue=8 |pages=e0182016 |doi=10.1371/journal.pone.0182016 |pmid=28771529 |pmc=5542473 |bibcode=2017PLoSO..1282016M |doi-access=free }}</ref> | ||
== 3 डी संरचनाएं == | == 3 डी संरचनाएं == | ||
{{see also| | {{see also|ट्रांसपोर्टर वर्गीकरण डेटाबेस}} | ||
=== प्रकाश अवशोषण संचालित ट्रांसपोर्टर === | === प्रकाश अवशोषण संचालित ट्रांसपोर्टर === | ||
* [[rhodopsin]] सहित बैक्टीरियोहोडोप्सिन-जैसे प्रोटीन | * [[rhodopsin|रोडोप्सिन]] सहित बैक्टीरियोहोडोप्सिन-जैसे प्रोटीन | ||
*[[जीवाणु]] प्रकाश संश्लेषण प्रतिक्रिया केंद्र और [[photosystem]] I और II | *[[जीवाणु]] प्रकाश संश्लेषण प्रतिक्रिया केंद्र और [[photosystem|फोटोसिस्टम]] I और II | ||
*बैक्टीरिया और क्लोरोप्लास्ट से [[प्रकाश संचयन परिसर]] | *बैक्टीरिया और क्लोरोप्लास्ट से [[प्रकाश संचयन परिसर]] | ||
===ऑक्सीडक्शन-संचालित ट्रांसपोर्टर === | ===ऑक्सीडक्शन-संचालित ट्रांसपोर्टर === | ||
*ट्रांसमेम्ब्रेन साइटोक्रोम बी- | *ट्रांसमेम्ब्रेन साइटोक्रोम बी-प्रकार प्रोटीन: [[कोएंजाइम क्यू - साइटोक्रोम सी रिडक्टेस|कोएंजाइम क्यू-साइटोक्रोम सी रिडक्टेस]] (साइटोक्रोम बीसी1); [[साइटोक्रोम बी6एफ कॉम्प्लेक्स]]; फॉर्मेट डिहाइड्रोजनेज, श्वसन [[नाइट्रेट रिडक्टेस]]; [[सक्सिनेट - कोएंजाइम क्यू रिडक्टेस|सक्सिनेट-कोएंजाइम क्यू रिडक्टेस]] (फ्यूमरेट रिडक्टेस), [[सक्सिनेट डिहाइड्रोजनेज]] और [[इलेक्ट्रॉन परिवहन श्रृंखला]] देखें। | ||
*बैक्टीरिया और माइटोकॉन्ड्रिया से [[साइटोक्रोम सी ऑक्सीडेज]] | *बैक्टीरिया और माइटोकॉन्ड्रिया से [[साइटोक्रोम सी ऑक्सीडेज]] | ||
===विद्युत रासायनिक क्षमता संचालित ट्रांसपोर्टर=== | ===विद्युत रासायनिक क्षमता संचालित ट्रांसपोर्टर=== | ||
*प्रोटॉन या सोडियम ट्रांसलोकेशन F-टाइप और V-टाइप [[ATPase]] | *प्रोटॉन या सोडियम ट्रांसलोकेशन F-टाइप और V-टाइप [[ATPase|एटीपीसेस]] | ||
=== | ===P-P-बॉन्ड हाइड्रोलिसिस-संचालित ट्रांसपोर्टर=== | ||
* | *P-प्रकार कैल्शियम एटीपीसेस (पांच अलग अनुरूपता) | ||
*कैल्शियम | *कैल्शियम एटीपीसेस रेगुलेटर [[फॉस्फोलैम्बन]] और [[सारकोलिपिन]] | ||
* [[एबीसी ट्रांसपोर्टर]] | * [[एबीसी ट्रांसपोर्टर]] | ||
*जनरल [[स्रावी मार्ग]] (सेक) ट्रांसलोकॉन (प्रीप्रोटीन ट्रांसलोकेस सेकवाई) | *जनरल [[स्रावी मार्ग]] (सेक) ट्रांसलोकॉन (प्रीप्रोटीन ट्रांसलोकेस सेकवाई) | ||
=== पोर्टर्स (यूनिपोर्टर्स, सिम्पोर्टर्स, एंटीपोर्टर्स) === | === पोर्टर्स (यूनिपोर्टर्स, सिम्पोर्टर्स, एंटीपोर्टर्स) === | ||
* [[mitochondrial]] [[वाहक प्रोटीन]] | * [[mitochondrial|माइट्रोकॉन्ड्रियल]] [[वाहक प्रोटीन]] | ||
*मेजर फैसिलिटेटर सुपरफैमिली (ग्लिसरॉल-3-फॉस्फेट ट्रांसपोर्टर, लैक्टोज [[परमीज़]] और मल्टीड्रग ट्रांसपोर्टर एमआरडी) | *मेजर फैसिलिटेटर सुपरफैमिली (ग्लिसरॉल-3-फॉस्फेट ट्रांसपोर्टर, लैक्टोज [[परमीज़]] और मल्टीड्रग ट्रांसपोर्टर एमआरडी) | ||
*[[रेजिस्टेंस-नोड्यूलेशन-सेल डिवीजन सुपरफैमिली (आरएनडी)]] | *[[रेजिस्टेंस-नोड्यूलेशन-सेल डिवीजन सुपरफैमिली (आरएनडी)]]| रेसिस्टेंस-नोड्यूलेशन-सेल डिवीजन (मल्टीड्रग एफ्लक्स (माइक्रोबायोलॉजी) ट्रांसपोर्टर एसीआरबी, [[बहुदवा प्रतिरोध]] देखें) | ||
*डायकार्बोक्सिलेट/एमिनो एसिड: कटियन सिम्पोर्टर (प्रोटॉन ग्लूटामेट सिम्पोर्टर) | *डायकार्बोक्सिलेट/एमिनो एसिड: कटियन सिम्पोर्टर (प्रोटॉन ग्लूटामेट सिम्पोर्टर) | ||
*मोनोवैलेंट केशन/प्रोटोन एंटीपोर्टर (सोडियम/प्रोटोन एंटीपोर्टर 1 | *मोनोवैलेंट केशन/प्रोटोन एंटीपोर्टर (सोडियम/प्रोटोन एंटीपोर्टर 1 एनएचए) | ||
*[[स्नायुसंचारी]] सोडियम सिम्पॉर्टर | *[[स्नायुसंचारी]] सोडियम सिम्पॉर्टर | ||
* अमोनिया ट्रांसपोर्टर | * अमोनिया ट्रांसपोर्टर | ||
*ड्रग/मेटाबोलाइट ट्रांसपोर्टर (छोटा मल्टीड्रग रेजिस्टेंस ट्रांसपोर्टर | *ड्रग/मेटाबोलाइट ट्रांसपोर्टर (छोटा मल्टीड्रग रेजिस्टेंस ट्रांसपोर्टर ईएमआरई-संरचनाओं को गलत मानकर वापस ले लिया जाता है) | ||
=== आयन चैनल सहित अल्फा-पेचदार चैनल === | === आयन चैनल सहित अल्फा-पेचदार चैनल === | ||
*[[पोटेशियम चैनल]] | *[[पोटेशियम चैनल]] केसीएसए और केवीएपी सहित [[वोल्टेज-गेटेड आयन चैनल]] और [[आवक-शुद्ध करनेवाला पोटेशियम आयन चैनल|शुद्ध करनेवाला पोटेशियम आयन चैनल]] किरबाक | ||
*बड़े-चालन मेकोनोसेंसिटिव चैनल, | *बड़े-चालन मेकोनोसेंसिटिव चैनल, एमएससीएल | ||
*[[मेकोनोसेंसिटिव आयन चैनल]] | *[[मेकोनोसेंसिटिव आयन चैनल]], स्मॉल-कंडक्शन मैकेनोसेंसिटिव आयन चैनल (एमएससीएस) | ||
* [[मैग्नीशियम ट्रांसपोर्टर]] | * [[मैग्नीशियम ट्रांसपोर्टर]] | ||
* न्यूरोट्रांसमीटर रिसेप्टर्स ([[एसिटाइलकोलाइन रिसेप्टर]]) के [[लिगैंड-गेटेड आयन चैनल]] | * न्यूरोट्रांसमीटर रिसेप्टर्स ([[एसिटाइलकोलाइन रिसेप्टर]]) के [[लिगैंड-गेटेड आयन चैनल]] | ||
*[[एक्वापोरिन]] | *[[एक्वापोरिन]] | ||
* [[क्लोराइड चैनल]] | * [[क्लोराइड चैनल]] | ||
* बाहरी झिल्ली सहायक प्रोटीन (पॉलीसेकेराइड ट्रांसपोर्टर) | * बाहरी झिल्ली सहायक प्रोटीन (पॉलीसेकेराइड ट्रांसपोर्टर), बाहरी जीवाणु झिल्ली से α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन | ||
=== एंजाइम === | === एंजाइम === | ||
* [[मीथेन मोनोऑक्सीजिनेज]] | * [[मीथेन मोनोऑक्सीजिनेज]] | ||
* विषमकोण प्रोटीज | * विषमकोण प्रोटीज | ||
* [[डाइसल्फ़ाइड बंधन]] गठन प्रोटीन ( | * [[डाइसल्फ़ाइड बंधन]] गठन प्रोटीन (डीएसबीए-डीएसबीबी कॉम्प्लेक्स) | ||
अल्फा-हेलिकल ट्रांसमेम्ब्रेन एंकर के साथ प्रोटीन | |||
* [[टी सेल रिसेप्टर]] ट्रांसमेम्ब्रेन डिमराइजेशन डोमेन] | * [[टी सेल रिसेप्टर|T सेल रिसेप्टर]] ट्रांसमेम्ब्रेन डिमराइजेशन डोमेन] | ||
*साइटोक्रोम सी [[नाइट्राइट रिडक्टेस]] कॉम्प्लेक्स | *साइटोक्रोम सी [[नाइट्राइट रिडक्टेस]] कॉम्प्लेक्स | ||
* स्टेरिल-सल्फेट सल्फोहाइड्रोलेज़ | * स्टेरिल-सल्फेट सल्फोहाइड्रोलेज़ | ||
*स्टैनिन | *स्टैनिन | ||
*[[ग्लाइकोफोरिन]] | *[[ग्लाइकोफोरिन]] A डिमर | ||
*इनोवायरस ([[फिलामेंटस फेज]]) प्रमुख कोट प्रोटीन | *इनोवायरस ([[फिलामेंटस फेज]]) प्रमुख कोट प्रोटीन | ||
*[[बैटरी का]] | *[[बैटरी का|पिलिन]] | ||
*फुफ्फुसीय सर्फेक्टेंट-जुड़े प्रोटीन | *फुफ्फुसीय सर्फेक्टेंट-जुड़े प्रोटीन | ||
* [[मोनोमाइन ऑक्सीडेज]] ए और बी | * [[मोनोमाइन ऑक्सीडेज]] ए और बी | ||
*[[फैटी एसिड एमाइड हाइड्रोलेस]]<ref name="pmid12459591">{{cite journal |vauthors=Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF | s2cid = 22656813 | title = Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling | journal = Science | volume = 298 | issue = 5599 | pages = 1793–6 |date=November 2002 | pmid = 12459591 | doi = 10.1126/science.1076535 | bibcode = 2002Sci...298.1793B | url = https://semanticscholar.org/paper/36231e3dac990f2a6e004c93eeafb1fc9cebdd0e}}</ref> | *[[फैटी एसिड एमाइड हाइड्रोलेस]]<ref name="pmid12459591">{{cite journal |vauthors=Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF | s2cid = 22656813 | title = Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling | journal = Science | volume = 298 | issue = 5599 | pages = 1793–6 |date=November 2002 | pmid = 12459591 | doi = 10.1126/science.1076535 | bibcode = 2002Sci...298.1793B | url = https://semanticscholar.org/paper/36231e3dac990f2a6e004c93eeafb1fc9cebdd0e}}</ref> | ||
* [[साइटोक्रोम P450 ऑक्सीडेज]] | * [[साइटोक्रोम P450 ऑक्सीडेज|साइटोक्रोम पी450 ऑक्सीडेज]] | ||
*मिनरलोकोर्टिकोइड | *मिनरलोकोर्टिकोइड. कॉर्टिकोस्टेरॉइड 11β-डिहाइड्रोजनेज। | ||
*[[सिग्नल पेप्टाइड पेप्टाइड]] | *[[सिग्नल पेप्टाइड पेप्टाइड]] | ||
* मेम्ब्रेन प्रोटीज एक स्टोमैटिन होमोलॉग के लिए विशिष्ट | * मेम्ब्रेन प्रोटीज एक स्टोमैटिन होमोलॉग के लिए विशिष्ट है। | ||
=== एकल पॉलीपेप्टाइड श्रृंखला से बना बीटा-बैरल === | === एकल पॉलीपेप्टाइड श्रृंखला से बना बीटा-बैरल === | ||
* आठ बीटा- | * आठ बीटा-जाति से बीटा बैरल और दस की केवल संख्या के साथ (n=8, S=10)। वे सम्मिलित करते हैं: | ||
**[[OmpA जैसा ट्रांसमेम्ब्रेन डोमेन]] ( | **[[OmpA जैसा ट्रांसमेम्ब्रेन डोमेन|ओएमपीए जैसा ट्रांसमेम्ब्रेन डोमेन]] (ओएमपीए) | ||
** विषाणु-संबंधी बाहरी झिल्ली प्रोटीन परिवार ( | ** विषाणु-संबंधी बाहरी झिल्ली प्रोटीन परिवार (ओएमपीएक्स) | ||
** [[बाहरी झिल्ली प्रोटीन OpcA]] परिवार ( | ** [[बाहरी झिल्ली प्रोटीन OpcA|बाहरी झिल्ली प्रोटीन ओपीसीए]] परिवार (ओएमपीडब्ल्यू) | ||
** [[रोगाणुरोधी पेप्टाइड प्रतिरोध और लिपिड ए एसाइलेशन प्रोटीन परिवार]] (पीएजीपी) | ** [[रोगाणुरोधी पेप्टाइड प्रतिरोध और लिपिड ए एसाइलेशन प्रोटीन परिवार]] (पीएजीपी) | ||
**[[लिपिड ए डेसीलेज PagL]] | **[[लिपिड ए डेसीलेज PagL|लिपिड ए डेसीलेज पीएजीएल]] | ||
**अपारदर्शिता पारिवारिक पोरिन ( | **अपारदर्शिता पारिवारिक पोरिन (एनएसपीए) | ||
* | * ऑटोट्रांसपोर्टर डोमेन (n=12,S=14) | ||
* [[FadL बाहरी झिल्ली प्रोटीन परिवहन परिवार]], [[वसा अम्ल]] ट्रांसपोर्टर | * [[FadL बाहरी झिल्ली प्रोटीन परिवहन परिवार|एफएडीएल बाहरी झिल्ली प्रोटीन परिवहन परिवार]], [[वसा अम्ल]] ट्रांसपोर्टर एफएडीएल सहित (n=14,S=14) | ||
* सामान्य बैक्टीरियल पोरिन परिवार, जिसे ट्रिमेरिक [[पोरिन (प्रोटीन)]] के रूप में जाना जाता है (n=16,S=20) | * सामान्य बैक्टीरियल पोरिन परिवार, जिसे ट्रिमेरिक [[पोरिन (प्रोटीन)]] के रूप में जाना जाता है (n=16,S=20) | ||
* [[मी और पोरिन]], या शुगर पोरिन (प्रोटीन) (n=18,S=22) | * [[मी और पोरिन]], या शुगर पोरिन (प्रोटीन) (n=18,S=22) | ||
* [[न्यूक्लियोसाइड-विशिष्ट पोरिन]] (n=12,S=16) | * [[न्यूक्लियोसाइड-विशिष्ट पोरिन]] (n=12,S=16) | ||
* [[बाहरी झिल्ली फॉस्फोलिपेज़ A1]](n=12,S=16) | * [[बाहरी झिल्ली फॉस्फोलिपेज़ A1]](n=12,S=16) | ||
* | *टॉन बी-निर्भर रिसेप्टर्स और उनके टॉन बी निर्भर रिसेप्टर्स प्लग डोमेन | ||
*[[बाहरी झिल्ली प्रोटीन डब्ल्यू परिवार]] (n=10,S=12) जिसमें आउटर मेम्ब्रेन [[प्रोटीज]] | *वे लिगैंड-गेटेड बाहरी झिल्ली चैनल (एन = 22, एस = 24) हैं। जिनमें [[कोबालिन]] ट्रांसपोर्टर बीटीयूबी, Fe (III) -पीओकेलिन रिसेप्टर एफपीटीए, रिसेप्टर एफईपीए, फेरिक हाइड्रॉक्सामेट अपटेक रिसेप्टर फूआ, ट्रांसपोर्टर एफईसीए और पाइओवरडाइन रिसेप्टर एफपीवीए सम्मिलित हैं। | ||
*[[बाहरी झिल्ली प्रोटीन जी]] पोरिन परिवार (n=14,S=16) | *[[बाहरी झिल्ली प्रोटीन डब्ल्यू परिवार]] (n=10,S=12) जिसमें आउटर मेम्ब्रेन [[प्रोटीज]] ओएमपीटी और आउटर मेम्ब्रेन प्रोटीन ओपीसीए एडहेसिन/इनवेसिन ओपीसीए प्रोटीन सम्मिलित है। | ||
*[[बाहरी झिल्ली प्रोटीन जी|बाहरी झिल्ली प्रोटीन]] पोरिन परिवार (n=14,S=16) | |||
नोट: | नोट: n और S क्रमशः बीटा की संख्या हैं<ref>{{cite journal |doi=10.1016/0022-2836(94)90064-7 |vauthors=Murzin AG, Lesk AM, Chothia C |title=Principles determining the structure of beta-sheet barrels in proteins. I. A theoretical analysis |journal=J. Mol. Biol. |volume=236 |issue=5 |pages=1369–81 |date=March 1994 |pmid=8126726 }}</ref> | ||
=== कई पॉलीपेप्टाइड श्रृंखलाओं से बना बीटा-बैरल === | === कई पॉलीपेप्टाइड श्रृंखलाओं से बना बीटा-बैरल === | ||
*[[ट्रिमेरिक ऑटोट्रांसपोर्टर एडहेसिन्स (TAA)]] | *[[ट्रिमेरिक ऑटोट्रांसपोर्टर एडहेसिन्स (TAA)|ट्रिमेरिक ऑटोट्रांसपोर्टर एडहेसिन्स (टीएए)]] (n=12,S=12) | ||
* [[बाहरी झिल्ली इफ्लक्स प्रोटीन]], जिसे ट्राइमेरिक आउटर मेम्ब्रेन फैक्टर्स (n=12,S=18) के रूप में भी जाना जाता | * [[बाहरी झिल्ली इफ्लक्स प्रोटीन]], जिसे ट्राइमेरिक आउटर मेम्ब्रेन फैक्टर्स (n=12,S=18) के रूप में भी जाना जाता है। जिसमें टोलसी और मल्टीड्रग रेजिस्टेंस प्रोटीन सम्मिलित हैं। | ||
* [[MspA porin]] ( | * [[MspA porin|एमएसपी ए पोरिन]] (अष्टक, n=S=16) और α-हेमोलिसिन (हेप्टामर n=S=14) । ये प्रोटीन स्रावित होते हैं। | ||
== यह भी देखें == | == यह भी देखें == | ||
| Line 127: | Line 129: | ||
* [[मेम्ब्रेन टोपोलॉजी]] | * [[मेम्ब्रेन टोपोलॉजी]] | ||
* ट्रांसमेम्ब्रेन डोमेन | * ट्रांसमेम्ब्रेन डोमेन | ||
* [[ट्रांसमेम्ब्रेन रिसेप्टर]] | * [[ट्रांसमेम्ब्रेन रिसेप्टर|ट्रांसमेम्ब्रेन रिसेप्टर्स]] | ||
==संदर्भ== | ==संदर्भ== | ||
| Line 134: | Line 136: | ||
{{Cell membranes}} | {{Cell membranes}} | ||
{{DEFAULTSORT:Transmembrane Protein}} | {{DEFAULTSORT:Transmembrane Protein}} | ||
[[Category: | [[Category:All pages needing factual verification]] | ||
[[Category:Created On 15/02/2023]] | [[Category:Articles with hatnote templates targeting a nonexistent page|Transmembrane Protein]] | ||
[[Category:CS1 English-language sources (en)]] | |||
[[Category:Collapse templates|Transmembrane Protein]] | |||
[[Category:Created On 15/02/2023|Transmembrane Protein]] | |||
[[Category:Machine Translated Page|Transmembrane Protein]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists|Transmembrane Protein]] | |||
[[Category:Pages with script errors|Transmembrane Protein]] | |||
[[Category:Sidebars with styles needing conversion|Transmembrane Protein]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats|Transmembrane Protein]] | |||
[[Category:Templates that are not mobile friendly|Transmembrane Protein]] | |||
[[Category:Templates using TemplateData|Transmembrane Protein]] | |||
[[Category:Wikipedia articles needing factual verification from July 2020]] | |||
[[Category:Wikipedia metatemplates|Transmembrane Protein]] | |||
[[Category:अभिन्न झिल्ली प्रोटीन|Transmembrane Protein]] | |||
Latest revision as of 09:37, 14 March 2023
एक ट्रांसमेम्ब्रेन प्रोटीन (टीपी) एक प्रकार की अभिन्न झिल्ली प्रोटीन है। जो कोशिका झिल्ली की संपूर्णता को प्रसारित करता है। कई ट्रांसमेम्ब्रेन प्रोटीन झिल्ली के पार विशिष्ट पदार्थों के झिल्ली परिवहन प्रोटीन के रूप में कार्य करते हैं। झिल्ली के माध्यम से पदार्थ को स्थानांतरित करने के लिए वे प्रायः महत्वपूर्ण प्रोटीन गतिकी से निकलते हैं। वे सामान्यतः अत्यधिक जल विरोधी होते हैं और जल में एकत्र और अवक्षेपित होते हैं। इनके निष्कर्षण के लिए उन्हें अपमार्जक या गैर-ध्रुवीय सॉल्वैंट्स की आवश्यकता होती है। चूंकि उनमें से कुछ बीटा बैरल को अभिकर्मकों (जैव रसायन) का उपयोग करके भी निकाला जा सकता है।
प्राथमिक प्रोटीन संरचना जो झिल्ली या ट्रांसमेम्ब्रेन डोमेन को फैलाती है। ये अत्यधिक हाइड्रोफोबिक होते हैं और हाइड्रोपेथी प्लॉट का उपयोग करके इसकी कल्पना की जा सकती है।[1] ट्रांसमेम्ब्रेन सेगमेंट की संख्या के आधार पर ट्रांसमेम्ब्रेन प्रोटीन को सिंगल-स्पैन या बाइटोपिक प्रोटीन या मल्टी-स्पैन (पॉलीटोपिक) के रूप में वर्गीकृत किया जा सकता है। कुछ अन्य इंटीग्रल मेम्ब्रेन प्रोटीन को अभिन्न मोनोटोपिक प्रोटीन कहा जाता है। जिसका अर्थ है कि वे सभी स्थायी रूप से मेम्ब्रेन से जुड़े होते हैं। किन्तु इससे निकलते नहीं हैं।[2]
प्रकार
संरचना द्वारा वर्गीकरण
ट्रांसमेम्ब्रेन प्रोटीन के दो मूल प्रकार हैं:[3] अल्फा हेलिक्स और बीटा बैरल। अल्फा-हेलीकल प्रोटीन जीवाणु कोशिकाओं के आंतरिक झिल्ली या यूकेरियोटिक कोशिकाओं के प्लाज्मा झिल्ली में और कभी-कभी जीवाणु बाहरी झिल्ली में उपस्थित होते हैं।[4] यह ट्रांसमेम्ब्रेन प्रोटीन की प्रमुख श्रेणी है। मनुष्यों में सभी प्रोटीनों का 27% अल्फा-हेलिकल मेम्ब्रेन प्रोटीन होने का अनुमान लगाया गया है।[5] बीटा-बैरल प्रोटीन अब तक केवल ग्राम-नकारात्मक बैक्टीरिया की बाहरी झिल्लियों, ग्राम पॉजिटिव बैक्टीरिया की कोशिका भित्ति, माइटोकॉन्ड्रिया और क्लोरोप्लास्ट के बाहरी माइटोकॉन्ड्रियल झिल्ली में पाए जाते हैं या छिद्र बनाने वाले विषाक्त पदार्थों के रूप में स्रावित हो सकते हैं। सभी बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन में सरलतम अप-एंड-डाउन टोपोलॉजी होती है। जो उनके सामान्य उत्पन्नता और समान सतह तंत्र को प्रदर्शित कर सकती है।
प्रोटीन डोमेन के अतिरिक्त पेप्टाइड्स द्वारा गठित असामान्य ट्रांसमेम्ब्रेन तत्व भी हैं। एक विशिष्ट उदाहरण ग्रामिसिडिन ए है। एक पेप्टाइड जो एक डिमेरिक ट्रांसमेम्ब्रेन β-हेलिक्स बनाता है।[6] यह पेप्टाइड ग्राम पॉजिटिव बैक्टीरिया द्वारा रोगाणुरोधी पेप्टाइड्स के रूप में स्रावित होता है। प्राकृतिक प्रोटीन में एक ट्रांसमेम्ब्रेन पॉलीप्रोलाइन हेलिक्स पॉलीप्रोलाइन- II हेलिक्स की सूची नहीं की गई है। यद्यपि इस संरचना को विशेष रूप से प्रारूपित किए गए कृत्रिम पेप्टाइड्स में प्रयोगात्मक रूप से देखा गया था।[7]
टोपोलॉजी द्वारा वर्गीकरण
यह वर्गीकरण प्रोटीन टोपोलॉजी को संदर्भित करता है। लिपिड बिलेयर के विभिन्न पक्षों पर प्रोटीन एन और सी-टर्मिनी की स्थिति टाइप I, II, III और IV बिटोपिक प्रोटीन हैं। सिंगल-पास अणु टाइप ट्रांसमेम्ब्रेन प्रोटीन एक स्टॉप-ट्रांसफर एंकर अनुक्रम के साथ लिपिड झिल्ली से जुडे रहते हैं और उनके N-टर्मिनल डोमेन संश्लेषण के समय अन्तः प्रदव्ययी जलिका (ER) लुमेन एनाटॉमी को लक्षित होते हैं और बाह्य स्थान, (यदि परिपक्व रूप स्थित हैं) कोशिका की झिल्लियाँ टाइप II और III को सिग्नल-एंकर अनुक्रम के साथ एंकर किया गया है, टाइप II को इसके C-टर्मिनल डोमेन के साथ ER लुमेन को लक्षित किया गया है। जबकि टाइप III में उनके N-टर्मिनल डोमेन ER लुमेन को लक्षित हैं। टाइप IV को IV-A में विभाजित किया गया है। उनके N-टर्मिनल डोमेन को साइटोसोल और IV-B को लक्षित किया गया है। जिसमें N-टर्मिनल डोमेन लुमेन को लक्षित है।[8] चार प्रकारों में विभाजन के निहितार्थ विशेष रूप से ट्रांसलोकेशन और ER-बाउंड ट्रांसलेशन के समय प्रकट होते हैं। जब प्रोटीन को ER झिल्ली के माध्यम से टाइप पर निर्भर दिशा में निकालना होता है।
3डी संरचना
झिल्ली प्रोटीन संरचना एक्स-रे क्रिस्टलोग्राफी, इलेक्ट्रॉन माइक्रोस्कोपी या एनएमआर स्पेक्ट्रोस्कोपी द्वारा निर्धारित की जा सकती है।[10] इन प्रोटीनों की सबसे सामान्य प्रोटीन तृतीयक संरचना ट्रांसमेम्ब्रेन हेलिक्स बंडल और बीटा बैरल हैं। झिल्ली प्रोटीन का वह भाग जो लिपिड बाईलेयर से जुड़ा होता है। कुंडलाकार लिपिड खोल में प्रायः हाइड्रोफोबिक अमीनो एसिड होते हैं।[11]
मेम्ब्रेन प्रोटीन जिनमें हाइड्रोफोबिक सतहें होती हैं, अपेक्षाकृत लचीली होती हैं और अपेक्षाकृत निम्न स्तरों पर व्यक्त की जाती हैं। यह पर्याप्त प्रोटीन प्राप्त करने और फिर क्रिस्टल उगाने में कठिनाइयाँ उत्पन्न करता है। इसलिए झिल्ली प्रोटीनों के महत्वपूर्ण कार्यात्मक महत्व के बाद भी इन प्रोटीनों के लिए परमाणु विभेदन संरचनाओं का निर्धारण गोलाकार प्रोटीनों की तुलना में अधिक कठिन है।[12] जनवरी 2013 तक निर्धारित प्रोटीन संरचनाओं के 0.1% से कम कुल प्रोटिओम के 20-30% होने के बाद झिल्ली प्रोटीन थे।[13] इस कठिनाई और प्रोटीन के इस वर्ग के महत्व के कारण हाइड्रोपेथी भूखंडों के आधार पर प्रोटीन संरचना की भविष्यवाणी के प्रकार, सकारात्मक आंतरिक नियम और अन्य प्रकारों का विकास किया गया है।[14][15][16]
थर्मोडायनामिक स्थिरता और फोल्डिंग
अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता
ट्रांसमेम्ब्रेन डोमेन अल्फा हेलिक्स (α-हेलिकल) प्रोटीन असामान्य रूप से थर्मल डेनेचुरेशन (बायोकेमिस्ट्री) अध्ययनों से देखते हुए स्थिर हैं क्योंकि वे झिल्ली के अन्दर पूर्णतयः से प्रकट नहीं होते हैं (पूर्णरूप से खोलने के लिए बहुत सारे α-हेलिकल H-बन्धों को तोड़ने की आवश्यकता होगी)। गैर-ध्रुवीय मीडिया में बंधन दूसरी ओर झिल्लियों में बिना एकत्रीकरण, पिघली हुई गोलाकार अवस्थाओं में संक्रमण, बिना डाइसल्फ़ाइड बांडों के निर्माण या परिधीय क्षेत्रों और गैर-नियमित छोरों के प्रकट होने के कारण ये प्रोटीन सरलता से मिसफॉल्ड हो जाते हैं। जो स्थानीय रूप से कम स्थिर होते हैं। अनफोल्डेड स्टेट को ठीक से परिभाषित करना भी महत्वपूर्ण है। अपमार्जक मिसेल में झिल्ली प्रोटीन की प्रकट अवस्था थर्मल मिश्रण (जैव रसायन) प्रयोगों से भिन्न होती है। यह अवस्था मुड़े हुए हाइड्रोफोबिक α-हेलिकॉप्टरों के संयोजन का प्रतिनिधित्व करता है और अपमार्जक द्वारा कवर किए गए आंशिक रूप से सामने आए खंडों का प्रतिनिधित्व करता है। उदाहरण के लिए सोडियम डोडेसिल सल्फेट मिसेल्स में अनफोल्डेड बैक्टीरियोहोडोप्सिन में चार ट्रांसमेम्ब्रेन α-हेलीकॉप्स मुड़े होते हैं। जबकि बचे हुए प्रोटीन मिसेल-वाटर इंटरफेस पर स्थित होता है और विभिन्न प्रकार की बिना एम्फीफिलिक संरचनाओं को ग्रहण कर सकता है। ऐसे अपमार्जक-अभिकर्मक और उनकी अवस्थाओं के बीच मुक्त ऊर्जा अंतर जल में घुलनशील प्रोटीन (<10 किलो कैलोरी/मोल) की स्थिरता के समान हैं।
α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की सतह
इन विट्रो में α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन की रीफोल्डिंग तन्त्र रूप से कठिन है। सफल रीफोल्डिंग प्रयोगों के अपेक्षाकृत कुछ उदाहरण हैं। जैसा कि बैक्टीरियोरोडोप्सिन के लिए है। अन्तर्जीव में ऐसे सभी प्रोटीन सामान्य रूप से बड़े ट्रांसमेम्ब्रेन ट्रांसलोकन के अन्दर सह-अनुवादिक रूप से मुड़े होते हैं। ट्रांसलोकॉन चैनल नये ट्रांसमेम्ब्रेन α-हेलिक्स के लिए अत्यधिक विषम वातावरण प्रदान करता है। अपेक्षाकृत ध्रुवीय एम्फीफिलिक α-हेलिक्स ट्रांसलोकन में एक ट्रांसमेम्ब्रेन ओरिएंटेशन को अपना सकता है। (चूंकि यह झिल्ली की सतह पर होगा या इन विट्रो में सामने आएगा।) क्योंकि इसके ध्रुवीय अवशेष ट्रांसलोकॉन के केंद्रीय जल से भरे चैनल का सामना कर सकते हैं। ट्रांसमेम्ब्रेन प्रोटीन की संरचनाओं में ध्रुवीय α-हेलिक्स को सम्मिलित करने के लिए ऐसा तंत्र आवश्यक है, जब तक प्रोटीन पूर्णतयः संश्लेषित और मुड़ा हुआ नहीं हो जाता। तब तक एम्फीफिलिक हेलिक्स ट्रांसलोकन से जुड़े रहते हैं। यदि प्रोटीन खुला रहता है और बहुत लंबे समय तक ट्रांसलोकन से जुड़ा रहता है। तो यह विशिष्ट गुणवत्ता नियंत्रण सेलुलर तन्त्र द्वारा अवक्रमित होता है।
बीटा-बैरल ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता और तह
बीटा बैरल (β-बैरल) ट्रांसमेम्ब्रेन प्रोटीन की स्थिरता रासायनिक मिश्रण अध्ययनों के आधार पर पानी में घुलनशील प्रोटीन की स्थिरता के समान है। उनमें से कुछ चॉट्रोपिक एजेंटों और उच्च तापमान में भी बहुत स्थिर हैं। अन्तर्जीव में उनकी सतह को पानी में घुलनशील चैपरोन (प्रोटीन) जैसे प्रोटीन एसकेपी द्वारा सरल बनाया जाता है। ऐसा माना जाता है कि β-बैरल झिल्ली प्रोटीन अनुवांशिकता से आते हैं। यहां तक कि अलग-अलग संख्या में सतहें होती हैं। जिन्हें विकास के समय जोड़ा या दोगुना किया जा सकता है। कुछ अध्ययन विभिन्न जीवों के बीच विशाल अनुक्रम संरक्षण और संरक्षित अमीनो एसिड भी प्रदर्शित करते हैं। जो संरचना को धारण करते हैं और मोड़ने में सहायता करते हैं।[17]
3 डी संरचनाएं
प्रकाश अवशोषण संचालित ट्रांसपोर्टर
- रोडोप्सिन सहित बैक्टीरियोहोडोप्सिन-जैसे प्रोटीन
- जीवाणु प्रकाश संश्लेषण प्रतिक्रिया केंद्र और फोटोसिस्टम I और II
- बैक्टीरिया और क्लोरोप्लास्ट से प्रकाश संचयन परिसर
ऑक्सीडक्शन-संचालित ट्रांसपोर्टर
- ट्रांसमेम्ब्रेन साइटोक्रोम बी-प्रकार प्रोटीन: कोएंजाइम क्यू-साइटोक्रोम सी रिडक्टेस (साइटोक्रोम बीसी1); साइटोक्रोम बी6एफ कॉम्प्लेक्स; फॉर्मेट डिहाइड्रोजनेज, श्वसन नाइट्रेट रिडक्टेस; सक्सिनेट-कोएंजाइम क्यू रिडक्टेस (फ्यूमरेट रिडक्टेस), सक्सिनेट डिहाइड्रोजनेज और इलेक्ट्रॉन परिवहन श्रृंखला देखें।
- बैक्टीरिया और माइटोकॉन्ड्रिया से साइटोक्रोम सी ऑक्सीडेज
विद्युत रासायनिक क्षमता संचालित ट्रांसपोर्टर
- प्रोटॉन या सोडियम ट्रांसलोकेशन F-टाइप और V-टाइप एटीपीसेस
P-P-बॉन्ड हाइड्रोलिसिस-संचालित ट्रांसपोर्टर
- P-प्रकार कैल्शियम एटीपीसेस (पांच अलग अनुरूपता)
- कैल्शियम एटीपीसेस रेगुलेटर फॉस्फोलैम्बन और सारकोलिपिन
- एबीसी ट्रांसपोर्टर
- जनरल स्रावी मार्ग (सेक) ट्रांसलोकॉन (प्रीप्रोटीन ट्रांसलोकेस सेकवाई)
पोर्टर्स (यूनिपोर्टर्स, सिम्पोर्टर्स, एंटीपोर्टर्स)
- माइट्रोकॉन्ड्रियल वाहक प्रोटीन
- मेजर फैसिलिटेटर सुपरफैमिली (ग्लिसरॉल-3-फॉस्फेट ट्रांसपोर्टर, लैक्टोज परमीज़ और मल्टीड्रग ट्रांसपोर्टर एमआरडी)
- रेजिस्टेंस-नोड्यूलेशन-सेल डिवीजन सुपरफैमिली (आरएनडी)| रेसिस्टेंस-नोड्यूलेशन-सेल डिवीजन (मल्टीड्रग एफ्लक्स (माइक्रोबायोलॉजी) ट्रांसपोर्टर एसीआरबी, बहुदवा प्रतिरोध देखें)
- डायकार्बोक्सिलेट/एमिनो एसिड: कटियन सिम्पोर्टर (प्रोटॉन ग्लूटामेट सिम्पोर्टर)
- मोनोवैलेंट केशन/प्रोटोन एंटीपोर्टर (सोडियम/प्रोटोन एंटीपोर्टर 1 एनएचए)
- स्नायुसंचारी सोडियम सिम्पॉर्टर
- अमोनिया ट्रांसपोर्टर
- ड्रग/मेटाबोलाइट ट्रांसपोर्टर (छोटा मल्टीड्रग रेजिस्टेंस ट्रांसपोर्टर ईएमआरई-संरचनाओं को गलत मानकर वापस ले लिया जाता है)
आयन चैनल सहित अल्फा-पेचदार चैनल
- पोटेशियम चैनल केसीएसए और केवीएपी सहित वोल्टेज-गेटेड आयन चैनल और शुद्ध करनेवाला पोटेशियम आयन चैनल किरबाक
- बड़े-चालन मेकोनोसेंसिटिव चैनल, एमएससीएल
- मेकोनोसेंसिटिव आयन चैनल, स्मॉल-कंडक्शन मैकेनोसेंसिटिव आयन चैनल (एमएससीएस)
- मैग्नीशियम ट्रांसपोर्टर
- न्यूरोट्रांसमीटर रिसेप्टर्स (एसिटाइलकोलाइन रिसेप्टर) के लिगैंड-गेटेड आयन चैनल
- एक्वापोरिन
- क्लोराइड चैनल
- बाहरी झिल्ली सहायक प्रोटीन (पॉलीसेकेराइड ट्रांसपोर्टर), बाहरी जीवाणु झिल्ली से α-पेचदार ट्रांसमेम्ब्रेन प्रोटीन
एंजाइम
- मीथेन मोनोऑक्सीजिनेज
- विषमकोण प्रोटीज
- डाइसल्फ़ाइड बंधन गठन प्रोटीन (डीएसबीए-डीएसबीबी कॉम्प्लेक्स)
अल्फा-हेलिकल ट्रांसमेम्ब्रेन एंकर के साथ प्रोटीन
- T सेल रिसेप्टर ट्रांसमेम्ब्रेन डिमराइजेशन डोमेन]
- साइटोक्रोम सी नाइट्राइट रिडक्टेस कॉम्प्लेक्स
- स्टेरिल-सल्फेट सल्फोहाइड्रोलेज़
- स्टैनिन
- ग्लाइकोफोरिन A डिमर
- इनोवायरस (फिलामेंटस फेज) प्रमुख कोट प्रोटीन
- पिलिन
- फुफ्फुसीय सर्फेक्टेंट-जुड़े प्रोटीन
- मोनोमाइन ऑक्सीडेज ए और बी
- फैटी एसिड एमाइड हाइड्रोलेस[18]
- साइटोक्रोम पी450 ऑक्सीडेज
- मिनरलोकोर्टिकोइड. कॉर्टिकोस्टेरॉइड 11β-डिहाइड्रोजनेज।
- सिग्नल पेप्टाइड पेप्टाइड
- मेम्ब्रेन प्रोटीज एक स्टोमैटिन होमोलॉग के लिए विशिष्ट है।
एकल पॉलीपेप्टाइड श्रृंखला से बना बीटा-बैरल
- आठ बीटा-जाति से बीटा बैरल और दस की केवल संख्या के साथ (n=8, S=10)। वे सम्मिलित करते हैं:
- ओएमपीए जैसा ट्रांसमेम्ब्रेन डोमेन (ओएमपीए)
- विषाणु-संबंधी बाहरी झिल्ली प्रोटीन परिवार (ओएमपीएक्स)
- बाहरी झिल्ली प्रोटीन ओपीसीए परिवार (ओएमपीडब्ल्यू)
- रोगाणुरोधी पेप्टाइड प्रतिरोध और लिपिड ए एसाइलेशन प्रोटीन परिवार (पीएजीपी)
- लिपिड ए डेसीलेज पीएजीएल
- अपारदर्शिता पारिवारिक पोरिन (एनएसपीए)
- ऑटोट्रांसपोर्टर डोमेन (n=12,S=14)
- एफएडीएल बाहरी झिल्ली प्रोटीन परिवहन परिवार, वसा अम्ल ट्रांसपोर्टर एफएडीएल सहित (n=14,S=14)
- सामान्य बैक्टीरियल पोरिन परिवार, जिसे ट्रिमेरिक पोरिन (प्रोटीन) के रूप में जाना जाता है (n=16,S=20)
- मी और पोरिन, या शुगर पोरिन (प्रोटीन) (n=18,S=22)
- न्यूक्लियोसाइड-विशिष्ट पोरिन (n=12,S=16)
- बाहरी झिल्ली फॉस्फोलिपेज़ A1(n=12,S=16)
- टॉन बी-निर्भर रिसेप्टर्स और उनके टॉन बी निर्भर रिसेप्टर्स प्लग डोमेन
- वे लिगैंड-गेटेड बाहरी झिल्ली चैनल (एन = 22, एस = 24) हैं। जिनमें कोबालिन ट्रांसपोर्टर बीटीयूबी, Fe (III) -पीओकेलिन रिसेप्टर एफपीटीए, रिसेप्टर एफईपीए, फेरिक हाइड्रॉक्सामेट अपटेक रिसेप्टर फूआ, ट्रांसपोर्टर एफईसीए और पाइओवरडाइन रिसेप्टर एफपीवीए सम्मिलित हैं।
- बाहरी झिल्ली प्रोटीन डब्ल्यू परिवार (n=10,S=12) जिसमें आउटर मेम्ब्रेन प्रोटीज ओएमपीटी और आउटर मेम्ब्रेन प्रोटीन ओपीसीए एडहेसिन/इनवेसिन ओपीसीए प्रोटीन सम्मिलित है।
- बाहरी झिल्ली प्रोटीन पोरिन परिवार (n=14,S=16)
नोट: n और S क्रमशः बीटा की संख्या हैं[19]
कई पॉलीपेप्टाइड श्रृंखलाओं से बना बीटा-बैरल
- ट्रिमेरिक ऑटोट्रांसपोर्टर एडहेसिन्स (टीएए) (n=12,S=12)
- बाहरी झिल्ली इफ्लक्स प्रोटीन, जिसे ट्राइमेरिक आउटर मेम्ब्रेन फैक्टर्स (n=12,S=18) के रूप में भी जाना जाता है। जिसमें टोलसी और मल्टीड्रग रेजिस्टेंस प्रोटीन सम्मिलित हैं।
- एमएसपी ए पोरिन (अष्टक, n=S=16) और α-हेमोलिसिन (हेप्टामर n=S=14) । ये प्रोटीन स्रावित होते हैं।
यह भी देखें
- मेम्ब्रेन प्रोटीन
- मेम्ब्रेन टोपोलॉजी
- ट्रांसमेम्ब्रेन डोमेन
- ट्रांसमेम्ब्रेन रिसेप्टर्स
संदर्भ
- ↑ Manor, Joshua; Feldblum, Esther S.; Arkin, Isaiah T. (2012). "Environment Polarity in Proteins Mapped Noninvasively by FTIR Spectroscopy". The Journal of Physical Chemistry Letters. 3 (7): 939–944. doi:10.1021/jz300150v. PMC 3341589. PMID 22563521.
- ↑ Steven R. Goodman (2008). Medical cell biology. Academic Press. pp. 37–. ISBN 978-0-12-370458-0. Retrieved 24 November 2010.
- ↑ Jin Xiong (2006). Essential bioinformatics. Cambridge University Press. pp. 208–. ISBN 978-0-521-84098-9. Retrieved 13 November 2010.
- ↑ alpha-helical proteins in outer membranes include Stannin and certain lipoproteins, and others
- ↑ Almén MS, Nordström KJ, Fredriksson R, Schiöth HB (2009). "Mapping the human membrane proteome: a majority of the human membrane proteins can be classified according to function and evolutionary origin". BMC Biol. 7: 50. doi:10.1186/1741-7007-7-50. PMC 2739160. PMID 19678920.
- ↑ Nicholson, L. K.; Cross, T. A. (1989). "Gramicidin cation channel: an experimental determination of the right-handed helix sense and verification of .beta.-type hydrogen bonding". Biochemistry (in English). 28 (24): 9379–9385. doi:10.1021/bi00450a019. PMID 2482072.
- ↑ Kubyshkin, Vladimir; Grage, Stephan L.; Ulrich, Anne S.; Budisa, Nediljko (2019). "Bilayer thickness determines the alignment of model polyproline helices in lipid membranes". Physical Chemistry Chemical Physics (in English). 21 (40): 22396–22408. Bibcode:2019PCCP...2122396K. doi:10.1039/c9cp02996f. PMID 31577299.
- ↑ Harvey Lodish etc.; Molecular Cell Biology, Sixth edition, p.546
- ↑ Goder, Veit; Spiess, Martin (31 August 2001). "Topogenesis of membrane proteins: determinants and dynamics". FEBS Letters. 504 (3): 87–93. doi:10.1016/S0014-5793(01)02712-0. PMID 11532438.
- ↑ Cross, Timothy A.; Sharma, Mukesh; Yi, Myunggi; Zhou, Huan-Xiang (2011). "Influence of Solubilizing Environments on Membrane Protein Structures". Trends in Biochemical Sciences. 36 (2): 117–125. doi:10.1016/j.tibs.2010.07.005. PMC 3161620. PMID 20724162.
- ↑ White, Stephen. "General Principle of Membrane Protein Folding and Stability". Stephen White Laboratory Homepage. 10 Nov. 2009. web.[verification needed]
- ↑ Carpenter, Elisabeth P; Beis, Konstantinos; Cameron, Alexander D; Iwata, So (October 2008). "Overcoming the challenges of membrane protein crystallography". Current Opinion in Structural Biology. 18 (5): 581–586. doi:10.1016/j.sbi.2008.07.001. PMC 2580798. PMID 18674618.
- ↑ Membrane Proteins of known 3D Structure
- ↑ Elofsson, Arne; Heijne, Gunnar von (7 June 2007). "Membrane Protein Structure: Prediction versus Reality". Annual Review of Biochemistry. 76 (1): 125–140. CiteSeerX 10.1.1.332.4023. doi:10.1146/annurev.biochem.76.052705.163539. PMID 17579561.
- ↑ Chen, Chien Peter; Rost, Burkhard (2002). "State-of-the-art in membrane protein prediction". Applied Bioinformatics. 1 (1): 21–35. CiteSeerX 10.1.1.134.7424. PMID 15130854.
- ↑ Hopf, Thomas A.; Colwell, Lucy J.; Sheridan, Robert; Rost, Burkhard; Sander, Chris; Marks, Debora S. (June 2012). "Three-Dimensional Structures of Membrane Proteins from Genomic Sequencing". Cell. 149 (7): 1607–1621. doi:10.1016/j.cell.2012.04.012. PMC 3641781. PMID 22579045.
- ↑ Michalik, Marcin; Orwick-Rydmark, Marcella; Habeck, Michael; Alva, Vikram; Arnold, Thomas; Linke, Dirk; Permyakov, Eugene A. (3 August 2017). "An evolutionarily conserved glycine-tyrosine motif forms a folding core in outer membrane proteins". PLOS ONE. 12 (8): e0182016. Bibcode:2017PLoSO..1282016M. doi:10.1371/journal.pone.0182016. PMC 5542473. PMID 28771529.
- ↑ Bracey MH, Hanson MA, Masuda KR, Stevens RC, Cravatt BF (November 2002). "Structural adaptations in a membrane enzyme that terminates endocannabinoid signaling". Science. 298 (5599): 1793–6. Bibcode:2002Sci...298.1793B. doi:10.1126/science.1076535. PMID 12459591. S2CID 22656813.
- ↑ Murzin AG, Lesk AM, Chothia C (March 1994). "Principles determining the structure of beta-sheet barrels in proteins. I. A theoretical analysis". J. Mol. Biol. 236 (5): 1369–81. doi:10.1016/0022-2836(94)90064-7. PMID 8126726.

