घनाकार परमाणु: Difference between revisions
(Created page with "{{Short description|Early atomic model}} क्यूबिकल परमाणु एक प्रारंभिक परमाणु मॉडल था जिसमे...") |
No edit summary |
||
| (3 intermediate revisions by 3 users not shown) | |||
| Line 1: | Line 1: | ||
{{Short description|Early atomic model}} | {{Short description|Early atomic model}} | ||
घनीय परमाणु एक प्रारंभिक परमाणु मॉडल था जिसमें एक गैर-ध्रुवीय परमाणु या अणु में घन के आठ कोनों पर इलेक्ट्रॉनों को रखा गया था। यह सिद्धांत 1902 में गिल्बर्ट एन. लुईस द्वारा विकसित किया गया था और 1916 में "द एटम एंड द मॉलिक्यूल" लेख में प्रकाशित किया गया था और संयोजकता की घटना के लिए प्रयोग किया गया था।<ref>{{Cite journal | |||
| doi = 10.1021/ja02261a002 | | doi = 10.1021/ja02261a002 | ||
| volume = 38 | | volume = 38 | ||
| Line 12: | Line 12: | ||
| s2cid = 95865413 | | s2cid = 95865413 | ||
| url = http://scarc.library.oregonstate.edu/coll/pauling/bond/papers/corr216.3-lewispub-19160400.html | | url = http://scarc.library.oregonstate.edu/coll/pauling/bond/papers/corr216.3-lewispub-19160400.html | ||
}}</ref> लुईस का सिद्धांत अबेग के नियम पर आधारित था। इसे 1919 में | }}</ref> लुईस का सिद्धांत अबेग के नियम पर आधारित था। इसे 1919 में इरविंग लैंगमुइर द्वारा घनीय ऑक्टेट परमाणु के रूप में विकसित किया गया था।<ref>{{Cite journal | ||
| doi = 10.1021/ja02227a002 | | doi = 10.1021/ja02227a002 | ||
| volume = 41 | | volume = 41 | ||
| Line 23: | Line 23: | ||
| date = 1919-06-01 | | date = 1919-06-01 | ||
| url = https://zenodo.org/record/1429026 | | url = https://zenodo.org/record/1429026 | ||
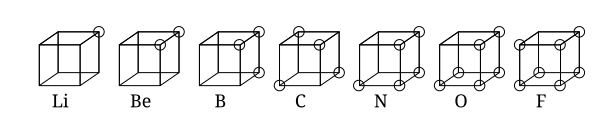
}}</ref> नीचे दिया गया आंकड़ा | }}</ref> नीचे दिया गया आंकड़ा तत्वों के लिए संरचनात्मक प्रतिनिधित्व दिखाता है। | ||
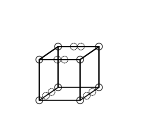
[[Image:cubical atom 1.svg|center]]यद्यपि श्रोडिंगर समीकरण के आधार पर | [[Image:cubical atom 1.svg|center]]यद्यपि श्रोडिंगर समीकरण के आधार पर क्वांटम यांत्रिक मॉडल के पक्ष में परमाणु के क्यूबिकल मॉडल को जल्द ही छोड़ दिया गया था, और इसलिए अब मुख्य रूप से ऐतिहासिक रुचि है, यह रासायनिक बंधन की समझ की दिशा में एक महत्वपूर्ण कदम का प्रतिनिधित्व करता है। लुईस के 1916 के लेख ने सहसंयोजक बंधन, ऑक्टेट नियम और अब तथाकथित लुईस संरचना में इलेक्ट्रॉन जोड़ी की अवधारणा को भी पेश किया। | ||
== | === घनीय परमाणु मॉडल में बंधन === | ||
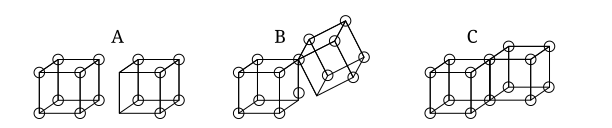
एकल सहसंयोजक बंधन तब बनते हैं जब दो परमाणु किनारे साझा करते हैं, जैसा कि नीचे संरचना | एकल सहसंयोजक बंधन तब बनते हैं जब दो परमाणु किनारे साझा करते हैं, जैसा कि नीचे संरचना C में है। इसके परिणामस्वरूप दो इलेक्ट्रॉनों की साझेदारी होती है। आयनिक बंधन एक किनारे (संरचना A) को साझा किए बिना एक घन से दूसरे घन में एक इलेक्ट्रॉन के स्थानांतरण से बनते हैं। एक मध्यवर्ती अवस्था जहां केवल एक कोने को साझा किया जाता है (संरचना B) भी लुईस द्वारा वर्णित किया गया था। | ||
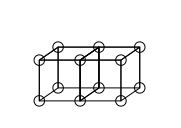
[[Image:cubical atom 2.svg]]दो घन परमाणुओं के बीच एक | [[Image:cubical atom 2.svg]]दो घन परमाणुओं के बीच एक फलक साझा करके दोहरे बंधन बनते हैं। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है: | ||
[[Image:cubical atom 3.svg]] | [[Image:cubical atom 3.svg]]घनीय परमाणु मॉडल द्वारा त्रिबंध का हिसाब नहीं लगाया जा सकता है, क्योंकि दो घनो के तीन समानांतर किनारों को साझा करने का कोई तरीका नहीं है। लुईस ने सुझाव दिया कि परमाणु बंधनों में इलेक्ट्रॉन जोड़े का एक विशेष आकर्षण होता है, जिसके परिणामस्वरूप चतुष्फलकीय बंधन संरचना होती है, जैसा कि नीचे की आकृति में है (इलेक्ट्रॉनों का नया स्थान मोटे किनारों के बीच में बिंदीदार हलकों द्वारा दर्शाया गया है)। यह एक कोने को साझा करके एक एकल बंधन, एक किनारे को साझा करके एक दोहरा बंधन और एक त्रिबंधन के गठन की अनुमति देता है। | ||
[[Image:cubical atom 4.svg]] | [[Image:cubical atom 4.svg]] | ||
== यह भी देखें == | === यह भी देखें === | ||
* [[अणु का इतिहास]] | * [[अणु का इतिहास]] | ||
==संदर्भ== | ===संदर्भ=== | ||
{{Reflist}} | {{Reflist}} | ||
{{Atomic models}} | {{Atomic models}} | ||
[[Category:CS1]] | |||
[[Category:Collapse templates]] | |||
[[Category: | |||
[[Category:Created On 17/05/2023]] | [[Category:Created On 17/05/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Translated in Hindi]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:परमाणुओं]] | |||
[[Category:भौतिकी में अप्रचलित सिद्धांत]] | |||
[[Category:रासायनिक संबंध]] | |||
Latest revision as of 18:06, 12 June 2023
घनीय परमाणु एक प्रारंभिक परमाणु मॉडल था जिसमें एक गैर-ध्रुवीय परमाणु या अणु में घन के आठ कोनों पर इलेक्ट्रॉनों को रखा गया था। यह सिद्धांत 1902 में गिल्बर्ट एन. लुईस द्वारा विकसित किया गया था और 1916 में "द एटम एंड द मॉलिक्यूल" लेख में प्रकाशित किया गया था और संयोजकता की घटना के लिए प्रयोग किया गया था।[1] लुईस का सिद्धांत अबेग के नियम पर आधारित था। इसे 1919 में इरविंग लैंगमुइर द्वारा घनीय ऑक्टेट परमाणु के रूप में विकसित किया गया था।[2] नीचे दिया गया आंकड़ा तत्वों के लिए संरचनात्मक प्रतिनिधित्व दिखाता है।
यद्यपि श्रोडिंगर समीकरण के आधार पर क्वांटम यांत्रिक मॉडल के पक्ष में परमाणु के क्यूबिकल मॉडल को जल्द ही छोड़ दिया गया था, और इसलिए अब मुख्य रूप से ऐतिहासिक रुचि है, यह रासायनिक बंधन की समझ की दिशा में एक महत्वपूर्ण कदम का प्रतिनिधित्व करता है। लुईस के 1916 के लेख ने सहसंयोजक बंधन, ऑक्टेट नियम और अब तथाकथित लुईस संरचना में इलेक्ट्रॉन जोड़ी की अवधारणा को भी पेश किया।
घनीय परमाणु मॉडल में बंधन
एकल सहसंयोजक बंधन तब बनते हैं जब दो परमाणु किनारे साझा करते हैं, जैसा कि नीचे संरचना C में है। इसके परिणामस्वरूप दो इलेक्ट्रॉनों की साझेदारी होती है। आयनिक बंधन एक किनारे (संरचना A) को साझा किए बिना एक घन से दूसरे घन में एक इलेक्ट्रॉन के स्थानांतरण से बनते हैं। एक मध्यवर्ती अवस्था जहां केवल एक कोने को साझा किया जाता है (संरचना B) भी लुईस द्वारा वर्णित किया गया था।
 दो घन परमाणुओं के बीच एक फलक साझा करके दोहरे बंधन बनते हैं। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:
दो घन परमाणुओं के बीच एक फलक साझा करके दोहरे बंधन बनते हैं। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:। इसका परिणाम चार इलेक्ट्रॉनों को साझा करने में होता है:
 घनीय परमाणु मॉडल द्वारा त्रिबंध का हिसाब नहीं लगाया जा सकता है, क्योंकि दो घनो के तीन समानांतर किनारों को साझा करने का कोई तरीका नहीं है। लुईस ने सुझाव दिया कि परमाणु बंधनों में इलेक्ट्रॉन जोड़े का एक विशेष आकर्षण होता है, जिसके परिणामस्वरूप चतुष्फलकीय बंधन संरचना होती है, जैसा कि नीचे की आकृति में है (इलेक्ट्रॉनों का नया स्थान मोटे किनारों के बीच में बिंदीदार हलकों द्वारा दर्शाया गया है)। यह एक कोने को साझा करके एक एकल बंधन, एक किनारे को साझा करके एक दोहरा बंधन और एक त्रिबंधन के गठन की अनुमति देता है।
घनीय परमाणु मॉडल द्वारा त्रिबंध का हिसाब नहीं लगाया जा सकता है, क्योंकि दो घनो के तीन समानांतर किनारों को साझा करने का कोई तरीका नहीं है। लुईस ने सुझाव दिया कि परमाणु बंधनों में इलेक्ट्रॉन जोड़े का एक विशेष आकर्षण होता है, जिसके परिणामस्वरूप चतुष्फलकीय बंधन संरचना होती है, जैसा कि नीचे की आकृति में है (इलेक्ट्रॉनों का नया स्थान मोटे किनारों के बीच में बिंदीदार हलकों द्वारा दर्शाया गया है)। यह एक कोने को साझा करके एक एकल बंधन, एक किनारे को साझा करके एक दोहरा बंधन और एक त्रिबंधन के गठन की अनुमति देता है।
यह भी देखें
संदर्भ
- ↑ Lewis, Gilbert N. (1916-04-01). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002. S2CID 95865413.
- ↑ Langmuir, Irving (1919-06-01). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.