कार्नो चक्र: Difference between revisions
No edit summary |
|||
| (7 intermediate revisions by 6 users not shown) | |||
| Line 3: | Line 3: | ||
कार्नोट चक्र 1824 में फ्रांसीसी भौतिक विज्ञानी निकोलस लियोनार्ड सादी कार्नोट द्वारा प्रस्तावित एक आदर्श ऊष्मागतिकी चक्र है और 1830 और 1840 के दशक में दूसरों द्वारा विस्तारित किया गया। कार्नोट के सिद्धांत के अनुसार, यह किसी भी पारम्परिक ऊष्मागतिकी इंजन की प्रदर्शकता के ऊपरी सीमा प्रदान करता है जब वह ऊष्मा को कार्य में परिवर्तित करता है, या उल्टा, एक प्रशीतन प्रणाली की प्रदर्शकता को जब वह कार्य को प्रणाली पर लागू करके तापमान मे अंतर करता है। | कार्नोट चक्र 1824 में फ्रांसीसी भौतिक विज्ञानी निकोलस लियोनार्ड सादी कार्नोट द्वारा प्रस्तावित एक आदर्श ऊष्मागतिकी चक्र है और 1830 और 1840 के दशक में दूसरों द्वारा विस्तारित किया गया। कार्नोट के सिद्धांत के अनुसार, यह किसी भी पारम्परिक ऊष्मागतिकी इंजन की प्रदर्शकता के ऊपरी सीमा प्रदान करता है जब वह ऊष्मा को कार्य में परिवर्तित करता है, या उल्टा, एक प्रशीतन प्रणाली की प्रदर्शकता को जब वह कार्य को प्रणाली पर लागू करके तापमान मे अंतर करता है। | ||
कार्नोट चक्र में,एक प्रणाली या इंजन एक ऊष्मीय भंडारण <math>T_H</math>और एक शीतल भंडारण <math>T_C</math> के मध्य ऊष्मा के रूप में ऊर्जा स्थानांतरित करती है, जिसे गर्म और शीत भंडारण के रूप में कहा जाता है, और इस स्थानांतरित ऊर्जा का एक भाग प्रणाली द्वारा किये गए कार्य में परिवर्तित होता है। यह चक्र परिवर्तनीय होता है, और भेदक उत्पन्न नहीं होता है। दूसरे शब्दों में, भेदक संरक्षित होता है; भेदक केवल ऊष्मा भंडारणों और प्रणाली के मध्य स्थानांतरित होता है और उसमें बढ़ोतरी या हानि नहीं होती है। जब प्रणाली पर कार्य लागू किया जाती है, तो ऊष्मा शीतल भंडारण से गर्म भंडारण में स्थानांतरित होती है, जिससे प्रणाली पर्यावरण पर | कार्नोट चक्र में,एक प्रणाली या इंजन एक ऊष्मीय भंडारण <math>T_H</math>और एक शीतल भंडारण <math>T_C</math> के मध्य ऊष्मा के रूप में ऊर्जा स्थानांतरित करती है, जिसे गर्म और शीत भंडारण के रूप में कहा जाता है, और इस स्थानांतरित ऊर्जा का एक भाग प्रणाली द्वारा किये गए कार्य में परिवर्तित होता है। यह चक्र परिवर्तनीय होता है, और भेदक उत्पन्न नहीं होता है। दूसरे शब्दों में, भेदक संरक्षित होता है; भेदक केवल ऊष्मा भंडारणों और प्रणाली के मध्य स्थानांतरित होता है और उसमें बढ़ोतरी या हानि नहीं होती है। जब प्रणाली पर कार्य लागू किया जाती है, तो ऊष्मा शीतल भंडारण से गर्म भंडारण में स्थानांतरित होती है, जिससे प्रणाली पर्यावरण पर कार्य करती है। प्रति कार्नोट चक्र में पर्यावरण के द्वारा किया गया कार्य <math>W</math> प्राथमिकता रखता है, जो ऊष्मा भंडारणों के तापमानों और गर्म भंडारण से प्रणाली में स्थानांतरित भेदक <math>\Delta S</math> के अनुसार होता है,जहां | ||
<math>W = (T_H - T_C) \Delta S = (T_H - T_C) \frac{Q_H}{T_H}</math>, है जहां <math>Q_H</math>प्रति कार्नोट चक्र गर्म भंडारण से प्रणाली में स्थानांतरित ऊष्मा है। | <math>W = (T_H - T_C) \Delta S = (T_H - T_C) \frac{Q_H}{T_H}</math>, है जहां <math>Q_H</math>प्रति कार्नोट चक्र गर्म भंडारण से प्रणाली में स्थानांतरित ऊष्मा है। | ||
| Line 13: | Line 13: | ||
एक ऊष्मा इंजन (कार्नोट ऊष्मा इंजन) द्वारा निष्पादित एक आदर्श ऊष्मागतिकी चक्र के रूप में एक कार्नोट चक्र में निम्नलिखित चरण होते हैं। | एक ऊष्मा इंजन (कार्नोट ऊष्मा इंजन) द्वारा निष्पादित एक आदर्श ऊष्मागतिकी चक्र के रूप में एक कार्नोट चक्र में निम्नलिखित चरण होते हैं। | ||
# | # समतापीय विस्तार. ऊष्मा स्थिर तापमान T<sub>H</sub> पर गर्म तापमान भंडार से विपरीत रूप से T<sub>H</sub> से कम तापमान पर गैस में स्थानांतरित की जाती है गैस के तापमान को व्यावहारिक रूप से बदले बिना गैस में ऊष्मा हस्तांतरण की अनुमति देने के लिए समतापीय ऊष्मा जोड़ या अवशोषण किया जाता है। इस चरण के समय, गैस को गर्म तापमान वाले भंडार के साथ तापीय रूप से संपर्क में रखा जाता है और गैस को कार्य करते हुए विस्तार करने की अनुमति दी जाती है पिस्टन को ऊपर की ओर धकेलने वाली गैस द्वारा परिवेश पर (चरण 1 चित्र, दाएँ)। यद्यपि दबाव बिंदु 1 से 2 (चित्र 1) तक गिरता है, प्रक्रिया के समय गैस का तापमान नहीं बदलता है क्योंकि गर्म तापमान भंडार से गैस में स्थानांतरित ऊष्मा का उपयोग गैस द्वारा परिवेश पर कार्य करने के लिए किया जाता है, इसलिए कोई गैस आंतरिक ऊर्जा परिवर्तन नहीं होता है, ऊष्मा Q<sub>H</sub> > 0 गर्म तापमान भंडार से अवशोषित होती है, जिसके परिणामस्वरूप <math>\Delta S_H = Q_H/T_H</math> की मात्रा से गैस की एन्ट्रापी <math>S</math> में वृद्धि होती है। | ||
# गैस की इसेंट्रोपिक (परावर्तनीय अधित्यापक) प्रसारण (इसेंट्रोपिक कार्याकारी उत्पादन)। इस चरण के लिए (चित्र 1 में 2 से 3, चित्र 2 में B से C) इंजन में गैस गर्म और ठंडे संग्रह क्षेत्रों से ऊष्मीय रूप से अलग है, इसलिए उन्हें न तो ऊष्मा मिलती है और न ही उन्हें ऊष्मा खोती है, इसे 'अधित्यापक' प्रक्रिया कहा जाता है। गैस अपने दबाव में कमी के साथ फैलती रहती है, तथा परिवेश पर कार्य करती है, और किए गए कार्य के बराबर आंतरिक ऊर्जा की मात्रा खत्म कर देती है। ऊष्मा इनपुट के बिना गैस के विस्तार के कारण गैस "ठंडे" तापमान तक ठंडी हो जाती है, जो ठंडे जलाशय के तापमान T<sub>C</sub> से असीम रूप से अधिक है। एन्ट्रापी अपरिवर्तित रहती है क्योंकि प्रणाली और उसके परिवेश के मध्य कोई ऊष्मा Q स्थानांतरण (Q = 0) नहीं होता है, इसलिए यह एक समएंट्रापी प्रक्रिया है, जिसका अर्थ है प्रक्रिया में कोई एन्ट्रापी परिवर्तन नहीं होता है। | |||
# समतापीय संपीड़न स्थिर तापमान T<sub>C</sub> पर ऊष्मा विपरीत रूप से कम तापमान वाले जलाशय में स्थानांतरित हो जाती है। इस चरण में (चित्र 1 पर 3 से 4, चित्र 2 पर सी से डी), इंजन में गैस तापमान T<sub>C</sub> पर ठंडे जलाशय के साथ तापीय संपर्क में है जबकि गर्म तापमान जलाशय से तापीय रूप से अलग किया गया है) और गैस का तापमान है इस तापमान से असीम रूप से अधिक व्यावहारिक रूप से गैस तापमान को बदले बिना गैस से ठंडे जलाशय में ऊष्मा हस्तांतरण की अनुमति देते है। तथा परिवेश गैस पर कार्य करता है,और पिस्टन को नीचे धकेलता है। इस कार्य से गैस द्वारा अर्जित ऊर्जा की मात्रा ऊष्मा ऊर्जा Q<sub>C</sub> <0 के रूप में ठंडे जलाशय में स्थानांतरित हो जाती है, इसलिए प्रणाली की एन्ट्रापी <math>\Delta S_C = Q_C/T_C</math> मात्रा से कम हो जाती है। <math>\Delta S_C < 0 </math> क्योंकि समतापीय संपीड़न से गैस की बहुलता कम हो जाती है। | |||
# | |||
# | |||
# समएंट्रापी संपीड़न। (चित्र 1 पर 4 से 1, चित्र 2 पर डी से ए) एक बार फिर इंजन में गैस को गर्म और ठंडे जलाशयों से तापीय रूप से इन्सुलेट किया जाता है, और इंजन को घर्षण रहित माना जाता है और प्रक्रिया अत्यधिक धीमी होती है, इसलिए प्रतिवर्ती होती है। इस चरण के समय, परिवेश गैस पर कार्य करता है, पिस्टन को और नीचे धकेलता है (चरण 4 चित्र, दाएं), इसकी आंतरिक ऊर्जा को बढ़ाता है, इसे संपीड़ित करता है, और इसके तापमान को केवल T<sub>H</sub> से असीम रूप से कम तापमान तक बढ़ा देता है। सिस्टम में कार्य जोड़ा गया, लेकिन एन्ट्रापी अपरिवर्तित रहती है। इस बिंदु पर गैस उसी स्थिति में है जो चरण 1 के प्रारंभ में थी। | |||
| Line 25: | Line 25: | ||
[[File:Carnot cycle p-V diagram.svg|400px|thumb|{{EquationRef|Figure 1}}: किए गए कार्य को दर्शाने के लिए एक पीवी आरेख पर एक कार्नोट चक्र दिखाया गया है। | [[File:Carnot cycle p-V diagram.svg|400px|thumb|{{EquationRef|Figure 1}}: किए गए कार्य को दर्शाने के लिए एक पीवी आरेख पर एक कार्नोट चक्र दिखाया गया है। | ||
1-टू-2 (इज़ोटेर्मल एक्सपेंशन), 2-टू-3 ( | 1-टू-2 (इज़ोटेर्मल एक्सपेंशन), 2-टू-3 (समएंट्रापी एक्सपेंशन), 3-टू-4 (इज़ोतापीय कम्प्रेशन), 4-टू-1 (समएंट्रापी कम्प्रेशन)।]]इस विषय में, चूंकि यह एक प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स) ऊष्मागतिकी चक्र है प्रणाली में कोई शुद्ध परिवर्तन नहीं है और प्रति चक्र इसके आसपास है<ref name="FermiBook">{{cite book |last=Fermi |first=E. |title=Thermodynamics |page=48 |contribution=equation 64 |publisher=Dover Publications |year=1956 |url=https://gutenberg.net.au/ebooks13/1305021p.pdf}}</ref><ref name="PlanckBook" /> | ||
<math display="block">\Delta S_H + \Delta S_C = \Delta S_\text{cycle} = 0, </math> | <math display="block">\Delta S_H + \Delta S_C = \Delta S_\text{cycle} = 0, </math> | ||
या, | या, | ||
| Line 32: | Line 32: | ||
=== दबाव-आयतन आरेख === | === दबाव-आयतन आरेख === | ||
जब एक कार्नोट चक्र को दबाव-आयतन आरेख पर प्लॉट किया जाता है ( | जब एक कार्नोट चक्र को दबाव-आयतन आरेख पर प्लॉट किया जाता है ('''आकृति 1'''), चरण कार्यशील तरल पदार्थ के लिए समतापीय रेखाओ का अनुसरण करते हैं, | ||
स्थिरोष्म चरण समतापी के मध्य चलते हैं, और पूर्ण चक्र पथ से घिरा क्षेत्र कुल कार्य का प्रतिनिधित्व करता है जो एक चक्र के समय किया जा सकता है। बिंदु 1 से 2 और बिंदु 3 से 4 तक तापमान स्थिर ( है। बिंदु 4 से 1 और बिंदु 2 से 3 तक ऊष्मा का स्थानांतरण शून्य के बराबर है। | |||
== गुण और महत्व == | == गुण और महत्व == | ||
| Line 56: | Line 51: | ||
[[File:Carnot Cycle T-S diagram.svg|400px|thumb|चित्र 2: कार्नोट चक्र एक आदर्शीकृत ऊष्मागतिकी चक्र जो एक ऊष्मा इंजन द्वारा प्रदर्शित किया जाता है, एक टीएस आरेखण पर दर्शाया गया है। यह चक्र एक गर्म भंडारण (तापमान TH) और एक शीतल भंडारण (तापमान TC) के मध्य होती है। लंबवत ध्यानसूत्र सतह प्रणाली का है, आयताकार ध्यानसूत्र भेदकता प्रणाली का है। ए-बी (इजोथर्मी विस्तार), बी-सी (भेदकीय विस्तार), सी-डी (इजोथर्मी संकुचन), डी-ए (भेदकीय संकुचन)]] | [[File:Carnot Cycle T-S diagram.svg|400px|thumb|चित्र 2: कार्नोट चक्र एक आदर्शीकृत ऊष्मागतिकी चक्र जो एक ऊष्मा इंजन द्वारा प्रदर्शित किया जाता है, एक टीएस आरेखण पर दर्शाया गया है। यह चक्र एक गर्म भंडारण (तापमान TH) और एक शीतल भंडारण (तापमान TC) के मध्य होती है। लंबवत ध्यानसूत्र सतह प्रणाली का है, आयताकार ध्यानसूत्र भेदकता प्रणाली का है। ए-बी (इजोथर्मी विस्तार), बी-सी (भेदकीय विस्तार), सी-डी (इजोथर्मी संकुचन), डी-ए (भेदकीय संकुचन)]] | ||
[[File:Ejemplo Diagrama T-S.png|300px|thumb|right|चित्र 3: एक सामान्यीकृत ऊष्मागतकी चक्र जो एक गर्म संग्रहालय जिसका तापमान ''T''<sub>H</sub> होता है और एक ठंडा संग्रहालय जिसका तापमान ''T''<sub>C</sub> होता है के मध्य हो रहा है। द्वितीय ऊष्मागतकी के नियम के अनुसार, चक्र ''T''<sub>C</sub> से ''T''<sub>H</sub> तापमान बैंड के बाहर नहीं फैल सकता है। लाल रंग में दिखाए गए क्षेत्र, Q<sub>C</sub> प्रणाली और ठंडे संग्रहालय के मध्य विनिमयित ऊर्जा की मात्रा हैसफेद क्षेत्र, W, प्रणाली की आस-पास के साथ प्रदान की गई कार्य ऊर्जा की मात्रा है। गर्म संग्रहालय के साथ विनिमयित ऊर्जा की मात्रा दोनों का योग होती है। यदि प्रणाली इंजन की तरह व्यवहार कर रही है, तो प्रक्रिया घड़ी की दिशा में घूमती है, और यदि यह एक फ्रिज की तरह व्यवहार कर रही है तो विपरीत दिशा में घूमती है। चक्र की क्षमता सफेद क्षेत्र (कार्य) का अनुपात होती है जिसे सफेद और लाल क्षेत्रों (गर्म संग्रहालय से शोषित | [[File:Ejemplo Diagrama T-S.png|300px|thumb|right|चित्र 3: एक सामान्यीकृत ऊष्मागतकी चक्र जो एक गर्म संग्रहालय जिसका तापमान ''T''<sub>H</sub> होता है और एक ठंडा संग्रहालय जिसका तापमान ''T''<sub>C</sub> होता है के मध्य हो रहा है। द्वितीय ऊष्मागतकी के नियम के अनुसार, चक्र ''T''<sub>C</sub> से ''T''<sub>H</sub> तापमान बैंड के बाहर नहीं फैल सकता है। लाल रंग में दिखाए गए क्षेत्र, Q<sub>C</sub> प्रणाली और ठंडे संग्रहालय के मध्य विनिमयित ऊर्जा की मात्रा हैसफेद क्षेत्र, W, प्रणाली की आस-पास के साथ प्रदान की गई कार्य ऊर्जा की मात्रा है। गर्म संग्रहालय के साथ विनिमयित ऊर्जा की मात्रा दोनों का योग होती है। यदि प्रणाली इंजन की तरह व्यवहार कर रही है, तो प्रक्रिया घड़ी की दिशा में घूमती है, और यदि यह एक फ्रिज की तरह व्यवहार कर रही है तो विपरीत दिशा में घूमती है। चक्र की क्षमता सफेद क्षेत्र (कार्य) का अनुपात होती है जिसे सफेद और लाल क्षेत्रों (गर्म संग्रहालय से शोषित ऊष्मा ) का योग से विभाजित किया जाता है। <br>Q<sub>C</sub> (ठंडे संग्रहालय को खो दी गई ऊर्जा) को सीधे घटाने के रूप में देखा जा सकता है, या एक नकारात्मक मात्रा के योग के रूप में व्यक्त किया जा सकता है, जो विभिन्न साधारण को ले जा सकता है।]]कार्नोट इंजन या प्रशीतक के व्यवहार को तापमान-एन्ट्रॉपी आरेख (टी-एस आरेख) का उपयोग करके सबसे अच्छी तरह से समझा जाता है, जिसमें ऊष्मागतिकी स्थिति को क्षैतिज अक्ष और तापमान के रूप में एंट्रॉपी (एस) के साथ आरेख पर एक बिंदु द्वारा निर्दिष्ट किया जाता है ( टी) ऊर्ध्वाधर अक्ष के रूप में ((चित्र 2). एक साधारण बंद प्रणाली के लिए, आरेख पर कोई भी बिंदु प्रणाली की एक विशेष स्थिति का प्रतिनिधित्व करता है। प्रारंभिक अवस्था (A) और अंतिम अवस्था (B) को जोड़ने वाले वक्र द्वारा एक ऊष्मागतिकी प्रक्रिया का प्रतिनिधित्व किया जाता है। वक्र के अंतर्गत क्षेत्र है: | ||
{{NumBlk|:|<math>Q = \int_A^B dQ = \int_A^B T\,dS</math>|{{EquationRef|1}}}} | {{NumBlk|:|<math>Q = \int_A^B dQ = \int_A^B T\,dS</math>|{{EquationRef|1}}}} | ||
| Line 72: | Line 67: | ||
<math display="block">W = \oint PdV = \oint TdS = (T_H-T_C)(S_B-S_A)</math> | <math display="block">W = \oint PdV = \oint TdS = (T_H-T_C)(S_B-S_A)</math> | ||
गर्म जलाशय से प्रणाली में स्थानांतरित | गर्म जलाशय से प्रणाली में स्थानांतरित ऊष्मा की कुल मात्रा होगी | ||
<math display="block">Q_H = T_H (S_B-S_A) = T_H \Delta S_H</math> | <math display="block">Q_H = T_H (S_B-S_A) = T_H \Delta S_H</math> | ||
और प्रणाली से ठंडे जलाशय में स्थानांतरित | और प्रणाली से ठंडे जलाशय में स्थानांतरित ऊष्मा की कुल मात्रा होगी | ||
<math display="block">Q_C = T_C (S_A - S_B) = T_C \Delta S_C < 0</math> | <math display="block">Q_C = T_C (S_A - S_B) = T_C \Delta S_C < 0</math> | ||
ऊर्जा संरक्षण के कारण, शुद्ध ऊष्मा हस्तांतरित, <math>Q</math>, किए गए कार्य के बराबर है<ref name="PlanckBook"/> | ऊर्जा संरक्षण के कारण, शुद्ध ऊष्मा हस्तांतरित, <math>Q</math>, किए गए कार्य के बराबर है<ref name="PlanckBook"/> | ||
| Line 85: | Line 80: | ||
* {{mvar|W}} प्रणाली द्वारा किया गया कार्य है | * {{mvar|W}} प्रणाली द्वारा किया गया कार्य है | ||
* <math>Q_C</math> <0 प्रणाली से ली गई ऊष्मा है ऊष्मा ऊर्जा प्रणाली को छोड़ती है, | * <math>Q_C</math> <0 प्रणाली से ली गई ऊष्मा है ऊष्मा ऊर्जा प्रणाली को छोड़ती है, | ||
* <math>Q_H</math> > 0 प्रणाली में डाली गई | * <math>Q_H</math> > 0 प्रणाली में डाली गई ऊष्मा है (प्रणाली में प्रवेश करने वाली ऊष्मा ऊर्जा), | ||
* <math>T_C</math> ठंडे जलाशय का पूर्ण तापमान है, और | * <math>T_C</math> ठंडे जलाशय का पूर्ण तापमान है, और | ||
* <math>T_H</math> गर्म जलाशय का पूर्ण तापमान है। | * <math>T_H</math> गर्म जलाशय का पूर्ण तापमान है। | ||
| Line 107: | Line 102: | ||
उपरोक्त आरेख से यह देखा जा सकता है कि तापमान के मध्य चलने वाले किसी भी चक्र के लिए <math>T_H</math> और <math>T_C</math>, कोई भी कार्नोट चक्र की दक्षता से अधिक नहीं हो सकता। | उपरोक्त आरेख से यह देखा जा सकता है कि तापमान के मध्य चलने वाले किसी भी चक्र के लिए <math>T_H</math> और <math>T_C</math>, कोई भी कार्नोट चक्र की दक्षता से अधिक नहीं हो सकता। | ||
[[File:Real vs Carnot.svg|500px|thumb|चित्र 6: एक वास्तविक इंजन (बायाँ ओर) को कर्नोट चक्र (दायाँ ओर) के साथ तुलना करते हुए एक वास्तविक पदार्थ की एंट्रोपी तापमान के साथ परिवर्तित होती है। इस परिवर्तन को T-S आरेखण पर द्वारा दिखाया जाता है। इस चित्र के लिए, यह आरेख एक वाष्प-तरल संतुलन को दर्शाती है (रैंकिन चक्र देखें)। अपरिणामी प्रणाली और ऊर्जा की हानियाँ (उदाहरण के लिए, घर्षण के कारण होने वाला कार्य और | [[File:Real vs Carnot.svg|500px|thumb|चित्र 6: एक वास्तविक इंजन (बायाँ ओर) को कर्नोट चक्र (दायाँ ओर) के साथ तुलना करते हुए एक वास्तविक पदार्थ की एंट्रोपी तापमान के साथ परिवर्तित होती है। इस परिवर्तन को T-S आरेखण पर द्वारा दिखाया जाता है। इस चित्र के लिए, यह आरेख एक वाष्प-तरल संतुलन को दर्शाती है (रैंकिन चक्र देखें)। अपरिणामी प्रणाली और ऊर्जा की हानियाँ (उदाहरण के लिए, घर्षण के कारण होने वाला कार्य और ऊष्मा की हानियाँ) प्रत्येक कदम पर आदर्श को होने से रोकती हैं।।]]कार्नोट की प्रमेय इस तथ्य का एक औपचारिक कथन है: दो ताप जलाशयों के मध्य चलने वाला कोई भी इंजन उन्हीं जलाशयों के मध्य चलने वाले कार्नोट इंजन की तुलना में अधिक कुशल नहीं हो सकता है। इस प्रकार, समीकरण {{EquationNote|3}} इसी तापमान का उपयोग करके किसी भी इंजन के लिए अधिकतम संभव दक्षता देता है। कार्नोट के प्रमेय के परिणाम में कहा गया है कि: समान ताप जलाशयों के मध्य कार्य करने वाले सभी उत्क्रमणीय इंजन समान रूप से कुशल होते हैं। समीकरण के दाहिने भाग को पुनर्व्यवस्थित करने से समीकरण का अधिक सरलता से समझा जाने वाला रूप हो सकता है, अर्थात् ताप इंजन की सैद्धांतिक अधिकतम दक्षता गर्म जलाशय के पूर्ण तापमान से विभाजित गर्म और ठंडे जलाशय के मध्य तापमान में अंतर के बराबर होती है। इस सूत्र को देखने पर एक रोचक तथ्य स्पष्ट हो जाता है।: ठंडे जलाशय के तापमान को कम करने से ताप इंजन की छत दक्षता पर अधिक प्रभाव पड़ता है, उसी मात्रा में गर्म जलाशय के तापमान को बढ़ाने से। वास्तविक दुनिया में, इसे हासिल करना मुश्किल हो सकता है क्योंकि ठंडा जलाशय प्रायः उपस्थित परिवेश का तापमान होता है। | ||
दूसरे शब्दों में, अधिकतम दक्षता तभी प्राप्त की जाती है यदि एंट्रॉपी प्रति चक्र नहीं बदलती है। चक्र प्रति चक्र में एंट्रोपी परिवर्तन होता है, उदाहरण के लिए, यदि घर्षण होती है और कार्य को ऊष्मा में विपथन में बदल दिया जाता है। उस मामले में, चक्र पुनर्वर्ती नहीं होता है और क्लॉसियस प्रमेय के सिद्धांत में अतिरिक्त असमानता होती है, क्योंकि एंट्रोपी एक क्षेत्रीय आवेश है, इसलिए अतिरिक्त एंट्रोपी को नष्ट करने के लिए पर्यावरण में ऊष्मा को छोड़ना आवश्यक होता है, जिससे न्यूनतम क्षमता में कमी होती है। इसलिए, समीकरण 3 किसी भी पुनर्वर्ती ऊष्मा इंजन की क्षमता देता है। | दूसरे शब्दों में, अधिकतम दक्षता तभी प्राप्त की जाती है यदि एंट्रॉपी प्रति चक्र नहीं बदलती है। चक्र प्रति चक्र में एंट्रोपी परिवर्तन होता है, उदाहरण के लिए, यदि घर्षण होती है और कार्य को ऊष्मा में विपथन में बदल दिया जाता है। उस मामले में, चक्र पुनर्वर्ती नहीं होता है और क्लॉसियस प्रमेय के सिद्धांत में अतिरिक्त असमानता होती है, क्योंकि एंट्रोपी एक क्षेत्रीय आवेश है, इसलिए अतिरिक्त एंट्रोपी को नष्ट करने के लिए पर्यावरण में ऊष्मा को छोड़ना आवश्यक होता है, जिससे न्यूनतम क्षमता में कमी होती है। इसलिए, समीकरण 3 किसी भी पुनर्वर्ती ऊष्मा इंजन की क्षमता देता है। | ||
मेसोस्कोपिक ऊष्मा इंजनों में, सामान्य रूप से संचालन प्रति चक्र में कार्य तापीय शोर के कारण बदलता रहता है। यदि चक्र को क्वासी-स्थिरता से पूरा किया जाता है, तो तरंगों का अभाव हो जाता है।<ref>{{cite journal|title=Cycling Tames Power Fluctuations near Optimum Efficiency|author= Holubec Viktor and Ryabov Artem |journal=Phys. Rev. Lett. |volume=121|issue=12 |year=2018 |pages=120601 |doi=10.1103/PhysRevLett.121.120601 |pmid=30296120 |arxiv = 1805.00848 |bibcode= 2018PhRvL.121l0601H |s2cid= 52943273 }}</ref> यद्यपि, चक्र कार्य करने का समय कार्य करने वाले माध्यम के संतुलन के समय से तेज होता है, तो कार्य के अस्थिरता अपरिहार्य होती है। जब कार्य और ऊष्मा की अस्थिरता को गणना की जाती है, एक सटीक समानता होती है जो किसी भी ऊष्मा इंजन द्वारा किये गए कार्य के अभिवर्तीय औसत को गर्म ऊष्मा से ऊष्मा संचार से जोड़ती है।<ref>{{cite journal |title=Fluctuation Relation for Heat Engines |author=N. A. Sinitsyn |journal=J. Phys. A: Math. Theor.|volume=44|issue=40 |year=2011|pages=405001|doi=10.1088/1751-8113/44/40/405001|arxiv = 1111.7014 |bibcode = 2011JPhA...44N5001S |s2cid=119261929 }}</ref> | मेसोस्कोपिक ऊष्मा इंजनों में, सामान्य रूप से संचालन प्रति चक्र में कार्य तापीय शोर के कारण बदलता रहता है। यदि चक्र को क्वासी-स्थिरता से पूरा किया जाता है, तो तरंगों का अभाव हो जाता है। <ref>{{cite journal|title=Cycling Tames Power Fluctuations near Optimum Efficiency|author= Holubec Viktor and Ryabov Artem |journal=Phys. Rev. Lett. |volume=121|issue=12 |year=2018 |pages=120601 |doi=10.1103/PhysRevLett.121.120601 |pmid=30296120 |arxiv = 1805.00848 |bibcode= 2018PhRvL.121l0601H |s2cid= 52943273 }}</ref> यद्यपि, चक्र कार्य करने का समय कार्य करने वाले माध्यम के संतुलन के समय से तेज होता है, तो कार्य के अस्थिरता अपरिहार्य होती है। जब कार्य और ऊष्मा की अस्थिरता को गणना की जाती है, एक सटीक समानता होती है जो किसी भी ऊष्मा इंजन द्वारा किये गए कार्य के अभिवर्तीय औसत को गर्म ऊष्मा से ऊष्मा संचार से जोड़ती है।<ref>{{cite journal |title=Fluctuation Relation for Heat Engines |author=N. A. Sinitsyn |journal=J. Phys. A: Math. Theor.|volume=44|issue=40 |year=2011|pages=405001|doi=10.1088/1751-8113/44/40/405001|arxiv = 1111.7014 |bibcode = 2011JPhA...44N5001S |s2cid=119261929 }}</ref> | ||
| Line 128: | Line 123: | ||
== एक अव्यावहारिक स्थूलदर्शीय निर्माण के रूप में कार्नोट ताप इंजन == | == एक अव्यावहारिक स्थूलदर्शीय निर्माण के रूप में कार्नोट ताप इंजन == | ||
एक कार्नोट ताप इंजन एक ऊष्मा इंजन है जो एक कार्नोट चक्र का प्रदर्शन करता है, और स्थूलदर्शीय पैमाने पर इसकी प्राप्ति अव्यावहारिक है। उदाहरण के लिए, कार्नोट चक्र के समतापीय प्रक्रिया भाग के लिए, विस्तार में प्रत्येक चरण पर एक साथ निम्नलिखित नियमों को पूरा किया जाता है:<ref>{{Cite web|last=D|first=Bob|date=2020-01-15|title=In the isothermal expansion phase of a Carnot cycle, why does the gas expand?|url=https://physics.stackexchange.com/q/525217|url-status=live|access-date=2022-01-02|website=StackExchange}}</ref> | एक कार्नोट ताप इंजन एक ऊष्मा इंजन है जो एक कार्नोट चक्र का प्रदर्शन करता है, और स्थूलदर्शीय पैमाने पर इसकी प्राप्ति अव्यावहारिक है। उदाहरण के लिए, कार्नोट चक्र के समतापीय प्रक्रिया भाग के लिए, विस्तार में प्रत्येक चरण पर एक साथ निम्नलिखित नियमों को पूरा किया जाता है:<ref>{{Cite web|last=D|first=Bob|date=2020-01-15|title=In the isothermal expansion phase of a Carnot cycle, why does the gas expand?|url=https://physics.stackexchange.com/q/525217|url-status=live|access-date=2022-01-02|website=StackExchange}}</ref> | ||
* गर्म भंडारण तापमान ''T<sub>H</sub>'' सिस्टम गैस के तापमान T से अत्यल्प रूप से ऊँचा होता है, तो गर्म भंडारण से गैस में ऊष्मीय प्रवाह बिना T को बढ़ाने किया जाता है गैस द्वारा परिसर पर अत्यल्प कार्य के माध्यम से); यदि ''T<sub>H</sub>'' T से काफी ऊँचा होता है, तो T गैस में समान नहीं हो सकता है, इसलिए सिस्टम | * गर्म भंडारण तापमान ''T<sub>H</sub>'' सिस्टम गैस के तापमान T से अत्यल्प रूप से ऊँचा होता है, तो गर्म भंडारण से गैस में ऊष्मीय प्रवाह बिना T को बढ़ाने किया जाता है गैस द्वारा परिसर पर अत्यल्प कार्य के माध्यम से); यदि ''T<sub>H</sub>'' T से काफी ऊँचा होता है, तो T गैस में समान नहीं हो सकता है, इसलिए सिस्टम तापीय समता से अनुतीर्ण होगा और प्रक्रिया पुनरावृत्ति नहीं होगी या T में पर्याप्त वृद्धि हो सकती है, तो यह एक समतापीय प्रक्रिया नहीं होगी। | ||
* चकली पर बाहरी रूप से लागू बल को अत्यल्प रूप से कम करने की आवश्यकता होती है। इस बाहरी सहायता के बिना, यदि एक घन चकली आयतन खंड पर चला जाना संभव नहीं होगा। क्योंकि इस खंड का पालन करना यह मानना होगा कि गैस- चकली बल (दबाव) घटता है जबकि आयतन विस्तार होता है। यदि यह सहायता इतनी मजबूत होती है कि आयतन विस्तार पर्याप्त होता है, तो प्रणाली तापीय समता से अनुतीर्ण हो सकता है और प्रक्रिया पुनरावृत्ति नहीं होगी। | * चकली पर बाहरी रूप से लागू बल को अत्यल्प रूप से कम करने की आवश्यकता होती है। इस बाहरी सहायता के बिना, यदि एक घन चकली आयतन खंड पर चला जाना संभव नहीं होगा। क्योंकि इस खंड का पालन करना यह मानना होगा कि गैस- चकली बल (दबाव) घटता है जबकि आयतन विस्तार होता है। यदि यह सहायता इतनी मजबूत होती है कि आयतन विस्तार पर्याप्त होता है, तो प्रणाली तापीय समता से अनुतीर्ण हो सकता है और प्रक्रिया पुनरावृत्ति नहीं होगी। | ||
| Line 159: | Line 154: | ||
{{Thermodynamic cycles|state=uncollapsed}} | {{Thermodynamic cycles|state=uncollapsed}} | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:CS1 maint]] | |||
[[Category: | [[Category:Chemistry sidebar templates]] | ||
[[Category:Collapse templates]] | |||
[[Category:Created On 18/01/2023]] | [[Category:Created On 18/01/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Mechanics templates]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with reference errors]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Physics sidebar templates]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Translated in Hindi]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:थर्मोडायनामिक चक्र]] | |||
Latest revision as of 13:23, 3 November 2023
| थर्मोडायनामिक्स |
|---|
 |
कार्नोट चक्र 1824 में फ्रांसीसी भौतिक विज्ञानी निकोलस लियोनार्ड सादी कार्नोट द्वारा प्रस्तावित एक आदर्श ऊष्मागतिकी चक्र है और 1830 और 1840 के दशक में दूसरों द्वारा विस्तारित किया गया। कार्नोट के सिद्धांत के अनुसार, यह किसी भी पारम्परिक ऊष्मागतिकी इंजन की प्रदर्शकता के ऊपरी सीमा प्रदान करता है जब वह ऊष्मा को कार्य में परिवर्तित करता है, या उल्टा, एक प्रशीतन प्रणाली की प्रदर्शकता को जब वह कार्य को प्रणाली पर लागू करके तापमान मे अंतर करता है।
कार्नोट चक्र में,एक प्रणाली या इंजन एक ऊष्मीय भंडारण और एक शीतल भंडारण के मध्य ऊष्मा के रूप में ऊर्जा स्थानांतरित करती है, जिसे गर्म और शीत भंडारण के रूप में कहा जाता है, और इस स्थानांतरित ऊर्जा का एक भाग प्रणाली द्वारा किये गए कार्य में परिवर्तित होता है। यह चक्र परिवर्तनीय होता है, और भेदक उत्पन्न नहीं होता है। दूसरे शब्दों में, भेदक संरक्षित होता है; भेदक केवल ऊष्मा भंडारणों और प्रणाली के मध्य स्थानांतरित होता है और उसमें बढ़ोतरी या हानि नहीं होती है। जब प्रणाली पर कार्य लागू किया जाती है, तो ऊष्मा शीतल भंडारण से गर्म भंडारण में स्थानांतरित होती है, जिससे प्रणाली पर्यावरण पर कार्य करती है। प्रति कार्नोट चक्र में पर्यावरण के द्वारा किया गया कार्य प्राथमिकता रखता है, जो ऊष्मा भंडारणों के तापमानों और गर्म भंडारण से प्रणाली में स्थानांतरित भेदक के अनुसार होता है,जहां
, है जहां प्रति कार्नोट चक्र गर्म भंडारण से प्रणाली में स्थानांतरित ऊष्मा है।
| External video | |
|---|---|
चरण
एक ऊष्मा इंजन (कार्नोट ऊष्मा इंजन) द्वारा निष्पादित एक आदर्श ऊष्मागतिकी चक्र के रूप में एक कार्नोट चक्र में निम्नलिखित चरण होते हैं।
- समतापीय विस्तार. ऊष्मा स्थिर तापमान TH पर गर्म तापमान भंडार से विपरीत रूप से TH से कम तापमान पर गैस में स्थानांतरित की जाती है गैस के तापमान को व्यावहारिक रूप से बदले बिना गैस में ऊष्मा हस्तांतरण की अनुमति देने के लिए समतापीय ऊष्मा जोड़ या अवशोषण किया जाता है। इस चरण के समय, गैस को गर्म तापमान वाले भंडार के साथ तापीय रूप से संपर्क में रखा जाता है और गैस को कार्य करते हुए विस्तार करने की अनुमति दी जाती है पिस्टन को ऊपर की ओर धकेलने वाली गैस द्वारा परिवेश पर (चरण 1 चित्र, दाएँ)। यद्यपि दबाव बिंदु 1 से 2 (चित्र 1) तक गिरता है, प्रक्रिया के समय गैस का तापमान नहीं बदलता है क्योंकि गर्म तापमान भंडार से गैस में स्थानांतरित ऊष्मा का उपयोग गैस द्वारा परिवेश पर कार्य करने के लिए किया जाता है, इसलिए कोई गैस आंतरिक ऊर्जा परिवर्तन नहीं होता है, ऊष्मा QH > 0 गर्म तापमान भंडार से अवशोषित होती है, जिसके परिणामस्वरूप की मात्रा से गैस की एन्ट्रापी में वृद्धि होती है।
- गैस की इसेंट्रोपिक (परावर्तनीय अधित्यापक) प्रसारण (इसेंट्रोपिक कार्याकारी उत्पादन)। इस चरण के लिए (चित्र 1 में 2 से 3, चित्र 2 में B से C) इंजन में गैस गर्म और ठंडे संग्रह क्षेत्रों से ऊष्मीय रूप से अलग है, इसलिए उन्हें न तो ऊष्मा मिलती है और न ही उन्हें ऊष्मा खोती है, इसे 'अधित्यापक' प्रक्रिया कहा जाता है। गैस अपने दबाव में कमी के साथ फैलती रहती है, तथा परिवेश पर कार्य करती है, और किए गए कार्य के बराबर आंतरिक ऊर्जा की मात्रा खत्म कर देती है। ऊष्मा इनपुट के बिना गैस के विस्तार के कारण गैस "ठंडे" तापमान तक ठंडी हो जाती है, जो ठंडे जलाशय के तापमान TC से असीम रूप से अधिक है। एन्ट्रापी अपरिवर्तित रहती है क्योंकि प्रणाली और उसके परिवेश के मध्य कोई ऊष्मा Q स्थानांतरण (Q = 0) नहीं होता है, इसलिए यह एक समएंट्रापी प्रक्रिया है, जिसका अर्थ है प्रक्रिया में कोई एन्ट्रापी परिवर्तन नहीं होता है।
- समतापीय संपीड़न स्थिर तापमान TC पर ऊष्मा विपरीत रूप से कम तापमान वाले जलाशय में स्थानांतरित हो जाती है। इस चरण में (चित्र 1 पर 3 से 4, चित्र 2 पर सी से डी), इंजन में गैस तापमान TC पर ठंडे जलाशय के साथ तापीय संपर्क में है जबकि गर्म तापमान जलाशय से तापीय रूप से अलग किया गया है) और गैस का तापमान है इस तापमान से असीम रूप से अधिक व्यावहारिक रूप से गैस तापमान को बदले बिना गैस से ठंडे जलाशय में ऊष्मा हस्तांतरण की अनुमति देते है। तथा परिवेश गैस पर कार्य करता है,और पिस्टन को नीचे धकेलता है। इस कार्य से गैस द्वारा अर्जित ऊर्जा की मात्रा ऊष्मा ऊर्जा QC <0 के रूप में ठंडे जलाशय में स्थानांतरित हो जाती है, इसलिए प्रणाली की एन्ट्रापी मात्रा से कम हो जाती है। क्योंकि समतापीय संपीड़न से गैस की बहुलता कम हो जाती है।
- समएंट्रापी संपीड़न। (चित्र 1 पर 4 से 1, चित्र 2 पर डी से ए) एक बार फिर इंजन में गैस को गर्म और ठंडे जलाशयों से तापीय रूप से इन्सुलेट किया जाता है, और इंजन को घर्षण रहित माना जाता है और प्रक्रिया अत्यधिक धीमी होती है, इसलिए प्रतिवर्ती होती है। इस चरण के समय, परिवेश गैस पर कार्य करता है, पिस्टन को और नीचे धकेलता है (चरण 4 चित्र, दाएं), इसकी आंतरिक ऊर्जा को बढ़ाता है, इसे संपीड़ित करता है, और इसके तापमान को केवल TH से असीम रूप से कम तापमान तक बढ़ा देता है। सिस्टम में कार्य जोड़ा गया, लेकिन एन्ट्रापी अपरिवर्तित रहती है। इस बिंदु पर गैस उसी स्थिति में है जो चरण 1 के प्रारंभ में थी।
इस विषय में, चूंकि यह एक प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स) ऊष्मागतिकी चक्र है प्रणाली में कोई शुद्ध परिवर्तन नहीं है और प्रति चक्र इसके आसपास है[1][2]
दबाव-आयतन आरेख
जब एक कार्नोट चक्र को दबाव-आयतन आरेख पर प्लॉट किया जाता है (आकृति 1), चरण कार्यशील तरल पदार्थ के लिए समतापीय रेखाओ का अनुसरण करते हैं,
स्थिरोष्म चरण समतापी के मध्य चलते हैं, और पूर्ण चक्र पथ से घिरा क्षेत्र कुल कार्य का प्रतिनिधित्व करता है जो एक चक्र के समय किया जा सकता है। बिंदु 1 से 2 और बिंदु 3 से 4 तक तापमान स्थिर ( है। बिंदु 4 से 1 और बिंदु 2 से 3 तक ऊष्मा का स्थानांतरण शून्य के बराबर है।
गुण और महत्व
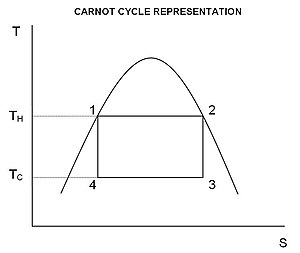
तापमान-एन्ट्रॉपी आरेख


QC (ठंडे संग्रहालय को खो दी गई ऊर्जा) को सीधे घटाने के रूप में देखा जा सकता है, या एक नकारात्मक मात्रा के योग के रूप में व्यक्त किया जा सकता है, जो विभिन्न साधारण को ले जा सकता है।
कार्नोट इंजन या प्रशीतक के व्यवहार को तापमान-एन्ट्रॉपी आरेख (टी-एस आरेख) का उपयोग करके सबसे अच्छी तरह से समझा जाता है, जिसमें ऊष्मागतिकी स्थिति को क्षैतिज अक्ष और तापमान के रूप में एंट्रॉपी (एस) के साथ आरेख पर एक बिंदु द्वारा निर्दिष्ट किया जाता है ( टी) ऊर्ध्वाधर अक्ष के रूप में ((चित्र 2). एक साधारण बंद प्रणाली के लिए, आरेख पर कोई भी बिंदु प्रणाली की एक विशेष स्थिति का प्रतिनिधित्व करता है। प्रारंभिक अवस्था (A) और अंतिम अवस्था (B) को जोड़ने वाले वक्र द्वारा एक ऊष्मागतिकी प्रक्रिया का प्रतिनिधित्व किया जाता है। वक्र के अंतर्गत क्षेत्र है:
-
(1)
यदि प्रक्रिया प्रणाली को अधिक भेदक की ओर ले जाती है, तो वक्र के नीचे क्षेत्र उस प्रक्रिया में प्रणाली द्वारा शोषित ऊष्मा की मात्रा होती है; अन्यथा, यह प्रक्रिया में से निकाली गई या प्रणाली से बाहर निकलने वाली ऊष्मा की मात्रा होती है। किसी भी चक्रीय प्रक्रिया के लिए, चक्र का एक ऊपरी भाग और एक निचला भाग होता है। टी-एस आरेखणों में एक घड़े की दिशा में चक्रीय प्रक्रिया के लिए, ऊचे भाग के नीचे का क्षेत्र प्रक्रिया के समय प्रणाली द्वारा शोषित ऊर्जा को दर्शाता है, जबकि निचले भाग के नीचे का क्षेत्र प्रक्रिया के समय प्रणाली से हटाई गई ऊर्जा को दर्शाता है। चक्र के अंदर का क्षेत्र तब दोनों के मध्य का अंतर है, चूंकि प्रणाली की आंतरिक ऊर्जा अपने प्रारंभिक मूल्य पर पुनरावर्तित हो जाती है, यह अंतर प्रणाली द्वारा प्रति चक्र किए गए कार्य की मात्रा होती है। प्रतिवर्ती प्रक्रिया के लिए, गणितीय रूप से चित्र 1, का संदर्भ लेते हुए, हम एक चक्रीय प्रक्रिया पर किए गए कार्य की मात्रा को इस प्रकार लिख सकते हैं:
-
(2)
चूँकि डीयू एक सटीक परिशिष्ट है, तो किसी भी बंद लूप पर इसकी समाकलनिका शून्य होती है, और इससे प्राप्त होता है कि टी-एस आरेखण पर लूप के अंदरीकृत क्षेत्र उस प्रणाली द्वारा पर्यावरण पर संपूर्ण कार्य के बराबर होता है, यदि लूप को दक्षिणावर्त दिशा मे पार किया जाता है, तो परिवेश द्वारा प्रणाली पर किए गए कुल कार्य के बराबर है क्योंकि लूप वामावर्त दिशा में घूमता है।
कार्नोट चक्र
उपरोक्त समाकलित का मूल्यांकन कार्नोट चक्र के लिए विशेष रूप से सरल है। कार्य के रूप में स्थानांतरित ऊर्जा की मात्रा है
-
(3)
जहाँ पे
- W प्रणाली द्वारा किया गया कार्य है
- <0 प्रणाली से ली गई ऊष्मा है ऊष्मा ऊर्जा प्रणाली को छोड़ती है,
- > 0 प्रणाली में डाली गई ऊष्मा है (प्रणाली में प्रवेश करने वाली ऊष्मा ऊर्जा),
- ठंडे जलाशय का पूर्ण तापमान है, और
- गर्म जलाशय का पूर्ण तापमान है।
- अधिकतम प्रणाली एन्ट्रापी है
- न्यूनतम प्रणाली एन्ट्रापी है
ऊपर दिए गए भेदकता संबंधित निरूपण से इस रूप में एक अभिव्यक्ति प्राप्त की जा सकती है: गर्म भंडारण का तापमान है :
और . तब से , के लिए .अंतिम अभिव्यक्ति में एक ऋण चिह्न प्रकट होता है .
यह कार्नोट ऊष्मा इंजन की कार्य क्षमता की परिभाषा है जिसमें प्रणाली द्वारा किया गया कार्य प्रति चक्र में गर्म भंडारण से प्राप्त ऊष्मिक ऊर्जा के अनुपात के रूप में प्रकट होती है। यह ऊष्मिक ऊर्जा प्रणाली का चक्र प्रारंभ करने वाली ऊर्जा होती है
विपरीत कार्नोट चक्र
एक कार्नोट ऊष्मा-इंजन चक्र विवरणित करता है जो पूर्णतः पुनर्वर्तनीय चक्र है। अर्थात, इसका सभी प्रक्रियाएँ पुनर्वर्तित की जा सकती हैं, जिसके परिणामस्वरूप यह कार्नोट ऊष्मा पंप और शीतलन चक्र बन जाता है। इस बार, चक्र ठीक वैसा ही रहता है, केवल इसका गर्म और कार्य संवेदनों की दिशाओं को पलट दिया जाता है। निम्न-तापमान भंडारण से ऊष्मा अवशोषित की जाती है, उच्च-तापमान भंडारण को ऊष्मा प्रदान की जाती है, और इस सब को साधने के लिए कार्य प्रविष्टि की जाती है। पुनर्वर्तित कार्नोट चक्र का पी-वी आरेख कार्नो ऊष्मा-इंजन चक्र के लिए ही होता है, केवल प्रक्रियाओं की दिशाएँ पलटी जाती हैं।[3]
कार्नोट का प्रमेय
उपरोक्त आरेख से यह देखा जा सकता है कि तापमान के मध्य चलने वाले किसी भी चक्र के लिए और , कोई भी कार्नोट चक्र की दक्षता से अधिक नहीं हो सकता।

कार्नोट की प्रमेय इस तथ्य का एक औपचारिक कथन है: दो ताप जलाशयों के मध्य चलने वाला कोई भी इंजन उन्हीं जलाशयों के मध्य चलने वाले कार्नोट इंजन की तुलना में अधिक कुशल नहीं हो सकता है। इस प्रकार, समीकरण 3 इसी तापमान का उपयोग करके किसी भी इंजन के लिए अधिकतम संभव दक्षता देता है। कार्नोट के प्रमेय के परिणाम में कहा गया है कि: समान ताप जलाशयों के मध्य कार्य करने वाले सभी उत्क्रमणीय इंजन समान रूप से कुशल होते हैं। समीकरण के दाहिने भाग को पुनर्व्यवस्थित करने से समीकरण का अधिक सरलता से समझा जाने वाला रूप हो सकता है, अर्थात् ताप इंजन की सैद्धांतिक अधिकतम दक्षता गर्म जलाशय के पूर्ण तापमान से विभाजित गर्म और ठंडे जलाशय के मध्य तापमान में अंतर के बराबर होती है। इस सूत्र को देखने पर एक रोचक तथ्य स्पष्ट हो जाता है।: ठंडे जलाशय के तापमान को कम करने से ताप इंजन की छत दक्षता पर अधिक प्रभाव पड़ता है, उसी मात्रा में गर्म जलाशय के तापमान को बढ़ाने से। वास्तविक दुनिया में, इसे हासिल करना मुश्किल हो सकता है क्योंकि ठंडा जलाशय प्रायः उपस्थित परिवेश का तापमान होता है।
दूसरे शब्दों में, अधिकतम दक्षता तभी प्राप्त की जाती है यदि एंट्रॉपी प्रति चक्र नहीं बदलती है। चक्र प्रति चक्र में एंट्रोपी परिवर्तन होता है, उदाहरण के लिए, यदि घर्षण होती है और कार्य को ऊष्मा में विपथन में बदल दिया जाता है। उस मामले में, चक्र पुनर्वर्ती नहीं होता है और क्लॉसियस प्रमेय के सिद्धांत में अतिरिक्त असमानता होती है, क्योंकि एंट्रोपी एक क्षेत्रीय आवेश है, इसलिए अतिरिक्त एंट्रोपी को नष्ट करने के लिए पर्यावरण में ऊष्मा को छोड़ना आवश्यक होता है, जिससे न्यूनतम क्षमता में कमी होती है। इसलिए, समीकरण 3 किसी भी पुनर्वर्ती ऊष्मा इंजन की क्षमता देता है।
मेसोस्कोपिक ऊष्मा इंजनों में, सामान्य रूप से संचालन प्रति चक्र में कार्य तापीय शोर के कारण बदलता रहता है। यदि चक्र को क्वासी-स्थिरता से पूरा किया जाता है, तो तरंगों का अभाव हो जाता है। [4] यद्यपि, चक्र कार्य करने का समय कार्य करने वाले माध्यम के संतुलन के समय से तेज होता है, तो कार्य के अस्थिरता अपरिहार्य होती है। जब कार्य और ऊष्मा की अस्थिरता को गणना की जाती है, एक सटीक समानता होती है जो किसी भी ऊष्मा इंजन द्वारा किये गए कार्य के अभिवर्तीय औसत को गर्म ऊष्मा से ऊष्मा संचार से जोड़ती है।[5]
वास्तविक ताप इंजन की क्षमता
कार्नोट ने महसूस किया कि, वास्तव में, एक ऊष्मा पुनर्वर्ती इंजन बनाना संभव नहीं है। इसलिए, वास्तविक ऊष्मा इंजन इसके फलस्वरूप समीकरण 3 द्वारा दिखाए गए से भी कम दक्ष होते हैं।इसके अतिरिक्त, कार्नोट चक्र के विधियों से संचालित वास्तविक इंजन अत्यंत दुर्लभ होते हैं यद्यपि, समीकरण 3 एक अत्यंत उपयोगी साधक है जो दिए गए तापीय जलाशय के लिए कभी भी अपेक्षित सर्वोच्च क्षमता का निर्धारण करने में मदद करता है।
यद्यपि कार्नोट का चक्र एक आदर्शीकरण है, समीकरण 3 क्योंकि कार्नोट दक्षता की अभिव्यक्ति अभी भी उपयोगी है। औसत तापमान पर विचार करें,
कार्नोट चक्र के लिए, या उसके समकक्ष के लिए, औसत मान ⟨TH⟩ सबसे ऊचा उपलब्ध तापमान, अर्थात TH के बराबर होगा, और ⟨TC⟩ सबसे निचला, अर्थात TC के बराबर होगा। अन्य कम क्षमता वाले ऊष्मागतिकी चक्रों के लिए, TH से कम होगा और TC से अधिक होगा।. यह समझाने में मदद कर सकता है, उदाहरण के लिए, क्यों एक अर्थशास्त्री या पुनर्योजी हीट एक्सचेंजर भाप बिजली संयंत्रों की तापीय दक्षता में सुधार कर सकता है और क्यों संयुक्त-चक्र बिजली संयंत्रों की तापीय दक्षता से अधिक है पारंपरिक भाप संयंत्र डीजल इंजन का पहला प्रोटोटाइप कार्नोट चक्र पर आधारित था।
एक अव्यावहारिक स्थूलदर्शीय निर्माण के रूप में कार्नोट ताप इंजन
एक कार्नोट ताप इंजन एक ऊष्मा इंजन है जो एक कार्नोट चक्र का प्रदर्शन करता है, और स्थूलदर्शीय पैमाने पर इसकी प्राप्ति अव्यावहारिक है। उदाहरण के लिए, कार्नोट चक्र के समतापीय प्रक्रिया भाग के लिए, विस्तार में प्रत्येक चरण पर एक साथ निम्नलिखित नियमों को पूरा किया जाता है:[6]
- गर्म भंडारण तापमान TH सिस्टम गैस के तापमान T से अत्यल्प रूप से ऊँचा होता है, तो गर्म भंडारण से गैस में ऊष्मीय प्रवाह बिना T को बढ़ाने किया जाता है गैस द्वारा परिसर पर अत्यल्प कार्य के माध्यम से); यदि TH T से काफी ऊँचा होता है, तो T गैस में समान नहीं हो सकता है, इसलिए सिस्टम तापीय समता से अनुतीर्ण होगा और प्रक्रिया पुनरावृत्ति नहीं होगी या T में पर्याप्त वृद्धि हो सकती है, तो यह एक समतापीय प्रक्रिया नहीं होगी।
- चकली पर बाहरी रूप से लागू बल को अत्यल्प रूप से कम करने की आवश्यकता होती है। इस बाहरी सहायता के बिना, यदि एक घन चकली आयतन खंड पर चला जाना संभव नहीं होगा। क्योंकि इस खंड का पालन करना यह मानना होगा कि गैस- चकली बल (दबाव) घटता है जबकि आयतन विस्तार होता है। यदि यह सहायता इतनी मजबूत होती है कि आयतन विस्तार पर्याप्त होता है, तो प्रणाली तापीय समता से अनुतीर्ण हो सकता है और प्रक्रिया पुनरावृत्ति नहीं होगी।
ये "अत्यल्प" आवश्यकताएं कर्नोट चक्र को अनंत समय लेने के लिए बनाती हैं। कर्नोट चक्र को प्रारम्भिक रूप से अनुभव कराने के लिए अन्य व्यावहारिक आवश्यकताएं भी होती हैं, जैसे गैस को संचालित करने का तंत्र, पर्यावरण के साथ तापीय संपर्क जिसमें उच्च और निम्न तापमान रखे जाते हैं। इसलिए, कर्नोट इंजन को व्यापक स्तर पर वाणिज्यिक यंत्र के रूप में नहीं बल्कि सिद्धांतिक सीमा के रूप में समझना चाहिए, जिसे कभी निर्मित किया जा सकने वाला एक प्राकृतिक उपकरण कहा जा सकता है।
यह भी देखें
- कार्नोट हीट इंजन
- प्रतिवर्ती प्रक्रिया (ऊष्मागतिकी्स)
संदर्भ
- Notes
- ↑ Fermi, E. (1956). "equation 64". Thermodynamics (PDF). Dover Publications. p. 48.
- ↑ 2.0 2.1 Cite error: Invalid
<ref>tag; no text was provided for refs namedPlanckBook - ↑ Çengel, Yunus A., and Michael A. Boles. Thermodynamics: An Engineering Approach. 7th ed. New York: McGraw-Hill, 2011. p. 299. Print.
- ↑ Holubec Viktor and Ryabov Artem (2018). "Cycling Tames Power Fluctuations near Optimum Efficiency". Phys. Rev. Lett. 121 (12): 120601. arXiv:1805.00848. Bibcode:2018PhRvL.121l0601H. doi:10.1103/PhysRevLett.121.120601. PMID 30296120. S2CID 52943273.
- ↑ N. A. Sinitsyn (2011). "Fluctuation Relation for Heat Engines". J. Phys. A: Math. Theor. 44 (40): 405001. arXiv:1111.7014. Bibcode:2011JPhA...44N5001S. doi:10.1088/1751-8113/44/40/405001. S2CID 119261929.
- ↑ D, Bob (2020-01-15). "In the isothermal expansion phase of a Carnot cycle, why does the gas expand?". StackExchange. Retrieved 2022-01-02.
{{cite web}}: CS1 maint: url-status (link)
- Sources
-
- Carnot, Sadi, Reflections on the Motive Power of Fire
- Ewing, J. A. (1910) The Steam-Engine and Other Engines edition 3, page 62, via Internet Archive
- Feynman, Richard P.; Leighton, Robert B.; Sands, Matthew (1963). The Feynman Lectures on Physics. Addison-Wesley Publishing Company. pp. Chapter 44. ISBN 978-0-201-02116-5.
- Halliday, David; Resnick, Robert (1978). Physics (3rd ed.). John Wiley & Sons. pp. 541–548. ISBN 978-0-471-02456-9.
- Kittel, Charles; Kroemer, Herbert (1980). Thermal Physics (2nd ed.). W. H. Freeman Company. ISBN 978-0-7167-1088-2.
- Kostic, M (2011). "Revisiting The Second Law of Energy Degradation and Entropy Generation: From Sadi Carnot's Ingenious Reasoning to Holistic Generalization". AIP Conf. Proc. AIP Conference Proceedings. 1411 (1): 327–350. Bibcode:2011AIPC.1411..327K. CiteSeerX 10.1.1.405.1945. doi:10.1063/1.3665247. American Institute of Physics, 2011. ISBN 978-0-7354-0985-9. Abstract at: [1]. Full article (24 pages [2]), also at [3].
बाहरी कड़ियाँ
- Hyperphysics article on the Carnot cycle.
- S. M. Blinder Carnot Cycle on Ideal Gas powered by Wolfram Mathematica