विकर्ण संबंध: Difference between revisions
No edit summary |
m (added Category:Vigyan Ready using HotCat) |
||
| Line 28: | Line 28: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 19/05/2023]] | [[Category:Created On 19/05/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 09:21, 8 June 2023
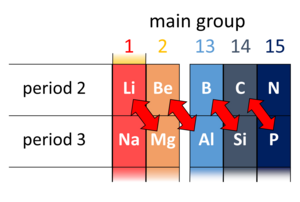
रसायन विज्ञान में, आवर्त सारणी के दूसरे और तीसरे आवर्त (पहले 20 तत्व) में तिरछे आसन्न रासायनिक तत्वों के कुछ जोड़े के बीच विकर्ण संबंध उपस्थित है। ये जोड़े (लिथियम (Li) और मैगनीशियम (Mg), बेरिलियम (Be) और एल्यूमीनियम (Al), बोरॉन (B) और सिलिकॉन (Si), आदि) समान गुण प्रदर्शित करते हैं; उदाहरण के लिए, बोरॉन और सिलिकॉन दोनों अर्धचालक हैं, जो हलाइड्स बनाते हैं, जो पानी में हाइड्रोलाइज्ड होते हैं और अम्लीय ऑक्साइड होते हैं।
आवर्त सारणी पर तत्वों का क्षैतिज पंक्तियों और ऊर्ध्वाधर स्तंभों में संगठन कुछ संबंधों को अधिक स्पष्ट करता है (आवर्त नियम)। आवर्त सारणी के दाहिनी ओर जाने और नीचे उतरने से पृथक परमाणुओं के परमाणु त्रिज्या पर विपरीत प्रभाव पड़ता है। आवर्त में दायीं ओर जाने पर परमाणुओं की परमाणु त्रिज्या कम हो जाती है, जबकि समूह में नीचे जाने पर परमाणु त्रिज्या बढ़ जाती है।[1]
इसी प्रकार, आवर्त के दायीं ओर जाने पर तत्व उत्तरोत्तर अधिक सहसंयोजक होते जाते हैं, कम क्षारकीय और अधिक वैद्युतीयऋणात्मकता होते हैं, जबकि समूह में नीचे जाने पर तत्व अधिक आयनिक, अधिक क्षारकीय और कम विद्युतऋणात्मक हो जाते हैं। इस प्रकार, आवर्त में अवरोही होने और तत्व द्वारा समूह को पार करने पर, परिवर्तन एक दूसरे को रोक कर देते हैं, और समान रसायन वाले समान गुणों वाले तत्व अधिकांशतः पाए जाते हैं - परमाणु आकार, इलेक्ट्रोनगेटिविटी, विकर्ण सदस्यों के यौगिकों (और आगे) के गुण समान हैं।
यह पाया गया है कि आवर्त 2 तत्व का रसायन अधिकांशतः आवर्त सारणी में उसके दाहिनी ओर स्तंभ के आवर्त 3 के तत्व के रसायन के समान होता है। इस प्रकार, Li के रसायन में तथा Mg के रसायन में समानता है, Be के रसायन में तथा Al के रसायन में समानता है, और B के रसायन में तथा Si के रसायन में समानता है। इन्हें विकर्ण संबंध कहा जाता है। (वे B और Si के बाद ध्यान देने योग्य नहीं हैं।)
विकर्ण संबंधों के अस्तित्व के कारणों को पूरी तरह से समझा नहीं गया है, लेकिन आवेश घनत्व कारक है। उदाहरण के लिए, Li+ +1 आवेश वाला छोटा धनायन है और +2 आवेश के साथ Mg2+ कुछ बड़ा है, इसलिए दोनों आयनों में से प्रत्येक की आयनिक क्षमता लगभग समान है। परीक्षण से पता चला कि लिथियम का आवेश घनत्व अन्य क्षार धातुओं की तुलना में मैग्नीशियम के बहुत निकट है।[2] Li-Mg जोड़ी (कमरे के तापमान और दबाव के अनुसार) का उपयोग करना:
- मानक परिस्थितियों में ऑक्सीजन के साथ संयुक्त होने पर, Li और Mg केवल सामान्य ऑक्साइड बनाते हैं जबकि Na पेरोक्साइड बनाता है और Na से नीचे की धातुएँ इसके अतिरिक्त सुपरऑक्साइड बनाती हैं।
- Li एकमात्र समूह 1 का तत्व है, जो स्थिर नाइट्राइड, Li3N बनाता है।[3] Mg और साथ ही समूह 2 के अन्य तत्व भी नाइट्राइड बनाते हैं।[3]
- लिथियम कार्बोनेट, फॉस्फेट और फ्लोराइड पानी में कम घुलनशील होते हैं। संबंधित समूह 2 लवण अघुलनशील हैं। (जाली और विलायक ऊर्जा सोचो)।
- Li और Mg दोनों सहसंयोजक ऑर्गेनोमेटैलिक यौगिक बनाते हैं। LiMe और MgMe2 (ग्रिग्नार्ड अभिकर्मक) दोनों मूल्यवान सिंथेटिक अभिकर्मक हैं। अन्य समूह 1 और समूह 2 के अनुरूप आयनिक और अत्यंत प्रतिक्रियाशील हैं (और इसलिए हेरफेर करना जटिल है)।[4]
- Li और Mg दोनों के क्लोराइड विलक्षण (आसपास से नमी को अवशोषित करते हैं) और अल्कोहल (रसायन) और पिरिडीन में घुलनशील होते हैं। लिथियम क्लोराइड, मैग्नीशियम क्लोराइड की तरह (MgCl2·6H2O) हाइड्रेटेड क्रिस्टल LiCl·2H2O से अलग हो जाता है।
- लिथियम कार्बोनेट और मैग्नीशियम कार्बोनेट दोनों अस्थिर हैं और गर्म होने पर संबंधित ऑक्साइड और कार्बन डाइऑक्साइड का उत्पादन कर सकते हैं।
Li-Mg और B-Al संबंधों को संक्रमण तत्वों (जैसे स्कैंडियम) में विस्तारित करने के साथ कार्बन-फास्फोरस और नाइट्रोजन-सल्फर के लिए और विकर्ण समानताएं भी सुझाई गई हैं।[5]
संदर्भ
- ↑ Ebbing, Darrell and Gammon, Steven D. (2009). "Atomic Radius". सामान्य रसायन शास्त्र (PDF) (9th ed.). Houghton Mifflin. pp. 312–314. ISBN 978-0-618-93469-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Rayner-Canham, Geoffrey (22 December 2013). वर्णनात्मक अकार्बनिक रसायन. Overton, Tina (Sixth ed.). New York, NY. ISBN 978-1-4641-2557-7. OCLC 882867766.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ 3.0 3.1 Clark, Jim (2005). "Reactions of the Group 2 Elements with Air or Oxygen". chemguide. Retrieved January 30, 2012.
- ↑ Shriver, Duward (2006). अकार्बनिक रसायन शास्त्र (4th ed.). Oxford University Press. ISBN 978-0199264636. Li/Mg p. 259; Be/Al p. 274; B/Si p. 288.
- ↑ Rayner-Canham, Geoff (2011-07-01). "आवर्त सारणी में आइसोडायगोनलिटी". Foundations of Chemistry (in English). 13 (2): 121–129. doi:10.1007/s10698-011-9108-y. ISSN 1572-8463. S2CID 97285573.