पोम1: Difference between revisions
m (added Category:Vigyan Ready using HotCat) |
|||
| Line 51: | Line 51: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 09/06/2023]] | [[Category:Created On 09/06/2023]] | ||
[[Category:Vigyan Ready]] | |||
Revision as of 10:33, 31 July 2023
| Pom1 | |
|---|---|
| Identifiers | |
| Organism | |
| Symbol | SPAC2F7.03c |
| Entrez | 2541889 |
पोम1 विखंडन खमीर, शिज़ोसैक्रोमाइसेस पोम्बे (एस. पोम्बे ), में एक ध्रुवीयता प्रोटीन काइनेज है,जो कोशिका के सिरों पर स्थानीयकृत होता है और कोशिका विभाजन को नियंत्रित करता है। जैसे-जैसे कोशिका लंबी होती जाती है, इसके बीच में पोम1 का स्तर कम होता जाता है, जिससे समसूत्री विभाजन प्रारम्भ हो जाता है।[1]
इस प्रकार से जीन पोम1 1087 अमीनो अम्ल लंबे प्रोटीन के लिए कोड करता है जिसका प्रोटीन काइनेज प्रांत संभवतः कार्बोक्सिल टर्मिनस पर स्थित होता है।[1] पोम1 एक संकेतन मार्ग को नियंत्रित करता है जिसमें सीडीके 1 सम्मलित होता है और अंततः समसूत्री प्रविष्टि को नियंत्रित करता है।[2] उत्परिवर्ती पोम1 वाली कोशिकाएं एक सेप्टा और विकास क्षेत्र बनाती हैं, परंतु कई असामान्यताएं दिखाती हैं जिनमें सेप्टा का अनुचित स्थान पर होना या अनुचित दिशा में होना, एक छोर पर यादृच्छिक वृद्धि के साथ प्रतिस्थापित द्वि-ध्रुवीय वृद्धि, या विकास अक्ष के अनुचित स्थानीकरण के कारण असामान्य शाखाएं होना सम्मलित हैं।[1][3]
अतः पोम1 एस पोम्बे कोशिका के प्राचीन और नवीन सिरे को अलग करने में महत्वपूर्ण भूमिका निभाता है। सामान्य कोशिका वृद्धि कोशिका के प्राचीन सिरे पर तुरंत प्रारम्भ हो जाती है और नवीन सिरे पर विलंबित होती है।[3] पोम1 उत्परिवर्ती दोनों सिरों पर तत्काल वृद्धि दिखाते हैं। चूंकि पोम1 को नवीन सिरे पर अत्यधिक संकेंद्रित और प्राचीन सिरे से लगभग अनुपस्थित दिखाया गया है, यह अन्य कारकों के साथ एक निरोधात्मक संकेत का भाग है जो नवीन सिरे से तत्काल विकास को रोकता है।[1] पोम1 की अतिअभिव्यक्ति से नवीन विकास सिरों का संरचना भी हो सकती है।[3]
इस प्रकार से पोम1 एक अपेक्षाकृत एकमात्र प्रोटीन काइनेज है क्योंकि एस पोम्बे में इसका निकटतम होमोलॉग मात्र 55% समान है। अन्य जीवों में होमोलोग्स में चूहों में डायर्क, मनुष्यों में डायर्क2 और डायर्क3, एस. सेरेविसिया[4] में याक1पी, और ड्रोसोफिला और मनुष्यों में मिनीब्रेन सम्मलित हैं।[1][5]
कोशिका स्थानीयकरण
इस प्रकार से अंतरावस्था के समय, पोम1 मध्यवर्ती प्रांतस्था नोड्स सहित पूर्ण कोशिका में रहता है। कोशिका विभाजन के समय ध्रुवों पर पोम1 का स्थानीयकरण टी1 और टी2 द्वारा नियंत्रित होता है।[6][7] टी 1 और टी 2 की अनुपस्थिति में, पोम 1 अपनी किनेज़ गतिविधि को बनाए रखता है, परंतु कोशिका के सिरों तक स्थानीयकृत नहीं होता है।[3][7] सूक्ष्मनलिका कोशिका में पोम1 को स्थानीयकृत करने में भी सहयता करते हैं क्योंकि पोम1 निरूपण को सूक्ष्मनलिका वियोजन के परिणामस्वरूप दिखाया गया है।[1] संरचनात्मक रूप से, पोम1 के उत्प्रेरक और गैर-उत्प्रेरक दोनों क्षेत्र कोशिका अंत स्थानीयकरण के लिए आवश्यक हैं।[3]
अतः सीडीआर2, सीडीआर1, वी1, मिड1, और बीएलटी1 प्रोटीन भी अंतरावस्था के समय मध्यवर्ती रूप के नोड पर स्थित होते हैं और माना जाता है कि ये समसूत्री प्रवेश के लिए संकेतन मार्ग का भाग हैं।[2][8] कोशिका मध्य में सीडीआर2 स्थानीयकरण को पोम1 और अन्य संकेतों की अभिव्यक्ति द्वारा नियंत्रित किया जाता है क्योंकि पोम1 उत्परिवर्ती सीडीआर2 को मध्यवर्ती रूप के नोड स्थानीयकरण से कोशिका के आधे भाग तक फैलने की अनुमति देते हैं।[2]
कोशिका आकार और स्थानिक प्रवणता
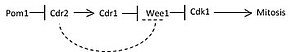
इस प्रकार से पोम1 एक स्थानिक प्रवणता बनाता है क्योंकि कोशिकाएँ पूर्ण जी2 चरण में बढ़ती हैं।[2] चित्र 1 कार्टून के रूप में अंतरावस्था के समय पूर्व एक अपेक्षाकृत छोटे कोशिका और जी2 चरण से गुजरने वाली एक लम्बी कोशिका में पोम 1 (गहन छायांकन द्वारा दिखाया गया) के प्रवणता को दर्शाता है। जैसे-जैसे कोशिकाएँ बढ़ती हैं, पोम1 सांद्रता दो ध्रुवों पर परम पर होती है और कोशिका के केंद्र की ओर कम हो जाती है। अतः सीडीआर2, पोम1 की सांद्रता प्रवणता से घटते निरोधात्मक संकेत को पढ़ता है और सीडीआर1 और बीएलटी1 को सक्रिय करता है जो सीडीआर2 भर्ती के कारण मध्यवर्ती के नोड पर स्थानीयकृत थे।[2] सीडीआर1 फिर फॉस्फोराइलेट करता है और वी1 को रोकता है, जिसे सीडीआर2 की उपस्थिति से मध्यवर्ती के नोड में भी भर्ती किया जाता है।[2] फॉस्फोराइलेटेड वीई1 सीडीसी25 को सीडीके1 को डीफॉस्फोराइलेट करने और कोशिका को समसूत्री विभाजन में ले जाने की अनुमति देता है।[2] इस प्रकार से चित्र 2 इस मॉडल के आधार पर आकार-निर्भर समसूत्री प्रविष्टि के लिए एक सरलीकृत संकेतन मार्ग को दर्शाता है। धराशायी रेखा द्वारा दिखाए गए सीडीआर2 द्वारा सीधे वी1 के निषेध की पुष्टि अभी तक नहीं की गई है।
पोम1 मॉडल के परीक्षण
अतः जीएफपी-टैग किए गए पोम1 को लम्बी कोशिकाओं में एक प्रवणता बनाते हुए दिखाया गया है जैसा कि चित्र 1 में दिखाया गया है। चित्र 2 के अनुसार, मध्यवर्ती के नोड में सीडीआर2 के स्थान पर पोम1 कम होने से सीडीआर2 का निषेध कम हो जाता है। इस मॉडल की अंतःक्रिया की पुष्टि में, परिणाम दिखाते हैं कि डेलोकलाइज़्ड पोम1 वाली कोशिकाएं जो टी1 उत्परिवर्ती से पूर्ण कीनेज गतिविधि को निरंतर रखती हैं, समसूत्री प्रवेश में देरी करती हैं। यह संभवतः सीडीआर2 के निरंतर अवरोध के कारण है।[2] इस प्रकार से आगे के प्रयोगों में, जो पूर्ण आवरण में अस्थानिक रूप से पोम1 को स्थानीयकृत करते हैं, उन्होंने सीडीआर2 अवाघात के बराबर विलंबित समसूत्री प्रवेश भी दिखाया, जिससे एक बार फिर पता चलता है कि पोम1 सीडीआर2 को रोकता है और जैसे ही पोम1 कोशिका बढ़ाव के साथ कम हो जाता है, सीडीआर2 वी1 को बाधित करने और अंततः समसूत्री विभाजन में प्रवेश करने के लिए एक संकेतन मार्ग प्रारम्भ करता है।[2]
भविष्य के अनुसंधान
अतः इस प्रकार से यह स्पष्ट नहीं है कि सीडीआर2 सीधे वी1 को रोकता है या यह मात्र सीडीआर1 या अन्य किनेसेस के माध्यम से अप्रत्यक्ष रूप से कार्य करता है। इसके अतिरिक्त, बीएलटी1, जो मध्यवर्ती के नोड पर भी स्थानीयकृत है, समसूत्री प्रवेश विनियमन में भूमिका निभा सकता है। बीएलटी1 उत्परिवर्ती विलंबित समसूत्री प्रवेश के अनुरूप बढ़ी हुई लंबाई दिखाते हैं।[2] यद्यपि वर्तमान में इसकी पुष्टि नहीं हुई है, परंतु यह अनुमान लगाया गया है कि बीएलटी1 वी1 को रोककर कार्य करता है।[2]
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Bahler, J., and Pringle, J.R. “Pom1p, a fission yeast protein kinase that provides positional information for both polarized growth and cytokinesis.” Genes and Development 12, 1356-1370 (1998).
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 Moseley, J.B., Mayeux, A., Paoletti, A. and Nurse, P. “A spatial gradient coordinates cell size and mitotic entry in fission yeast.” Nature 459, 857-861 (2009).
- ↑ 3.0 3.1 3.2 3.3 3.4 Bahler, J., and Nurse, P. “Fission yeast Pom1p kinase activity is cell cycle regulated and essential for cellular symmetry during growth and division.” The EMBO Journal 20, 1064-1073 (2001).
- ↑ Souza, G.M., Lu, S., and Kuspa, A. “YakA, a protein kinase required for the transition from growth to development in Dictyostelium. Development 125, 2291-2302 (1998).
- ↑ Tejedor, F., Zhu, X.R., Kaltenbach, E., Ackermann, A., Baumann, A., Canal, I., Heisenberg, M., Fischbach, K.F., and Pongs, O. “Minibrain: A new protein kinase family involved in postembryonic neurogenesis in Drosophila. Neuron 14, 287-301 (1995).
- ↑ Browning, H., Hayles, J., Mata, J., Aveline, L., Nurse, P. and McIntosh, J.R. “Tea2p is a kinesin-like protein required to generate polarized growth in fission yeast.” The Journal of Cell Biology 151,15-27 (2000).
- ↑ 7.0 7.1 Behrens, R., and Nurse, P. “Roles of fission yeast tea1p in the localization of polarity factors and in organizing the microtubular cytoskeleton.” The Journal of Cell Biology 157, 783-793 (2002).
- ↑ Morrell, J.L., Nichols, C.B., and Gould, K.L. “The GIN4 family kinase, Cdr2p, acts independently of septins in fission yeast. The Journal of Cell Science 117, 5293-5302 (2004).