क्रोड इलेक्ट्रॉन: Difference between revisions
(Created page with "कोर इलेक्ट्रॉन एक परमाणु में इलेक्ट्रॉन होते हैं जो रासायनिक स...") |
No edit summary |
||
| Line 1: | Line 1: | ||
क्रोड [[इलेक्ट्रॉन]] किसी परमाणु में वे इलेक्ट्रॉन होते हैं जो न ही [[ रासायनिक संयोजन इलेक्ट्रॉन |रासायनिक संयोजन इलेक्ट्रॉन]] होते हैं और न ही [[रासायनिक बंध]]न में भाग लेते हैं।<ref>{{cite journal|title= कोर इलेक्ट्रॉन की परिभाषा|journal= Chemical Physics Letters|date= 2001-12-28|pages= 573–576|volume= 350|issue= 5–6|doi= 10.1016/S0009-2614(01)01345-8|first= Vitaly A|last= Rassolov|first2= John A|last2= Pople|first3= Paul C|last3= Redfern|first4= Larry A|last4= Curtiss|bibcode= 2001CPL...350..573R}}</ref> [[परमाणु नाभिक]] और परमाणु के क्रोड इलेक्ट्रॉन परमाणु क्रोड बनाते हैं। क्रोड इलेक्ट्रॉन नाभिक से कसकर बंधे होते हैं। इसलिए, संयोजी इलेक्ट्रॉनों के विपरीत, क्रोड इलेक्ट्रॉन संयोजी इलेक्ट्रॉनों से परमाणु नाभिक के सकारात्मक आवेश को स्क्रीन करके रासायनिक बंधन और प्रतिक्रियाओं में द्वितीयक भूमिका निभाते हैं।<ref>{{cite book|title= अकार्बनिक रसायन शास्त्र|last= Miessler, Tarr|first= G.L.|publisher= Prentice-Hall|year= 1999}}</ref> | |||
तत्व के | |||
* [[मुख्य समूह तत्व]] | तत्व के संयोजी इलेक्ट्रॉनों की संख्या तत्व के [[समूह (आवर्त सारणी)]] द्वारा निर्धारित की जा सकती है (संयोजी इलेक्ट्रॉन देखें): | ||
* [[संक्रमण धातु]]ओं के लिए, | * [[मुख्य समूह तत्व]] के लिए, संयोजी इलेक्ट्रॉनों की संख्या 1-8 इलेक्ट्रॉनों (ns और np ऑर्बिटल्स) से होती है। | ||
*[[लैंथेनाइड]] और [[एक्टिनाइड]] | * [[संक्रमण धातु]]ओं के लिए, संयोजी इलेक्ट्रॉनों की संख्या 3-12 इलेक्ट्रॉनों (ns और (n−1)d ऑर्बिटल्स) से होती है। | ||
उस तत्व के एक परमाणु के लिए अन्य सभी गैर-संयोजी इलेक्ट्रॉनों को | *[[लैंथेनाइड]] और [[एक्टिनाइड]] के लिए, संयोजी इलेक्ट्रॉनों की संख्या 3-16 इलेक्ट्रॉनों (ns, (n−2)f और (n−1)d ऑर्बिटल्स) तक होती है। | ||
उस तत्व के एक परमाणु के लिए अन्य सभी गैर-संयोजी इलेक्ट्रॉनों को क्रोड इलेक्ट्रॉन माना जाता है। | |||
== कक्षीय सिद्धांत == | == कक्षीय सिद्धांत == | ||
क्रोड और संयोजी इलेक्ट्रॉनों के बीच अंतर का एक अधिक जटिल विवरण परमाण्विक कक्षीय सिद्धांत के साथ वर्णित किया जा सकता है। | |||
किसी एकल इलेक्ट्रॉन वाले परमाणुओं में एक कक्षीय ऊर्जा विशेष रूप से सिद्धांत क्वांटम संख्या n द्वारा निर्धारित की जाती है। n = 1 कक्षा में परमाणु में सबसे कम संभव ऊर्जा होती है। बड़े n के लिए, ऊर्जा इतनी बढ़ जाती है कि इलेक्ट्रॉन परमाणु कक्षा से आसानी से निकल सकता है। एकल इलेक्ट्रॉन परमाणुओं में, समान सिद्धांत क्वांटम संख्या वाले सभी ऊर्जा स्तर पतित होते हैं, और समान ऊर्जा निहित होती है। | |||
एक से अधिक इलेक्ट्रॉन वाले परमाणुओं में, एक इलेक्ट्रॉन की ऊर्जा न केवल उस | एक से अधिक इलेक्ट्रॉन वाले परमाणुओं में, एक इलेक्ट्रॉन की ऊर्जा न केवल उस कक्षा के गुणों पर निर्भर करती है, जिसमें वह घूर्णन करता है, बल्कि अन्य कक्षकों में इलेक्ट्रॉनों के साथ उसकी पारस्परिक क्रिया पर भी निर्भर करता है। इसके लिए ℓ क्वांटम संख्या पर विचार करने की आवश्यकता है। ℓ के उच्च मान ऊर्जा के उच्च मूल्यों से जुड़े हैं; उदाहरण के लिए, 2p अवस्था 2s अवस्था से अधिक है। जब ℓ = 2, कक्षीय की ऊर्जा में वृद्धि इतनी बड़ी हो जाती है कि कक्षा की ऊर्जा को अगले उच्चतर कोश में s-कक्षक की ऊर्जा से ऊपर धकेल दिया जाए; जब ℓ = 3 ऊर्जा को आवर्त में दो कदम ऊपर धकेल दिया जाता है। 3d कक्षकों का भरना तब तक नहीं होता जब तक कि 4s कक्षकों को भर नहीं दिया जाता। | ||
बड़े परमाणुओं में बढ़ती कोणीय गति के उप-भागों के लिए ऊर्जा में वृद्धि इलेक्ट्रॉन-इलेक्ट्रॉन संपर्क प्रभावों के कारण होती है, और यह विशेष रूप से कम कोणीय गति वाले इलेक्ट्रॉनों की नाभिक की ओर अधिक प्रभावी ढंग से प्रवेश करने की क्षमता से संबंधित होती है, जहां वे कम स्क्रीनिंग के अधीन होते हैं। | बड़े परमाणुओं में बढ़ती कोणीय गति के उप-भागों के लिए ऊर्जा में वृद्धि इलेक्ट्रॉन-इलेक्ट्रॉन संपर्क प्रभावों के कारण होती है, और यह विशेष रूप से कम कोणीय गति वाले इलेक्ट्रॉनों की नाभिक की ओर अधिक प्रभावी ढंग से प्रवेश करने की क्षमता से संबंधित होती है, जहां वे हस्तक्षेप करने वाले इलेक्ट्रॉनों के आवेश से कम स्क्रीनिंग के अधीन होते हैं। इस प्रकार, उच्च [[परमाणु संख्या]] वाले परमाणुओं में, इलेक्ट्रॉनों का ℓ उनकी ऊर्जा में अधिक से अधिक एक निर्धारक कारक बन जाता है, और इलेक्ट्रॉनों की प्रमुख क्वांटम संख्या n उनके ऊर्जा नियोजन व्यवस्था में कम और महत्वपूर्ण हो जाती है। पहले 35 उपकोशों (जैसे, 1s, 2s, 2p, 3s, आदि) का ऊर्जा क्रम निम्न तालिका में दिया गया है। प्रत्येक कोश क्रमशः अपनी पंक्ति और स्तंभ सूचकांकों द्वारा दिए गए n और ℓ के साथ एक उपकोश का प्रतिनिधित्व करता है। कोश में निर्धारित संख्या उपकोश क्रम की स्थिति को दर्शाता है। उपकोशों द्वारा व्यवस्थित नीचे दी गई आवर्त सारणी देखें। | ||
[[File:ADOMAH periodic table (horizontal) - electron orbitals.svg|केंद्र|फ्रेमरहित|800x800px|परमाणु कक्षकों द्वारा आयोजित आवर्त सारणी।]] | [[File:ADOMAH periodic table (horizontal) - electron orbitals.svg|केंद्र|फ्रेमरहित|800x800px|परमाणु कक्षकों द्वारा आयोजित आवर्त सारणी।]] | ||
== परमाणु | == परमाणु क्रोड == | ||
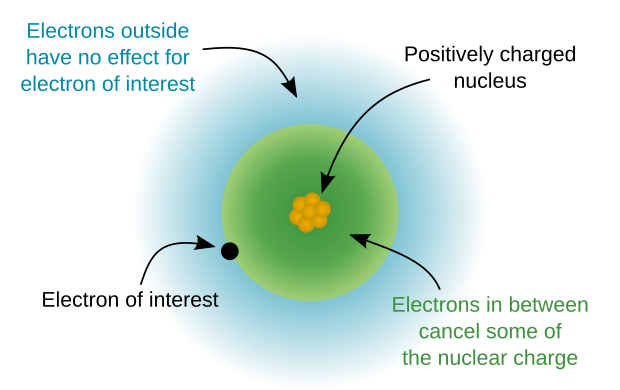
परमाणु | परमाणु क्रोड संयोजी इलेक्ट्रॉनों के बिना एक परमाणु को संदर्भित करता है।<ref>Harald Ibach, Hans Lüth. Solid-State Physics: An Introduction to Principles of Materials Science. Springer Science & Business Media, 2009. P.135</ref> [[परमाणु कोर|परमाणु क्रोड]] में एक सकारात्मक विद्युत आवेश होता है जिसे क्रोड आवेश कहा जाता है और यह बाहरी आवरण इलेक्ट्रॉन द्वारा अनुभव किया जाने वाला प्रभावी परमाणु आवेश है। दूसरे शब्दों में, क्रोड आवेश एक परमाणु के परमाणु क्रोड के संयोजी इलेक्ट्रॉनों द्वारा अनुभव किए गए आकर्षक बल की अभिव्यक्ति है जो क्रोड इलेक्ट्रॉनों के [[परिरक्षण प्रभाव]] को ध्यान में रखता है। क्रोड आवेश की गणना नाभिक (परमाणु संरचना) में [[प्रोटॉन]] की संख्या को घटाकर क्रोड इलेक्ट्रॉनों की संख्या से की जा सकती है, जिसे आंतरिक शेल इलेक्ट्रॉन भी कहा जाता है, और तटस्थ परमाणुओं में सदैव एक सकारात्मक मूल्य होता है। | ||
क्रोड का द्रव्यमान लगभग परमाणु के द्रव्यमान के बराबर होता है। पर्याप्त यथार्थता के साथ परमाणु क्रोड को गोलाकार रूप से सममित माना जा सकता है। क्रोड त्रिज्या संबंधित परमाणु के त्रिज्या से कम से कम तीन गुना छोटा है (यदि हम समान तरीकों से त्रिज्या की गणना करते हैं)। भारी परमाणुओं के लिए, इलेक्ट्रॉनों की बढ़ती संख्या के साथ क्रोड त्रिज्या कुछ बढ़ता है। प्राकृतिक रूप से पाए जाने वाले सबसे भारी तत्व [[यूरेनियम]] के क्रोड की त्रिज्या लिथियम परमाणु की त्रिज्या के बराबर है, हालांकि बाद वाले तत्व में केवल तीन इलेक्ट्रॉन होते हैं। | |||
रासायनिक विधियाँ | रासायनिक विधियाँ क्रोड के इलेक्ट्रॉनों को परमाणु से अलग नहीं कर सकती हैं। लौ या [[पराबैंगनी]] विकिरण द्वारा आयनित होने पर, परमाणु क्रोड, एक नियम के रूप में, बरकरार रहते हैं। | ||
आवर्त सारणी में रुझानों की व्याख्या करने का एक सुविधाजनक तरीका | '''आवर्त सारणी में रुझानों की व्याख्या''' करने का एक सुविधाजनक तरीका क्रोड आवेश है।<ref>{{cite book | last = Spencer | first = James | last2=Bodner|first2=George M.|last3=Rickard|first3=Lyman H.|edition=5th|title = Chemistry : structure and dynamics | publisher = John Wiley & Sons | location = Hoboken, N.J | year = 2012 | isbn = 978-0-470-58711-9 |pages=85–87}}</ref> चूँकि [[आवर्त सारणी]] की एक पंक्ति में आगे बढ़ने पर क्रोड आवेश बढ़ता है, बाहरी खोल के इलेक्ट्रॉनों को नाभिक की ओर अधिक मजबूती से खींचा जाता है और परमाणु त्रिज्या कम हो जाती है। इसका उपयोग कई [[आवधिक प्रवृत्ति]]यों जैसे कि परमाणु त्रिज्या, प्रथम आयनीकरण ऊर्जा (आईई), [[वैद्युतीयऋणात्मकता]] और [[ऑक्सीकरण]] की व्याख्या करने के लिए किया जा सकता है। | ||
क्रोड आवेश की गणना 'परमाणु संख्या' माइनस 'बाहरी शेल में मौजूद सभी इलेक्ट्रॉनों को छोड़कर' के रूप में भी की जा सकती है। उदाहरण के लिए, [[क्लोरीन]] (तत्व 17), इलेक्ट्रॉन विन्यास 1s के साथ<sup>2</sup> 2s<sup>2</sup> 2p<sup>6</sup> 3से<sup>2</sup> 3p<sup>5</sup>, में 17 प्रोटॉन और 10 आंतरिक खोल इलेक्ट्रॉन हैं (2 पहले खोल में, और 8 दूसरे में) इसलिए: | |||
: | : क्रोड आवेश = 17 − 10 = +7 | ||
एक | एक क्रोड आवेश एक नाभिक का शुद्ध आवेश होता है, जो इलेक्ट्रॉनों के पूर्ण [[इलेक्ट्रॉन कवच]] को 'ढाल' के रूप में कार्य करने पर विचार करता है। जैसे-जैसे क्रोड आवेश बढ़ता है, [[अणु की संयोजन क्षमता]] नाभिक की ओर अधिक मजबूती से आकर्षित होते हैं, और अवधि के दौरान परमाणु त्रिज्या घट जाती है। | ||
== सापेक्षतावादी प्रभाव == | == सापेक्षतावादी प्रभाव == | ||
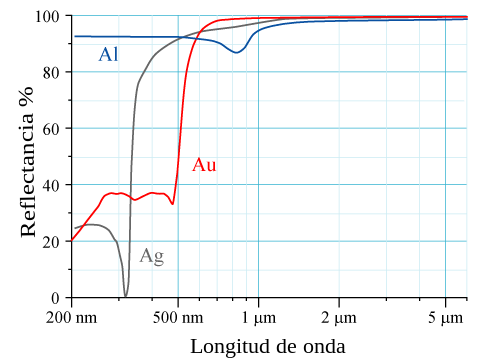
उच्च परमाणु संख्या Z वाले तत्वों के लिए, | उच्च परमाणु संख्या Z वाले तत्वों के लिए, क्रोड इलेक्ट्रॉनों के लिए सापेक्ष प्रभाव देखा जा सकता है। क्रोड s इलेक्ट्रॉनों का वेग आपेक्षिकीय संवेग तक पहुँचता है जो 5d कक्षकों के सापेक्ष 6s कक्षकों के संकुचन की ओर ले जाता है। इन आपेक्षिकीय प्रभावों से प्रभावित भौतिक गुणों में पारे के पिघलने का तापमान कम होना और ऊर्जा अंतराल के कम होने के कारण सोने और [[सीज़ियम]] का सुनहरा रंग देखा जाना शामिल है।<ref>{{cite web|title= क्वांटम प्राइमर|url= http://www.chem1.com/acad/webtut/atomic/qprimer/#Q26|website= www.chem1.com|access-date= 2015-12-11}}</ref> सोना पीला दिखाई देता है क्योंकि यह प्रकाश के अन्य दृश्य तरंग दैर्ध्य को अवशोषित करने की तुलना में नीले प्रकाश को अधिक अवशोषित करता है और इसलिए पीले रंग के प्रकाश को वापस दर्शाता है। | ||
[[File:Image-Metal-reflectance es.svg|सेंटर|फ्रेमलेस|480x480पीएक्स|गोल्ड स्पेक्ट्रम]] | [[File:Image-Metal-reflectance es.svg|सेंटर|फ्रेमलेस|480x480पीएक्स|गोल्ड स्पेक्ट्रम]] | ||
== इलेक्ट्रॉन संक्रमण == | == इलेक्ट्रॉन संक्रमण == | ||
विद्युत चुम्बकीय विकिरण के अवशोषण पर एक | विद्युत चुम्बकीय विकिरण के अवशोषण पर एक क्रोड इलेक्ट्रॉन को उसके क्रोड-स्तर से हटाया जा सकता है। यह या तो इलेक्ट्रॉन को एक खाली संयोजी शेल में उत्तेजित करेगा या [[प्रकाश विद्युत प्रभाव]] के कारण इसे फोटोइलेक्ट्रॉन के रूप में उत्सर्जित करेगा। परिणामी परमाणु के क्रोड इलेक्ट्रॉन खोल में एक खाली जगह होगी, जिसे अक्सर क्रोड-होल कहा जाता है। यह एक मेटास्टेबल अवस्था में है और 10 के भीतर क्षय हो जाएगा<sup>−15</sup> s, [[एक्स-रे प्रतिदीप्ति]] (एक [[विशेषता एक्स-रे]] के रूप में) या ऑग्रे प्रभाव द्वारा अतिरिक्त ऊर्जा जारी करना।<ref>{{GoldBookRef |title=auger effect |file=A00520 }}</ref> कम-ऊर्जा कक्षीय में गिरने वाले संयोजी इलेक्ट्रॉन द्वारा उत्सर्जित ऊर्जा का पता लगाने से सामग्री के इलेक्ट्रॉनिक और स्थानीय जाली संरचनाओं पर उपयोगी जानकारी मिलती है। हालांकि अधिकांश समय यह ऊर्जा एक फोटॉन के रूप में जारी होती है, ऊर्जा को दूसरे इलेक्ट्रॉन में भी स्थानांतरित किया जा सकता है, जो परमाणु से बाहर निकलता है। इस दूसरे उत्सर्जित इलेक्ट्रॉन को ऑगर इलेक्ट्रॉन कहा जाता है और अप्रत्यक्ष विकिरण उत्सर्जन के साथ इलेक्ट्रॉनिक संक्रमण की इस प्रक्रिया को ऑगर प्रभाव के रूप में जाना जाता है।<ref>{{cite web|title= बरमा प्रभाव और अन्य विकिरण रहित संक्रमण|url= http://www.cambridge.org/va/academic/subjects/physics/particle-physics-and-nuclear-physics/auger-effect-and-other-radiationless-transitions?format=PB|website= Cambridge University Press|access-date= 2015-12-11}}</ref> | ||
हाइड्रोजन को छोड़कर प्रत्येक परमाणु में अच्छी तरह से परिभाषित बाध्यकारी ऊर्जा वाले | हाइड्रोजन को छोड़कर प्रत्येक परमाणु में अच्छी तरह से परिभाषित बाध्यकारी ऊर्जा वाले क्रोड-स्तर के इलेक्ट्रॉन होते हैं। इसलिए एक्स-रे ऊर्जा को उपयुक्त अवशोषण किनारे पर ट्यून करके जांच के लिए एक तत्व का चयन करना संभव है। उत्सर्जित विकिरण के स्पेक्ट्रा का उपयोग सामग्री की मौलिक संरचना को निर्धारित करने के लिए किया जा सकता है। | ||
[[File:Effective Nuclear Charge.svg|केंद्र|फ्रेमरहित|620x620px]] | [[File:Effective Nuclear Charge.svg|केंद्र|फ्रेमरहित|620x620px]] | ||
| Line 48: | Line 49: | ||
* [[सापेक्षवादी क्वांटम रसायन]] | * [[सापेक्षवादी क्वांटम रसायन]] | ||
* परिरक्षण प्रभाव | * परिरक्षण प्रभाव | ||
* भूतल | * भूतल क्रोड स्तर बदलाव | ||
*रासायनिक संयोजन इलेक्ट्रॉन | *रासायनिक संयोजन इलेक्ट्रॉन | ||
==संदर्भ== | ==संदर्भ== | ||
{{Reflist}} | {{Reflist}} | ||
[[Category: परमाणु भौतिकी]] [[Category: परमाणु, आणविक और ऑप्टिकल भौतिकी]] [[Category: क्वांटम रसायन]] | [[Category: परमाणु भौतिकी]] [[Category: परमाणु, आणविक और ऑप्टिकल भौतिकी]] [[Category: क्वांटम रसायन]] | ||
Revision as of 16:26, 11 April 2023
क्रोड इलेक्ट्रॉन किसी परमाणु में वे इलेक्ट्रॉन होते हैं जो न ही रासायनिक संयोजन इलेक्ट्रॉन होते हैं और न ही रासायनिक बंधन में भाग लेते हैं।[1] परमाणु नाभिक और परमाणु के क्रोड इलेक्ट्रॉन परमाणु क्रोड बनाते हैं। क्रोड इलेक्ट्रॉन नाभिक से कसकर बंधे होते हैं। इसलिए, संयोजी इलेक्ट्रॉनों के विपरीत, क्रोड इलेक्ट्रॉन संयोजी इलेक्ट्रॉनों से परमाणु नाभिक के सकारात्मक आवेश को स्क्रीन करके रासायनिक बंधन और प्रतिक्रियाओं में द्वितीयक भूमिका निभाते हैं।[2]
तत्व के संयोजी इलेक्ट्रॉनों की संख्या तत्व के समूह (आवर्त सारणी) द्वारा निर्धारित की जा सकती है (संयोजी इलेक्ट्रॉन देखें):
- मुख्य समूह तत्व के लिए, संयोजी इलेक्ट्रॉनों की संख्या 1-8 इलेक्ट्रॉनों (ns और np ऑर्बिटल्स) से होती है।
- संक्रमण धातुओं के लिए, संयोजी इलेक्ट्रॉनों की संख्या 3-12 इलेक्ट्रॉनों (ns और (n−1)d ऑर्बिटल्स) से होती है।
- लैंथेनाइड और एक्टिनाइड के लिए, संयोजी इलेक्ट्रॉनों की संख्या 3-16 इलेक्ट्रॉनों (ns, (n−2)f और (n−1)d ऑर्बिटल्स) तक होती है।
उस तत्व के एक परमाणु के लिए अन्य सभी गैर-संयोजी इलेक्ट्रॉनों को क्रोड इलेक्ट्रॉन माना जाता है।
कक्षीय सिद्धांत
क्रोड और संयोजी इलेक्ट्रॉनों के बीच अंतर का एक अधिक जटिल विवरण परमाण्विक कक्षीय सिद्धांत के साथ वर्णित किया जा सकता है।
किसी एकल इलेक्ट्रॉन वाले परमाणुओं में एक कक्षीय ऊर्जा विशेष रूप से सिद्धांत क्वांटम संख्या n द्वारा निर्धारित की जाती है। n = 1 कक्षा में परमाणु में सबसे कम संभव ऊर्जा होती है। बड़े n के लिए, ऊर्जा इतनी बढ़ जाती है कि इलेक्ट्रॉन परमाणु कक्षा से आसानी से निकल सकता है। एकल इलेक्ट्रॉन परमाणुओं में, समान सिद्धांत क्वांटम संख्या वाले सभी ऊर्जा स्तर पतित होते हैं, और समान ऊर्जा निहित होती है।
एक से अधिक इलेक्ट्रॉन वाले परमाणुओं में, एक इलेक्ट्रॉन की ऊर्जा न केवल उस कक्षा के गुणों पर निर्भर करती है, जिसमें वह घूर्णन करता है, बल्कि अन्य कक्षकों में इलेक्ट्रॉनों के साथ उसकी पारस्परिक क्रिया पर भी निर्भर करता है। इसके लिए ℓ क्वांटम संख्या पर विचार करने की आवश्यकता है। ℓ के उच्च मान ऊर्जा के उच्च मूल्यों से जुड़े हैं; उदाहरण के लिए, 2p अवस्था 2s अवस्था से अधिक है। जब ℓ = 2, कक्षीय की ऊर्जा में वृद्धि इतनी बड़ी हो जाती है कि कक्षा की ऊर्जा को अगले उच्चतर कोश में s-कक्षक की ऊर्जा से ऊपर धकेल दिया जाए; जब ℓ = 3 ऊर्जा को आवर्त में दो कदम ऊपर धकेल दिया जाता है। 3d कक्षकों का भरना तब तक नहीं होता जब तक कि 4s कक्षकों को भर नहीं दिया जाता।
बड़े परमाणुओं में बढ़ती कोणीय गति के उप-भागों के लिए ऊर्जा में वृद्धि इलेक्ट्रॉन-इलेक्ट्रॉन संपर्क प्रभावों के कारण होती है, और यह विशेष रूप से कम कोणीय गति वाले इलेक्ट्रॉनों की नाभिक की ओर अधिक प्रभावी ढंग से प्रवेश करने की क्षमता से संबंधित होती है, जहां वे हस्तक्षेप करने वाले इलेक्ट्रॉनों के आवेश से कम स्क्रीनिंग के अधीन होते हैं। इस प्रकार, उच्च परमाणु संख्या वाले परमाणुओं में, इलेक्ट्रॉनों का ℓ उनकी ऊर्जा में अधिक से अधिक एक निर्धारक कारक बन जाता है, और इलेक्ट्रॉनों की प्रमुख क्वांटम संख्या n उनके ऊर्जा नियोजन व्यवस्था में कम और महत्वपूर्ण हो जाती है। पहले 35 उपकोशों (जैसे, 1s, 2s, 2p, 3s, आदि) का ऊर्जा क्रम निम्न तालिका में दिया गया है। प्रत्येक कोश क्रमशः अपनी पंक्ति और स्तंभ सूचकांकों द्वारा दिए गए n और ℓ के साथ एक उपकोश का प्रतिनिधित्व करता है। कोश में निर्धारित संख्या उपकोश क्रम की स्थिति को दर्शाता है। उपकोशों द्वारा व्यवस्थित नीचे दी गई आवर्त सारणी देखें।
परमाणु क्रोड
परमाणु क्रोड संयोजी इलेक्ट्रॉनों के बिना एक परमाणु को संदर्भित करता है।[3] परमाणु क्रोड में एक सकारात्मक विद्युत आवेश होता है जिसे क्रोड आवेश कहा जाता है और यह बाहरी आवरण इलेक्ट्रॉन द्वारा अनुभव किया जाने वाला प्रभावी परमाणु आवेश है। दूसरे शब्दों में, क्रोड आवेश एक परमाणु के परमाणु क्रोड के संयोजी इलेक्ट्रॉनों द्वारा अनुभव किए गए आकर्षक बल की अभिव्यक्ति है जो क्रोड इलेक्ट्रॉनों के परिरक्षण प्रभाव को ध्यान में रखता है। क्रोड आवेश की गणना नाभिक (परमाणु संरचना) में प्रोटॉन की संख्या को घटाकर क्रोड इलेक्ट्रॉनों की संख्या से की जा सकती है, जिसे आंतरिक शेल इलेक्ट्रॉन भी कहा जाता है, और तटस्थ परमाणुओं में सदैव एक सकारात्मक मूल्य होता है।
क्रोड का द्रव्यमान लगभग परमाणु के द्रव्यमान के बराबर होता है। पर्याप्त यथार्थता के साथ परमाणु क्रोड को गोलाकार रूप से सममित माना जा सकता है। क्रोड त्रिज्या संबंधित परमाणु के त्रिज्या से कम से कम तीन गुना छोटा है (यदि हम समान तरीकों से त्रिज्या की गणना करते हैं)। भारी परमाणुओं के लिए, इलेक्ट्रॉनों की बढ़ती संख्या के साथ क्रोड त्रिज्या कुछ बढ़ता है। प्राकृतिक रूप से पाए जाने वाले सबसे भारी तत्व यूरेनियम के क्रोड की त्रिज्या लिथियम परमाणु की त्रिज्या के बराबर है, हालांकि बाद वाले तत्व में केवल तीन इलेक्ट्रॉन होते हैं।
रासायनिक विधियाँ क्रोड के इलेक्ट्रॉनों को परमाणु से अलग नहीं कर सकती हैं। लौ या पराबैंगनी विकिरण द्वारा आयनित होने पर, परमाणु क्रोड, एक नियम के रूप में, बरकरार रहते हैं।
आवर्त सारणी में रुझानों की व्याख्या करने का एक सुविधाजनक तरीका क्रोड आवेश है।[4] चूँकि आवर्त सारणी की एक पंक्ति में आगे बढ़ने पर क्रोड आवेश बढ़ता है, बाहरी खोल के इलेक्ट्रॉनों को नाभिक की ओर अधिक मजबूती से खींचा जाता है और परमाणु त्रिज्या कम हो जाती है। इसका उपयोग कई आवधिक प्रवृत्तियों जैसे कि परमाणु त्रिज्या, प्रथम आयनीकरण ऊर्जा (आईई), वैद्युतीयऋणात्मकता और ऑक्सीकरण की व्याख्या करने के लिए किया जा सकता है।
क्रोड आवेश की गणना 'परमाणु संख्या' माइनस 'बाहरी शेल में मौजूद सभी इलेक्ट्रॉनों को छोड़कर' के रूप में भी की जा सकती है। उदाहरण के लिए, क्लोरीन (तत्व 17), इलेक्ट्रॉन विन्यास 1s के साथ2 2s2 2p6 3से2 3p5, में 17 प्रोटॉन और 10 आंतरिक खोल इलेक्ट्रॉन हैं (2 पहले खोल में, और 8 दूसरे में) इसलिए:
- क्रोड आवेश = 17 − 10 = +7
एक क्रोड आवेश एक नाभिक का शुद्ध आवेश होता है, जो इलेक्ट्रॉनों के पूर्ण इलेक्ट्रॉन कवच को 'ढाल' के रूप में कार्य करने पर विचार करता है। जैसे-जैसे क्रोड आवेश बढ़ता है, अणु की संयोजन क्षमता नाभिक की ओर अधिक मजबूती से आकर्षित होते हैं, और अवधि के दौरान परमाणु त्रिज्या घट जाती है।
सापेक्षतावादी प्रभाव
उच्च परमाणु संख्या Z वाले तत्वों के लिए, क्रोड इलेक्ट्रॉनों के लिए सापेक्ष प्रभाव देखा जा सकता है। क्रोड s इलेक्ट्रॉनों का वेग आपेक्षिकीय संवेग तक पहुँचता है जो 5d कक्षकों के सापेक्ष 6s कक्षकों के संकुचन की ओर ले जाता है। इन आपेक्षिकीय प्रभावों से प्रभावित भौतिक गुणों में पारे के पिघलने का तापमान कम होना और ऊर्जा अंतराल के कम होने के कारण सोने और सीज़ियम का सुनहरा रंग देखा जाना शामिल है।[5] सोना पीला दिखाई देता है क्योंकि यह प्रकाश के अन्य दृश्य तरंग दैर्ध्य को अवशोषित करने की तुलना में नीले प्रकाश को अधिक अवशोषित करता है और इसलिए पीले रंग के प्रकाश को वापस दर्शाता है।
इलेक्ट्रॉन संक्रमण
विद्युत चुम्बकीय विकिरण के अवशोषण पर एक क्रोड इलेक्ट्रॉन को उसके क्रोड-स्तर से हटाया जा सकता है। यह या तो इलेक्ट्रॉन को एक खाली संयोजी शेल में उत्तेजित करेगा या प्रकाश विद्युत प्रभाव के कारण इसे फोटोइलेक्ट्रॉन के रूप में उत्सर्जित करेगा। परिणामी परमाणु के क्रोड इलेक्ट्रॉन खोल में एक खाली जगह होगी, जिसे अक्सर क्रोड-होल कहा जाता है। यह एक मेटास्टेबल अवस्था में है और 10 के भीतर क्षय हो जाएगा−15 s, एक्स-रे प्रतिदीप्ति (एक विशेषता एक्स-रे के रूप में) या ऑग्रे प्रभाव द्वारा अतिरिक्त ऊर्जा जारी करना।[6] कम-ऊर्जा कक्षीय में गिरने वाले संयोजी इलेक्ट्रॉन द्वारा उत्सर्जित ऊर्जा का पता लगाने से सामग्री के इलेक्ट्रॉनिक और स्थानीय जाली संरचनाओं पर उपयोगी जानकारी मिलती है। हालांकि अधिकांश समय यह ऊर्जा एक फोटॉन के रूप में जारी होती है, ऊर्जा को दूसरे इलेक्ट्रॉन में भी स्थानांतरित किया जा सकता है, जो परमाणु से बाहर निकलता है। इस दूसरे उत्सर्जित इलेक्ट्रॉन को ऑगर इलेक्ट्रॉन कहा जाता है और अप्रत्यक्ष विकिरण उत्सर्जन के साथ इलेक्ट्रॉनिक संक्रमण की इस प्रक्रिया को ऑगर प्रभाव के रूप में जाना जाता है।[7] हाइड्रोजन को छोड़कर प्रत्येक परमाणु में अच्छी तरह से परिभाषित बाध्यकारी ऊर्जा वाले क्रोड-स्तर के इलेक्ट्रॉन होते हैं। इसलिए एक्स-रे ऊर्जा को उपयुक्त अवशोषण किनारे पर ट्यून करके जांच के लिए एक तत्व का चयन करना संभव है। उत्सर्जित विकिरण के स्पेक्ट्रा का उपयोग सामग्री की मौलिक संरचना को निर्धारित करने के लिए किया जा सकता है।
यह भी देखें
- परमाणु कक्षीय
- बरमा प्रभाव
- लैन्थेनाइड संकुचन
- सापेक्षवादी क्वांटम रसायन
- परिरक्षण प्रभाव
- भूतल क्रोड स्तर बदलाव
- रासायनिक संयोजन इलेक्ट्रॉन
संदर्भ
- ↑ Rassolov, Vitaly A; Pople, John A; Redfern, Paul C; Curtiss, Larry A (2001-12-28). "कोर इलेक्ट्रॉन की परिभाषा". Chemical Physics Letters. 350 (5–6): 573–576. Bibcode:2001CPL...350..573R. doi:10.1016/S0009-2614(01)01345-8.
- ↑ Miessler, Tarr, G.L. (1999). अकार्बनिक रसायन शास्त्र. Prentice-Hall.
- ↑ Harald Ibach, Hans Lüth. Solid-State Physics: An Introduction to Principles of Materials Science. Springer Science & Business Media, 2009. P.135
- ↑ Spencer, James; Bodner, George M.; Rickard, Lyman H. (2012). Chemistry : structure and dynamics (5th ed.). Hoboken, N.J: John Wiley & Sons. pp. 85–87. ISBN 978-0-470-58711-9.
- ↑ "क्वांटम प्राइमर". www.chem1.com. Retrieved 2015-12-11.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "auger effect". doi:10.1351/goldbook.A00520
- ↑ "बरमा प्रभाव और अन्य विकिरण रहित संक्रमण". Cambridge University Press. Retrieved 2015-12-11.