संभावित ऊर्जा सतह: Difference between revisions
(Created page with "{{Merge from|Energy landscape|date=February 2023}}{{short description|Function describing the energy of a physical system in terms of certain parameters}} एक संभा...") |
|||
| Line 24: | Line 24: | ||
== आकर्षक और प्रतिकारक सतहें == | == आकर्षक और प्रतिकारक सतहें == | ||
रासायनिक प्रतिक्रियाओं के लिए संभावित ऊर्जा सतहों को अभिकारकों और उत्पादों के सापेक्ष सक्रिय परिसर में बांड की लंबाई के विस्तार की तुलना करके आकर्षक या प्रतिकारक के रूप में वर्गीकृत किया जा सकता | रासायनिक प्रतिक्रियाओं के लिए संभावित ऊर्जा सतहों को अभिकारकों और उत्पादों के सापेक्ष सक्रिय परिसर में बांड की लंबाई के विस्तार की तुलना करके आकर्षक या प्रतिकारक के रूप में वर्गीकृत किया जा सकता है।प्रकार ए + बी-सी → ए-बी + सी की प्रतिक्रिया के लिए, नवगठित ए-बी बांड के लिए बंधन लंबाई विस्तार को आर * के रूप में परिभाषित किया गया है आर, जहां आर संक्रमण अवस्था में A-B बंध लंबाई है और उत्पाद अणु में। इसी प्रकार प्रतिक्रिया में टूटे हुए बंधन के लिए,आर - आर, जहां आर अभिकारक अणु को संदर्भित करता है। | ||
एक्ज़ोथिर्मिक प्रतिक्रियाओं के लिए, एक PES को आकर्षक (या प्रारंभिक-डाउनहिल) के रूप में वर्गीकृत किया जाता है यदि | एक्ज़ोथिर्मिक प्रतिक्रियाओं के लिए, एक PES को आकर्षक (या प्रारंभिक-डाउनहिल) के रूप में वर्गीकृत किया जाता है यदि आर*, ताकि संक्रमण अवस्था तक पहुँच जाए जबकि अभिकारक एक दूसरे के निकट आ रहे हों। संक्रमण अवस्था के बाद, A-B बॉन्ड की लंबाई घटती रहती है, जिससे मुक्त प्रतिक्रिया ऊर्जा का अधिकांश भाग A-B बॉन्ड की [[आणविक कंपन]] ऊर्जा में परिवर्तित हो जाता है। द्वारा उत्पाद अणुओं की कंपन से उत्साहित आबादी का पता लगाया जा सकता है। | ||
प्रतिक्रिया एच + सीएल के लिए पीईएस के विपरीत | प्रतिक्रिया एच + सीएल के लिए पीईएस के विपरीत एचसीएल + सीएल प्रतिकूल (या देर से डाउनहिल) है क्योंकि आर और संक्रमण अवस्था तब पहुँच जाती है जब उत्पाद अलग हो रहे होते हैं।इस प्रतिक्रिया के लिए जिसमें परमाणु ए (यहाँ एच) बी और सी की तुलना में हल्का है, प्रतिक्रिया ऊर्जा मुख्य रूप से उत्पादों की अनुवादिक [[गतिज ऊर्जा]] के रूप में जारी की जाती है। एफ + एच जैसी प्रतिक्रिया के लिए एचएफ + एच जिसमें परमाणु ए बी और सी से भारी है, मिश्रित ऊर्जा रिलीज है, कंपन और अनुवाद दोनों, भले ही पीईएस प्रतिकारक है। | ||
[[एंडोथर्मिक प्रक्रिया]] के लिए, सतह का प्रकार ऊर्जा के प्रकार को निर्धारित करता है जो प्रतिक्रिया करने में सबसे प्रभावी होता है। एक आकर्षक सतह के साथ प्रतिक्रियाओं को प्रेरित करने के लिए अभिकारकों की ट्रांसलेशनल ऊर्जा सबसे प्रभावी होती है, जबकि एक प्रतिकारक सतह के साथ प्रतिक्रियाओं के लिए कंपन उत्तेजना (उच्च आणविक कंपन वी) अधिक प्रभावी होती | [[एंडोथर्मिक प्रक्रिया]] के लिए, सतह का प्रकार ऊर्जा के प्रकार को निर्धारित करता है जो प्रतिक्रिया करने में सबसे प्रभावी होता है। एक आकर्षक सतह के साथ प्रतिक्रियाओं को प्रेरित करने के लिए अभिकारकों की ट्रांसलेशनल ऊर्जा सबसे प्रभावी होती है, जबकि एक प्रतिकारक सतह के साथ प्रतिक्रियाओं के लिए कंपन उत्तेजना (उच्च आणविक कंपन वी) अधिक प्रभावी होती है।बाद के मामले के एक उदाहरण के रूप में, प्रतिक्रिया एफ + एचसीएल (वी = 1) → सीएल + एचएफ एचसीएल की समान कुल ऊर्जा के लिए एफ + एचसीएल (वी = 0) → सीएल + एचएफ से लगभग पांच गुना तेज है। | ||
[[Category:All articles to be merged]] | |||
[[Category:Articles to be merged from February 2023]] | |||
[[Category:Articles with invalid date parameter in template]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 18/05/2023]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
== इतिहास == | == इतिहास == | ||
Revision as of 13:04, 6 June 2023
It has been suggested that Energy landscape be merged into this article. (Discuss) Proposed since February 2023. |
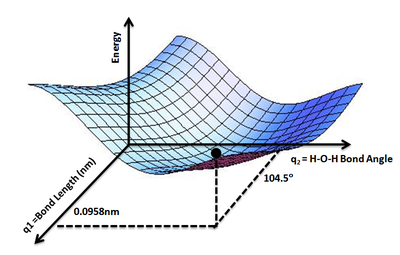
एक संभावित ऊर्जा सतह (पीईएस) एक भौतिक प्रणाली की ऊर्जा का वर्णन करती है, विशेष रूप से परमाणुओं का एक संग्रह, कुछ पैरामीटर के संदर्भ में, आमतौर पर परमाणुओं की स्थिति। भूतल (गणित) ऊर्जा को एक या अधिक निर्देशांकों के फलन (गणित) के रूप में परिभाषित कर सकता है; यदि केवल एक निर्देशांक है, तो सतह को संभावित ऊर्जा वक्र या ऊर्जा प्रोफ़ाइल कहा जाता है। एक उदाहरण मोर्स/लॉन्ग-रेंज क्षमता है।
भूदृश्य की सादृश्यता का उपयोग करना सहायक होता है: स्वतंत्रता की दो डिग्री (भौतिकी और रसायन विज्ञान) (जैसे दो बंधन लंबाई) वाली प्रणाली के लिए, ऊर्जा का मूल्य (सादृश्य: भूमि की ऊंचाई) दो का एक कार्य है बांड की लंबाई (सादृश्य: जमीन पर स्थिति के निर्देशांक)।[1]
पीईएस अवधारणा रसायन विज्ञान और भौतिकी जैसे क्षेत्रों में विशेष रूप से इन विषयों की सैद्धांतिक उप-शाखाओं में आवेदन पाती है। इसका उपयोग सैद्धांतिक रूप से परमाणुओं से बनी संरचनाओं के गुणों का पता लगाने के लिए किया जा सकता है, उदाहरण के लिए, अणु के न्यूनतम ऊर्जा आकार का पता लगाना या रासायनिक प्रतिक्रिया की प्रतिक्रिया दर की गणना करना।
गणितीय परिभाषा और संगणना
परमाणुओं के एक समूह की ज्यामिति को सदिश द्वारा वर्णित किया जा सकता है, r, जिनके तत्व परमाणु स्थितियों का प्रतिनिधित्व करते हैं। सदिश r परमाणुओं के कार्तीय निर्देशांकों का समुच्चय हो सकता है, या अंतर-परमाणु दूरियों और कोणों का समुच्चय भी हो सकता है।
दिया गया r, पदों के कार्य के रूप में ऊर्जा, E(r), का मान है E(r) सभी के लिए r ब्याज की। प्रस्तावना से परिदृश्य सादृश्य का उपयोग करते हुए, ई ऊर्जा परिदृश्य पर ऊंचाई देता है ताकि एक संभावित ऊर्जा सतह की अवधारणा उत्पन्न हो।
परमाणु स्थितियों के एक समारोह के रूप में PES का उपयोग करके एक रासायनिक प्रतिक्रिया का अध्ययन करने के लिए, ब्याज की प्रत्येक परमाणु व्यवस्था के लिए ऊर्जा की गणना करना आवश्यक है। कम्प्यूटेशनल रसायन विज्ञान लेख में परमाणुओं की एक विशेष परमाणु व्यवस्था की ऊर्जा की गणना करने के तरीकों का अच्छी तरह से वर्णन किया गया है, और यहां पर बल के अनुमानों को खोजने पर जोर दिया जाएगा। E(r) ठीक-ठाक ऊर्जा-स्थिति की जानकारी प्राप्त करने के लिए।
बहुत ही सरल रासायनिक प्रणालियों के लिए या जब अंतर-परमाणु संबंधों के बारे में सरल अनुमान लगाया जाता है, तो कभी-कभी परमाणु स्थितियों के कार्य के रूप में ऊर्जा के लिए विश्लेषणात्मक रूप से व्युत्पन्न अभिव्यक्ति का उपयोग करना संभव होता है। एक उदाहरण फ्रिट्ज लंदन-हेनरी आइरिंग (केमिस्ट)-माइकल पोलैनी-सातो क्षमता है[2][3][4] सिस्टम एच + एच के लिए2 तीन एचएच दूरियों के एक समारोह के रूप में।
अधिक जटिल प्रणालियों के लिए, परमाणुओं की एक विशेष व्यवस्था की ऊर्जा की गणना अक्सर कम्प्यूटेशनल रूप से महंगी होती है, जिससे सतह के बड़े पैमाने पर प्रतिनिधित्व संभव नहीं हो पाता है। इन प्रणालियों के लिए एक संभावित तरीका यह है कि PES पर केवल अंकों के घटे हुए सेट की गणना की जाए और फिर कम्प्यूटेशनल रूप से सस्ते इंटरपोलेशन विधि का उपयोग किया जाए, उदाहरण के लिए उलटा दूरी भार , अंतराल को भरने के लिए।[5]
आवेदन
PES आणविक ज्यामिति और रासायनिक प्रतिक्रिया गतिकी के विश्लेषण में सहायता के लिए एक वैचारिक उपकरण है। एक बार PES पर आवश्यक बिंदुओं का मूल्यांकन हो जाने के बाद, बिंदुओं को स्थिति के संबंध में ऊर्जा के पहले और दूसरे डेरिवेटिव के अनुसार वर्गीकृत किया जा सकता है, जो क्रमशः ढाल और वक्रता हैं। स्थिर बिंदु (या शून्य ढाल वाले बिंदु) का भौतिक अर्थ है: ऊर्जा मिनिमा भौतिक रूप से स्थिर रासायनिक प्रजातियों के अनुरूप है और काठी बिंदु संक्रमण अवस्थाओं के अनुरूप है, प्रतिक्रिया समन्वय पर उच्चतम ऊर्जा बिंदु (जो रासायनिक अभिकारक को जोड़ने वाला सबसे कम ऊर्जा मार्ग है) एक रासायनिक उत्पाद)।
आकर्षक और प्रतिकारक सतहें
रासायनिक प्रतिक्रियाओं के लिए संभावित ऊर्जा सतहों को अभिकारकों और उत्पादों के सापेक्ष सक्रिय परिसर में बांड की लंबाई के विस्तार की तुलना करके आकर्षक या प्रतिकारक के रूप में वर्गीकृत किया जा सकता है।प्रकार ए + बी-सी → ए-बी + सी की प्रतिक्रिया के लिए, नवगठित ए-बी बांड के लिए बंधन लंबाई विस्तार को आर * के रूप में परिभाषित किया गया है आर, जहां आर संक्रमण अवस्था में A-B बंध लंबाई है और उत्पाद अणु में। इसी प्रकार प्रतिक्रिया में टूटे हुए बंधन के लिए,आर - आर, जहां आर अभिकारक अणु को संदर्भित करता है। एक्ज़ोथिर्मिक प्रतिक्रियाओं के लिए, एक PES को आकर्षक (या प्रारंभिक-डाउनहिल) के रूप में वर्गीकृत किया जाता है यदि आर*, ताकि संक्रमण अवस्था तक पहुँच जाए जबकि अभिकारक एक दूसरे के निकट आ रहे हों। संक्रमण अवस्था के बाद, A-B बॉन्ड की लंबाई घटती रहती है, जिससे मुक्त प्रतिक्रिया ऊर्जा का अधिकांश भाग A-B बॉन्ड की आणविक कंपन ऊर्जा में परिवर्तित हो जाता है। द्वारा उत्पाद अणुओं की कंपन से उत्साहित आबादी का पता लगाया जा सकता है। प्रतिक्रिया एच + सीएल के लिए पीईएस के विपरीत एचसीएल + सीएल प्रतिकूल (या देर से डाउनहिल) है क्योंकि आर और संक्रमण अवस्था तब पहुँच जाती है जब उत्पाद अलग हो रहे होते हैं।इस प्रतिक्रिया के लिए जिसमें परमाणु ए (यहाँ एच) बी और सी की तुलना में हल्का है, प्रतिक्रिया ऊर्जा मुख्य रूप से उत्पादों की अनुवादिक गतिज ऊर्जा के रूप में जारी की जाती है। एफ + एच जैसी प्रतिक्रिया के लिए एचएफ + एच जिसमें परमाणु ए बी और सी से भारी है, मिश्रित ऊर्जा रिलीज है, कंपन और अनुवाद दोनों, भले ही पीईएस प्रतिकारक है।
एंडोथर्मिक प्रक्रिया के लिए, सतह का प्रकार ऊर्जा के प्रकार को निर्धारित करता है जो प्रतिक्रिया करने में सबसे प्रभावी होता है। एक आकर्षक सतह के साथ प्रतिक्रियाओं को प्रेरित करने के लिए अभिकारकों की ट्रांसलेशनल ऊर्जा सबसे प्रभावी होती है, जबकि एक प्रतिकारक सतह के साथ प्रतिक्रियाओं के लिए कंपन उत्तेजना (उच्च आणविक कंपन वी) अधिक प्रभावी होती है।बाद के मामले के एक उदाहरण के रूप में, प्रतिक्रिया एफ + एचसीएल (वी = 1) → सीएल + एचएफ एचसीएल की समान कुल ऊर्जा के लिए एफ + एचसीएल (वी = 0) → सीएल + एचएफ से लगभग पांच गुना तेज है।
इतिहास
रासायनिक प्रतिक्रियाओं के लिए एक संभावित ऊर्जा सतह की अवधारणा पहली बार 1913 में फ्रांसीसी भौतिक विज्ञानी रेने मार्सेलिन द्वारा सुझाई गई थी।[6] एच + एच के लिए एक संभावित ऊर्जा सतह की पहली अर्ध-अनुभवजन्य गणना प्रस्तावित की गई थी2 1931 में हेनरी आइरिंग (रसायनज्ञ) और माइकल पोलैनी द्वारा प्रतिक्रिया। 1935 में संक्रमण अवस्था सिद्धांत में प्रतिक्रिया दर स्थिरांक की गणना करने के लिए आयरिंग ने संभावित ऊर्जा सतहों का उपयोग किया।
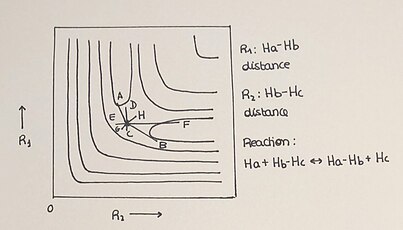
एच + एच2 द्वि-आयामी पीईएस
संभावित ऊर्जा सतहों को आमतौर पर त्रि-आयामी ग्राफ के रूप में दिखाया जाता है, लेकिन उन्हें द्वि-आयामी ग्राफ द्वारा भी प्रदर्शित किया जा सकता है, जिसमें प्रतिक्रिया की प्रगति को आइसोएनर्जेटिक लाइनों के उपयोग से प्लॉट किया जाता है। संरेख प्रणाली एच + एच2 एक सरल प्रतिक्रिया है जो एक दो-आयामी PES को आसान और समझने योग्य तरीके से प्लॉट करने की अनुमति देती है। इस अभिक्रिया में हाइड्रोजन परमाणु (H) डाइहाइड्रोजन अणु (H2) अणु से एक परमाणु के साथ एक नया बंधन बनाकर, जो बदले में मूल अणु के बंधन को तोड़ देता है। इसे H से दर्शाया जाता हैa + एचb-एचc → एचa-एचb + एचc. अभिकारकों (H+H₂) से उत्पादों (H-H-H) तक प्रतिक्रिया की प्रगति, साथ ही प्रतिक्रिया में भाग लेने वाली प्रजातियों की ऊर्जा, संबंधित संभावित ऊर्जा सतह में अच्छी तरह से परिभाषित हैं। ऊर्जा प्रोफाइल संभावित ऊर्जा का वर्णन ज्यामितीय चर के एक समारोह के रूप में करते हैं (पीईएस किसी भी आयाम में समय और तापमान से स्वतंत्र हैं)।
2-डी पीईएस में हमारे पास विभिन्न प्रासंगिक तत्व हैं:
- 2-डी प्लॉट न्यूनतम बिंदुओं को दिखाता है जहां हम अभिकारकों, उत्पादों और काठी बिंदु या संक्रमण अवस्था को पाते हैं।
- संक्रमण अवस्था अभिक्रिया निर्देशांक में अधिकतम और अभिक्रिया पथ के लम्बवत् निर्देशांक में न्यूनतम होती है।
- समय की प्रगति प्रत्येक प्रतिक्रिया में एक प्रक्षेपवक्र का वर्णन करती है। प्रतिक्रिया की स्थितियों के आधार पर प्रक्रिया 2 अक्षों के बीच प्लॉट किए गए उत्पाद निर्माण के लिए अलग-अलग तरीके दिखाएगी।
यह भी देखें
- कम्प्यूटेशनल रसायन विज्ञान
- ऊर्जा परिदृश्य
- ऊर्जा न्यूनीकरण (या ज्यामिति अनुकूलन)
- ऊर्जा प्रोफ़ाइल (रसायन विज्ञान)
- प्रतिक्रिया समन्वय
संदर्भ
- ↑ Potential-energy (reaction) surface in Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997)
- ↑ Sato, S. (1955). "संभावित ऊर्जा सतह को चित्रित करने का एक नया तरीका". Bulletin of the Chemical Society of Japan. 28 (7): 450–453. doi:10.1246/bcsj.28.450.Sato, Shin (1955). "On a New Method of Drawing the Potential Energy Surface". The Journal of Chemical Physics. 23 (3): 592–593. Bibcode:1955JChPh..23..592S. doi:10.1063/1.1742043.
- ↑ Keith J. Laidler, Chemical Kinetics (3rd ed., Harper & Row 1987) p.68-70 ISBN 0-06-043862-2
- ↑ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1998) p.201-2 ISBN 0-13-737123-3
- ↑ Moving least-squares enhanced Shepard interpolation for the fast marching and string methods, Burger SK1, Liu Y, Sarkar U, Ayers PW, J Chem Phys. 2009 130(2) 024103. doi: 10.1063/1.2996579.
- ↑ Computational Chemistry: Introduction to the Theory and Applications of Molecular and Quantum Mechanics Errol G. Lewars, 2nd ed. (Springer 2011) p.21 ISBN 978-9048138616