चौगुना बंधन
एक चौगुनी बंधन आठ इलेक्ट्रॉनों वाले दो परमाणुओं के बीच एक प्रकार का रासायनिक बंधन है। यह बॉन्ड अधिक परिचित प्रकार के डबल बंधन और ट्रिपल बंधन का विस्तार है।[1] के बीच में संक्रमण धातुओं के बीच स्थिर चौगुनी बांड सबसे आम हैं d-block, जैसे रेनीयाम , टंगस्टन, टेक्नेटियम, मोलिब्डेनम और क्रोमियम। आमतौर पर चौगुनी बांड का समर्थन करने वाले लिगेंड पाई-डोनर लिगैंड्स हैं | π-डोनर, न कि पाई बैकबॉन्डिंग|
इतिहास
क्रोमियम (द्वितीय) एसीटेट, सीआर2(μ-ओ2सीसीएच3)4(एच2ओ)2, पहला रासायनिक यौगिक था जिसमें संश्लेषित होने वाला चौगुना बंधन था। इसका वर्णन 1844 में ई. पेलिगोट द्वारा किया गया था, हालांकि इसके विशिष्ट बंधन को एक सदी से अधिक समय तक मान्यता नहीं मिली थी।[2]
चौगुनी बंधन वाले यौगिक का पहला क्रिस्टलोग्राफिक अध्ययन सोवियत रसायनज्ञों द्वारा लवण के लिए प्रदान किया गया था Re
2Cl2−
8.[3] बहुत कम री-रे दूरी नोट की गई थी। इस छोटी दूरी (और नमक का प्रतिचुंबकत्व) ने पुनः-पुनः बंधन का संकेत दिया। हालांकि इन शोधकर्ताओं ने ऋणायन को पुनः (II) के व्युत्पन्न के रूप में गलत रूप से प्रस्तुत किया, अर्थात, Re
2Cl4−
8.
इसके तुरंत बाद, एफ. अल्बर्ट कॉटन और सी.बी. हैरिस ने पोटेशियम ऑक्टाक्लोरोडिरहेनेट या के. की क्रिस्टल संरचना की सूचना दी2[दोबारा2क्लोरीन8] · इ2ओ[4] इस संरचनात्मक विश्लेषण ने संकेत दिया कि पिछला लक्षण वर्णन गलत था। कॉटन और हैरिस ने बंधन के लिए एक आणविक कक्षीय औचित्य तैयार किया जो स्पष्ट रूप से चौगुनी बंधन का संकेत देता है।[2]इस यौगिक में रेनियम-रेनियम बांड की लंबाई केवल 224 picometre है। आणविक कक्षीय सिद्धांत में, बंधन को σ के रूप में वर्णित किया गया है2</सुप>प4डी2 एक सिग्मा बंधन, दो पाई बांड और एक डेल्टा बंधन के साथ।
संरचना और संबंध
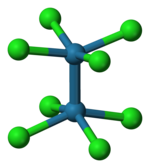
वहाँ2क्लोरीन8]2− आयन एक ग्रहण ग्रहण की रचना को अपनाता है जैसा कि बाईं ओर दिखाया गया है। डेल्टा बॉन्डिंग ऑर्बिटल तब प्रत्येक रेनियम परमाणु पर d ऑर्बिटल्स के ओवरलैप द्वारा बनता है, जो Re-Re अक्ष के लंबवत होते हैं और Re-Cl बॉन्ड के बीच में स्थित होते हैं। Re-Cl बॉन्ड के साथ निर्देशित d ऑर्बिटल्स क्लोरीन लिगैंड ऑर्बिटल्स के साथ परस्पर क्रिया द्वारा स्थिर होते हैं और Re-Re बॉन्डिंग में योगदान नहीं करते हैं।[5] इसके विपरीत, [Os2क्लोरीन8]2− आयन दो और इलेक्ट्रॉनों के साथ
संक्रमण धातु परमाणुओं के बीच चौगुनी बंधन वाले कई अन्य यौगिकों का वर्णन अक्सर कॉटन और उनके सहकर्मियों द्वारा किया गया है। डायरेनियम यौगिक के साथ समइलेक्ट्रॉनिकता लवण K है4[के लिए क्लोरीन(पोटेशियम ऑक्टाक्लोरोडिमोलीबडेट)।[6] चौगुनी बंधन के साथ एक डिटुंगस्टन यौगिक का एक उदाहरण डिटुंगस्टन टेट्रा (एचपीपी) है।
मुख्य-समूह तत्वों के परमाणुओं के बीच चौगुनी बंधन अज्ञात हैं। आणविक कक्षीय सिद्धांत से पता चलता है कि सिग्मा सिस्टम (एक बंधन, एक एंटीबॉडी) में युग्मित इलेक्ट्रॉनों के दो सेट होते हैं, और युग्मित इलेक्ट्रॉनों के दो सेट ऑर्बिटल्स के पतित π-बॉन्डिंग सेट में होते हैं। यह 2 का बंधन क्रम देने के लिए जोड़ता है, जिसका अर्थ है कि डाइ[[डाइकार्बन]] (C) में दो कार्बन परमाणुओं के बीच एक दोहरा बंधन मौजूद है।अणु। डायटोमिक कार्बन के आणविक कक्षीय आरेख से पता चलता है कि दो पाई बांड हैं और सिग्मा बांड नहीं हैं। हालाँकि, एस। शैक एट अल द्वारा हाल ही में एक पेपर। ने सुझाव दिया है कि डायटोमिक कार्बन में एक चौगुना बंधन मौजूद है,[7] लेकिन यह विवादित है।[8]
यह भी देखें
संदर्भ
- ↑ Radius, U.; Breher, F. (2006). "'To Boldly Pass the Metal–Metal Quadruple Bond". Angew. Chem. Int. Ed. 45 (19): 3006–3010. doi:10.1002/anie.200504322.
- ↑ 2.0 2.1 Cotton, F. A.; Walton, R. A. (1993). धातु परमाणुओं के बीच एकाधिक बंधन. Oxford: Oxford University Press. ISBN 0-19-855649-7.
- ↑ Kuznetsov, V. G.; Koz'min, P. A. "The structure of (pyH)HReCl4" Zhurnal Strukturnoi Khimii 1963, 4, 55-62.
- ↑ Cotton, F. A.; Harris, C. B. (1965). "The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O". Inorg. Chem. 4 (3): 330–333. doi:10.1021/ic50025a015.
- ↑ Miessler, G. L.; Tarr, D. A. (1999). अकार्बनिक रसायन शास्त्र (2nd ed.). Prentice-Hall. p. 531. ISBN 0-13-841891-8.
- ↑ Girolami, G. S.; Rauchfuss, T. B.; Angelici, R. J. (1999). अकार्बनिक रसायन विज्ञान में संश्लेषण और तकनीक. Mill Valley, CA: University Science Books. ISBN 0935702482.
- ↑ Shaik, Sason; Danovich, David; Wu, Wei; Su, Peifeng; Rzepa, Henry S.; Hiberty, Philippe C. (2012). "Quadruple bonding in C2 and analogous eight-valence electron species". Nature Chemistry. 4: 195–200. Bibcode:2012NatCh...4..195S. doi:10.1038/nchem.1263.
- ↑ Grunenberg, Jörg (2012). "Quantum chemistry: Quadruply bonded carbon". Nature Chemistry. 4 (3): 154–155. Bibcode:2012NatCh...4..154G. doi:10.1038/nchem.1274. PMID 22354425.
अग्रिम पठन
- Cotton, F. A.; Harris, C. B. (1965). "The Crystal and Molecular Structure of Dipotassium Octachlorodirhenate(III) Dihydrate, K2[Re2Cl8]·2H2O". Inorg. Chem. 4 (3): 330–333. doi:10.1021/ic50025a015.