टंगस्टन
 | |||||||||||||||||||||||||||||||||||||||||
| Tungsten | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| उच्चारण | /ˈtʌŋstən/ | ||||||||||||||||||||||||||||||||||||||||
| Alternative name | wolfram, pronounced: /ˈwʊlfrəm/ (WUUL-frəm) | ||||||||||||||||||||||||||||||||||||||||
| allotropes | α-tungsten (common), β-tungsten | ||||||||||||||||||||||||||||||||||||||||
| दिखावट | grayish white, lustrous | ||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(W) |
| ||||||||||||||||||||||||||||||||||||||||
| Tungsten in the periodic table | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 74 | ||||||||||||||||||||||||||||||||||||||||
| समूह | group 6 | ||||||||||||||||||||||||||||||||||||||||
| अवधि | period 6 | ||||||||||||||||||||||||||||||||||||||||
| ब्लॉक | d-block | ||||||||||||||||||||||||||||||||||||||||
| ऋणावेशित सूक्ष्म अणु का विन्यास | [Xe] 4f14 5d4 6s2[2] | ||||||||||||||||||||||||||||||||||||||||
| प्रति शेल इलेक्ट्रॉन | 2, 8, 18, 32, 12, 2 | ||||||||||||||||||||||||||||||||||||||||
| भौतिक गुण | |||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||
| गलनांक | 3695 K (3422 °C, 6192 °F) | ||||||||||||||||||||||||||||||||||||||||
| क्वथनांक | 6203 K (5930 °C, 10706 °F) | ||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 19.25 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 17.6 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| संलयन की गर्मी | 52.31 kJ/mol[3][4] | ||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 774 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| दाढ़ गर्मी क्षमता | 24.27 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| |||||||||||||||||||||||||||||||||||||||||
| परमाणु गुण | |||||||||||||||||||||||||||||||||||||||||
| ऑक्सीकरण राज्य | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (a mildly acidic oxide) | ||||||||||||||||||||||||||||||||||||||||
| इलेक्ट्रोनगेटिविटी | Pauling scale: 2.36 | ||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| ||||||||||||||||||||||||||||||||||||||||
| परमाणु का आधा घेरा | empirical: 139 pm | ||||||||||||||||||||||||||||||||||||||||
| सहसंयोजक त्रिज्या | 162±7 pm | ||||||||||||||||||||||||||||||||||||||||
| Spectral lines of tungsten | |||||||||||||||||||||||||||||||||||||||||
| अन्य गुण | |||||||||||||||||||||||||||||||||||||||||
| प्राकृतिक घटना | primordial | ||||||||||||||||||||||||||||||||||||||||
| क्रिस्टल की संरचना | body-centered cubic (bcc) | ||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4620 m/s (at r.t.) (annealed) | ||||||||||||||||||||||||||||||||||||||||
| थर्मल विस्तार | 4.5 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||
| ऊष्मीय चालकता | 173 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||
| विद्युत प्रतिरोधकता | 52.8 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| चुंबकीय आदेश | paramagnetic[5] | ||||||||||||||||||||||||||||||||||||||||
| दाढ़ चुंबकीय संवेदनशीलता | +59.0×10−6 cm3/mol (298 K)[6] | ||||||||||||||||||||||||||||||||||||||||
| यंग मापांक | 411 GPa | ||||||||||||||||||||||||||||||||||||||||
| कतरनी मापांक | 161 GPa | ||||||||||||||||||||||||||||||||||||||||
| थोक मापांक | 310 GPa | ||||||||||||||||||||||||||||||||||||||||
| पॉइसन अनुपात | 0.28 | ||||||||||||||||||||||||||||||||||||||||
| मोहन कठोरता | 7.5 | ||||||||||||||||||||||||||||||||||||||||
| विकर्स कठोरता | 3430–4600 MPa | ||||||||||||||||||||||||||||||||||||||||
| ब्रिनेल हार्डनेस | 2000–4000 MPa | ||||||||||||||||||||||||||||||||||||||||
| CAS नंबर | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||
| खोज और पहला अलगाव | Juan José Elhuyar and Fausto Elhuyar[7] (1783) | ||||||||||||||||||||||||||||||||||||||||
| Named by | Torbern Bergman (1781) | ||||||||||||||||||||||||||||||||||||||||
| चिन्ह, प्रतीक | "W": from Wolfram, originally from Middle High German wolf-rahm 'wolf's foam' describing the mineral wolframite[8] | ||||||||||||||||||||||||||||||||||||||||
| Main isotopes of tungsten | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
टंगस्टन, या वोल्फ्राम,[9][10] प्रतीक (रसायन विज्ञान) W और परमाणु संख्या 74 के साथ रासायनिक तत्व है। टंगस्टन वह दुर्लभ धातु है जो पृथ्वी पर प्राकृतिक रूप से लगभग विशेष रूप से अन्य तत्वों के साथ यौगिकों के रूप में पाई जाती है। इसे 1781 में नए तत्व के रूप में पहचाना गया था और पहली बार 1783 में एक धातु के रूप में अलग किया गया था। इसके महत्वपूर्ण अयस्कों में स्कीलाइट और वुल्फ्रामाइट सम्मलित हैं, इसके पश्चात आने वाले तत्वों को इसका वैकल्पिक नाम दिया।
मुक्त तत्व इसकी मजबूती के लिए उल्लेखनीय है, विशेष रूप से तथ्य यह है कि इसमें कार्बन को छोड़कर सभी ज्ञात तत्वों का उच्चतम गलनांक होता है (जो सामान्य दबाव में उर्ध्वपातित होता है), पिघलने पर 3,422 °C (6,192 °F; 3,695 K). इसका उच्चतम क्वथनांक भी है 5,930 °C (10,706 °F; 6,203 K).[11] इसका घनत्व है 19.30 grams per cubic centimetre (0.697 lb/cu in),[12] यूरेनियम और सोने की तुलना में, और सीसा की तुलना में बहुत अधिक (लगभग 1.7 गुना)।[13] पॉलीक्रिस्टलाइन टंगस्टन एक आंतरिक रूप से भंगुर है[14][15][16] और कठोरता सामग्री (मानक स्थितियों के अनुसार, जब असंबद्ध), यह धातु के लिए मुश्किल बना रही है। चूंकि, शुद्ध सिंगल-क्रिस्टलीय टंगस्टन में अधिक लचीलापन होता है और इसे हार्ड-स्टील हैक्सॉ से काटा जा सकता है।[17] टंगस्टन कई मिश्र धातुओं में होता है, जिसमें कई अनुप्रयोग होते हैं, जिनमें गरमागरम प्रकाश बल्ब तंतु, एक्स-रे ट्यूब, गैस टंग्सटन आर्क वेल्डिंग में इलेक्ट्रोड, सुपरलॉइज़ और विकिरण सुरक्षा सम्मलित हैं। टंगस्टन की कठोरता और उच्च घनत्व इसे काइनेटिक ऊर्जा भेदक में सैन्य अनुप्रयोगों के लिए उपयुक्त बनाता है। टंगस्टन यौगिकों का उपयोग अधिकांशतः औद्योगिक उत्प्रेरक के रूप में किया जाता है।
तीसरी संक्रमण धातु श्रृंखला में टंगस्टन एकमात्र धातु है जो जैव अणुओं में होने के लिए जानी जाती है, जो बैक्टीरिया और आर्किया की कुछ प्रजातियों में पाई जाती है। चूंकि, टंगस्टन मोलिब्डेनम और तांबे के चयापचय में हस्तक्षेप करता है और पशु जीवन के अधिकांश रूपों के लिए कुछ सीमा तक जहरीला होता है।[18][19]
विशेषताएं
भौतिक गुण
अपने कच्चे रूप में, टंगस्टन एक कठोर स्टील-ग्रे धातु है जो अधिकांशतः धातु के काम के लिए भंगुर और कठोर होता है। शुद्ध, मोनोक्रिस्टलाइन टंगस्टन अपनी कठोरता (जो कई स्टील्स से अधिक है) को निरंतर रखता है, और इतना लचीला हो जाता है कि इसे सरलता से काम किया जा सकता है।[17] यह लोहारी, ड्राइंग (निर्माण), या बाहर निकालना द्वारा काम किया जाता है, लेकिन यह सामान्यतः सिंटरिंग द्वारा बनता है।
शुद्ध रूप में सभी धातुओं में, टंगस्टन का गलनांक सबसे अधिक होता है (3,422 °C, 6,192 °F), सबसे कम वाष्प दबाव (ऊपर के तापमान पर 1,650 °C, 3,000 °F), और उच्चतम तन्यता ताकत।[20] यद्यपि कार्बन टंगस्टन की तुलना में उच्च तापमान पर ठोस रहता है, कार्बन उच्च बनाने की क्रिया (चरण संक्रमण) पिघलने के अतिरिक्त वायुमंडलीय दबाव पर होता है, इसलिए इसका कोई गलनांक नहीं होता है। इसके अतिरिक्त, टंगस्टन का सबसे स्थिर क्रिस्टल चरण कम से कम 364 गीगापास्कल तक के दबावों के लिए किसी भी उच्च दबाव-प्रेरित संरचनात्मक परिवर्तनों को प्रदर्शित नहीं करता है।[21] टंगस्टन में किसी भी शुद्ध धातु के उष्मीय विस्तार का सबसे कम गुणांक होता है। कम तापीय विस्तार और उच्च गलनांक और टंगस्टन की तन्य शक्ति 5d इलेक्ट्रॉनों द्वारा टंगस्टन परमाणुओं के बीच बने मजबूत धात्विक बंधों से उत्पन्न होती है।[22] स्टील के साथ टंगस्टन की थोड़ी मात्रा मिलाने से इसकी कठोरता बहुत बढ़ जाती है।[13]
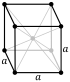
टंगस्टन दो प्रमुख स्फटिकता रूपों में सम्मलित है: α और β। पूर्व में एक शरीर-केंद्रित घन संरचना है और यह अधिक स्थिर रूप है। इस चरण की संरचना को A15 चरण कहा जाता है; यह मेटास्टेबल है, लेकिन गैर-संतुलन संश्लेषण या अशुद्धियों द्वारा स्थिरीकरण के कारण परिवेशी परिस्थितियों में α चरण के साथ सह-अस्तित्व में हो सकता है। Α चरण के विपरीत जो आइसोमेट्रिक अनाज में क्रिस्टलीकृत होता है, β रूप एक स्तंभकार क्रिस्टल की आदत प्रदर्शित करता है। α चरण में विद्युत प्रतिरोधकता का एक तिहाई होता है[23] और बहुत कम सुपरकंडक्टिविटी TC β चरण के सापेक्ष: सीए। 0.015 के बनाम 1–4 के; दो चरणों को मिलाकर मध्यवर्ती TC मान से प्राप्त करने की अनुमति मिलती है।[24][25] TC टंगस्टन को किसी अन्य धातु के साथ मिश्रित करके भी मूल्य बढ़ाया जा सकता है (उदाहरण के लिए W-टेक्नेटियम के लिए 7.9 K)।[26] ऐसे टंगस्टन मिश्र कभी-कभी कम तापमान वाले सुपरकंडक्टिंग सर्किट में उपयोग किए जाते हैं।[27][28][29]
समस्थानिक
स्वाभाविक रूप से होने वाले टंगस्टन में चार स्थिर समस्थानिक होते हैं (182W, 183W, 184W, और 186W) और एक बहुत लंबे समय तक रहने वाला रेडियोआइसोटोप, 180W सैद्धांतिक रूप से, सभी पांच अल्फा उत्सर्जन द्वारा तत्व 72 (हेफ़नियम) के समस्थानिकों में क्षय हो सकते हैं, लेकिन केवल 180W को ऐसा करते हुए देखा गया है, जिसका आधा जीवन है (1.8±0.2)×1018 वर्षों;[30][31] औसतन, इससे लगभग दो अल्फा क्षय प्राप्त होते हैं 180 W प्रति ग्राम प्राकृतिक टंगस्टन प्रति वर्ष।[32] यह दर लगभग 63 माइक्रो-बेक्यूरल (यूनिट) प्रति किलोग्राम की विशिष्ट गतिविधि के बराबर है। क्षय की यह दर पृथ्वी पर पाए जाने वाले कार्बन या पोटेशियम में देखी गई परिमाण की तुलना में कम परिमाण का क्रम है, जिसमें लंबे समय तक रहने वाले रेडियोधर्मी समस्थानिकों की थोड़ी मात्रा होती है। विस्मुट को लंबे समय तक गैर-रेडियोधर्मी माना जाता था, लेकिन 209
Bi (इसका सबसे लंबे समय तक रहने वाला आइसोटोप) वास्तव में के आधे जीवन के साथ घटता है 2.01×1019 साल या इसके कारक के बारे में 10 से धीमी 180
W. चूंकि, स्वाभाविक रूप से बिस्मथ 100% होने के कारण 209
Bi, इसकी विशिष्ट गतिविधि वास्तव में प्राकृतिक टंगस्टन की तुलना में 3 मिली-बेक्यूरेल प्रति किलोग्राम अधिक है। टंगस्टन के अन्य प्राकृतिक रूप से पाए जाने वाले समस्थानिकों को क्षय होते हुए नहीं देखा गया है, जिससे उनका आधा जीवन कम से कम 4 × 1021 वर्ष हो जाता है - यदि वे बिल्कुल भी क्षय होते हैं।
टंगस्टन के अन्य 30 कृत्रिम रेडियो आइसोटोप की विशेषता बताई गई है, जिनमें से सबसे स्थिर हैं 181121.2 दिनों की अर्द्ध-आयु के साथ W, 18575.1 दिनों की अर्द्ध-आयु के साथ 188W, 69.4 दिनों की अर्द्ध-आयु के साथ W, 178 21.6 दिनों की अर्द्ध-आयु के साथ W, और 187W, 23.72 h की अर्ध-आयु के साथ।[32] शेष सभी रेडियोधर्मी समस्थानिकों का आधा जीवन 3 घंटे से कम है, और इनमें से अधिकांश का आधा जीवन 8 मिनट से कम है।[32] टंगस्टन में 11 मेटा अवस्थाएँ भी होती हैं, जिनमें 179W (T1/2 6.4 मिनट) सबसे अधिक स्थिर होती हैं ।
रासायनिक गुण
टंगस्टन ज्यादातर गैर-प्रतिक्रियाशील तत्व है: यह पानी से प्रतिक्रिया नहीं करता है, अधिकांश अम्लीय और बेस द्वारा हमला करने के लिए प्रतिरोधी है, और कमरे के तापमान पर ऑक्सीजन या हवा के साथ प्रतिक्रिया नहीं करता है। ऊंचे तापमान पर (अर्थात, जब लाल-गर्म) यह ऑक्सीजन के साथ प्रतिक्रिया करके ट्राइऑक्साइड यौगिक टंगस्टन (VI), WO3 बनाता है। चूंकि यह सीधे फ्लोरीन के साथ प्रतिक्रिया करेगा (F2टंगस्टन हेक्साफ्लोराइड | टंगस्टन (VI) फ्लोराइड (WF) बनाने के लिए कमरे के तापमान पर6), एक रंगहीन गैस। लगभग 250 °C पर यह क्लोरीन या ब्रोमीन के साथ प्रतिक्रिया करेगा, और कुछ गर्म परिस्थितियों में आयोडीन के साथ प्रतिक्रिया करेगा। बारीक विभाजित टंगस्टन पायरोफोरिक है।[33][34]
टंगस्टन का सबसे आम औपचारिक ऑक्सीकरण स्थिति +6 है, लेकिन यह -2 से +6 तक सभी ऑक्सीकरण स्थितियों को प्रदर्शित करता है।[34][35] टंगस्टन सामान्यतः पीले टंगस्टन ट्राइऑक्साइड, WO3 बनाने के लिए ऑक्सीजन के साथ जोड़ती है, जो टंगस्टेट आयन बनाने के लिए जलीय क्षारीय विलयनों में घुल जाता है, WO2−
4 टंगस्टन कार्बाइड (W2C और WC) पाउडर टंगस्टन को कार्बन के साथ गर्म करके उत्पादित किया जाता है। W2C रासायनिक हमले के लिए प्रतिरोधी है, चूंकि यह टंगस्टन हेक्साक्लोराइड (WCl)6 बनाने के लिए क्लोरीन के साथ दृढ़ता से प्रतिक्रिया करता है।)[13]
जलीय घोल में, तटस्थ और अम्लीय परिस्थितियों में टंगस्टेट विषमलैंगिक अम्ल और पॉली ओ एक्सओ मेटा लेट आयन देता है। जैसा कि टंगस्टेट को उत्तरोत्तर अम्ल के साथ उपचारित किया जाता है, यह पहले घुलनशील, मेटास्टेबल पैराटुंगस्टेट ए आयन उत्पन्न करता है, W
7O6−
24, जो समय के साथ कम घुलनशील पैराटुंगस्टेट बी आयनों में परिवर्तित हो जाता है, H
2W
12O10−
42[36] आगे अम्लीकरण बहुत घुलनशील मेटाटुंगस्टेट आयनों का उत्पादन करता है, H
2W
12O6−
40, जिसके पश्चात संतुलन प्राप्त किया जाता है। मेटाटंगस्टेट आयन बारह टंगस्टन-ऑक्सीजन अष्टफलक के सममित क्लस्टर के रूप में सम्मलित है जिसे केगिन संरचना आयन के रूप में जाना जाता है। मेटास्टेबल प्रजातियों के रूप में कई अन्य पॉलीऑक्सोमेटलेट आयन सम्मलित हैं। मेटाटुंगस्टेट में दो केंद्रीय हाइड्रोजन के स्थान पर फास्फोरस जैसे एक अलग परमाणु को सम्मलित करने से फॉस्फोटुंगस्टिक अम्लीय H जैसे हेटरोपॉली P3W12O40 अम्लीय की विस्तृत विविधता पैदा होती है।.
टंगस्टन ट्रायऑक्साइड क्षार धातुओं के साथ इंटरकलेशन (रसायन विज्ञान) यौगिक बना सकता है। इन्हें कांसे के रूप में जाना जाता है; एक उदाहरण सोडियम टंगस्टन कांस्य है।
गैसीय रूप में, टंगस्टन द्विपरमाणुक प्रजाति W2 बनाता है, इन अणुओं में टंगस्टन परमाणुओं के बीच एक सेक्स्टुपल बंधन होता है - रेडियोधर्मिता परमाणुओं के बीच उच्चतम ज्ञात बंधन क्रम।[37][38]
इतिहास
1781 में, कार्ल विल्हेम शेहेले ने खोजा कि एक नया अम्ल, टंगस्टिक अम्लीय, स्केलाइट से बनाया जा सकता है (उस समय जिसे टंगस्टन कहा जाता था)।[39][40] शेले और टोरबर्न बर्गमैन ने सुझाव दिया कि इस अम्लीय को कम करके नई धातु प्राप्त करना संभव हो सकता है।[41]1783 में, जुआन जोस एलहुयार जोस और फॉस्टो एलहुयार ने वोल्फ्रामाइट से बना एक अम्लीय पाया जो टंगस्टिक अम्लीय के समान था। उस वर्ष पश्चात में, स्पेन के बर्गा को शहर में रियल सोसाइडाड बास्कोंगाडा डी एमिगोस डेल पेस में, भाइयों ने लकड़ी का कोयला के साथ इस अम्लीय को कम करके टंगस्टन को अलग करने में सफलता प्राप्त की, और उन्हें तत्व की खोज का श्रेय दिया जाता है (उन्होंने इसे वोल्फ्राम कहा या वोल्फ्राम)।[42][43][44][45][46] 20वीं सदी की प्रारंभ में टंगस्टन के सामरिक महत्व का पता चला। ब्रिटिश अधिकारियों ने 1912 में कैरॉक फेल को जर्मन स्वामित्व वाली कुम्ब्रियन माइनिंग कंपनी से मुक्त करने के लिए कार्य किया और प्रथम विश्व युद्ध के समय में जर्मन की पहुंच को प्रतिबंधित कर दिया।[47] द्वितीय विश्व युद्ध में, टंगस्टन ने वोल्फ्राम क्राइसिस पृष्ठभूमि राजनीतिक स्थितियों में अधिक महत्वपूर्ण भूमिका निभाई थी। पुर्तगाल, तत्व के मुख्य यूरोपीय स्रोत के रूप में, द्वितीय विश्व युद्ध वोल्फ्राम (टंगस्टन) के समय में पुर्तगाल था, इसकी वजह पनसकुइरा में वुल्फ्रामाइट अयस्क की जमा राशि थी। टंगस्टन के वांछनीय गुणों जैसे उच्च तापमान के प्रतिरोध, इसकी कठोरता और घनत्व, और इसकी मिश्र धातुओं की मजबूती ने इसे हथियार उद्योग के लिए एक महत्वपूर्ण कच्चा माल बना दिया,[48][49] दोनों हथियारों और उपकरणों के घटक के रूप में और उत्पादन में ही कार्यरत हैं, उदाहरण के लिए, मशीनिंग स्टील के लिए टंगस्टन कार्बाइड काटने के उपकरण में अब टंगस्टन का उपयोग मोटरस्पोर्ट गिट्टी भार, डार्ट्स, एंटी-वाइब्रेशन टूलिंग और खेल उपकरण जैसे कई और अनुप्रयोगों में किया जाता है।
टंगस्टन तत्वों में अद्वितीय है क्योंकि यह पेटेंट कार्यवाही का विषय रहा है। 1928 में, एक अमेरिकी अदालत ने इसे पेटेंट कराने के सामान्य विद्युतीय के प्रयास को पलटते हुए खारिज कर दिया U.S. Patent 1,082,933 1913 में विलियम डी. कूलिज को प्रदान किया गया।[50][51][52]
व्युत्पत्ति
टंगस्टन नाम (जिसका अर्थ स्वीडिश भाषा में भारी पत्थर है) का उपयोग अंग्रेजी, फ्रेंच और कई अन्य भाषाओं में तत्व के नाम के रूप में किया जाता है, लेकिन नॉर्डिक देशों में नहीं। टंगस्टन खनिज स्कीलाइट का पुराना स्वीडिश नाम था। वोल्फ्राम (या वोल्फ्राम) का उपयोग अधिकांश यूरोपीय (विशेष रूप से जर्मनिक, स्पैनिश और स्लाविक) भाषाओं में किया जाता है और यह खनिज वोलफ्रामाइट से प्राप्त होता है, जो कि रासायनिक प्रतीक W का मूल है।[17] वोल्फ्रामाइट नाम जर्मन वूल्फ (वूल्फ क्रीम) से लिया गया है, जो 1747 में जोहान गॉट्सचैक वालेरियस द्वारा टंगस्टन को दिया गया नाम है। यह बदले में, लैटिन ल्यूपी स्पूमा से निकला है, नाम जॉर्ज एग्रीकोला 1546 में तत्व के लिए उपयोग किया गया था। , जो अंग्रेजी में भेड़िये के झाग के रूप में अनुवादित है और खनिज द्वारा इसके निष्कर्षण के समय में बड़ी मात्रा में टिन की खपत का एक संदर्भ है, चूंकि खनिज ने इसे वूल्फ की तरह खा लिया।[8] यह नामकरण रंगीन नामों की एक परंपरा का अनुसरण करता है अयस्क पर्वत से खनिक विभिन्न खनिजों को देते हैं, एक अंधविश्वास से बाहर जो कि कुछ ऐसे दिखते थे जैसे कि उनमें तत्कालीन ज्ञात मूल्यवान धातुएँ थीं लेकिन किसी तरह हेक्स नहीं थे। कोबाल्ट (c.f. Kobold), पिचब्लेंड (c.f. जर्मन शब्द:ब्लेंडन टू ब्लाइंड ऑर टू डिसीव) और निकल (c.f. ओल्ड निक) एक ही खनिक के मुहावरे से अपने नाम प्राप्त करते हैं।
घटना
टंगस्टन अब तक प्रकृति में अपने शुद्ध रूप में नहीं पाया गया है।[53] इसके अतिरिक्त, टंगस्टन मुख्य रूप से वुल्फ्रामाइट और स्केलाइट खनिजों में पाया जाता है।[53] वोल्फ्रामाइट लोहा-मैंगनीज टंगस्टेट है (Fe,Mn)WO4, दो खनिजों तैयार का ठोस समाधान (FeWO4) और हबनेराइट (MnWO4), जबकि स्कीलाइट कैल्शियम टंगस्टेट (CaWO4). अन्य टंगस्टन खनिज बहुतायत के अपने स्तर में मध्यम से बहुत दुर्लभ तक होते हैं, और उनका लगभग कोई आर्थिक मूल्य नहीं है।
रासायनिक यौगिक
W6 की संरचना Cl18 (टंगस्टन ट्राइक्लोराइड) टंगस्टन -II से VI तक ऑक्सीकरण स्थितियों में रासायनिक यौगिक बनाता है। उच्च ऑक्सीकरण स्थिति, हमेशा ऑक्साइड के रूप में, इसकी स्थलीय घटना और इसकी जैविक भूमिकाओं के लिए प्रासंगिक होते हैं, मध्य-स्तरीय ऑक्सीकरण स्थिति अधिकांशतः धातु समूहों से जुड़े होते हैं, और बहुत कम ऑक्सीकरण स्थिति सामान्यतः धातु कार्बोनिल से जुड़े होते हैं। टंगस्टन और मोलिब्डेनम के रसायन एक दूसरे के साथ मजबूत समानता दिखाते हैं, साथ ही साथ उनके लाइटर कोजेनर, क्रोमियम के विपरीत भी होते हैं। टंगस्टन (III) की सापेक्ष दुर्लभता, उदाहरण के लिए, क्रोमियम (III) यौगिकों की व्यापकता के विपरीत है। उच्चतम ऑक्सीकरण अवस्था टंगस्टन (VI) ऑक्साइड (WO3).[54] टंगस्टन (VI) ऑक्साइड जलीय आधार (रसायन विज्ञान) में घुलनशील है, जिससे टंगस्टेट (WO) बनता है42−). यह ऑक्सीजन कम पीH मान पर संघनित होता है, जिससे पॉलीऑक्सोमेटालेट्स बनते हैं।[55]
टंगस्टन के ऑक्सीकरण स्थितियों की विस्तृत श्रृंखला इसके विभिन्न क्लोराइड में परिलक्षित होती है:[54]* टंगस्टन (II) क्लोराइड, जो हेक्सामेर W के रूप में सम्मलित है6क्लोरीन12
- टंगस्टन (III) क्लोराइड, जो हेक्सामेर W6Cl18के रूप में सम्मलित है
- टंगस्टन (चतुर्थ) क्लोराइड, WCl4, एक काला ठोस, जो बहुलक संरचना को अपनाता है।
- टंगस्टन (वी) क्लोराइड WCl5, एक काला ठोस जो एक मंदक संरचना को अपनाता है।
- टंगस्टन (VI) क्लोराइड WCl6, जो MoCl6 की अस्थिरता के विपरीत है।
ऑर्गनोमोलिब्डेनम और ऑक्सीकरण स्थितियों की एक श्रृंखला भी फैलाते हैं। उल्लेखनीय उदाहरणों में W(CH3)6 और अष्टफलकीय W(CO)6 त्रिकोणीय प्रिज्मीय सम्मलित हैं।
उत्पादन
भंडार
दुनिया में टंगस्टन का भंडार 3,200,000 टन है; वे ज्यादातर चीन (1,800,000 टी), कनाडा (290,000 टी),[56] रूस (160,000 टन), वियतनाम (95,000 टन) और बोलीविया। 2017 तक, चीन, वियतनाम और रूस क्रमशः 79,000, 7,200 और 3,100 टन के साथ प्रमुख आपूर्तिकर्ता हैं। कनाडा ने अपनी एकमात्र टंगस्टन खदान के बंद होने के कारण 2015 के अंत में उत्पादन बंद कर दिया था। इस बीच, वियतनाम ने 2010 के दशक में अपने घरेलू शोधन कार्यों के प्रमुख अनुकूलन के कारण अपने उत्पादन में काफी वृद्धि की थी और रूस और बोलिविया को पीछे छोड़ दिया था।[57]
चीन न केवल उत्पादन में बल्कि टंगस्टन उत्पादों के निर्यात और खपत में भी विश्व में अग्रणी बना हुआ है। बढ़ती मांग के कारण चीन के बाहर टंगस्टन का उत्पादन धीरे-धीरे बढ़ रहा है। इस बीच, चीन द्वारा इसकी आपूर्ति को चीनी सरकार द्वारा कड़ाई से विनियमित किया जाता है, जो अवैध खनन और खनन और शोधन प्रक्रियाओं से उत्पन्न होने वाले अत्यधिक प्रदूषण से लड़ती है।[58] यूनाइटेड किंगडम में डार्टमूर के किनारे पर टंगस्टन अयस्क का एक बड़ा भंडार है, जिसका उपयोग प्रथम विश्व युद्ध और द्वितीय विश्व युद्ध के समय में हेमरडॉन खान के रूप में किया गया था। टंगस्टन की कीमतों में वृद्धि के पश्चात, इस खदान को 2014 में फिर से सक्रिय किया गया था,[59] लेकिन 2018 में गतिविधियों को बंद कर दिया।[60] यूरोपीय संघ के भीतर, ऑस्ट्रिया फेलबर्टल स्कीलाइट जमा कुछ टंगस्टन खानों का उत्पादन करने वालों में से एक है।[61] पुर्तगाल यूरोप के प्रमुख टंगस्टन उत्पादकों में से एक है, जिसमें 1910 से 2020 तक 121 kt निहित टंगस्टन खनिज केंद्रित है, जो वैश्विक उत्पादन का लगभग 3.3% है।[62] कांगो लोकतांत्रिक गणस्थिति में देखी गई अनैतिक खनन प्रथाओं के कारण टंगस्टन को एक संघर्षशील खनिज माना जाता है।[63][64]
निष्कर्षण
टंगस्टन को इसके अयस्कों से कई चरणों में निकाला जाता है। अयस्क अंततः टंगस्टन (VI) ऑक्साइड (WO3), जिसे पाउडर टंगस्टन बनाने के लिए हाइड्रोजन या कार्बन के साथ गर्म किया जाता है।[41] टंगस्टन के उच्च गलनांक के कारण, टंगस्टन सिल्लियां डालना व्यावसायिक रूप से संभव नहीं है। इसके अतिरिक्त, पाउडर टंगस्टन को थोड़ी मात्रा में पाउडर निकल या अन्य धातुओं और सिंटरिंग के साथ मिलाया जाता है। सिंटरिंग प्रक्रिया के समय में, निकल मिश्र धातु का निर्माण करते हुए टंगस्टन में फैल जाता है।
टंगस्टन हेक्साफ्लोराइड | WF6 की हाइड्रोजन कमी से टंगस्टन भी निकाला जा सकता है:
- WF6 + 3 H2 → W + 6 HF
या पायरोलिसिस:[65]
- WF6 → W + 3 F2 (प्रतिक्रिया की गर्मी | ΔHr= +)
टंगस्टन का वायदा अनुबंध के रूप में कारोबार नहीं किया जाता है और इसे लंदन मेटल एक्सचेंज जैसे एक्सचेंजों पर ट्रैक नहीं किया जा सकता है। टंगस्टन उद्योग अधिकांशतः अनुबंधों के आधार के रूप में आर्गस मीडिया या धातु बुलेटिन जैसे स्वतंत्र मूल्य निर्धारण संदर्भों का उपयोग करता है।[66] कीमतों को सामान्यतः टंगस्टन कॉन्संट्रेट या WO के लिए उद्धृत किया जाता है3.[57]
अनुप्रयोग

टंगस्टन का लगभग आधा हिस्सा कठिन सामग्री के उत्पादन के लिए उपयोग किया जाता है - अर्थात् टंगस्टन कार्बाइड - शेष प्रमुख उपयोग मिश्र धातुओं और स्टील्स में होता है। अन्य रासायनिक यौगिक में 10% से कम का उपयोग किया जाता है।[67] टंगस्टन के उच्च नमनीय-भंगुर संक्रमण तापमान के कारण, इसके उत्पाद पारंपरिक रूप से पाउडर धातु विज्ञान, स्पार्क प्लाज्मा सिंटरिंग, रासायनिक वाष्प जमाव, गर्म आइसोस्टैटिक दबाने और थर्मोप्लास्टिक मार्गों के माध्यम से निर्मित होते हैं। एक अधिक लचीला विनिर्माण विकल्प चयनात्मक लेजर मेल्टिंग है, जो 3 डी प्रिंटिग का एक रूप है और जटिल त्रि-आयामी आकार बनाने की अनुमति देता है।[68]
औद्योगिक
टंगस्टन का उपयोग मुख्य रूप से टंगस्टन करबैड (WC) पर आधारित कठोर सामग्रियों के उत्पादन में किया जाता है, जो सबसे कठोर कार्बाइड में से एक है। WC एक कुशल विद्युत चालक है, लेकिन W2सी कम है। WC का उपयोग पहनने के लिए प्रतिरोधी अपघर्षक, और कार्बाइड काटने के उपकरण जैसे चाकू, ड्रिल, परिपत्र आरी, डाई (निर्माण), मिलिंग मशीन और धातु, लकड़ी के काम, खनन, पेट्रोलियम और निर्माण उद्योगों द्वारा उपयोग किए जाने वाले खराद (धातु) उपकरण बनाने के लिए किया जाता है।[13]कार्बाइड टूलींग वास्तव में एक सिरेमिक/मेटल कम्पोजिट है, जहां धातु कोबाल्ट WC कणों को जगह में रखने के लिए बाध्यकारी धातु मैट्रिक्स समग्र (मैट्रिक्स) सामग्री के रूप में कार्य करता है। इस प्रकार का औद्योगिक उपयोग वर्तमान टंगस्टन खपत का लगभग 60% है।[69] आभूषण उद्योग निसादित टंगस्टन कार्बाइड, टंगस्टन कार्बाइड/धातु सम्मिश्र, और धात्विक टंगस्टन के छल्ले भी बनाता है।[70] WC/मेटल कम्पोजिट रिंग कोबाल्ट के स्थान पर मेटल मैट्रिक्स के रूप में निकेल का उपयोग करते हैं क्योंकि पॉलिश किए जाने पर यह उच्च चमक लेता है। कभी-कभी निर्माता या खुदरा विक्रेता टंगस्टन कार्बाइड को धातु के रूप में संदर्भित करते हैं, लेकिन यह एक सिरेमिक है।[71] टंगस्टन कार्बाइड की कठोरता के कारण, इस सामग्री से बने छल्ले बेसीमा घर्षण प्रतिरोधी होते हैं, और धातु के टंगस्टन से बने छल्ले की तुलना में लंबे समय तक जले हुए खत्म होते हैं। चूंकि, टंगस्टन कार्बाइड के छल्ले भंगुर होते हैं, और तेज झटका लगने पर फट सकते हैं।[72]
मिश्र
टंगस्टन की कठोरता और गर्मी प्रतिरोध उपयोगी मिश्र धातुओं में योगदान कर सकते हैं। एक अच्छा उदाहरण उच्च गति स्टील है, जिसमें 18% टंगस्टन हो सकता है।[73] टंगस्टन का उच्च गलनांक टंगस्टन को रॉकेट इंजन नोजल जैसे अनुप्रयोगों के लिए एक अच्छी सामग्री बनाता है, उदाहरण के लिए UGM-27 पोलारिस पनडुब्बी-प्रक्षेपित बैलिस्टिक मिसाइल में।[74] टंगस्टन मिश्र धातुओं का उपयोग एयरोस्पेस और ऑटोमोटिव उद्योगों और विकिरण परिरक्षण सहित अनुप्रयोगों की एक विस्तृत श्रृंखला में किया जाता है।[75] टंगस्टन युक्त सुपरऑलॉयज, जैसे हेस्टएलॉय और स्टेटलाइट, का उपयोग टर्बाइन ब्लेड और पहनने के लिए प्रतिरोधी भागों और परत में किया जाता है।
टंगस्टन का ताप प्रतिरोध इसे चाप वेल्डिंग अनुप्रयोगों में उपयोगी बनाता है जब इसे किसी अन्य उच्च-प्रवाहकीय धातु जैसे चांदी या तांबे के साथ जोड़ा जाता है। चांदी या तांबा आवश्यक चालकता प्रदान करता है और टंगस्टन वेल्डिंग रॉड को चाप वेल्डिंग वातावरण के उच्च तापमान का सामना करने की अनुमति देता है।[76]
स्थायी चुंबक
क्वेंच्ड (मार्टेंसिटिक) टंगस्टन स्टील (लगभग 5.5% से 7.0% W 0.5% से 0.7% C के साथ) का उपयोग कठोर स्थायी चुम्बक बनाने के लिए किया गया था, इसकी उच्च अवशेषता और ज़बरदस्ती के कारण, जैसा कि जॉन हॉपकिंसन (1849-1898) ने नोट किया था। 1886 की प्रारंभ में। धातु या मिश्र धातु के चुंबकीय गुण सूक्ष्म संरचना के प्रति बहुत संवेदनशील होते हैं। उदाहरण के लिए, जबकि तत्व टंगस्टन फेरोमैग्नेटिक नहीं है (लेकिन लोहा है), जब यह इन अनुपातों में स्टील में सम्मलित होता है, तो यह मार्टेंसाईट चरण को स्थिर करता है, जिसमें लोहे के एलोट्रोप्स की तुलना में अधिक फेरोमैग्नेटिज्म होता है। फेराइट (लोहा) चरण इसकी वजह से डोमेन दीवार (चुंबकत्व) के लिए अधिक प्रतिरोध।
सैन्य
टंगस्टन, सामान्यतः भारी मिश्र धातु बनाने के लिए निकल, लोहा, या कोबाल्ट के साथ मिश्रधातु का उपयोग काइनेटिक एनर्जी पेनेट्रेटर्स में घटते यूरेनियम के विकल्प के रूप में किया जाता है, उन अनुप्रयोगों में जहां यूरेनियम की रेडियोधर्मिता कम रूप में भी समस्याग्रस्त है, या जहां यूरेनियम के अतिरिक्त पायरोफोरिक गुण वांछित नहीं हैं। (उदाहरण के लिए, शरीर के कवच को भेदने के लिए डिज़ाइन की गई साधारण छोटी हथियारों की गोलियों में)। इसी तरह, सुपरसोनिक छर्रे बनाने के लिए शेल (प्रोजेक्टाइल), ग्रेनेड और मिसाइल में टंगस्टन मिश्र धातुओं का भी उपयोग किया गया है। जर्मनी ने द्वितीय विश्व युद्ध के समय में टंगस्टन का उपयोग एंटी-टैंक गन डिजाइन के लिए गोले का निर्माण करने के लिए किया था, जिसमें गेरलिच स्क्वीज़ बोर सिद्धांत का उपयोग करके बहुत उच्च थूथन वेग प्राप्त किया गया था और तुलनात्मक रूप से छोटे कैलिबर और हल्के वजन वाले क्षेत्र तोपखाने से कवच का पैठ बढ़ाया गया था। हथियार अत्यधिक प्रभावी थे लेकिन शेल कोर में उपयोग होने वाले टंगस्टन की कमी, आंशिक रूप से वोल्फ्राम संकट के कारण हुई, उनके उपयोग को सीमित कर दिया।[citation needed] टंगस्टन का उपयोग घने अक्रिय धातु विस्फोटकों में भी किया गया है, जो एक छोटे दायरे में विस्फोटकों की घातकता को बढ़ाते हुए संपार्श्विक क्षति को कम करने के लिए घने पाउडर के रूप में इसका उपयोग करते हैं।[77]
रासायनिक अनुप्रयोग
टंगस्टन (IV) सल्फाइड एक उच्च तापमान स्नेहक है और हाइड्रोडीसल्फराइजेशन के लिए उत्प्रेरक का एक घटक है।[78] NO2 ऐसे अनुप्रयोगों के लिए अधिक सामान्यतः उपयोग किया जाता है।[79] टंगस्टन ऑक्साइड का उपयोग सिरेमिक ग्लेज़ में किया जाता है और कैल्शियम/मैग्नीशियम टंगस्टेट का उपयोग फ्लोरोसेंट प्रकाश व्यवस्था में व्यापक रूप से किया जाता है। क्रिस्टल टंगस्टेट्स का उपयोग परमाणु भौतिकी और परमाणु चिकित्सा में स्कंटिलेटर के रूप में किया जाता है। अन्य लवण जिनमें टंगस्टन होता है, का उपयोग रासायनिक और टैनिंग (चमड़ा) उद्योगों में किया जाता है।[20] टंगस्टन ऑक्साइड (WO3) कोयले से चलने वाले बिजली संयंत्रों में पाए जाने वाले चयनात्मक उत्प्रेरक कमी (SCR) उत्प्रेरकों में सम्मलित है। ये उत्प्रेरक नाइट्रोजन ऑक्साइड (NOx|NOx) से नाइट्रोजन (N2) और पानी (H2हे) अमोनिया (NH3). टंगस्टन ऑक्साइड उत्प्रेरक की भौतिक शक्ति के साथ मदद करता है और उत्प्रेरक जीवन को बढ़ाता है।[80] टंगस्टन युक्त उत्प्रेरक एपॉक्सीडेशन के लिए आशाजनक हैं,[81] ऑक्सीकरण,[82] और हाइड्रोजनोलिसिस प्रतिक्रियाएं।[83] टंगस्टन हेटरोपॉली अम्लीय मल्टीफंक्शनल उत्प्रेरक के प्रमुख घटक हैं।[84] टंगस्टेट्स को फोटोकैटलिस्ट के रूप में उपयोग किया जा सकता है,[85] जबकि टंगस्टन सल्फाइड विद्युत उत्प्रेरक के रूप में।[86]
आला उपयोग
इसके उच्च घनत्व वाले अनुप्रयोगों में वज़न, मैलोरी धातु, नौकाओं के लिए गिट्टी कील्स, वाणिज्यिक विमानों के लिए टेल गिट्टी, नागरिक और सैन्य हेलीकाप्टरों के लिए रोटर भार और नैसकार और फार्मूला वन के लिए रेस कारों में गिट्टी के रूप में सम्मलित हैं।[87] घनत्व के दोगुने से थोड़ा कम होने के कारण, टंगस्टन को लीड मछली पकड़ने का सिंकर के लिए एक विकल्प (यद्यपि अधिक महंगा) के रूप में देखा जाता है। इसी तरह उच्च घनत्व के कारण इन उद्देश्यों के लिए हटाए गए यूरेनियम का भी उपयोग किया जाता है। 2012 मंगल विज्ञान प्रयोगशाला अंतरिक्ष यान के प्रवेश वाहन हिस्से पर टंगस्टन के पचहत्तर किलोग्राम के ब्लॉक को क्रूज बैलेंस मास डिवाइस के रूप में उपयोग किया गया था। दिलचस्प के लिए डॉली (उपकरण) के रूप में उपयोग करने के लिए यह एक आदर्श सामग्री है, जहां एक कॉम्पैक्ट बार में अच्छे परिणामों के लिए आवश्यक द्रव्यमान प्राप्त किया जा सकता है। उच्च गुणवत्ता वाले डार्ट में निकल, तांबे या लोहे के साथ टंगस्टन के उच्च घनत्व वाले मिश्र धातुओं का उपयोग किया जाता है[88] (एक छोटे व्यास और इस प्रकार सख्त समूहों के लिए अनुमति देने के लिए) या फ्लाई टाईंग के लिए (टंगस्टन मोती फ्लाई को तेजी से सिंक करने की अनुमति देते हैं)। टंगस्टन का उपयोग कोबरा कंपनी की आग की दर को कम करने के लिए एक भारी बोल्ट के रूप में भी किया जाता है | SWD M11/9 सब-मशीन गन 1300 RPM से 700 RPM तक। टंगस्टन ने हाल ही में 3डी प्रिंटिंग के लिए नोजल में उपयोग देखा है; टंगस्टन कार्बाइड के उच्च पहनने के प्रतिरोध और तापीय चालकता से अपघर्षक तंतुओं की छपाई में सुधार होता है।[89] कुछ वाद्य यंत्रों के तार टंगस्टन से लपेटे जाते हैं।[90][unreliable source?] टंगस्टन का उपयोग दो वायेजर कार्यक्रम के कॉस्मिक रे सिस्टम पर इलेक्ट्रॉन टेलीस्कोप पर एक अवशोषक के रूप में किया जाता है।[91]
सोना प्रतिस्थापन
इसका घनत्व, सोने के समान, टंगस्टन को सोने या प्लैटिनम के विकल्प के रूप में गहनों में उपयोग करने की अनुमति देता है।[17][92] धात्विक टंगस्टन hypoallergenic है, और सोने के मिश्र धातु (चूंकि टंगस्टन कार्बाइड जितना कठोर नहीं है) की तुलना में कठिन है, जो इसे अंगूठी (उंगली) के लिए उपयोगी बनाता है जो विशेष रूप से ब्रश खत्म के साथ डिजाइन में होने वाली खरोंच का विरोध करेगा।
क्योंकि घनत्व सोने के समान है (टंगस्टन केवल 0.36% कम घना है), और इसकी कीमत एक-हजारवें क्रम की है, टंगस्टन का उपयोग सोने की सलाखों की जालसाजी में भी किया जा सकता है, जैसे कि टंगस्टन बार को चढ़ाना सोना,[93][94][95] जो 1980 के दशक से देखा जा रहा है,[96] या सम्मलित सोने की पट्टी लेना, छेद करना और हटाए गए सोने को टंगस्टन की छड़ से परिर्वतित किया जाता है।[97] जिसका घनत्व बिल्कुल भी समान नहीं हैं, और सोने और टंगस्टन के अन्य गुण भिन्न हैं, लेकिन सोना चढ़ाया हुआ टंगस्टन सतही परीक्षण पास करेगा।[93] इसमें सोना चढ़ाया हुआ टंगस्टन चीन (टंगस्टन का मुख्य स्रोत) से व्यावसायिक रूप से उपलब्ध है जो दोनों गहनों और बार के रूप में होता है।[98]
इलेक्ट्रॉनिक्स
क्योंकि यह उच्च तापमान पर अपनी ताकत निरंतर रखता है और एक उच्च गलनांक होता है, तात्विक टंगस्टन का उपयोग कई उच्च तापमान अनुप्रयोगों में किया जाता है,[99] जैसे गरमागरम प्रकाश बल्ब, कैथोड रे ट्यूब, और वैक्यूम ट्यूब तंतु, ताप तत्व, और रॉकेट इंजन नोजल।[17] इसका उच्च गलनांक भी टंगस्टन को एयरोस्पेस और उच्च तापमान के उपयोग जैसे बिजली, हीटिंग और वेल्डिंग अनुप्रयोगों के लिए उपयुक्त बनाता है, विशेष रूप से गैस टंगस्टन चाप वेल्डिंग प्रक्रिया (जिसे टंगस्टन निष्क्रिय गैस (टीआईजी) वेल्डिंग भी कहा जाता है) में।[100]
इसके प्रवाहकीय गुणों और सापेक्ष रासायनिक जड़ता के कारण, टंगस्टन का उपयोग इलेक्ट्रोड में भी किया जाता है, और इलेक्ट्रॉन-बीम उपकरणों में उत्सर्जक युक्तियों में भी किया जाता है, जो इलेक्ट्रॉन सूक्ष्मदर्शी जैसे क्षेत्र उत्सर्जन गन का उपयोग करते हैं। इलेक्ट्रॉनिक्स में, टंगस्टन का उपयोग सिलिकॉन डाइऑक्साइड ढांकता हुआ सामग्री और ट्रांजिस्टर के बीच एकीकृत परिपथों में एक इंटरकनेक्ट सामग्री के रूप में किया जाता है। इसका उपयोग धातु की फिल्मों में किया जाता है, जो पारंपरिक इलेक्ट्रॉनिक्स में उपयोग होने वाली वायरिंग को सिलिकॉन पर टंगस्टन (या मोलिब्डेनम) के कोट के साथ बदल देता है।[65]
टंगस्टन की इलेक्ट्रॉनिक संरचना इसे एक्स-रे लक्ष्य के मुख्य स्रोतों में से एक बनाती है,[101][102] और उच्च-ऊर्जा विकिरणों से परिरक्षण के लिए भी (जैसे कि रेडियोफार्मास्युटिकल उद्योग में फ्लूडऑक्सी ग्लूकोज (18F) के रेडियोधर्मी नमूनों के परिरक्षण के लिए)। इसका उपयोग गामा इमेजिंग में एक सामग्री के रूप में भी किया जाता है जिससे इसके उत्कृष्ट परिरक्षण गुणों के कारण कोडित एपर्चर बनाए जाते हैं। टंगस्टन पाउडर का उपयोग प्लास्टिक कंपोजिट में भराव सामग्री के रूप में किया जाता है, जिसका उपयोग गोली, नेतृत्व गढ़ना और रेडिएशन शील्ड में सीसे के गैर विषैले विकल्प के रूप में किया जाता है। चूंकि इस तत्व का उष्मीय विस्तार बोरोसिल ग्लास के समान है, इसका उपयोग ग्लास-टू-मेटल सील बनाने के लिए किया जाता है।[20] इसके उच्च गलनांक के अतिरिक्त, जब टंगस्टन को पोटेशियम से डोप किया जाता है, तो यह आकार की स्थिरता में वृद्धि करता है (गैर-डोप्ड टंगस्टन की तुलना में)। यह सुनिश्चित करता है कि फिलामेंट शिथिल न हो और कोई अवांछित परिवर्तन न हो।[103]
नैनोवायर्स
टॉप-डाउन नैनो फैब्रिकेशन प्रक्रियाओं के माध्यम से, 2002 से टंगस्टन नैनोवायरों का निर्माण और अध्ययन किया गया है।[104] विशेष रूप से उच्च सतह से आयतन अनुपात के कारण, सतह ऑक्साइड परत का निर्माण और ऐसी सामग्री की एकल क्रिस्टल प्रकृति, यांत्रिक गुण बल्क टंगस्टन से मौलिक रूप से भिन्न होते हैं।[105] इस तरह के टंगस्टन नैनोवायरों में नैनो इलेक्ट्रॉनिक्स और महत्वपूर्ण रूप से PH जांच और गैस सेंसर के रूप में संभावित अनुप्रयोग हैं।[106] सिलिकॉन नैनोवायरों की समानता में, टंगस्टन नैनोवायरों को अधिकांशतः बल्क टंगस्टन अग्रदूत से उत्पादित किया जाता है, जिसके पश्चात लंबाई और पहलू अनुपात के संदर्भ में आकृति विज्ञान को नियंत्रित करने के लिए एक उष्मीय ऑक्सीकरण कदम होता है।[107] डील-ग्रोव मॉडल का उपयोग करके इस तरह के उष्मीय ऑक्सीकरण प्रसंस्करण के माध्यम से निर्मित नैनोवायरों के ऑक्सीकरण कैनेटीक्स की भविष्यवाणी करना संभव है।[108]
संलयन शक्ति
अपने उच्च गलनांक और अच्छे क्षरण प्रतिरोध के कारण, टंगस्टन परमाणु संलयन संलयन शक्ति की प्लाज्मा-सामना करने वाली आंतरिक दीवार के सबसे अधिक उजागर वर्गों के लिए एक प्रमुख उम्मीदवार है। इसका उपयोग आईटीईआर (ITER) रिएक्टर में डायवर्टर की प्लाज्मा का सामना करने वाली सामग्री के रूप में किया जाएगा,[109] और वर्तमान में संयुक्त यूरोपीय टोरस परीक्षण रिएक्टर में उपयोग में है।
जैविक भूमिका
टंगस्टन, परमाणु संख्या Z = 74 पर, जैविक रूप से कार्यात्मक होने के लिए जाना जाने वाला सबसे भारी तत्व है। इसका उपयोग कुछ बैक्टीरिया और आर्किया द्वारा किया जाता है,[110] लेकिन यूकैर्योसाइटों में नहीं। उदाहरण के लिए, ऑक्सीडोरडक्टेस नामक एंजाइम मोलिब्डेनम के समान टंगस्टन का उपयोग [[मोलिब्डोपटरिन]] के साथ टंगस्टन-टेरिन कॉम्प्लेक्स में करते हैं (मोलिब्डोप्टेरिन, इसके नाम के अतिरिक्त, मोलिब्डेनम नहीं होता है, लेकिन जीवित जीवों द्वारा उपयोग में मोलिब्डेनम या टंगस्टन के साथ जटिल हो सकता है)। टंगस्टन-उपयोग करने वाले एंजाइम सामान्यतः एल्डिहाइड में कार्बोक्जिलिक अम्लीय को कम करते हैं।[111] टंगस्टन ऑक्सीडोरडक्टेस भी ऑक्सीकरण को उत्प्रेरित कर सकते हैं। खोजे जाने वाले पहले टंगस्टन-आवश्यक एंजाइम को भी सेलेनियम की आवश्यकता होती है, और इस स्थिति में टंगस्टन-सेलेनियम जोड़ी मोलिब्डेनम-सल्फर जोड़ी के कुछ मोलिब्डोप्टेरिन-आवश्यक एंजाइमों के अनुरूप कार्य कर सकती है। [112] ऑक्सीडोरडक्टेस परिवार में एंजाइमों में से एक जो कभी-कभी टंगस्टन (जीवाणु फॉर्मेट डिहाइड्रोजनेज H) को नियोजित करता है, मोलिब्डोप्टेरिन के सेलेनियम-मोलिब्डेनम संस्करण का उपयोग करने के लिए जाना जाता है। [113] एसिटिलीन हाइड्रैटेज़ असामान्य मेटलोएंजाइम है जिसमें यह एक हाइड्रेशन प्रतिक्रिया को उत्प्रेरित करता है। दो प्रतिक्रिया तंत्र प्रस्तावित किए गए हैं, जिनमें से एक में टंगस्टन परमाणु और C≡C ट्रिपल बॉन्ड के बीच सीधा संपर्क है। [114] चूंकि बैक्टीरिया से प्राप्त टंगस्टन-युक्त ज़ैंथिन डिहाइड्रोजनेज में टंगस्टन-मोलिडोप्टेरिन और गैर-प्रोटीन बाध्य सेलेनियम भी पाया गया है, टंगस्टन-सेलेनियम मोलिब्डोप्टेरिन कॉम्प्लेक्स का निश्चित रूप से वर्णन नहीं किया गया है। [115]
मिट्टी में, टंगस्टन धातु टंगस्टेट आयन में ऑक्सीकृत हो जाती है। यह कुछ प्रोकैरियोट द्वारा चुनिंदा या गैर-चयनात्मक रूप से आयात किया जा सकता है और कुछ एंजाइमों में मोलिब्डेनम का विकल्प हो सकता है। इन एंजाइमों की क्रिया पर इसका प्रभाव कुछ स्थितियों में निरोधात्मक और अन्य में सकारात्मक होता है। [116] मिट्टी का रसायन यह निर्धारित करता है कि टंगस्टन कैसे बहुलकित होता है; क्षारीय मिट्टी मोनोमेरिक टंगस्टेट्स का कारण बनती है; अम्लीय मिट्टी पॉलिमरिक टंगस्टेट का कारण बनती है।[117]
केंचुओं पर उनके प्रभाव के लिए सोडियम टंगस्टेट और लेड का अध्ययन किया गया है। निम्न स्तर पर लेड घातक पाया गया और सोडियम टंगस्टेट बहुत कम विषैला था, लेकिन टंगस्टेट ने उनके प्रजनन को पूर्ण रूप से बाधित कर दिया जाता है।[118]
मोलिब्डेनम की क्रिया के समान भूमिका में टंगस्टन को एक जैविक तांबे चयापचय रिसेप्टर विरोधी के रूप में अध्ययन किया गया है। इसमें यह पाया गया है कि टेट्रा थोटुंगस्टेट नमक को जैविक कॉपर केलेशन रसायनों के रूप में उपयोग किया जा सकता है, जैसे टेट्राथियोमोलीबडेट्स।[119]
- ↑ "Standard Atomic Weights: Tungsten". CIAAW. 1991.
- ↑ Berger, Dan. "Why does Tungsten not 'Kick' up an electron from the s sublevel ?". Bluffton College, USA.
- ↑ Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. p. 6-134. ISBN 978-1-4200-9084-0.
- ↑ Tolias P. (2017). "Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications". Nuclear Materials and Energy. 13: 42–57. arXiv:1703.06302. Bibcode:2017arXiv170306302T. doi:10.1016/j.nme.2017.08.002. S2CID 99610871.
- ↑ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds" (PDF). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0486-6. Archived from the original (PDF) on 2011-03-03.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. p. E110. ISBN 978-0-8493-0464-4.
- ↑ "Tungsten". Royal Society of Chemistry. Royal Society of Chemistry. Retrieved May 2, 2020.
- ↑ Jump up to: 8.0 8.1 van der Krogt, Peter. "Wolframium Wolfram Tungsten". Elementymology& Elements Multidict. Archived from the original on 2010-01-23. Retrieved 2010-03-11.
- ↑ "wolfram" on Merriam-Webster.
- ↑ "wolfram" on Oxford Dictionaries.
- ↑ Zhang Y; Evans JRG and Zhang S (January 2011). "हैंडबुक में क्वथनांक और तत्वों के वाष्पीकरण की एन्थैल्पी के लिए सही मान". J. Chem. Eng. Data. 56 (2): 328–337. doi:10.1021/je1011086.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ "राष्ट्रीय विज्ञान और प्रौद्योगिकी संस्थान". physics.nist.gov. May 14, 2022. Retrieved May 14, 2022.
- ↑ Jump up to: 13.0 13.1 13.2 13.3 Daintith, John (2005). रसायन शास्त्र के फ़ाइल शब्दकोश पर तथ्य (4th ed.). New York: Checkmark Books. ISBN 978-0-8160-5649-1.
- ↑ Lassner, Erik; Schubert, Wolf-Dieter (1999). "low temperature brittleness". टंगस्टन: गुण, रसायन, तत्व की तकनीक, मिश्र धातु और रासायनिक यौगिक. Springer. pp. 20–21. ISBN 978-0-306-45053-2.
- ↑ Prakash, C.; Lee, H.; Alucozai, M.; Tomar, V. (2016). "पॉलीक्रिस्टलाइन टंगस्टन में माइक्रोस्ट्रक्चर आश्रित फ्रैक्चर पर अनाज सीमा शक्ति के प्रभाव का विश्लेषण". International Journal of Fracture. 199: 1–20. doi:10.1007/s10704-016-0083-0. S2CID 137928096.
- ↑ Gludovatz, B.; Wurster, S.; Weingärtner, T.; Hoffmann, A.; Pippan, R. (2011). "टंगस्टन के फ्रैक्चर व्यवहार पर अशुद्धियों का प्रभाव". Philosophical Magazine (Submitted manuscript). 91 (22): 3006–3020. Bibcode:2011PMag...91.3006G. doi:10.1080/14786435.2011.558861. S2CID 137145004.
- ↑ Jump up to: 17.0 17.1 17.2 17.3 17.4 Stwertka, Albert (2002). तत्वों के लिए एक गाइड (2nd ed.). New York: Oxford University Press. ISBN 978-0-19-515026-1.
- ↑ McMaster, J. & Enemark, John H. (1998). "मोलिब्डेनम- और टंगस्टन युक्त एंजाइम की सक्रिय साइटें". Current Opinion in Chemical Biology. 2 (2): 201–207. doi:10.1016/S1367-5931(98)80061-6. PMID 9667924.
- ↑ Hille, Russ (2002). "जीव विज्ञान में मोलिब्डेनम और टंगस्टन". Trends in Biochemical Sciences. 27 (7): 360–367. doi:10.1016/S0968-0004(02)02107-2. PMID 12114025.
- ↑ Jump up to: 20.0 20.1 20.2 Hammond, C. R. (2004). तत्व, रसायन विज्ञान और भौतिकी की पुस्तिका में (81st ed.). CRC press. ISBN 978-0-8493-0485-9.
- ↑ McMahon, Malcolm I.; Nelmes, Richard J. (2006). "तात्विक धातुओं में उच्च दबाव संरचनाएं और चरण परिवर्तन". Chemical Society Reviews (in English). 35 (10): 943–963. doi:10.1039/b517777b. ISSN 0306-0012. PMID 17003900.
- ↑ Lassner, Erik; Schubert, Wolf-Dieter (1999). टंगस्टन: गुण, रसायन, तत्व की तकनीक, मिश्र धातु और रासायनिक यौगिक. Springer. p. 9. ISBN 978-0-306-45053-2.
- ↑ Bean, Heather (October 19, 1998). Material Properties and Analysis Techniques for Tungsten Thin Films. frii.com
- ↑ Lita, A. E.; Rosenberg, D.; Nam, S.; Miller, A.; Balzar, D.; Kaatz, L. M.; Schwall, R. E. (2005). "फोटॉन नंबर रिज़ॉल्विंग डिटेक्टरों के निर्माण के लिए टंगस्टन पतली फिल्म सुपरकंडक्टिंग ट्रांज़िशन तापमान की ट्यूनिंग" (PDF). IEEE Transactions on Applied Superconductivity. 15 (2): 3528–3531. Bibcode:2005ITAS...15.3528L. doi:10.1109/TASC.2005.849033. S2CID 5804011. Archived (PDF) from the original on 2013-05-13.
- ↑ Johnson, R. T.; O. E. Vilches; J. C. Wheatley; Suso Gygax (1966). "टंगस्टन की अतिचालकता". Physical Review Letters. 16 (3): 101–104. Bibcode:1966PhRvL..16..101J. doi:10.1103/PhysRevLett.16.101.
- ↑ Autler, S. H.; J. K. Hulm; R. S. Kemper (1965). "सुपरकंडक्टिंग टेक्नटियम-टंगस्टन मिश्र". Physical Review. 140 (4A): A1177–A1180. Bibcode:1965PhRv..140.1177A. doi:10.1103/PhysRev.140.A1177.
- ↑ Shailos, A.; W Nativel; A Kasumov; C Collet; M Ferrier; S Guéron; R Deblock; H Bouchiat (2007). "निकटता प्रभाव और कुछ-परत ग्राफीन में कई एंड्रीव प्रतिबिंब". Europhysics Letters (EPL). 79 (5): 57008. arXiv:cond-mat/0612058. Bibcode:2007EL.....7957008S. doi:10.1209/0295-5075/79/57008. S2CID 119351442.
- ↑ Kasumov, A. Yu.; K. Tsukagoshi; M. Kawamura; T. Kobayashi; Y. Aoyagi; K. Senba; T. Kodama; H. Nishikawa; I. Ikemoto; K. Kikuchi; V. T. Volkov; Yu. A. Kasumov; R. Deblock; S. Guéron; H. Bouchiat (2005). "एक सुपरकंडक्टर-मेटालोफुलरीन-सुपरकंडक्टर आणविक जंक्शन में निकटता प्रभाव". Physical Review B. 72 (3): 033414. arXiv:cond-mat/0402312. Bibcode:2005PhRvB..72c3414K. doi:10.1103/PhysRevB.72.033414. S2CID 54624704.
- ↑ Kirk, M. D.; D. P. E. Smith; D. B. Mitzi; J. Z. Sun; D. J. Webb; K. Char; M. R. Hahn; M. Naito; B. Oh; M. R. Beasley; T. H. Geballe; R. H. Hammond; A. Kapitulnik; C. F. Quate (1987). "उच्च-T_{c} सुपरकंडक्टर Y-Ba-Cu-O में पॉइंट-कॉन्टैक्ट इलेक्ट्रॉन टनलिंग". Physical Review B. 35 (16): 8850–8852. Bibcode:1987PhRvB..35.8850K. doi:10.1103/PhysRevB.35.8850. PMID 9941272.
- ↑ Danevich, F. A.; et al. (2003). "α प्राकृतिक टंगस्टन समस्थानिकों की गतिविधि". Phys. Rev. C. 67 (1): 014310. arXiv:nucl-ex/0211013. Bibcode:2003PhRvC..67a4310D. doi:10.1103/PhysRevC.67.014310. S2CID 6733875.
- ↑ Cozzini, C.; et al. (2004). "टंगस्टन के प्राकृतिक α क्षय का पता लगाना". Phys. Rev. C. 70 (6): 064606. arXiv:nucl-ex/0408006. Bibcode:2004PhRvC..70f4606C. doi:10.1103/PhysRevC.70.064606. S2CID 118891861.
- ↑ Jump up to: 32.0 32.1 32.2 Sonzogni, Alejandro. "न्यूक्लाइड्स का इंटरएक्टिव चार्ट". National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 2008-05-22. Retrieved 2008-06-06.
- ↑ "टंगस्टन: तत्वों की प्रतिक्रिया".
- ↑ Jump up to: 34.0 34.1 Emsley, John E. (1991). अवयव (2nd ed.). New York: Oxford University Press. ISBN 978-0-19-855569-8.
- ↑ Morse, P. M.; Shelby, Q. D.; Kim, D. Y.; Girolami, G. S. (2008). "प्रारंभिक संक्रमण धातुओं के एथिलीन कॉम्प्लेक्स: [HfEt4(C2H4)2− की क्रिस्टल संरचनाएं ] और नकारात्मक-ऑक्सीडेशन-स्टेट प्रजातियां [TaHEt(C2H4)33−] और [WH(C2H4)43−]". Organometallics. 27 (5): 984–993. doi:10.1021/om701189e.
- ↑ Smith, Bradley J.; Patrick, Vincent A. (2000). "183W N.M.R द्वारा सोडियम मेटाटुंगस्टेट प्रजाति का मात्रात्मक निर्धारण स्पेक्ट्रोस्कोपी". Australian Journal of Chemistry. 53 (12): 965. doi:10.1071/CH00140.
- ↑ Borin, Antonio Carlos; Gobbo, João Paulo; Roos, Björn O. (January 2008). "Mo2 अणु के बंधन और इलेक्ट्रॉनिक स्पेक्ट्रम का एक सैद्धांतिक अध्ययन". Chemical Physics. 343 (2–3): 210–216. Bibcode:2008CP....343..210B. doi:10.1016/j.chemphys.2007.05.028. ISSN 0301-0104.
- ↑ Roos, Björn O.; Borin, Antonio C.; Laura Gagliardi (2007). "सहसंयोजक रासायनिक बंधन की अधिकतम बहुलता तक पहुँचना". Angew. Chem. Int. Ed. 46 (9): 1469–72. doi:10.1002/anie.200603600. PMID 17225237.
- ↑ Scheele, Carl Wilhelm (1781) "Tungstens bestånds-delar" (Tungsten's constituents), Kungliga Vetenskaps Academiens Nya Handlingar (Royal Scientific Academy's New Proceedings), 2 : 89–95 (in Swedish).
- ↑ English translation on pp. 4–13 of: de Luyart, John Joseph and Fausto, with Charles Cullen, trans., A Chemical Analysis of Wolfram and Examination of a New Metal, Which Enters its Composition (London, England, G. Nicol, 1785).
- ↑ Jump up to: 41.0 41.1 Saunders, Nigel (2004). टंगस्टन और समूह 3 से 7 के तत्व (आवर्त सारणी). Chicago, Illinois: Heinemann Library. ISBN 978-1-4034-3518-7.
- ↑ "आईटीआईए न्यूजलेटर" (PDF). International Tungsten Industry Association. June 2005. Archived from the original on July 21, 2011. Retrieved 2008-06-18.
{{cite news}}: CS1 maint: unfit URL (link) - ↑ "आईटीआईए न्यूजलेटर" (PDF). International Tungsten Industry Association. December 2005. Archived from the original on July 21, 2011. Retrieved 2008-06-18.
{{cite news}}: CS1 maint: unfit URL (link) - ↑ de Luyart, J.J. and F. (September 1783) "Análisis químico del volfram, y examen de un nuevo metal, que entra en su composición" (Chemical analysis of wolframite, and examination of a new metal, which enters into its composition), Extractos de las Juntas Generales celebradas por la Real Sociedad Bascongada de los Amigos del País en la ciudad de Vitoria por setiembre de 1783, pp. 46–88.
- ↑ de Luyart, John Joseph and Fausto, with Charles Cullen, trans., A Chemical Analysis of Wolfram and Examination of a New Metal, Which Enters its Composition (London, England, G. Nicol, 1785).
- ↑ Caswell, Lyman R. and Stone Daley, Rebecca W. (1999) "The Delhuyar brothers, tungsten, and Spanish silver," Bulletin for the History of Chemistry, 23 : 11–19. Available at: University of Illinois (USA) Archived 2015-12-30 at the Wayback Machine
- ↑ Watson, Greig (2014-06-06). "महत्वपूर्ण WW1 धातु 'दुश्मन के हाथों में'". BBC News. Retrieved 2018-02-10.
- ↑ Stevens, Donald G. (1999). "द्वितीय विश्व युद्ध आर्थिक युद्ध: संयुक्त राज्य अमेरिका, ब्रिटेन और पुर्तगाली वोल्फ्राम". The Historian. 61 (3): 539. doi:10.1111/j.1540-6563.1999.tb01036.x.
- ↑ Wheeler, L. Douglas (Summer 1986). "तटस्थता की कीमत: पुर्तगाल, वोल्फ्राम प्रश्न और द्वितीय विश्व युद्ध". Luso-Brazilian Review. 23 (1): 107–127. JSTOR 3513391.
- ↑ General Electric Co. v. De Forest Radio Co., 28 F.2d 641, 643 (3rd Cir. 1928)
- ↑ Guruswamy, Lakshman D.; McNeely, Jeffrey A. (1998). वैश्विक जैव विविधता का संरक्षण: अभिसारी रणनीतियाँ. Duke University Press. pp. 333–. ISBN 978-0-8223-2188-0.
- ↑ General Electric Co. v. De Forest Radio Co., 28 F.2d 641 (3d Cir. 1928).
- ↑ Jump up to: 53.0 53.1 "टंगस्टन, डब्ल्यू, परमाणु संख्या 74". Institute of rare earths elements and strategic metals.
- ↑ Jump up to: 54.0 54.1 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan". अकार्बनिक रसायन विज्ञान की पाठ्यपुस्तक (in Deutsch) (91–100 ed.). Walter de Gruyter. pp. 1110–1117. ISBN 978-3-11-007511-3.
- ↑ Pope, Michael T.; Müller, Achim (1997). "पॉलीऑक्सोमेटालेट केमिस्ट्री: कई विषयों में नए आयामों वाला एक पुराना क्षेत्र". Angewandte Chemie International Edition. 30: 34–48. doi:10.1002/anie.199100341.
- ↑ Tungsten. Mineral Commodity Summaries. USGS (2017)
- ↑ Jump up to: 57.0 57.1 Shedd, Kim B. (December 2018) Tungsten. 2016 Minerals Yearbook. USGS
- ↑ Tungsten. Mineral Commodity Summaries. USGS (2018)
- ↑ "काम £130m डेवोन टंगस्टन खान पर शुरू होता है". BBC News. 9 June 2014. Archived from the original on 2014-12-05.
- ↑ "कैसे हेमरडॉन खान ने केवल तीन वर्षों में £100m खो दिया". Plymouth Herald. 12 October 2018. Retrieved 24 January 2019.
- ↑ Altenberger, Florian; Raith, Johann G.; Weilbold, Julia; Auer, Christian; Knoll, Tanja; Paulick, Holger; Schedl, Albert; Aupers, Karsten; Schmidt, Steffen; Neinavaie, Hassan (2021-05-07). "पूर्वी आल्प्स में टंगस्टन जमा पर नई रोशनी डालना". Zeitschrift der Deutschen Gesellschaft für Geowissenschaften (in English). 172: 63–72. doi:10.1127/zdgg/2021/0262. S2CID 233912162.
- ↑ Mateus, António; Lopes, Catarina; Martins, Luís; Gonçalves, Mário Abel (June 2021). "पुर्तगाल में वर्तमान और अनुमानित टंगस्टन उत्पादन, और प्रासंगिक ज्ञात संसाधनों तक पहुंच की सुरक्षा की आवश्यकता". Resources (in English). 10 (6): 64. doi:10.3390/resources10060064. ISSN 2079-9276.
- ↑ Kristof, Nicholas D. (2010-06-27). "गैजेट द्वारा मौत". The New York Times. Archived from the original on 2016-08-31.
- ↑ "आपके स्मार्ट फोन के पीछे नरसंहार". The Daily Beast. July 16, 2010. Archived from the original on 2011-11-17.
- ↑ Jump up to: 65.0 65.1 Schey, John A. (1987). विनिर्माण प्रक्रियाओं का परिचय (2nd ed.). McGraw-Hill, Inc.
- ↑ "टंगस्टन मूल्य निर्धारण". International Tungsten Industry Association. Retrieved 18 June 2020.
- ↑ Erik Lassner, Wolf-Dieter Schubert, Eberhard Lüderitz, Hans Uwe Wolf, "Tungsten, Tungsten Alloys, and Tungsten Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a27_229.
- ↑ Tan, C. (2018). "उच्च-प्रदर्शन शुद्ध टंगस्टन का चयनात्मक लेजर पिघलने: पैरामीटर डिजाइन, घनत्व व्यवहार और यांत्रिक गुण". Sci. Technol. Adv. Mater. 19 (1): 370–380. Bibcode:2018STAdM..19..370T. doi:10.1080/14686996.2018.1455154. PMC 5917440. PMID 29707073.
- ↑ Don Law-West; Louis Perron. "टंगस्टन". The Canadian Encyclopaedia. Retrieved 2020-07-18.
- ↑ Tungsten: The Element, History, Uses and Wedding Bands.tungstenworld.com
- ↑ de Laubenfels, Blair; Weber, Christy; Bamberg, Kim (2009). नैक प्लानिंग योर वेडिंग: ए स्टेप-बाय-स्टेप गाइड टू क्रिएटिंग योर परफेक्ट डे. Globe Pequot. pp. 35–. ISBN 978-1-59921-397-2.
- ↑ Schultz, Ken (2009). केन शुल्ज़ की मछली पकड़ने की अनिवार्यता: मीठे पानी और खारे पानी की मछली पकड़ने के लिए आपको केवल एक गाइड की आवश्यकता होती है. John Wiley and Sons. pp. 138–. ISBN 978-0-470-44431-3.
- ↑ "टंगस्टन अनुप्रयोग - स्टील". Azom. 2000–2008. Archived from the original on 2008-08-15. Retrieved 2008-06-18.
- ↑ Ramakrishnan, P. (2007). "Powder metallurgy for Aerospace Applications". पाउडर धातुकर्म: ऑटोमोटिव, इलेक्ट्रिकल / इलेक्ट्रॉनिक और इंजीनियरिंग उद्योग के लिए प्रसंस्करण. New Age International. p. 38. ISBN 978-81-224-2030-2.
- ↑ "टंगस्टन अनुप्रयोग". wolfmet.com. Archived from the original on 2013-09-01.
- ↑ "TIG टॉर्च और TIG टॉर्च पार्ट्स". AES Industrial Supplies Limited (in British English). Retrieved 2021-05-06.
- ↑ Dense Inert Metal Explosive (DIME). Defense-update.com. Retrieved on 2011-08-07.
- ↑ Delmon, Bernard & Froment, Gilbert F. (1999). तेल अंशों का हाइड्रोट्रीटमेंट और हाइड्रोक्रैकिंग: दूसरी अंतर्राष्ट्रीय संगोष्ठी की कार्यवाही, 7वीं यूरोपीय कार्यशाला, एंटवर्पेन, बेल्जियम, नवंबर 14-17, 1999. Elsevier. pp. 351–. ISBN 978-0-444-50214-8. Retrieved 18 December 2011.
- ↑ Mang, Theo & Dresel, Wilfried (2007). स्नेहक और स्नेहन. John Wiley & Sons. pp. 695–. ISBN 978-3-527-61033-4.
- ↑ Spivey, James J. (2002). कटैलिसीस. Royal Society of Chemistry. pp. 239–. ISBN 978-0-85404-224-1. Retrieved 18 December 2011.
- ↑ Lewandowski, Grzegorz; Kujbida, Marcin; Wróblewska, Agnieszka (1 April 2021). "चरण-स्थानांतरण कटैलिसीस स्थितियों के तहत हाइड्रोजन पेरोक्साइड के साथ 1,5,9-साइक्लोडोडेकेट्रीन का एपॉक्सीडेशन: एपॉक्सीडेशन के दौरान चयनित मापदंडों का प्रभाव". Reaction Kinetics, Mechanisms and Catalysis (in English). 132 (2): 983–1001. doi:10.1007/s11144-021-01960-7. ISSN 1878-5204.
- ↑ मो और वी आधारित मिश्रित ऑक्साइड उत्प्रेरक पर प्रोपेन ऑक्सीकरण का काइनेटिक अध्ययन।. 2011. pp. 165–170.
- ↑ Liu, Lujie; Asano, Takehiro; Nakagawa, Yoshinao; Gu, Minyan; Li, Congcong; Tamura, Masazumi; Tomishige, Keiichi (5 September 2021). "ग्लिसरॉल और 1,4-एनहाइड्रोएरिथ्रिटोल के चयनात्मक सीओ हाइड्रोजनोलिसिस में सिलिका-समर्थित प्लैटिनम-टंगस्टन उत्प्रेरक की संरचना और प्रदर्शन संबंध". Applied Catalysis B: Environmental. 292: 120164. doi:10.1016/j.apcatb.2021.120164.
- ↑ Kornas, A.; Śliwa, M.; Ruggiero-Mikołajczyk, M.; Samson, K.; Podobiński, J.; Karcz, R.; Duraczyńska, D.; Rutkowska-Zbik, D.; Grabowski, R. (1 June 2020). "डाइमिथाइल ईथर (DME) में CO2 का प्रत्यक्ष हाइड्रोजनीकरण एक धात्विक क्रिया के रूप में CuO/ZrO2 वाले संकर उत्प्रेरकों पर और एक अम्लीय क्रिया के रूप में हेटरोपॉलीएसिड्स". Reaction Kinetics, Mechanisms and Catalysis (in English). 130 (1): 179–194. doi:10.1007/s11144-020-01778-9. ISSN 1878-5204.
- ↑ Campos, Willison E. O.; Lopes, Anna S. C.; Monteiro, Waldinei R.; Filho, Geraldo N. R.; Nobre, Francisco X.; Luz, Patrícia T. S.; Nascimento, Luís A. S.; Costa, Carlos E. F.; Monteiro, Wesley F.; Vieira, Michele O.; Zamian, José R. (1 October 2020). "दृश्य-प्रकाश-संचालित अनुप्रयोगों की ओर उन्मुख विषमसंरचना के रूप में स्तरित डबल हाइड्रॉक्साइड्स: संश्लेषण, लक्षण वर्णन और इसके फोटोकैटलिटिक गुण". Reaction Kinetics, Mechanisms and Catalysis (in English). 131 (1): 505–524. doi:10.1007/s11144-020-01830-8. ISSN 1878-5204. S2CID 220948033.
- ↑ Maslana, K.; Wenelska, K.; Biegun, M.; Mijowska, E. (5 June 2020). "क्षारीय घोलों में ऑक्सीजन विकास प्रतिक्रियाओं में टंगस्टन डाइसल्फ़ाइड का उच्च उत्प्रेरक प्रदर्शन". Applied Catalysis B: Environmental. 266: 118575. doi:10.1016/j.apcatb.2019.118575. S2CID 213246090.
- ↑ "F1 तकनीक: फॉर्मूला 1 कार में गिट्टी के रहस्य". Auto123.com. 2013-12-25. Retrieved 2019-02-03.
- ↑ Turrell, Kerry (2004). टंगस्टन. Marshall Cavendish. p. 24. ISBN 978-0-7614-1548-0.
- ↑ Duchaine, Simon (2018-03-09). "टंगस्टन कार्बाइड नोजल पहनने के प्रतिरोध और उच्च प्रदर्शन के बीच संतुलन प्रदान करता है". 3dprint.com. Retrieved 2018-10-23.
- ↑ "स्पाइरोकोर टंगस्टन सी स्ट्रिंग क्यों". cello-strings.com. Archived from the original on 2016-05-10.
- ↑ "सीआरएस उपकरण". NASA. Archived from the original on 2017-02-01.
- ↑ Hesse, Rayner W. (2007). "tungsten". ज्वेलरीमेकिंग थ्रू हिस्ट्री: एन इनसाइक्लोपीडिया. Westport, Conn.: Greenwood Press. pp. 190–192. ISBN 978-0-313-33507-5.
- ↑ Jump up to: 93.0 93.1 Gray, Theo (March 14, 2008). "कायल करने वाली नकली सोने की पट्टियां कैसे बनाएं". Popular Science. Archived from the original on December 29, 2014. Retrieved 2008-06-18.
- ↑ "Zinc Dimes, Tungsten Gold & Lost Respect Archived 2011-10-08 at the Wayback Machine", Jim Willie, Nov 18 2009
- ↑ "सबसे बड़ी निजी रिफाइनरी ने सोना चढ़ाया टंगस्टन बार - सिक्का अपडेट की खोज की". news.coinupdate.com.
- ↑ "Austrians Seize False Gold Tied to London Bullion Theft". The New York Times. Reuters. 1983-12-22. Archived from the original on 2012-03-27. Retrieved 2012-03-25.
- ↑ Tungsten filled Gold bars Archived 2012-03-26 at the Wayback Machine, ABC Bullion, Thursday, March 22, 2012
- ↑ Tungsten Alloy for Gold Substitution Archived 2012-03-22 at the Wayback Machine, China Tungsten
- ↑ DeGarmo, E. Paul (1979). निर्माण में सामग्री और प्रक्रियाएं (5th ed.). New York: MacMillan Publishing.
- ↑ Cary, Hoawrd B.; Helzer, Scott (2005). आधुनिक वेल्डिंग तकनीक. 978-0-13-113029-6.: Upper Saddle River. ISBN 978-0-13-113029-6.
{{cite book}}: CS1 maint: location (link) - ↑ Curry, Thomas S.; Dowdey, James E.; Murry, Robert C.; Christensen, Edward E. (1990-08-01). डायग्नोस्टिक रेडियोलॉजी की क्रिस्टेंसेन की भौतिकी. pp. 29–35. ISBN 978-0-8121-1310-5. Archived from the original on 2017-11-11.
- ↑ Hasz, Wayne Charles et al. (August 6, 2002) "X-ray target" U.S. Patent 6,428,904
- ↑ "नॉन-सैग डॉप्ड टंगस्टन - यूनियन सिटी फिलामेंट". Union City Filament. Retrieved 2017-04-28.
- ↑ Li Yadong (2002). "सर्फैक्टेंट-इनऑर्गेनिक मेसोस्ट्रक्चर से लेकर टंगस्टन नैनोवायर तक". Angewandte Chemie. 114 (2): 333–335. Bibcode:2002AngCh.114..343L. doi:10.1002/1521-3773(20020118)41:2<333::AID-ANIE333>3.0.CO;2-5. PMID 12491423.
- ↑ Volker Cimalla (2008). "एकल क्रिस्टलीय टंगस्टन नैनोवायरों के नैनोयांत्रिकी". Journal of Nanomaterials. 2008: 1–9. doi:10.1155/2008/638947.
- ↑ CNR Rao (2006). "टंगस्टन ऑक्साइड नैनोवायरों पर आधारित उच्च-संवेदनशीलता वाले हाइड्रोकार्बन सेंसर". Journal of Materials Chemistry.
- ↑ Liu, M.; Peng, J.; et al. (2016). "सिलिकॉन और टंगस्टन नैनोवायरों में स्व-सीमित ऑक्सीकरण का द्वि-आयामी मॉडलिंग". Theoretical and Applied Mechanics Letters. 6 (5): 195–199. arXiv:1911.08908. doi:10.1016/j.taml.2016.08.002.
- ↑ JTL Thong (2010). "पॉलीक्रिस्टलाइन टंगस्टन नैनोवायर का थर्मल ऑक्सीकरण" (PDF). Journal of Applied Physics. 108 (9): 094312–094312–6. Bibcode:2010JAP...108i4312Y. doi:10.1063/1.3504248. Archived (PDF) from the original on 2017-03-15.
- ↑ Pitts, R. A.; Carpentier, S.; Escourbiac, F.; Hirai, T.; Komarov, V.; Lisgo, S.; Kukushkin, A. S.; Loarte, A.; Merola, M.; Sashala Naik, A.; Mitteau, R. (2013-07-01). "ITER के लिए एक पूर्ण टंगस्टन डायवर्टर: भौतिकी के मुद्दे और डिजाइन की स्थिति". Journal of Nuclear Materials. Proceedings of the 20th International Conference on Plasma-Surface Interactions in Controlled Fusion Devices (in English). 438: S48–S56. Bibcode:2013JNuM..438S..48P. doi:10.1016/j.jnucmat.2013.01.008. ISSN 0022-3115.
- ↑ Johnson JL, Rajagopalan KV, Mukund S, Adams MW. (5 March 1993). "हाइपरथर्मोफिलिक आर्किया से चार एंजाइमों में टंगस्टन कॉफ़ेक्टर के कार्बनिक घटक के रूप में मोलिब्डोप्टेरिन की पहचान". Journal of Biological Chemistry. 268 (7): 4848–52. doi:10.1016/S0021-9258(18)53474-8. PMID 8444863.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Lassner, Erik (1999). टंगस्टन: गुण, रसायन विज्ञान, तत्व की प्रौद्योगिकी, मिश्र धातु और रासायनिक यौगिक. Springer. pp. 409–411. ISBN 978-0-306-45053-2.
- ↑ Stiefel, E. I. (1998). "संक्रमण धातु सल्फर रसायन और मोलिब्डेनम और टंगस्टन एंजाइमों के लिए इसकी प्रासंगिकता" (PDF). Pure Appl. Chem. 70 (4): 889–896. CiteSeerX 10.1.1.614.5712. doi:10.1351/pac199870040889. S2CID 98647064. Archived (PDF) from the original on 2008-12-03.
- ↑ Khangulov, S. V.; et al. (1998). "Escherichia coli से सेलेनियम-युक्त फ़ॉर्मेट डीहाइड्रोजनेज एच: एक मोलिब्डोप्टेरिन एंजाइम जो ऑक्सीजन हस्तांतरण के बिना फ़ॉर्मेट ऑक्सीकरण को उत्प्रेरित करता है". Biochemistry. 37 (10): 3518–3528. doi:10.1021/bi972177k. PMID 9521673.
- ↑ ten Brink, Felix (2014). "Chapter 2. Living on acetylene. A Primordial Energy Source". In Peter M.H. Kroneck; Martha E. Sosa Torres (eds.). पर्यावरण में गैसीय यौगिकों की धातु-चालित जैव-रसायन. Metal Ions in Life Sciences. Vol. 14. Springer. pp. 15–35. doi:10.1007/978-94-017-9269-1_2. ISBN 978-94-017-9268-4. PMID 25416389.
- ↑ Schrader, Thomas; Rienhofer, Annette; Andreesen, Jan R. (1999). "यूबैक्टीरियम बरकेरी से सेलेनियम युक्त ज़ैंथिन डिहाइड्रोजनेज". Eur. J. Biochem. 264 (3): 862–71. doi:10.1046/j.1432-1327.1999.00678.x. PMID 10491134.
- ↑ Andreesen, J. R.; Makdessi, K. (2008). "टंगस्टन, प्रोकैरियोट्स के लिए आश्चर्यजनक रूप से सकारात्मक अभिनय भारी धातु तत्व". Annals of the New York Academy of Sciences. 1125 (1): 215–229. Bibcode:2008NYASA1125..215A. doi:10.1196/annals.1419.003. PMID 18096847. S2CID 19459237.
- ↑ Petkewich, Rachel A. (19 January 2009). "टंगस्टन पर बेचैनी". Chemical & Engineering News. 87 (3): 63–65. doi:10.1021/cen-v087n003.p063.
- ↑ Inouye, L. S.; et al. (2006). "केंचुए में अस्तित्व, विकास और प्रजनन पर टंगस्टन प्रभाव, एसेनिया फेटिडा". Environmental Toxicology and Chemistry. 25 (3): 763–8. doi:10.1897/04-578R.1. PMID 16566161. S2CID 38620368.
- ↑ McQuaid A; Lamand M; Mason J (1994). "थियोटुंगस्टेट-कॉपर इंटरैक्शन II। सामान्य और तांबे से उपचारित चूहों में प्रणालीगत तांबे के चयापचय पर टेट्राथिओटुंगस्टेट के प्रभाव". J Inorg Biochem. 53 (3): 205–18. doi:10.1016/0162-0134(94)80005-7. PMID 8133256.