विकर्ण संबंध
This article needs additional citations for verification. (February 2007) (Learn how and when to remove this template message) |
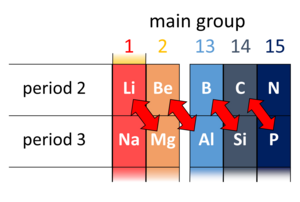
रसायन विज्ञान में आवर्त सारणी के दूसरे और तीसरे काल (पहले 20 तत्व) में तिरछे आसन्न रासायनिक तत्वों के कुछ जोड़े के बीच एक विकर्ण संबंध मौजूद है। ये जोड़े (लिथियम (Li) और मैगनीशियम (Mg), फीरोज़ा (Be) और अल्युमीनियम (Al), बोरॉन (B) और सिलिकॉन (Si), आदि) समान गुण प्रदर्शित करते हैं; उदाहरण के लिए, बोरॉन और सिलिकॉन दोनों अर्धचालक हैं, जो हलाइड्स बनाते हैं जो पानी में हाइड्रोलाइज्ड होते हैं और अम्लीय ऑक्साइड होते हैं।
आवर्त सारणी पर तत्वों का क्षैतिज पंक्तियों और ऊर्ध्वाधर स्तंभों में संगठन कुछ संबंधों को अधिक स्पष्ट करता है (आवर्त नियम)। आवर्त सारणी के दाहिनी ओर जाने और नीचे उतरने से पृथक परमाणुओं के परमाणु त्रिज्या पर विपरीत प्रभाव पड़ता है। आवर्त में दायीं ओर जाने पर परमाणुओं की परमाणु त्रिज्या कम हो जाती है, जबकि समूह में नीचे जाने पर परमाणु त्रिज्या बढ़ जाती है।[1] इसी प्रकार, आवर्त के दायीं ओर जाने पर तत्व उत्तरोत्तर अधिक सहसंयोजक होते जाते हैं[clarification needed], कम क्षारकीय और अधिक वैद्युतीयऋणात्मकता, जबकि एक समूह में नीचे जाने पर तत्व अधिक आयनिक, अधिक क्षारकीय और कम विद्युतऋणात्मक हो जाते हैं। इस प्रकार, एक आवर्त में अवरोही होने और एक तत्व द्वारा एक समूह को पार करने पर, परिवर्तन एक दूसरे को रद्द कर देते हैं, और समान रसायन वाले समान गुणों वाले तत्व अक्सर पाए जाते हैं - परमाणु आकार[clarification needed], इलेक्ट्रोनगेटिविटी, विकर्ण सदस्यों के यौगिकों (और आगे) के गुण समान हैं।
यह पाया गया है कि एक आवर्त 2 तत्व का रसायन अक्सर आवर्त सारणी में उसके दाहिनी ओर एक स्तंभ के आवर्त 3 के तत्व के रसायन के समान होता है। इस प्रकार, Li के रसायन में Mg के रसायन में समानता है, Be के रसायन में Al के रसायन में समानता है, और B के रसायन में Si के रसायन में समानता है। इन्हें विकर्ण संबंध कहा जाता है। (वे बी और सी के बाद ध्यान देने योग्य नहीं हैं।)
विकर्ण संबंधों के अस्तित्व के कारणों को पूरी तरह से समझा नहीं गया है, लेकिन चार्ज घनत्व एक कारक है। उदाहरण के लिए, ली+ +1 आवेश और Mg के साथ एक छोटा धनायन है2+ +2 आवेश के साथ कुछ बड़ा है, इसलिए दोनों आयनों में से प्रत्येक की आयनिक क्षमता लगभग समान है। एक परीक्षा से पता चला कि लिथियम का चार्ज घनत्व अन्य क्षार धातुओं की तुलना में मैग्नीशियम के बहुत करीब है।[2] ली-एमजी जोड़ी (कमरे के तापमान और दबाव के तहत) का उपयोग करना:
- मानक परिस्थितियों में ऑक्सीजन के साथ संयुक्त होने पर, Li और Mg केवल सामान्य ऑक्साइड बनाते हैं जबकि Na पेरोक्साइड बनाता है और Na से नीचे की धातुएँ इसके अलावा सुपरऑक्साइड बनाती हैं।
- ली एकमात्र समूह 1 तत्व है जो एक स्थिर नाइट्राइड, लिथियम नाइट्राइड | ली बनाता है3एन।[3] Mg, साथ ही समूह 2 के अन्य तत्व भी नाइट्राइड बनाते हैं।[3]# लिथियम कार्बोनेट, फॉस्फेट और फ्लोराइड पानी में कम घुलनशील होते हैं। संबंधित समूह 2 लवण अघुलनशील हैं। (जाली और विलायक ऊर्जा सोचो)।
- Li और Mg दोनों सहसंयोजक organometallic यौगिक बनाते हैं। लीमे और एमजीएमई2 (cf. ग्रिग्नार्ड अभिकर्मक) दोनों मूल्यवान सिंथेटिक अभिकर्मक हैं। अन्य समूह 1 और समूह 2 के अनुरूप आयनिक और अत्यंत प्रतिक्रियाशील हैं (और इसलिए हेरफेर करना मुश्किल है)।[4]
- Li और Mg दोनों के क्लोराइड विलक्षण (आसपास से नमी को अवशोषित करते हैं) और अल्कोहल (रसायन) और पिरिडीन में घुलनशील होते हैं। लिथियम क्लोराइड, मैग्नीशियम क्लोराइड की तरह (MgCl2ताहा2O) हाइड्रेटेड क्रिस्टल LiCl·2H से अलग हो जाता है2ओ
- लिथियम कार्बोनेट और मैग्नीशियम कार्बोनेट दोनों अस्थिर हैं और गर्म होने पर संबंधित ऑक्साइड और कार्बन डाइऑक्साइड का उत्पादन कर सकते हैं।
ली-एमजी और बी-अल संबंधों को संक्रमण तत्वों (जैसे स्कैंडियम) में विस्तारित करने के साथ कार्बन-फास्फोरस और नाइट्रोजन-सल्फर के लिए और विकर्ण समानताएं भी सुझाई गई हैं।[5]
संदर्भ
- ↑ Ebbing, Darrell and Gammon, Steven D. (2009). "Atomic Radius". सामान्य रसायन शास्त्र (PDF) (9th ed.). Houghton Mifflin. pp. 312–314. ISBN 978-0-618-93469-0.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Rayner-Canham, Geoffrey (22 December 2013). वर्णनात्मक अकार्बनिक रसायन. Overton, Tina (Sixth ed.). New York, NY. ISBN 978-1-4641-2557-7. OCLC 882867766.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ 3.0 3.1 Clark, Jim (2005). "Reactions of the Group 2 Elements with Air or Oxygen". chemguide. Retrieved January 30, 2012.
- ↑ Shriver, Duward (2006). अकार्बनिक रसायन शास्त्र (4th ed.). Oxford University Press. ISBN 978-0199264636. Li/Mg p. 259; Be/Al p. 274; B/Si p. 288.
- ↑ Rayner-Canham, Geoff (2011-07-01). "आवर्त सारणी में आइसोडायगोनलिटी". Foundations of Chemistry (in English). 13 (2): 121–129. doi:10.1007/s10698-011-9108-y. ISSN 1572-8463. S2CID 97285573.