पोम1
| Pom1 | |
|---|---|
| Identifiers | |
| Organism | |
| Symbol | SPAC2F7.03c |
| Entrez | 2541889 |
पोम1 विखंडन खमीर, शिज़ोसैक्रोमाइसेस पोम्बे (एस. पोम्बे ),में एक ध्रुवीयता प्रोटीन काइनेज है,जो कोशिका के सिरों पर स्थानीयकृत होता है और कोशिका विभाजन को नियंत्रित करता है। जैसे-जैसे कोशिका लंबी होती जाती है, बीच में पोम1 का स्तर कम होता जाता है, जिससे माइटोसिस शुरू हो जाता है।[1]
जीन पोम1 1087 अमीनो एसिड लंबे प्रोटीन के लिए कोड करता है जिसका प्रोटीन काइनेज डोमेन संभवतः कार्बोक्सिल टर्मिनस पर स्थित होता है।[1] पोम1 एक सिग्नलिंग मार्ग को नियंत्रित करता है जिसमें सीडीके 1 शामिल होता है और अंततः माइटोटिक प्रविष्टि को नियंत्रित करता है।[2] उत्परिवर्ती पोम1 वाली कोशिकाएं एक सेप्टा और विकास क्षेत्र बनाती हैं, लेकिन कई असामान्यताएं दिखाती हैं जिनमें सेप्टा का गलत स्थान पर होना या गलत दिशा में होना, एक छोर पर यादृच्छिक वृद्धि के साथ प्रतिस्थापित द्वि-ध्रुवीय वृद्धि, या विकास अक्ष के गलत स्थानीकरण के कारण असामान्य शाखाएं होना शामिल हैं।[1][3]
पोम1 एस पोम्बे सेल के पुराने और नए सिरे को अलग करने में महत्वपूर्ण भूमिका निभाता है। सामान्य कोशिका वृद्धि कोशिका के पुराने सिरे पर तुरंत शुरू हो जाती है और नए सिरे पर विलंबित होती है।[3] पोम1 म्यूटेंट दोनों सिरों पर तत्काल वृद्धि दिखाते हैं। चूंकि पोम1 को नए सिरे पर अत्यधिक संकेंद्रित और पुराने सिरे से लगभग अनुपस्थित दिखाया गया है, यह अन्य कारकों के साथ एक निरोधात्मक संकेत का हिस्सा है जो नए सिरे से तत्काल विकास को रोकता है।[1] पोम1 की अतिअभिव्यक्ति से नए विकास सिरों का निर्माण भी हो सकता है।[3]
पोम1 एक अपेक्षाकृत अनोखा प्रोटीन काइनेज है क्योंकि एस पोम्बे में इसका निकटतम होमोलॉग केवल 55% समान है।अन्य जीवों में होमोलोग्स में चूहों में डायर्क, मनुष्यों में डायर्क2 और डायर्क3, एस. सेरेविसिया [4] में याक1पी, और ड्रोसोफिला और मनुष्यों में मिनीब्रेन शामिल हैं।[1][5]
कोशिका स्थानीयकरण
इंटरफ़ेज़ के दौरान, पोम1 मीडियल कॉर्टिकल नोड्स सहित पूरे सेल में रहता है।कोशिका विभाजन के दौरान ध्रुवों पर पोम1 का स्थानीयकरण टी1 और टी2 द्वारा नियंत्रित होता है।[6][7] टी 1 और टी 2 की अनुपस्थिति में, पोम 1 अपनी किनेज़ गतिविधि को बनाए रखता है, लेकिन कोशिका के सिरों तक स्थानीयकृत नहीं होता है।[3][7] सूक्ष्मनलिका कोशिका में पोम1 को स्थानीयकृत करने में भी मदद करते हैं क्योंकि पोम1 निरूपण को सूक्ष्मनलिका वियोजन के परिणामस्वरूप दिखाया गया है।[1] संरचनात्मक रूप से, पोम1 के उत्प्रेरक और गैर-उत्प्रेरक दोनों क्षेत्र कोशिका अंत स्थानीयकरण के लिए आवश्यक हैं।[3]
सीडीआर2, सीडीआर1, वी1, मिड1, और बीएलटी1 प्रोटीन भी इंटरफेज़ के दौरान औसत दर्जे के नोड पर स्थित होते हैं और माना जाता है कि ये माइटोटिक प्रवेश के लिए सिग्नलिंग मार्ग का हिस्सा हैं।[2][8] कोशिका मध्य में सीडीआर2 स्थानीयकरण को पोम1 और अन्य संकेतों की अभिव्यक्ति द्वारा नियंत्रित किया जाता है क्योंकि पोम1 म्यूटेंट सीडीआर2 को औसत दर्जे के नोड स्थानीयकरण से कोशिका के आधे हिस्से तक फैलने की अनुमति देते हैं।[2]
सेल आकार और स्थानिक प्रवणता
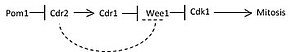
Pom1 एक स्थानिक ढाल बनाता है क्योंकि कोशिकाएं G2 चरण में बढ़ती हैं।[2] चित्र 1 इंटरपेज़ के दौरान पहली अपेक्षाकृत छोटी कोशिका और G2 चरण से गुजरने वाली एक लम्बी कोशिका के पार पोम1 (डार्क शेडिंग द्वारा दिखाया गया) की ढाल को कार्टून रूप में दिखाता है। जैसे-जैसे कोशिकाएँ बढ़ती हैं, Pom1 सांद्रता दो ध्रुवों पर पहुँचती है और कोशिका के केंद्र की ओर घटती जाती है। Cdr2 Pom1 के सघनता प्रवणता से घटते निरोधात्मक संकेत को पढ़ता है और Cdr1 और Blt1 को सक्रिय करता है जो Cdr2 भर्ती के कारण औसत दर्जे के नोड पर स्थानीयकृत थे।[2] Cdr1 तब फॉस्फोराइलेट करता है और Wee1 को रोकता है, Cdr2 की उपस्थिति से औसत दर्जे का नोड भी भर्ती होता है।[2] फॉस्फोराइलेटेड वीई1 सीडीसी25 को सीडीके1 को डीफॉस्फोराइलेट करने और कोशिका को माइटोसिस में ले जाने की अनुमति देता है।[2] चित्र 2 में इस मॉडल के आधार पर आकार-निर्भर माइटोटिक प्रविष्टि के लिए एक सरलीकृत सिग्नलिंग मार्ग दर्शाया गया है। धराशायी रेखा द्वारा दिखाए गए Cdr2 द्वारा सीधे Wee1 के निषेध की पुष्टि की जानी बाकी है।
== Pom1 मॉडल == के टेस्ट
जीएफपी-टैग किए गए पोम1 को चित्रा 1 में विशेषता के रूप में विस्तारित कोशिकाओं में ढाल बनाने के लिए दिखाया गया है। चित्रा 2 के अनुसार, औसत दर्जे का नोड में सीडीआर2 के स्थान पर घटी हुई पोम1 सीडीआर2 के अवरोध को कम करती है। इस मॉडल की बातचीत की पुष्टि में, परिणाम बताते हैं कि delocalized Pom1 वाली कोशिकाएं जो tea1 म्यूटेंट से पूर्ण किनासे गतिविधि को बनाए रखती हैं, माइटोटिक प्रविष्टि में देरी करती हैं। यह संभवतः Cdr2 के निरंतर निषेध के कारण है।[2] आगे के प्रयोग जो पूरे कोर्टेक्स में पोम1 को एक्टोपिक रूप से स्थानीयकृत करते हैं, ने सीडीआर2 नॉकडाउन के बराबर विलंबित माइटोटिक प्रविष्टि को एक बार फिर सुझाव दिया कि पोम1 सीडीआर2 को रोकता है और जैसे ही पोम1 सेल बढ़ाव के साथ कम होता है, सीडीआर2 वीई1 को बाधित करने के लिए एक सिग्नलिंग मार्ग शुरू करता है और अंततः माइटोसिस में प्रवेश करता है।[2]
फ्यूचर रिसर्च
यह स्पष्ट नहीं है कि Cdr2 सीधे Wee1 को रोकता है या यदि यह Cdr1 या अन्य किनेसेस के माध्यम से केवल अप्रत्यक्ष रूप से कार्य करता है। इसके अलावा, Blt1, औसत दर्जे के नोड पर भी स्थानीयकृत है, माइटोटिक प्रवेश नियमन में भूमिका निभा सकता है। Blt1 म्यूटेंट विलंबित माइटोटिक प्रविष्टि के अनुरूप बढ़ी हुई लंबाई दिखाते हैं।[2] हालांकि वर्तमान में अपुष्ट, यह अनुमान लगाया जाता है कि Blt1 वीई1 को बाधित करके कार्य करता है।[2]
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Bahler, J., and Pringle, J.R. “Pom1p, a fission yeast protein kinase that provides positional information for both polarized growth and cytokinesis.” Genes and Development 12, 1356-1370 (1998).
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 Moseley, J.B., Mayeux, A., Paoletti, A. and Nurse, P. “A spatial gradient coordinates cell size and mitotic entry in fission yeast.” Nature 459, 857-861 (2009).
- ↑ 3.0 3.1 3.2 3.3 3.4 Bahler, J., and Nurse, P. “Fission yeast Pom1p kinase activity is cell cycle regulated and essential for cellular symmetry during growth and division.” The EMBO Journal 20, 1064-1073 (2001).
- ↑ Souza, G.M., Lu, S., and Kuspa, A. “YakA, a protein kinase required for the transition from growth to development in Dictyostelium. Development 125, 2291-2302 (1998).
- ↑ Tejedor, F., Zhu, X.R., Kaltenbach, E., Ackermann, A., Baumann, A., Canal, I., Heisenberg, M., Fischbach, K.F., and Pongs, O. “Minibrain: A new protein kinase family involved in postembryonic neurogenesis in Drosophila. Neuron 14, 287-301 (1995).
- ↑ Browning, H., Hayles, J., Mata, J., Aveline, L., Nurse, P. and McIntosh, J.R. “Tea2p is a kinesin-like protein required to generate polarized growth in fission yeast.” The Journal of Cell Biology 151,15-27 (2000).
- ↑ 7.0 7.1 Behrens, R., and Nurse, P. “Roles of fission yeast tea1p in the localization of polarity factors and in organizing the microtubular cytoskeleton.” The Journal of Cell Biology 157, 783-793 (2002).
- ↑ Morrell, J.L., Nichols, C.B., and Gould, K.L. “The GIN4 family kinase, Cdr2p, acts independently of septins in fission yeast. The Journal of Cell Science 117, 5293-5302 (2004).