टेट्रामेरिक प्रोटीन
टेट्रामेरिक प्रोटीन एक प्रोटीन है जिसमें चार उप-इकाई की चतुर्धातुक संरचना होती है। होमो चतुष्टय में चार समान प्रोटीन उप-इकाई होते हैं, और हेटरो चतुष्टय विभिन्न उप-इकाई के मल्टीप्रोटीन कॉम्प्लेक्स होते हैं। एक चतुष्टय को दो होमोडीमर उप-इकाई जैसे सोर्बिटोल डिहाइड्रोजनेज या दो हेटेरोडिमर उप-इकाई जैसे हीमोग्लोबिन के साथ डिमर के रूप में एकत्रित किया जा सकता है।
चतुष्टय में उपइकाई का पारस्परिक प्रभाव
चतुष्टय बनाने वाली उपइकाइयों के बीच पारस्परिक क्रिया मुख्य रूप से गैर सहसंयोजक अंतःक्रिया द्वारा निर्धारित की जाती है।[1] उप-इकाई के बीच इस बाध्यकारी प्रक्रिया के लिए हाइड्रोफोबिक प्रभाव, हाइड्रोजन बंध और स्थिरवैद्युतिकी पारस्परिक प्रभाव प्राथमिक स्रोत हैं। ऐसा माना जाता है कि सॉर्बिटोल डिहाइड्रोजनेज जैसे होमोटेट्रामेरिक प्रोटीन के लिए, संरचना एक मोनोमेरिक से एक डिमेरिक और अंत में विकास के टेट्रामेरिक संरचना के रूप में विकसित हुई है। एसडीएच औरअन्य कई टेट्रामेरिक एंजाइमों में बाध्यकारी प्रक्रिया को मुक्त ऊर्जा में लाभ से वर्णित किया जा सकता है जिसे वियोजन सीमा संबंधों की दर से निर्धारित किया जा सकता है।[1] जिसमे एसडीएच छवि में चार उप-इकाई (ए, बी, सी और डी) की समन्वायोजन देखा जा सकता है।
उप-इकाई के बीच हाइड्रोजन बंध
टेट्रामेरिक प्रोटीन चतुष्क संरचना की स्थिरता के लिए उप-इकाई के बीच हाइड्रोजन बंधित नेटवर्क को महत्वपूर्ण दिखाया गया है। उदाहरण के लिए,एसडीएच का एक अध्ययन जिसमें प्रोटीन अनुक्रम संरेखण, संरचनात्मक तुलना, ऊर्जा गणना, जेल निस्पंदन प्रयोग और एंजाइम कैनेटीक्स प्रयोगों जैसे विविध तरीकों का उपयोग किया गया था, एक महत्वपूर्ण हाइड्रोजन बंधित नेटवर्क को प्रकट कर सकता है जो स्तनधारी एसडीएच में टेट्रामेरिक चतुर्धातुक संरचना को स्थिर करता है।[1]
इम्मुनोलोगि में चतुष्टय्स
इम्यूनोलॉजी में, एंटीजन-विशिष्ट टी कोशिकाओं (विशेष रूप से सीडी 8+ टी कोशिकाओं) की संख्या निर्धारित करने के लिए एमएचसी चतुष्टय्स का उपयोग चतुष्टय परख में किया जा सकता है। MHC चतुष्टय्स पुनः संयोजक वर्ग I MHC पर आधारित होते हैं, जो बैक्टीरियल बीआरए की क्रिया के माध्यम से बायोटिनाइलेटेड होते हैं। इन अणुओं को ब्याज के पेप्टाइड और β2M के साथ मोड़ा जाता है और एक फ्लोरोसेंटली लेबल streptavidin द्वारा चतुष्टयाइज़ किया जाता है। (स्ट्रेप्टाविडिन चार बायोटिन प्रति अणु से बांधता है।) यह चतुष्टय अभिकर्मक विशेष रूप से टी कोशिकाओं को लेबल करेगा जो टी सेल रिसेप्टर्स को व्यक्त करते हैं जो किसी दिए गए पेप्टाइड-एमएचसी कॉम्प्लेक्स के लिए विशिष्ट हैं। उदाहरण के लिए, एक Kb/FAPGNYPAL चतुष्टय विशेष रूप से C57BL/6 माउस में सेंदाई वायरस विशिष्ट साइटोटॉक्सिक टी सेल से जुड़ जाएगा। एंटीजन विशिष्ट प्रतिक्रियाओं को सीडी8+, चतुष्टय+ टी कोशिकाओं के रूप में सभी सीडी8+ लिम्फोसाइटों के अंश के रूप में मापा जा सकता है।
एकल लेबल वाले MHC वर्ग I अणु के विपरीत, एक चतुष्टय का उपयोग करने का कारण यह है कि टेट्राहेड्रल चतुष्टय्स एक बार में तीन टी सेल रिसेप्टर से जुड़ सकते हैं, जिससे विशिष्ट वर्ग I की कम (1 माइक्रोमोलर) आत्मीयता के बावजूद विशिष्ट बंधन की अनुमति मिलती है। -पेप्टाइड-TCR बातचीत। MHC वर्ग II चतुष्टय्स भी बनाए जा सकते हैं, हालांकि व्यावहारिक रूप से इनके साथ काम करना अधिक कठिन है।[2]
होमो चतुष्टय्स और हेटरो चतुष्टय्स
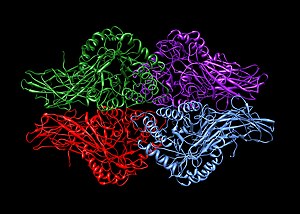

एक होमो चतुष्टय एक प्रोटीन कॉम्प्लेक्स है जो चार समान उप-इकाई से बना होता है जो जुड़े होते हैं लेकिन सहसंयोजक रूप से बंधे नहीं होते हैं।[3] इसके विपरीत, एक हेटरो चतुष्टय एक 4-सबयूनिट कॉम्प्लेक्स है जहां एक या अधिक सबयूनिट भिन्न होते हैं।[4]
होमो चतुष्टय्स के उदाहरणों में शामिल हैं:
- बीटा-ग्लुकुरोनिडेज़ जैसे एंजाइम (चित्रित)
- निर्यात कारक जैसे Escherichia coli से SecB[5]
- CorA जैसे मैगनीशियम आयन ट्रांसपोर्टर।[6]
- लेक्टिन्स जैसे कि कोंकनावेलिन ए
- आईएमपी डिहाइड्रोजनेज और IMPDH2
हेटरो चतुष्टय्स के उदाहरणों में हीमोग्लोबिन (चित्रित), NMDA रिसेप्टर, कुछ एक्वापोरिन,[7] कुछ AMPA रिसेप्टर्स, साथ ही कुछ एंजाइम।[8]
हेटरो चतुष्टय्स का शुद्धिकरण
आयन क्रोमैटोग्राफी|आयन-एक्सचेंज क्रोमैटोग्राफी विशिष्ट हेटरोटेट्रामेरिक प्रोटीन असेंबली को अलग करने के लिए उपयोगी है, जो चार्ज किए गए पेप्टाइड टैग की संख्या और स्थिति दोनों के अनुसार विशिष्ट परिसरों की शुद्धि की अनुमति देता है।[9][10] एफिनिटी क्रोमैटोग्राफी # इमोबिलाइज्ड मेटल आयन एफिनिटी क्रोमैटोग्राफी को हेटरो चतुष्टय शुद्धि के लिए भी नियोजित किया जा सकता है।[11]
आंतरिक पूरकता
एक जीन द्वारा एन्कोड किए गए पॉलीपेप्टाइड की कई प्रतियां अक्सर एक मल्टीमर के रूप में संदर्भित समुच्चय का निर्माण कर सकती हैं। जब किसी विशेष जीन के दो अलग-अलग उत्परिवर्तित युग्मविकल्पियों द्वारा निर्मित पॉलीपेप्टाइड्स से एक बहुउद्देशीय का निर्माण होता है, तो मिश्रित बहुगुणक अकेले प्रत्येक उत्परिवर्तियों द्वारा निर्मित अमिश्रित बहुगुणकों की तुलना में अधिक कार्यात्मक गतिविधि प्रदर्शित कर सकता है। जब एक मिश्रित मल्टीमर अमिश्रित मल्टीमर्स के सापेक्ष बढ़ी हुई कार्यक्षमता प्रदर्शित करता है, तो इस घटना को पूरकता (आनुवांशिकी) के रूप में संदर्भित किया जाता है। मनुष्यों में, argininosuccinate lyase (ASL) एक होमोटेट्रामेरिक एंजाइम है जो अंतर्गर्भाशयी पूरकता से गुजर सकता है। मनुष्यों में एएसएल विकार एएसएल जीन में उत्परिवर्तन से उत्पन्न हो सकता है, विशेष रूप से उत्परिवर्तन जो टेट्रामेरिक एंजाइम की सक्रिय साइट को प्रभावित करते हैं। एएसएल विकार काफी नैदानिक और आनुवंशिक विषमता से जुड़ा हुआ है, जिसे विभिन्न व्यक्तिगत रोगियों के बीच होने वाले व्यापक अंतर्गर्भाशयी पूरकता को प्रतिबिंबित करने के लिए माना जाता है।[12][13][14]
संदर्भ
- ↑ 1.0 1.1 1.2 Hellgren M, Kaiser C, de Haij S, Norberg A, Höög JO (December 2007). "A hydrogen-bonding network in mammalian sorbitol dehydrogenase stabilizes the tetrameric state and is essential for the catalytic power". Cellular and Molecular Life Sciences. 64 (23): 3129–3138. doi:10.1007/s00018-007-7318-1. PMID 17952367. S2CID 22090973.
- ↑ Dolton G, Tungatt K, Lloyd A, Bianchi V, Theaker SM, Trimby A, et al. (September 2015). "More tricks with tetramers: a practical guide to staining T cells with peptide-MHC multimers". Immunology. 146 (1): 11–22. doi:10.1111/imm.12499. PMC 4552497. PMID 26076649.
- ↑ "GO term: protein homotetramerization". YeastGenome. Archived from the original on 27 September 2011. Retrieved 14 May 2011.
- ↑ "GO term: protein heterotetramerization". YeastGenome. Archived from the original on 27 September 2011. Retrieved 14 May 2011.
- ↑ Watanabe M, Blobel G (April 1989). "Cytosolic factor purified from Escherichia coli is necessary and sufficient for the export of a preprotein and is a homotetramer of SecB". Proceedings of the National Academy of Sciences of the United States of America. 86 (8): 2728–2732. Bibcode:1989PNAS...86.2728W. doi:10.1073/pnas.86.8.2728. PMC 286991. PMID 2649892.
- ↑ Warren MA, Kucharski LM, Veenstra A, Shi L, Grulich PF, Maguire ME (July 2004). "The CorA Mg2+ transporter is a homotetramer". Journal of Bacteriology. 186 (14): 4605–4612. doi:10.1128/JB.186.14.4605-4612.2004. PMC 438605. PMID 15231793.
- ↑ Neely JD, Christensen BM, Nielsen S, Agre P (August 1999). "Heterotetrameric composition of aquaporin-4 water channels". Biochemistry. 38 (34): 11156–11163. doi:10.1021/bi990941s. PMID 10460172.
- ↑ Chang TH, Hsieh FL, Ko TP, Teng KH, Liang PH, Wang AH (February 2010). "Structure of a heterotetrameric geranyl pyrophosphate synthase from mint (Mentha piperita) reveals intersubunit regulation". The Plant Cell. 22 (2): 454–467. doi:10.1105/tpc.109.071738. PMC 2845413. PMID 20139160.
- ↑ Sakash JB, Kantrowitz ER (September 2000). "The contribution of individual interchain interactions to the stabilization of the T and R states of Escherichia coli aspartate transcarbamoylase". The Journal of Biological Chemistry. 275 (37): 28701–28707. doi:10.1074/jbc.M005079200. PMID 10875936.
- ↑ Fairhead M, Krndija D, Lowe ED, Howarth M (January 2014). "Plug-and-play pairing via defined divalent streptavidins". Journal of Molecular Biology. 426 (1): 199–214. doi:10.1016/j.jmb.2013.09.016. PMC 4047826. PMID 24056174.
- ↑ Howarth M, Chinnapen DJ, Gerrow K, Dorrestein PC, Grandy MR, Kelleher NL, et al. (April 2006). "A monovalent streptavidin with a single femtomolar biotin binding site". Nature Methods. 3 (4): 267–273. doi:10.1038/nmeth861. PMC 2576293. PMID 16554831.
- ↑ Turner MA, Simpson A, McInnes RR, Howell PL (August 1997). "Human argininosuccinate lyase: a structural basis for intragenic complementation". Proceedings of the National Academy of Sciences of the United States of America. 94 (17): 9063–9068. Bibcode:1997PNAS...94.9063T. doi:10.1073/pnas.94.17.9063. PMC 23030. PMID 9256435.
- ↑ Yu B, Howell PL (October 2000). "Intragenic complementation and the structure and function of argininosuccinate lyase". Cellular and Molecular Life Sciences. 57 (11): 1637–1651. doi:10.1007/PL00000646. PMID 11092456. S2CID 1254964.
- ↑ Yu B, Thompson GD, Yip P, Howell PL, Davidson AR (December 2001). "Mechanisms for intragenic complementation at the human argininosuccinate lyase locus". Biochemistry. 40 (51): 15581–15590. doi:10.1021/bi011526e. PMID 11747433.
