झिल्ली विभव

झिल्ली क्षमता (ट्रांसमेम्ब्रेन क्षमता या झिल्ली वोल्टेज) जैविक कोशिका के आंतरिक एवं बाहरी के मध्य विद्युत क्षमता में अंतर है। अर्थात्, विद्युत आवेशों को आंतरिक से बाहरी सेलुलर वातावरण में जाने के लिए आवश्यक ऊर्जा में अंतर होता है एवं इसके विपरीत, जब तक गतिज ऊर्जा का अधिग्रहण या विकिरण का उत्पादन नहीं होता है। आवेशों की सान्द्रता प्रवणता सीधे इस ऊर्जा आवश्यकता को निर्धारित करती है। सेल के बाहरी भाग के लिए, झिल्ली क्षमता के विशिष्ट मान, सामान्य रूप से mV की इकाइयों में दिए जाते हैं एवं mV के रूप में दर्शाए जाते हैं, जो -80 mV से -40 mV तक होते हैं।
सभी जन्तु कोशिकाएं कोशिका झिल्ली से घिरी होती हैं जो लिपिड बिलेयर से बनी होती है जिसमें प्रोटीन अंतःस्थापित होता है। झिल्ली आयनों की गति के लिए इन्सुलेटर एवं प्रसार बाधा दोनों के रूप में कार्य करती है। ट्रांसमेम्ब्रेन प्रोटीन, जिसे आयन ट्रांसपोर्टर या आयन पंप प्रोटीन के रूप में भी जाना जाता है, सक्रिय रूप से झिल्ली के पार आयनों को विस्तारित करता है एवं झिल्ली के पार सांद्रता प्रवणता स्थापित करता है, एवं आयन चैनल को सांद्रता प्रवणताओं के नीचे झिल्ली में जाने की अनुमति देते हैं। आयन पंप एवं आयन चैनल विद्युत रूप से झिल्ली में डाली गई बैटरी एवं प्रतिरोधों के समूह के समतुल्य होते हैं, इसलिए झिल्ली के दोनों किनारों के मध्य वोल्टेज बनाते हैं।
लगभग सभी प्लाज्मा झिल्लियों में विद्युत क्षमता होती है, जिसके अंदर सामान्यतः बाहर के संबंध में नकारात्मक होती है।[1] झिल्ली क्षमता के दो वास्तविक कार्य हैं। सबसे पहले, यह सेल को बैटरी के रूप में कार्य करने की अनुमति देता है, झिल्ली में एम्बेडेड विभिन्न प्रकार के "आणविक उपकरणों" को संचालित करने की शक्ति प्रदान करता है।[2] दूसरा, विद्युत रूप से उत्तेजनीय कोशिकाओं जैसे न्यूरॉन्स एवं पेशी कोशिकाओं में, इसका उपयोग कोशिका के विभिन्न भागों के मध्य संकेतों को प्रसारित करने के लिए किया जाता है। झिल्ली में बिंदु पर आयन चैनलों को खोलने या बंद करने से सिग्नल उत्पन्न होते हैं, जिससे झिल्ली क्षमता में स्थानीय परिवर्तन होता है। विद्युत क्षेत्र में इस परिवर्तन को झिल्ली में आसन्न या अधिक दूर के आयन चैनलों द्वारा शीघ्रता से अनुभूत किया जा सकता है। वे आयन चैनल सिग्नल को पुन: उत्पन्न करने वाले संभावित परिवर्तन के परिणामस्वरूप खुल या बंद हो सकते हैं।
अन्य-उत्तेजक कोशिकाओं में, एवं उनके आधारभूत राज्यों में उत्तेजनीय कोशिकाओं में, झिल्ली क्षमता अपेक्षाकृत स्थिर मूल्य पर होती है, जिसे विश्राम क्षमता कहा जाता है। न्यूरॉन्स के लिए, विश्राम क्षमता को -80 से -70 मिलीवोल्ट तक के रूप में परिभाषित किया गया है; अर्थात्, सेल के आंतरिक भाग में वोल्ट के दसवें भाग से अल्प ऋणात्मक आधारभूत वोल्टेज होता है। आयन चैनलों के खुलने एवं बंद होने से विश्राम क्षमता से प्रस्थान हो सकता है। इसे विध्रुवण कहा जाता है यदि आंतरिक वोल्टेज अल्प ऋणात्मक हो जाता है (जैसे -70 mV से -60 mV), या अतिध्रुवीकरण (जीव विज्ञान) यदि आंतरिक वोल्टेज (-70 mV से -80 mV तक) अधिक ऋणात्मक हो जाता है । उत्तेजनीय कोशिकाओं में, पर्याप्त रूप से बड़ा विध्रुवण ऐक्शन पोटेंशिअल उत्पन्न कर सकता है, जिसमें झिल्ली क्षमता अल्प समय के लिए (1 से 100 मिलीसेकंड के क्रम में) शीघ्रता से एवं महत्वपूर्ण रूप से परिवर्तित होती है, प्रायः इसकी ध्रुवीयता को परिवर्तित कर देती है एक्शन पोटेंशिअल कुछ वोल्टेज-गेटेड आयन चैनलों की सक्रियता से उत्पन्न होते हैं।
न्यूरॉन्स में, झिल्ली क्षमता को प्रभावित करने वाले विविध कारक होते हैं। उनमें अनेक प्रकार के आयन चैनल सम्मिलित हैं, जिनमें से कुछ रासायनिक रूप से हैं एवं कुछ वोल्टेज-रूप से हैं। क्योंकि वोल्टेज-आयन चैनल झिल्ली क्षमता द्वारा नियंत्रित होते हैं, जबकि झिल्ली क्षमता स्वयं इन्हीं आयन चैनलों से प्रभावित होती है, फीडबैक लूप जो जटिल लौकिक गतिकी की अनुमति देते हैं, जिसमें दोलन एवं पुनर्योजी घटनाएं जैसे क्रिया क्षमता सम्मिलित हैं।
भौतिक आधार
कोशिका में झिल्ली क्षमता अंततः दो कारकों: विद्युत बल एवं प्रसार से उत्पन्न होती है। विद्युत बल विपरीत विद्युत आवेशों (सकारात्मक एवं ऋणात्मक) वाले कणों के मध्य परस्पर आकर्षण एवं आवेश वाले कणों के मध्य पारस्परिक प्रतिकर्षण (धनात्मक या दोनों ऋणात्मक) से उत्पन्न होता है। कणों की सांख्यिकीय प्रवृत्ति से प्रसार उन क्षेत्रों से पुनर्वितरण के लिए उत्पन्न होता है जहां वे उन क्षेत्रों में अत्यधिक केंद्रित होते हैं जहां एकाग्रता अल्प होती है।
वोल्टेज
वोल्टेज, जो विद्युत क्षमता में अंतर का पर्याय है, एवं यह प्रतिरोध में विद्युत प्रवाह की क्षमता है। वास्तव में, वोल्टेज की सबसे सरल परिभाषा ओम के नियम द्वारा दी गई है: V = IR, जहाँ V वोल्टेज है, I धारा एवं R प्रतिरोध है। यदि वोल्टेज स्रोत जैसे कि बैटरी को विद्युत परिपथ में रखा जाता है, तो स्रोत का वोल्टेज जितना अधिक होगा, उतनी ही अधिक मात्रा में यह उपलब्ध प्रतिरोध में प्रवाहित होगा। वोल्टेज का कार्यात्मक महत्व केवल परिपथ में दो बिंदुओं के मध्य संभावित अंतरों में निहित है। बिंदु पर वोल्टेज का विचार अर्थहीन है। परिपथ के कुछ इच्छानुसार रूप से चयन किये गए तत्व के लिए शून्य का वोल्टेज असाइन करना इलेक्ट्रॉनिक्स में पारंपरिक है, एवं फिर उस शून्य बिंदु के सापेक्ष मापे गए अन्य तत्वों के लिए वोल्टेज असाइन करना होता है। इसमें कोई महत्व नहीं है कि किस तत्व को शून्य बिंदु के रूप में चयन किया जाता है- परिपथ का कार्य केवल अंतर पर निर्भर करता है न कि वोल्टेज पर निर्भर करता है। चूँकि, अधिकांशतः स्तिथियों में, शून्य स्तर को प्रायः परिपथ के भाग को प्रदान किया जाता है जो भूमि के संपर्क में होता है।
कोशिका विज्ञान में वोल्टेज पर भी यही सिद्धांत प्रारम्भ होता है। विद्युत रूप से सक्रिय ऊतक में, किसी भी दो बिंदुओं के मध्य संभावित अंतर को प्रत्येक बिंदु पर इलेक्ट्रोड डालकर मापा जा सकता है, उदाहरण के लिए सेल के अंदर एवं बाहर, एवं दोनों इलेक्ट्रोड को विशेष वाल्टमीटर के सार से जोड़कर मापा जाता है। प्रथा के अनुसार, शून्य संभावित मान को सेल के बाहर के लिए नियत किया जाता है एवं बाहरी एवं अंदर के मध्य बाहरी शून्य के सापेक्ष अंदर की क्षमता से निर्धारित होता है।
गणितीय शब्दों में, वोल्टेज की परिभाषा विद्युत क्षेत्र E की अवधारणा से प्रारंभ होती है, सदिश क्षेत्र जो अंतरिक्ष में प्रत्येक बिंदु को परिमाण एवं दिशा प्रदान करता है। अनेक स्थितियों में, विद्युत क्षेत्र रूढ़िवादी क्षेत्र है, जिसका अर्थ है कि इसे अदिश फलन V की प्रवणता के रूप में E = –∇V व्यक्त किया जा सकता है, इस अदिश क्षेत्र V को वोल्टेज वितरण के रूप में जाना जाता है। परिभाषा एकीकरण के इच्छानुसार स्थिरांक की अनुमति देती है- यही कारण है कि वोल्टेज के निरपेक्ष मान अर्थपूर्ण नहीं हैं। सामान्यतः, विद्युत क्षेत्रों को रूढ़िवादी माना जा सकता है यदि चुंबकीय क्षेत्र उन्हें महत्वपूर्ण रूप से प्रभावित नहीं करते हैं, किन्तु यह स्थिति सामान्यतः जैविक ऊतक पर उत्तम प्रकार से प्रारम्भ होती है।
क्योंकि विद्युत क्षेत्र वोल्टेज वितरण की प्रवणता है, छोटे क्षेत्र में वोल्टेज में शीघ्रता से परिवर्तन दृढ़ विद्युत क्षेत्र का संकेत देता है; इसके विपरीत, यदि किसी बड़े क्षेत्र में वोल्टेज लगभग समान रहता है, तो उस क्षेत्र में विद्युत क्षेत्र शक्तिहीन होना चाहिए। दृढ़ विद्युत क्षेत्र, दृढ़ वोल्टेज प्रवणता के समान रहता है इसका तात्पर्य है कि किसी भी आवेशित कण पर दृढ़ बल लगाया जाता है जो क्षेत्र के अंदर होता है।
आयन एवं अपनी गति चलाने वाले बल

जैविक जीवों के अंदर विद्युत संकेत सामान्य रूप से आयनों द्वारा संचालित होते हैं।[4] ऐक्शन पोटेंशिअल के लिए सबसे महत्वपूर्ण धनायन सोडियम (Na+) एवं पोटैशियम (K+) हैं।Cite error: Closing </ref> missing for <ref> tag ये दोनों संयोजक धनायन हैं जो धनात्मक आवेश को वहन करते हैं। ऐक्शन पोटेंशिअल में कैल्शियम (Ca2+), भी सम्मिलित हो सकता है,[5] जो कि द्विसंयोजक धनायन है जिसमें दोहरा धनात्मक आवेश होता है। क्लोराइड आयन (Cl−) कुछ शैवाल की क्रिया क्षमता में प्रमुख भूमिका निभाता है,[5] किन्तु अधिकांश जानवरों की क्रिया क्षमता में नगण्य भूमिका निभाता है। संदर्भ>नट श्मिट-नीलसन|श्मिट-नीलसन, पृ. 483.</ref>
आयन कोशिका झिल्ली को दो प्रभावों के अनुसार पार करते हैं: प्रसार एवं विद्युत क्षेत्र। सरल उदाहरण जिसमें दो समाधान-A एवं B अवरोध से भिन्न होते हैं, यह दर्शाता है कि प्रसार यह सुनिश्चित करेगा कि वे अंततः समान समाधानों में युग्मित हो जायेंगे। यह मिश्रण उनकी सांद्रता में अंतर के कारण होता है। उच्च सांद्रता वाला क्षेत्र अल्प सांद्रता वाले क्षेत्र की ओर विस्तारित हो जाएगा। उदाहरण का विस्तार करने के लिए, समाधान A में 30 सोडियम आयन एवं 30 क्लोराइड आयन हैं। साथ ही, मान लें कि विलयन B में केवल 20 सोडियम आयन एवं 20 क्लोराइड आयन हैं। यह मानते हुए कि अवरोध दोनों प्रकार के आयनों को इसके माध्यम से यात्रा करने की अनुमति देता है, तब स्थिर स्थिति प्राप्त होगी जिससे दोनों समाधानों में 25 सोडियम आयन एवं 25 क्लोराइड आयन होंगे। यदि, चूँकि, बाधा चयनात्मक है जिसके माध्यम से आयनों को जाने दिया जाता है, तो केवल विसरण परिणामी समाधान का निर्धारण नहीं करेगा। पिछले उदाहरण में, अवरोध का निर्माण करते हुए जो केवल सोडियम आयनों के लिए पारगम्य है। अब, केवल सोडियम को समाधान A में इसकी उच्च सांद्रता से समाधान B में अल्प सांद्रता तक बाधा को पार करने की अनुमति है। इसके परिणामस्वरूप समाधान B में क्लोराइड आयनों की तुलना में सोडियम आयनों का अधिक संचय होगा एवं सोडियम आयनों की संख्या अल्प होगी।
इसका तात्पर्य यह है कि नकारात्मक रूप से आवेशित किए गए क्लोराइड आयनों की तुलना में धनात्मक रूप से आवेशित किए गए सोडियम आयनों की उच्च सांद्रता से समाधान B में शुद्ध धनात्मक आवेश होता है। इसी प्रकार, धनात्मक सोडियम आयनों की तुलना में नकारात्मक क्लोराइड आयनों की अधिक सांद्रता से समाधान A में शुद्ध नकारात्मक आवेश होता है। चूँकि विपरीत आवेश आकर्षित होते हैं एवं समान आवेश प्रतिकर्षित होते हैं, आयन अब विद्युत क्षेत्रों के साथ-साथ विसरण की शक्तियों से भी प्रभावित होते हैं। इसलिए, धनात्मक सोडियम आयनों की अधिक-धनात्मक B समाधान की यात्रा करने की संभावना अल्प होगी एवं अधिक-नकारात्मक A समाधान में बने रहेंगे। जिस बिंदु पर विद्युत क्षेत्र के बल विसरण के कारण बल का पूर्ण रूप से प्रतिकार करते हैं उसे संतुलन क्षमता कहा जाता है। इस बिंदु पर, विशिष्ट आयन (इस स्थिति में सोडियम) का शुद्ध प्रवाह शून्य है।
प्लाज्मा झिल्ली

प्रत्येक कोशिका प्लाज़्मा झिल्ली में घिरी होती है, जिसमें लिपिड बाईलेयर की संरचना होती है जिसमें अनेक प्रकार के बड़े अणु सन्निहित होते हैं। क्योंकि यह लिपिड अणुओं से बना है, प्लाज्मा झिल्ली में आंतरिक रूप से उच्च विद्युत प्रतिरोधकता होती है, दूसरे शब्दों में आयनों के लिए अल्प आंतरिक पारगम्यता होती है। चूँकि, झिल्ली में एम्बेडेड कुछ अणु सक्रिय रूप से आयनों को झिल्ली के ओर से दूसरी ओर ले जाने या चैनल प्रदान करने में सक्षम होते हैं जिसके माध्यम से वे स्थानांतरित हो सकते हैं।[6]
विद्युत शब्दावली में, प्लाज्मा झिल्ली एक संयुक्त प्रतिरोधक और संधारित्र के रूप में कार्य करती है। प्रतिरोध इस तथ्य से उत्पन्न होता है कि झिल्ली इसके पार आवेशों की गति को बाधित करती है। कैपेसिटेंस इस तथ्य से उत्पन्न होता है कि लिपिड बाइलेयर इतना पतला होता है कि एक तरफ आवेशित कणों का संचय एक विद्युत बल को जन्म देता है जो विपरीत आवेशित कणों को दूसरी ओर खींचता है। झिल्ली की समाई इसमें निहित अणुओं से अपेक्षाकृत अप्रभावित होती है, इसलिए इसमें 2 μF/cm पर अनुमानित मूल्य कम या ज्यादा होता है।2 (झिल्ली के एक पैच की कुल धारिता उसके क्षेत्रफल के समानुपाती होती है)। दूसरी ओर, एक शुद्ध लिपिड बाईलेयर का चालन इतना कम होता है कि जैविक स्थितियों में यह हमेशा एम्बेडेड अणुओं द्वारा प्रदान किए गए वैकल्पिक मार्गों के संचालन पर हावी रहता है। इस प्रकार, झिल्ली की समाई कमोबेश स्थिर होती है, लेकिन प्रतिरोध अत्यधिक परिवर्तनशील होता है।
प्लाज्मा झिल्ली की मोटाई लगभग 7-8 नैनोमीटर होने का अनुमान है। क्योंकि झिल्ली इतनी पतली होती है, इसके भीतर एक मजबूत विद्युत क्षेत्र बनाने के लिए बहुत बड़े ट्रांसमेम्ब्रेन वोल्टेज की आवश्यकता नहीं होती है। पशु कोशिकाओं में विशिष्ट झिल्ली क्षमता 100 मिलीवोल्ट (अर्थात् वोल्ट का दसवां हिस्सा) के क्रम में होती है, लेकिन गणना से पता चलता है कि यह एक विद्युत क्षेत्र उत्पन्न करता है जो झिल्ली को बनाए रख सकता है - यह गणना की गई है कि एक वोल्टेज 200 मिलिवोल्ट से बहुत बड़ा अंतर परावैद्युत विखंडन का कारण बन सकता है, अर्थात, झिल्ली के आर-पार उत्पन्न हो सकता है।
सुविधाजनक प्रसार और परिवहन

एक शुद्ध लिपिड बाईलेयर का इसके पार आयनों के पारित होने का प्रतिरोध बहुत अधिक है, लेकिन झिल्ली में एम्बेडेड संरचनाएं आयन गति को बढ़ा सकती हैं, या तो सक्रिय परिवहन या निष्क्रिय परिवहन, तंत्र के माध्यम से जिसे सुगम परिवहन और सुगम प्रसार कहा जाता है। दो प्रकार की संरचनाएं जो सबसे बड़ी भूमिका निभाती हैं, आयन चैनल और आयन ट्रांसपोर्टर हैं, दोनों आमतौर पर प्रोटीन अणुओं के संयोजन से बनती हैं। आयन चैनल मार्ग प्रदान करते हैं जिसके माध्यम से आयन स्थानांतरित हो सकते हैं। ज्यादातर मामलों में, एक आयन चैनल केवल विशिष्ट प्रकार के आयनों (उदाहरण के लिए, सोडियम और पोटेशियम लेकिन क्लोराइड या कैल्शियम नहीं) के लिए पारगम्य होता है, और कभी-कभी पारगम्यता आयन आंदोलन की दिशा के आधार पर भिन्न होती है। आयन पंप, जिसे आयन ट्रांसपोर्टर या वाहक प्रोटीन के रूप में भी जाना जाता है, सक्रिय रूप से विशिष्ट प्रकार के आयनों को झिल्ली के एक तरफ से दूसरी तरफ ले जाता है, कभी-कभी ऐसा करने के लिए चयापचय प्रक्रियाओं से प्राप्त ऊर्जा का उपयोग करता है।
आयन पंप
आयन ट्रांसपोर्टर अभिन्न झिल्ली प्रोटीन होते हैं जो सक्रिय परिवहन करते हैं, यानी आयनों को उनकी सांद्रता प्रवणता के खिलाफ पंप करने के लिए सेलुलर ऊर्जा (एटीपी) का उपयोग करते हैं।[7] इस तरह के आयन पंप झिल्ली के एक तरफ से आयन लेते हैं (इसकी एकाग्रता को कम करते हैं) और उन्हें दूसरी तरफ छोड़ देते हैं (वहां इसकी एकाग्रता में वृद्धि)।
एक्शन पोटेंशिअल के लिए सबसे अधिक प्रासंगिक आयन पंप Na+/K+-ATPase|सोडियम-पोटेशियम पंप है, जो सेल से तीन सोडियम आयनों और दो पोटेशियम आयनों को अंदर पहुंचाता है।[8]
परिणामस्वरूप, पोटेशियम आयनों की सांद्रता K+ न्यूरॉन के अंदर बाहरी सांद्रता की तुलना में लगभग 20 गुना बड़ा है, जबकि बाहर की सोडियम सांद्रता अंदर की तुलना में लगभग नौ गुना बड़ी है।[9][10] इसी तरह, अन्य आयनों में न्यूरॉन के अंदर और बाहर अलग-अलग सांद्रता होती है, जैसे कैल्शियम, क्लोराइड और मैगनीशियम
यदि प्रत्येक प्रकार के आयन की संख्या बराबर होती है, तो सोडियम-पोटेशियम पंप विद्युत रूप से तटस्थ होगा, लेकिन, तीन-के-दो विनिमय के कारण, यह प्रत्येक चक्र के लिए इंट्रासेल्युलर से बाह्यकोशिकीय तक एक सकारात्मक चार्ज का शुद्ध संचलन देता है, जिससे एक सकारात्मक वोल्टेज अंतर में योगदान होता है। पंप के तीन प्रभाव होते हैं: (1) यह सोडियम सांद्रता को बाह्य अंतरिक्ष में उच्च और अंतःकोशिकीय स्थान में कम बनाता है; (2) यह पोटेशियम सांद्रता को इंट्रासेल्युलर स्पेस में उच्च और बाह्य स्पेस में कम बनाता है; (3) यह इंट्रासेल्युलर स्पेस को एक्सट्रासेलुलर स्पेस के संबंध में एक नकारात्मक वोल्टेज देता है।
सोडियम-पोटेशियम पंप ऑपरेशन में अपेक्षाकृत धीमा है। यदि एक सेल को हर जगह सोडियम और पोटेशियम की समान सांद्रता के साथ आरंभ किया जाता है, तो पंप को संतुलन स्थापित करने में घंटों लगेंगे। पंप लगातार काम करता है, लेकिन धीरे-धीरे कम कुशल हो जाता है क्योंकि पंपिंग के लिए उपलब्ध सोडियम और पोटेशियम की सांद्रता कम हो जाती है।
आयन पंप अंतःकोशिकीय और बाह्यकोशिकीय आयन सांद्रता के सापेक्ष अनुपात को स्थापित करके ही क्रिया क्षमता को प्रभावित करते हैं। एक्शन पोटेंशिअल में मुख्य रूप से आयन चैनलों को खोलना और बंद करना शामिल है, न कि आयन पंपों को। यदि आयन पंपों को उनके ऊर्जा स्रोत को हटाकर बंद कर दिया जाता है, या ऊबैन जैसे अवरोधक को जोड़कर, अक्षतंतु अभी भी सैकड़ों हजारों कार्रवाई क्षमता को आग लगा सकता है इससे पहले कि उनके आयाम महत्वपूर्ण रूप से क्षय होने लगें। विशेष रूप से, आयन पंप ऐक्शन पोटेंशिअल के बाद झिल्ली के पुनर्ध्रुवीकरण में कोई महत्वपूर्ण भूमिका नहीं निभाते हैं।
एक अन्य कार्यात्मक रूप से महत्वपूर्ण आयन पंप सोडियम-कैल्शियम एक्सचेंजर है। यह पंप वैचारिक रूप से सोडियम-पोटेशियम पंप के समान तरीके से संचालित होता है, सिवाय इसके कि प्रत्येक चक्र में यह तीन Na का आदान-प्रदान करता है।+ एक सीए के लिए बाह्य अंतरिक्ष से++ इंट्रासेल्युलर स्पेस से। क्योंकि आवेश का शुद्ध प्रवाह अंदर की ओर होता है, यह पंप वास्तव में नीचे की ओर चलता है, और इसलिए झिल्ली वोल्टेज को छोड़कर किसी ऊर्जा स्रोत की आवश्यकता नहीं होती है। इसका सबसे महत्वपूर्ण प्रभाव कैल्शियम को बाहर की ओर पंप करना है - यह सोडियम के आवक प्रवाह की भी अनुमति देता है, जिससे सोडियम-पोटेशियम पंप का प्रतिकार होता है, लेकिन, क्योंकि समग्र सोडियम और पोटेशियम सांद्रता कैल्शियम सांद्रता से बहुत अधिक हैं, यह प्रभाव अपेक्षाकृत महत्वहीन है। सोडियम-कैल्शियम एक्सचेंजर का शुद्ध परिणाम यह है कि आराम की स्थिति में, इंट्रासेल्युलर कैल्शियम सांद्रता बहुत कम हो जाती है।
आयन चैनल
[[File:Action potential ion sizes.svg|thumb|उनके त्रिज्या में छोटे अंतर के बावजूद,<ref>CRC Handbook of Chemistry and Physics, 83rd edition, ISBN 0-8493-0483-0, pp. 12–14 to 12–16.</ref> आयन संभवतः ही कभी त्रुटिपूर्ण चैनल से निकलते हैं। उदाहरण के लिए, सोडियम या कैल्शियम आयन पोटेशियम चैनल के माध्यम से संभवतः ही कभी निकलते हैं। सात गोले जिनकी त्रिज्या मोनो-वैलेंट लिथियम, सोडियम, पोटेशियम, रुबिडियम, सीज़ियम केशन (0.76, 1.02, 1.38, 1.52, एवं) की त्रिज्या के समानुपाती होती है। (1.67 Å, क्रमशः), डाइवेलेंट कैल्शियम केशन (1.00 Å) एवं मोनो-वैलेंट क्लोराइड (1.81 Å) है। आयन चैनल छिद्र के साथ अभिन्न झिल्ली प्रोटीन होते हैं जिसके माध्यम से आयन बाह्य अंतरिक्ष एवं कोशिका आंतरिक के मध्य यात्रा कर सकते हैं। अधिकांश चैनल आयन के लिए विशिष्ट (चयनात्मक) होते हैं; उदाहरण के लिए, अधिकांश पोटेशियम चैनल 1000: 1 सोडियम पर पोटेशियम के लिए चयनात्मकता अनुपात की विशेषता है, चूँकि पोटेशियम एवं सोडियम आयनों पर आवेशित होते है एवं उनके त्रिज्या में केवल थोड़ा भिन्न होता है। चैनल सामान्यतः इतना छोटा होता है कि आयनों को एकल-क्रम में इसके माध्यम से निकलना पड़ता है।[11] आयन मार्ग के लिए चैनल छिद्र या तो खुले या बंद हो सकते हैं, हालांकि कई चैनल विभिन्न उप-चालन स्तरों को प्रदर्शित करते हैं। जब एक चैनल खुला होता है, तो आयन चैनल के माध्यम से उस विशेष आयन के लिए ट्रांसमेम्ब्रेन एकाग्रता प्रवणता को कम कर देते हैं। चैनल के माध्यम से आयनिक प्रवाह की दर, यानी एकल-चैनल वर्तमान आयाम, उस आयन के लिए अधिकतम चैनल चालन और विद्युत रासायनिक चालन बल द्वारा निर्धारित किया जाता है, जो कि झिल्ली क्षमता के तात्कालिक मूल्य और उत्क्रमण क्षमता के मूल्य के बीच का अंतर है।<ref name="junge_33_37">यंग, पीपी. 33-37.</ref>
चैनल में अनेक भिन्न-भिन्न अवस्थाएँ हो सकती हैं (प्रोटीन की विभिन्न प्रोटीन संरचना के अनुरूप), किन्तु ऐसी प्रत्येक अवस्था या तो खुली या बंद होती है। सामान्यतः, बंद अवस्थाएँ या तो छिद्र के संकुचन के अनुरूप होती हैं जिससे यह आयन के लिए अगम्य हो जाता है- या प्रोटीन के भिन्न भाग में, छिद्र को बाधित कर देता है। उदाहरण के लिए, वोल्टेज पर निर्भर सोडियम चैनल निष्क्रियता से निकलता है, जिसमें प्रोटीन का भाग छिद्र में प्रवेश हो जाता है, इसे बंद कर देता है।[12] यह निष्क्रियता सोडियम धारा को समाप्त कर देती है एवं ऐक्शन पोटेंशिअल में महत्वपूर्ण भूमिका निभाती है।
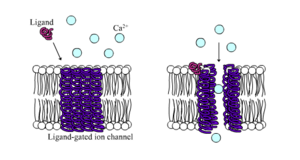
आयन चैनलों को वर्गीकृत किया जा सकता है कि वे अपने पर्यावरण पर कैसे प्रतिक्रिया करते हैं।[13] उदाहरण के लिए, ऐक्शन पोटेंशिअल में सम्मिलित आयन चैनल वोल्टेज-संवेदी चैनल हैं; वे झिल्ली के पार वोल्टेज की प्रतिक्रिया में खुलते एवं बंद होते हैं। लिगैंड-चैनल महत्वपूर्ण वर्ग बनाते हैं; ये आयन चैनल स्नायुसंचारी जैसे लिगैंड (जैव रसायन) के बंधन के उत्तर में खुलते एवं बंद होते हैं। अन्य आयन चैनल यांत्रिक बलों के साथ खुलते एवं बंद होते हैं। अभी भी अन्य आयन चैनल- जैसे कि संवेदी न्यूरॉन्स-प्रकाश, तापमान या दबाव जैसे अन्य उत्तेजनाओं में खुलते एवं बंद होते हैं।
बहिर्वाह चैनल
बहिर्वाह चैनल सबसे सरल प्रकार के आयन चैनल हैं, जिसमें उनकी पारगम्यता अल्प या अधिक स्थिर होती है। बहिर्वाह चैनलों के प्रकार जिनका न्यूरॉन्स में सबसे बड़ा महत्व है, पोटेशियम एवं क्लोराइड चैनल हैं। यहां तक कि ये अपने गुणों में पूर्ण रूप से स्थिर नहीं हैं: सबसे प्रथम, उनमें से अधिकतर वोल्टेज-निर्भर हैं इस अर्थ में कि वे दिशा में दूसरे की तुलना में उत्तम संचालन करते हैं (दूसरे शब्दों में, वे सुधारक हैं); दूसरा, उनमें से कुछ रासायनिक लिगैंड द्वारा समाप्त करने में सक्षम हैं, फिर उन्हें संचालित करने के लिए लिगैंड की आवश्यकता न हो।
लिगैंड-चैनल
लिगैंड-आयन चैनल वे चैनल होते हैं जिनकी पारगम्यता अधिक बढ़ जाती है जब कुछ प्रकार के रासायनिक लिगैंड प्रोटीन संरचना से जुड़ जाते हैं। पशु कोशिकाओं में सैकड़ों नहीं तो हजारों प्रकार के होते हैं। न्यूरोट्रांसमीटर रिसेप्टर्स के रूप में बड़ा उप-समुच्चय कार्य- वे पोस्टअन्तर्ग्रथनी साइटों पर होते हैं, एवं रासायनिक लिगैंड जो उन्हें प्रवेशित करता है, प्रीसानेप्टिक एक्सज़ोन का अंत द्वारा निरंतर किया जाता है। इस प्रकार का उदाहरण एएमपीए (AAMPA) रिसेप्टर है, न्यूरोट्रांसमीटर ग्लुटामिक एसिड के लिए रिसेप्टर है जो सक्रिय होने पर सोडियम एवं पोटेशियम आयनों को पारित करने की अनुमति देता है। अन्य उदाहरण गाबा (GABA) रिसेप्टर हैI गाबा रिसेप्टर, न्यूरोट्रांसमीटर गाबा के लिए रिसेप्टर जो सक्रिय होने पर क्लोराइड आयनों को पारित करने की अनुमति देता है।
न्यूरोट्रांसमीटर रिसेप्टर्स लिगेंड द्वारा सक्रिय होते हैं जो बाह्य क्षेत्र में दिखाई देते हैं, किन्तु अन्य प्रकार के लिगैंड-चैनल जो इंट्रासेल्युलर पक्ष द्वारा नियंत्रित होते हैं।
वोल्टेज पर निर्भर चैनल
वोल्टेज-आयन चैनल, जिन्हें वोल्टेज निर्भर आयन चैनल भी कहा जाता है, ऐसे चैनल जिनकी पारगम्यता झिल्ली क्षमता से प्रभावित होती है। एवं वे अत्यधिक बड़ा समूह बनाते हैं, जिसमें प्रत्येक सदस्य के निकट विशेष आयन चयनात्मकता एवं विशेष वोल्टेज निर्भरता होती है। अनेक समय-निर्भर भी होते हैं- दूसरे शब्दों में, वे वोल्टेज परिवर्तन पर अविलम्ब प्रतिक्रिया नहीं देते हैं, किन्तु केवल देरी के पश्चात ऐसा होता है।
इस समूह के सबसे महत्वपूर्ण सदस्यों में से वोल्टेज-सोडियम चैनल है जो एक्शन पोटेंशिअल को रेखांकित करता है- इन्हें कभी-कभी हॉजकिन-हक्सले सोडियम चैनल कहा जाता है क्योंकि प्रारम्भ में उन्हें एलन लॉयड हॉजकिन एवं एंड्रयू हक्सले ने अपने नोबेल पुरस्कार विजेता में चित्रित किया था। क्रिया क्षमता के शरीर विज्ञान का अध्ययन चैनल विश्राम करने वाले वोल्टेज स्तर पर समाप्त होता है, किन्तु जब वोल्टेज निश्चित सीमा से अधिक हो जाता है, तो सोडियम आयनों का बड़ा प्रवाह होता है जो झिल्ली क्षमता में अत्यधिक शीघ्रता से परिवर्तन उत्पन्न करता है। ऐक्शन पोटेंशिअल आंशिक रूप से वोल्टेज-पोटेशियम चैनल पर निर्भर करती है जो विश्राम वोल्टेज स्तर पर समाप्त होता है, किन्तु ऐक्शन पोटेंशिअल के समय उत्पन्न बड़े वोल्टेज परिवर्तन के परिणामस्वरूप होते है।
उत्क्रमण क्षमता
आयन की उत्क्रमण क्षमता (या संतुलन क्षमता) ट्रांसमेम्ब्रेन वोल्टेज का मान है, जिस पर विसारक एवं विद्युत बल प्रति-संतुलन करते हैं, जिससे कि झिल्ली में कोई शुद्ध आयन प्रवाह न हो। इसका तात्पर्य यह है कि ट्रांसमेम्ब्रेन वोल्टेज आयन के प्रसार के बल का विरोध करता है, जैसे कि झिल्ली के आयन का शुद्ध प्रवाह शून्य एवं अपरिवर्तनीय होता है। उत्क्रमण क्षमता महत्वपूर्ण है क्योंकि यह वोल्टेज देता है जो उस आयन के लिए पारगम्य चैनलों पर कार्य करता है- दूसरे शब्दों में, यह वोल्टेज देता है जो आयन एकाग्रता प्रवणता उत्पन्न करता है जब यह बैटरी के रूप में कार्य करती है।
किसी विशेष आयन की संतुलन क्षमता को सामान्यतः संकेतन Eion द्वारा निर्दिष्ट किया जाता है, किसी भी आयन के लिए संतुलन क्षमता की गणना नर्नस्ट समीकरण का उपयोग करके की जा सकती है।[14] उदाहरण के लिए, पोटेशियम आयनों की उत्क्रमण क्षमता इस प्रकार होगी:
जहाँ
- Eeq,K+ वोल्ट में मापे गए पोटेशियम के लिए संतुलन क्षमता है।
- R सार्वभौमिक गैस स्थिरांक है, जो 8.314 जूल·K−1·mol−1 के समान है।
- T पूर्ण तापमान है, जिसे केल्विन में मापा जाता है (= K = डिग्री सेल्सियस + 273.15)
- Z प्रतिक्रिया में सम्मिलित विचाराधीन आयन के प्राथमिक आवेशों की संख्या है।
- F फैराडे स्थिरांक है, जो 96,485 कूलॉम·mol−1 या J·V−1·mol−1 के समान है।
- [K+]o पोटेशियम की बाह्य कोशिकीय सांद्रता है, जिसे mol·m−3 या mmol·l−1 में मापा जाता है।
- [K+]i पोटेशियम की इंट्रासेल्युलर एकाग्रता है।
दो भिन्न आयनों का आवेश समान हो (अर्थात्, K+ एवं Na+), उनके निकट अभी भी अत्यधिक भिन्न संतुलन क्षमता हो सकती है, नियमानुसार उनकी बाहरी या अंदर की सांद्रता भिन्न-भिन्न हो। उदाहरण के लिए, न्यूरॉन्स में पोटेशियम एवं सोडियम की संतुलन क्षमता होती है। पोटेशियम संतुलन क्षमता EK -84 mV है जिसमें 5 मिलीमीटर पोटेशियम बाहर एवं 140 मिलीमीटर अंदर है। दूसरी ओर, सोडियम संतुलन क्षमता, ENa, लगभग +66 mV है जिसमें लगभग 12 mm सोडियम अंदर एवं 140 mm बाहर है।
विकास के समय झिल्ली क्षमता में परिवर्तन
जीव के तंत्रिका विकास के समय न्यूरॉन की विश्राम करने वाली झिल्ली क्षमता वास्तव में परिवर्तित हो जाती है। न्यूरॉन के लिए अंततः अपने पूर्ण वयस्क कार्य को अपनाने के लिए, विकास के समय इसकी क्षमता को नियंत्रित किया जाना चाहिए। जैसे-जैसे जीव विकास के माध्यम से विस्तारित होता है, विश्राम करने वाली झिल्ली क्षमता अधिक नकारात्मक हो जाती है।[15] मस्तिष्क में विकास की प्रगति के रूप में न्यूरोग्लिया भी विभेदित एवं प्रसार कर रहे हैं।[16] इन ग्लिअल कोशिकाओं के जुड़ने से बाह्य कोशिकीय पोटेशियम को विनियमित करने की जीव की क्षमता विस्तारित हो जाती है। बाह्य पोटेशियम में पतन से झिल्ली क्षमता में 35 mV की अल्पता हो सकती है।[17]
कोशिका उत्तेजना
कोशिका उत्तेजना झिल्ली क्षमता में परिवर्तन होता है जो विभिन्न ऊतकों में सेलुलर प्रतिक्रियाओं के लिए आवश्यक है। कोशिका उत्तेजनशीलता ऐसा गुण है जो प्रारंभिक भ्रूणजनन के समय प्रेरित होती है।[18] कोशिका की उत्तेजना को भी उस सरलता के रूप में परिभाषित किया गया है जिसके साथ प्रतिक्रिया प्रारंभ हो सकती है।[19] विश्राम एवं सीमा क्षमता कोशिका उत्तेजना को आधार बनाते हैं एवं ये प्रक्रियाएँ एक्शन पोटेंशिअल के निर्माण के लिए मूलभूत हैं।
कोशिका उत्तेजना का अत्यधिक महत्वपूर्ण नियामक बाह्य इलेक्ट्रोलाइट सांद्रता (अर्थात Na+, K+, Ca2+, Cl−, Mg2+) और जीव विज्ञान में संबंधित प्रोटीन कोशिका उत्तेजना को नियंत्रित करने वाले महत्वपूर्ण प्रोटीन वोल्टेज-आयन चैनल, आयन ट्रांसपोर्टर (जैसे Na + / K + -ATPase, मैग्नीशियम ट्रांसपोर्टर, एसिड-बेस ट्रांसपोर्टर), झिल्ली रिसेप्टर्स एवं HCN चैनल सम्मलित हैं। हाइपरपोलराइजेशन-एक्टिवेटेड साइक्लिक-न्यूक्लियोटाइड चैनल हैं।[20] उदाहरण के लिए, पोटेशियम चैनल एवं कैल्शियम-सेंसिंग रिसेप्टर्सर न्यूरॉन्स, कार्डियक मायोसाइट्स एवं अनेक अन्य उत्तेजक कोशिकाओं जैसे एस्ट्रोसाइट्स में उत्तेजना के महत्वपूर्ण नियामक सम्मलित हैं।[21] एक्साइटेबल कोशिका सिग्नलिंग में कैल्शियम आयन भी सबसे महत्वपूर्ण दूसरा संदेशवाहक प्रणाली है। सिनैप्टिक रिसेप्टर्स की सक्रियता न्यूरोप्लास्टिकिटी को प्रारम्भ करती है। न्यूरोनल उत्तेजना में लंबे समय तक चलने वाले परिवर्तन [22] थायराइड हार्मोन, अधिवृक्क ग्रंथि एवं अन्य हार्मोन भी कोशिका उत्तेजना को नियंत्रित करते हैं, उदाहरण के लिए, प्रोजेस्टेरोन एवं एस्ट्रोजन मायोमेट्रियल पेशी कोशिका उत्तेजना को नियंत्रित करते हैं।
अनेक प्रकार की कोशिकाओं को उत्तेजनीय झिल्ली माना जाता है। उत्तेजक कोशिकाएं न्यूरॉन्स, मायोसाइट्स (हृदय, कंकाल, पेशी), संवहनी एंडोथेलियल कोशिकाएं, पेरिसाईट, जूसटैग्लोमेरुलर कोशिकाएं, अंतरालीय कोशिका, अनेक प्रकार के उपकला कोशिकाएं (जैसे बीटा कोशिका, अल्फा कोशिका, डेल्टा कोशिका, एंटरोएंडोक्राइन कोशिकाएं, पल्मोनरी न्यूरोएंडोक्राइन कोशिकाएं, न्यूरोएंडोक्राइन कोशिकाएं, पीनियलोसाइट, ग्लियाल कोशिकाएं (जैसे एस्ट्रोसाइट्स), मेचानोरेसप्टर्स कोशिकाएं (जैसे बालों की कोशिकाएं एवं मर्केल कोशिकाएं), कीमोरिसेप्टर कोशिकाएं (जैसे ग्लोमस कोशिकाएं, स्वाद रिसेप्टर्सर), कुछ पादप कोशिकाएं एवं संभवतः श्वेत रक्त कोशिका [23] एस्ट्रोसाइट्स अनेक रिसेप्टर्स की अभिव्यक्ति से संबंधित इंट्रासेल्युलर कैल्शियम विविधताओं के आधार पर अन्य-विद्युत उत्तेजना का रूप प्रदर्शित करते हैं जिसके माध्यम से वे सिनैप्टिक सिग्नल को ज्ञात कर सकते हैं। न्यूरॉन्स में, कोशिका के कुछ भागो में भिन्न-भिन्न झिल्ली गुण होते हैं, उदाहरण के लिए, डेंड्राइटिक उत्तेजना न्यूरॉन्स को स्थानिक रूप से भिन्न किए गए इनपुट के संयोग को ज्ञात करने की क्षमता प्रदान करती हैI[24]
समतुल्य परिपथ
इलेक्ट्रो फिजियोलॉजिस्ट समतुल्य परिपथ के संदर्भ में आयनिक सांद्रता अंतर, आयन चैनल एवं झिल्ली समाई के प्रभाव को मॉडल करते हैं, जिसका उद्देश्य झिल्ली के छोटे पैच के विद्युत गुणों का प्रतिनिधित्व करना है। समतुल्य परिपथ समानांतर में संधारित्र होता है, जिसमें प्रत्येक में गतिमान चालन के साथ श्रृंखला में बैटरी होती है। समाई लिपिड बाईलेयर के गुणों द्वारा निर्धारित की जाती है, एवं इसे निर्धारित करने के लिए लिया जाता है। चार समानांतर मार्गों में से प्रत्येक प्रमुख आयनों, सोडियम, पोटेशियम, क्लोराइड एवं कैल्शियम में से आता है। प्रत्येक आयनिक मार्ग का वोल्टेज झिल्ली के प्रत्येक ओर आयन की सांद्रता द्वारा निर्धारित किया जाता है; ऊपर मेम्ब्रेन पोटेंशिअल रिवर्सल पोटेंशिअल सेक्शन देखे, किसी भी समय प्रत्येक आयनिक मार्ग का संचालन उन सभी आयन चैनलों की अवस्थाओं द्वारा निर्धारित किया जाता है जो उस आयन के लिए संभावित रूप से पारगम्य हैं, जिसमें बहिर्वाह चैनल, लिगैंड चैनल एवं वोल्टेज- आयन चैनल सम्मिलित हैं।
[[File:Cell membrane reduced circuit.svg|thumb|left|गोल्डमैन समीकरण का उपयोग करके आयन-विशिष्ट मार्गों के संयोजन से प्राप्त अल्प परिपथ ]]निश्चित आयन सांद्रता एवं आयन चैनल चालन के निश्चित मूल्यों के लिए, समतुल्य परिपथ को अल्प किया जा सकता है, जैसा कि नीचे वर्णित गोल्डमैन समीकरण का उपयोग करके, बैटरी एवं चालन के समानांतर समाई वाले परिपथ में किया जा सकता है। विद्युत शब्दों में, यह विशेष प्रकार का आरसी परिपथ है, एवं इसके विद्युत गुण अत्यधिक सरल हैं। किसी भी प्रारंभिक अवस्था से प्रारंभ होकर, प्रवाहकत्त्व में प्रवाह होने वाली धारा घातीय समय पाठ्यक्रम के साथ τ = RC, के समय स्थिरांक के साथ घटती है, जहाँ C झिल्ली पैच की धारिता है, एवं R = 1/gnet शुद्ध प्रतिरोध है। यथार्थवादी स्थितियों के लिए, समय स्थिरांक सामान्यतः 1—100 मिलीसेकंड की सीमा में होता है। अधिकांशतः स्तिथियों में, आयन चैनलों के चालन में परिवर्तन शीघ्रता से समय के स्तर पर होता है, इसलिए आरसी परिपथ उत्तम नहीं है; चूँकि, झिल्ली पैच को मॉडल करने के लिए उपयोग किया जाने वाला अंतर समीकरण सामान्यतः आरसी परिपथ समीकरण का संशोधित संस्करण है।
विश्राम करने की क्षमता
जब किसी कोशिका की झिल्ली क्षमता बिना महत्वपूर्ण परिवर्तन के अत्यधिक समय तक चलती है, तो इसे विश्राम करने की क्षमता या विश्राम करने वाली वोल्टेज के रूप में संदर्भित किया जाता है। यह शब्द अन्य उत्तेजक कोशिकाओं की झिल्ली क्षमता के लिए प्रयोग किया जाता है, किन्तु उत्तेजना के अभाव में उत्तेजनीय कोशिकाओं की झिल्ली क्षमता के लिए भी उत्तेजनीय कोशिकाओं में, अन्य संभावित अवस्थाएँ वर्गीकृत झिल्ली क्षमताएँ (गतिमान आयाम वाली) हैं, एवं क्रिया क्षमताएँ, बड़ी हैं, झिल्ली क्षमता उत्पादित नहीं होती है जो सामान्यतः निश्चित समय पाठ्यक्रम का पालन करती हैं। उत्तेजक कोशिकाओं में न्यूरॉन्स, मांसपेशियों की कोशिकाएं एवं ग्रंथियों में कुछ स्रावी कोशिकाएं सम्मिलित हैं। चूँकि, अन्य प्रकार की कोशिकाओं में भी, झिल्ली वोल्टेज पर्यावरण या इंट्रासेल्युलर उत्तेजनाओं में परिवर्तन हो सकता है। उदाहरण के लिए, प्लाज्मा झिल्ली का विध्रुवण (एपोप्टोसिस) में महत्वपूर्ण चरण प्रतीत होता है।[25]
विश्राम क्षमता उत्पन्न करने वाली अंतःक्रियाओं को गोल्डमैन समीकरण द्वारा प्रतिरूपित किया जाता है।[26] यह ऊपर दिखाए गए नर्नस्ट समीकरण के रूप में समान है, जिसमें यह प्रश्न में आयनों के आरोपों के साथ-साथ उनके अंदर एवं बाहर की सांद्रता के मध्य के अंतर पर आधारित है। चूँकि, यह प्रश्न में प्रत्येक आयन के लिए प्लाज्मा झिल्ली की सापेक्ष पारगम्यता को भी ध्यान में रखता है।
इस समीकरण में प्रकट होने वाले तीन आयन पोटेशियम (K+), सोडियम (Na+), एवं क्लोराइड (Cl-) हैं। कैल्शियम सम्मलित नहीं है, किन्तु उन स्थितियों से निकलने के लिए जोड़ा जा सकता है जिनमें यह महत्वपूर्ण भूमिका निभाता है।[27] ऋणायन होने के कारण, क्लोराइड पदों को धनायन पदों से भिन्न माना जाता है; इंट्रासेल्युलर एकाग्रता अंश में है, एवं बाह्य एकाग्रता, जो कि कटियन शब्दों के विपरीत है। Pi आयन प्रकार i की सापेक्ष पारगम्यता के लिए उपलब्ध है।
संक्षेप में, गोल्डमैन सूत्र झिल्ली क्षमता को पारगम्यता द्वारा भारित व्यक्तिगत आयन प्रकारों के लिए उत्क्रमण क्षमता के भारित औसत के रूप में व्यक्त करता है।(चूँकि ऐक्शन पोटेंशिअल के समय झिल्ली क्षमता में लगभग 100 mV परिवर्तन होता है, कोशिका के अंदर एवं बाहर आयनों की सांद्रता महत्वपूर्ण रूप से परिवर्तित नहीं होती है। वे अपनी संबंधित सांद्रता के निकट रहते हैं जब झिल्ली स्थिर क्षमता पर होती है।) अधिकांश पशु कोशिकाओं में, सोडियम की पारगम्यता की तुलना में विश्राम की अवस्था में पोटेशियम की पारगम्यता अधिक होती है। परिणाम स्वरुप, विश्राम करने की क्षमता सामान्यतः पोटेशियम उत्क्रमण क्षमता के निकट होती है।[28][29] क्लोराइड की पारगम्यता महत्वपूर्ण होने के लिए पर्याप्त उच्च हो सकती है, किन्तु, अन्य आयनों के विपरीत, क्लोराइड को सक्रिय रूप से पंप नहीं किया जाता है, इसलिए अन्य आयनों द्वारा निर्धारित विश्राम क्षमता के अधिक निकट उत्क्रमण क्षमता पर संतुलित होता है।
अधिकांश पशु कोशिकाओं में विश्राम करने वाली झिल्ली क्षमता के मान सामान्यतः पोटेशियम उत्क्रमण क्षमता (सामान्यतः लगभग-80 mV) एवं लगभग-40 mV के मध्य भिन्न होते हैं। उत्तेजनीय कोशिकाओं (ऐक्शन पोटेंशिअल उत्पन्न करने में सक्षम) में विश्राम क्षमता सामान्यतः -60 mV के निकट होती है अधिक विध्रुवित वोल्टेज से ऐक्शन पोटेंशिअल का सरल उत्पादन होता है। अपरिपक्व या अविभेदित कोशिकाएं स्थिर वोल्टेज के अत्यधिक चर मान दिखाती हैं, सामान्यतः विभेदित कोशिकाओं की तुलना में अत्यधिक सकारात्मक होती हैं।[30] ऐसी कोशिकाओं में, विश्राम संभावित मूल्य विभेदन की डिग्री के साथ सह-संबंधित होता है: कुछ स्तिथियों में अविभाजित कोशिकाएं किसी भी ट्रांसमेम्ब्रेन वोल्टेज अंतर को नहीं दिखा सकती हैं।
बहिर्वाह चैनलों के कारण क्षति का सामना करने के लिए आयनों के सक्रिय पंपिंग की आवश्यकता के कारण विश्राम क्षमता की सुरक्षा सेल के लिए उप-पाचन रूप से मूलयवान हो सकता है। वित्त सबसे अधिक होता है जब सेल फलन को झिल्ली वोल्टेज के विशेष रूप से विध्रुवित मूल्य की आवश्यकता होती है। उदाहरण के लिए, दिन के उजाले-अनुकूलित कैलीफोरिडे में विश्राम करने की क्षमता में साधारण आँखें -30 mV जितनी अधिक हो सकती हैं।[31] यह उन्नत झिल्ली क्षमता कोशिकाओं को दृश्य आदानों के लिए अधिक शीघ्रता से प्रतिक्रिया करने की अनुमति देती है; वित्त यह है कि विश्राम करने की क्षमता का सुरक्षा समग्र सेलुलर एडेनोसाइन ट्रायफ़ोस्फेट के 20% से अधिक का उपभोग कर सकता है।[32]
दूसरी ओर, अविभेदित कोशिकाओं में उच्च विश्राम क्षमता के लिए आवश्यक रूप से उच्च उप-पाचन वित्त नहीं होती है। यह स्पष्ट विरोधाभास उस विश्राम क्षमता की उत्पत्ति की परिक्षण से विलयन हो गया है। छोटे-विभेदित कोशिकाओं को अत्यधिक उच्च इनपुट प्रतिरोध की विशेषता होती है,[30] जिसका तात्पर्य है कि कोशिका जीवन के इस गतिमान में कुछ बहिर्वाह चैनल उपस्थित हैं। स्पष्ट परिणाम के रूप में, पोटेशियम पारगम्यता सोडियम आयनों के समान हो जाती है, जो ऊपर वर्णन के अनुसार सोडियम एवं पोटेशियम के निकलने की क्षमता के मध्य विश्राम करने की क्षमता रखती है।इसलिए अल्प उप-पाचन वित्त एवं अल्प बहिर्वाह धाराओं का तात्पर्य यह भी है कि क्षतिपूर्ति के लिए सक्रिय पम्पिंग की अधिक अल्प आवश्यकता है।
वर्गीकृत क्षमता
जैसा कि ऊपर बताया गया है, कोशिका की झिल्ली में किसी भी बिंदु पर क्षमता इंट्रासेल्युलर एवं बाह्य क्षेत्रों के मध्य आयन एकाग्रता के अंतर एवं प्रत्येक प्रकार के आयन के लिए झिल्ली की पारगम्यता द्वारा निर्धारित की जाती है। आयन सांद्रता सामान्य रूप से शीघ्रता से परिवर्तित नहीं होती है (Ca2+ के अपवाद के साथ, जहां बेसलाइन इंट्रासेल्युलर सांद्रता इतनी अल्प है कि परिमाण के क्रम में छोटा सा प्रवाह भी इसे बढ़ा सकता है), किन्तु आयनों की पारगम्यता लिगैंड आयन चैनलों के सक्रियण के परिणामस्वरूप मिलीसेकंड के अंश में परिवर्तित हो सकती है। झिल्ली क्षमता में परिवर्तन बड़ा या छोटा हो सकता है, यह इस कथन पर निर्भर करता है कि कितने आयन चैनल सक्रिय हैं एवं वे किस प्रकार के हैं, या तो लंबा या छोटा हो सकता है, जो चैनल के खुले रहने की अवधि पर निर्भर करता है। एक्शन पोटेंशिअल के विपरीत, इस प्रकार के परिवर्तनों को ग्रेडेड पोटेंशिअल कहा जाता है, जिनका निश्चित आयाम एवं समय पाठ्यक्रम होता है।
जैसा कि ऊपर दिखाए गए गोल्डमैन समीकरण से प्राप्त किया जा सकता है, झिल्ली की पारगम्यता को विशेष प्रकार के आयन में बढ़ाने का प्रभाव झिल्ली क्षमता को उस आयन के उत्क्रमण क्षमता की ओर ले जाता है। इस प्रकार, Na+ चैनल खोलने से झिल्ली क्षमता Na+ उत्क्रमण क्षमता की ओर स्थानांतरित हो जाती है, जो सामान्यतः +100 mV के निकट होती है। इसी प्रकार, K+ चैनल खोलने से झिल्ली क्षमता को लगभग -90 mV की ओर स्थानांतरित हो जाती है, Cl− चैनल खोलने से यह लगभग -70 mV (अधिकांश झिल्लियों की विश्राम क्षमता) की ओर स्थानांतरित हो जाती है। इस प्रकार, Na+ चैनल झिल्ली क्षमता को सकारात्मक दिशा में स्थानांतरित करते हैं, K+ चैनल इसे नकारात्मक दिशा में स्थानांतरित करते हैं (इसके अतिरिक्त कि जब झिल्ली मान K+ उत्क्रमण क्षमता की तुलना में अधिक नकारात्मक मूल्य पर हाइपरपोलराइज़्ड हो), एवं Cl− चैनल इसे स्थिर क्षमता की ओर स्थानांतरित करते हैं।
ग्रेडेड मेम्ब्रेन पोटेंशिअल विशेष रूप से न्यूरॉन्स में महत्वपूर्ण होते हैं, जहां वे सिनैप्स द्वारा निर्मित होते हैं- सिंगल ग्रेडेड या एक्शन पोटेंशिअल द्वारा सिनैप्स के सक्रियण द्वारा उत्पन्न मेम्ब्रेन पोटेंशिअल में अस्थायी परिवर्तन को पोस्टसिनेप्टिक क्षमता कहा जाता है। न्यूरोट्रांसमीटर जो Na+ चैनल खोलने का कार्य करते हैं सामान्यतः झिल्ली क्षमता को अधिक सकारात्मक बनाते हैं, जबकि जो K+ चैनल को सक्रिय करने वाले न्यूरोट्रांसमीटर सामान्यतः इसे अधिक नकारात्मक बना देते हैं; जो इन चैनलों को बाधित करते हैं उनका विपरीत प्रभाव पड़ता है।
क्या पोस्टसिनेप्टिक क्षमता को उत्तेजक या निरोधात्मक माना जाता है, यह उस धारा के आयनों के लिए उत्क्रमण क्षमता पर निर्भर करता है, एवं कोशिका के लिए ऐक्शन पोटेंशिअल (लगभग -50mV) को अग्नि प्रकट करने की सीमा से ऊपर उत्क्रमण क्षमता के साथ पोस्टसिनेप्टिक धारा, जैसे कि विशिष्ट Na+ धारा, उत्तेजक माना जाता है। सीमा रेखा के नीचे उत्क्रमण क्षमता वाली धारा, जैसे कि विशिष्ट K+ वर्तमान, निरोधात्मक माना जाता है। विश्राम पोटेंशिअल के ऊपर, किन्तु थ्रेसहोल्ड के नीचे रिवर्सल पोटेंशिअल के साथ धारा स्वयं में ऐक्शन पोटेंशिअल नहीं लाएगा, किन्तु सबथ्रेशोल्ड झिल्ली संभावित कंपन का उत्पादन करेगा। इस प्रकार, न्यूरोट्रांसमीटर जो Na को खोलने का कार्य करते हैं, चैनल उत्तेजक पोस्टसिनेप्टिक क्षमता या ईपीएसपी (epsp) उत्पन्न करते हैं, जबकि न्यूरोट्रांसमीटर जो K+ को खोलने का कार्य करते हैं या Cl− चैनल सामान्यतः निरोधात्मक पोस्टसिनेप्टिक क्षमता उत्पन्न करते हैं। जबकि अवधि के अंदर अनेक प्रकार के चैनल खुले होते हैं, तो उनकी पश्च-अन्तर्ग्रथनी क्षमताएँ योग करती हैं।
अन्य मूल्य
बायोफिजिक्स के दृष्टिकोण से, विश्राम झिल्ली क्षमता केवल झिल्ली क्षमता है जो कोशिका के विश्राम करने पर प्रबल होने वाली झिल्ली पारगम्यता से उत्पन्न होती है। भारित अनुपात का उपरोक्त समीकरण सदैव प्रारम्भ होता है, किन्तु निम्नलिखित दृष्टिकोण को अधिक सरलता से दर्शाया जा सकता है।
किसी भी समय, आयन के लिए दो कारक होते हैं जो यह निर्धारित करते हैं कि कोशिका की झिल्ली क्षमता पर उस आयन का कितना प्रभाव होगा:
- वह आयन की प्रेरक शक्ति
- वह आयन की पारगम्यता
यदि चालन बल अधिक है, तो आयन को झिल्ली के पार "आघात" दिया जा रहा है। यदि पारगम्यता अधिक है, तो आयन के लिए झिल्ली में विस्तारित होना सरल होगा।
- 'प्रेरक बल' उस आयन को झिल्ली के पार ले जाने के लिए उपलब्ध शुद्ध विद्युत बल है। इसकी गणना उस वोल्टेज के मध्य के अंतर के रूप में की जाती है जो आयन (इसकी संतुलन क्षमता) एवं वास्तविक झिल्ली क्षमता (Em) पर होना चाहता है।). अतः, औपचारिक शब्दों में, आयन के लिए प्रेरक बल = Em - Eion है।
- उदाहरण के लिए, हमारी पूर्व की गणना की गई -73 mV की विश्राम क्षमता, पोटेशियम पर प्रेरक बल 7 mV है: (−73 mV) - (−80 mV) = 7 mV। सोडियम पर प्रेरक शक्ति (−73 mV) - (60 mV) = -133 mV होगी।
- पारगम्यता इस विषय का माप है कि आयन कितनी सरलता से झिल्ली को पार कर सकता है। इसे सामान्यतः (विद्युत) चालन के रूप में मापा जाता है एवं इकाई, सीमेंस (इकाई), 1 C·s−1 V1 के अनुरूप होती है, जो कि कूलॉम प्रति सेकंड प्रति वोल्ट विभव है। तो, विश्राम करने वाली झिल्ली में, जबकि पोटेशियम के लिए प्रेरक बल अल्प होता है, इसकी पारगम्यता अधिक होती है। सोडियम के निकट विशाल प्रेरणा शक्ति है किन्तु लगभग कोई विश्राम पारगम्यता नहीं है। इस स्थिति में, पोटेशियम सोडियम की तुलना में लगभग 20 गुना अधिक धारा वहन करता है, एवं इस प्रकार Em पर सोडियम की तुलना में 20 गुना अधिक प्रभाव पड़ता है ।
चूँकि, इस स्थिति पर विचार करें- एक्शन पोटेंशिअल का का शिखर हैI यहाँ, Na की पारगम्यता अधिक है एवं K की पारगम्यता अपेक्षाकृत अल्प है। इस प्रकार, झिल्ली ENa के निकट एवं EK से दूर चली जाती है।
जितने अधिक आयन पारगम्य होते हैं, झिल्ली क्षमता का अनुमान लगाना उतना ही कठिन हो जाता है। चूँकि, यह गोल्डमैन-हॉजकिन-काट्ज़ समीकरण या भारित साधन समीकरण का उपयोग करके किया जा सकता है। समय पर किसी भी समय सांद्रता प्रवणताओं एवं आयनों की पारगम्यता में प्लगिंग करके, उस समय झिल्ली क्षमता का निर्धारण किया जा सकता है। जीएचके (GHK) समीकरणों का अर्थ यह है कि किसी भी समय झिल्ली क्षमता का मान सभी पारगम्य आयनों की संतुलन क्षमता का भारित अनुपात होगा। "गुरुत्व" झिल्ली के पार आयनों की सापेक्ष पारगम्यता है।
प्रभाव एवं निहितार्थ
जबकि कोशिकाएं आयनों के परिवहन के लिए ऊर्जा उपयोग करती हैं एवं ट्रांसमेम्ब्रेन क्षमता स्थापित करती हैं, वे परिवर्तन में इस क्षमता का उपयोग अन्य आयनों एवं मेटाबोलाइट्स जैसे चीनी के परिवहन के लिए करती हैं। माइटोकॉन्ड्रियल झिल्ली की ट्रांसमेम्ब्रेन क्षमता एडेनोसिन ट्राइफॉस्फेट (एटीपी) का उत्पादन करती है, जो जैविक ऊर्जा की सामान्य मुद्रा है।
क्रिया क्षमता या उत्तेजना के अन्य रूपों को चलाने के लिए कोशिकाएं उस ऊर्जा पर आकर्षित हो सकती हैं जिसे वे विश्राम करने की क्षमता में संग्रहीत करती हैं। झिल्ली क्षमता में ये परिवर्तन अन्य कोशिकाओं (एक्शन पोटेंशिअल के साथ) के साथ संचार को सक्षम करते हैं या कोशिका के अंदर परिवर्तन प्रारंभ करते हैं, जो शुक्राणु द्वारा निषेचित होने पर अंडे में होता है।
प्लाज्मा झिल्ली के डाइइलेक्ट्रिक गुणों में परिवर्तन मधुमेह एवं डिस्लिपिडेमिया जैसी अंतर्निहित स्थितियों की पहचान के रूप में कार्य कर सकता है।[33]
न्यूरोनल कोशिकाओं में, सोडियम चैनलों के माध्यम से सेल में सोडियम आयनों के साथ क्रिया क्षमता प्रारंभ होती है, जिसके परिणामस्वरूप विध्रुवण होता है, जबकि पुनर्प्राप्ति में पोटेशियम चैनलों के माध्यम से पोटेशियम की बाहरी जन-समुदाय सम्मिलित होती है। ये दोनों प्रवाह निष्क्रिय प्रसार द्वारा होते हैं।
सोडियम क्लोराइड की मात्रा द्रव्यमान के नवीन निवारक अभी भी कार्य कर रहे न्यूरॉन्स को फायरिंग में ट्रिगर कर सकती है, जिससे मांसपेशियों में पीड़ा हो सकती है।
यह भी देखें
- बायोइलेक्ट्रोकैमिस्ट्री
- केमियोस्मोटिक क्षमता
- विद्युत रासायनिक क्षमता
- गोल्डमैन समीकरण
- मेम्ब्रेन बायोफिजिक्स
- माइक्रोइलेक्ट्रोड सरणी
- सल्तटोरी कोंडुक्ट्न
- भूतल क्षमता
- गिब्स-डोनन प्रभाव
- सिनैप्टिक क्षमता
टिप्पणियाँ
संदर्भ
- ↑ Bruce, Alberts (2014-11-18). Molecular biology of the cell (Sixth ed.). New York, NY. ISBN 9780815344322. OCLC 887605755.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ Abdul Kadir, Lina; Stacey, Michael; Barrett-Jolley, Richard (2018). "Emerging Roles of the Membrane Potential: Action Beyond the Action Potential". Frontiers in Physiology (in English). 9: 1661. doi:10.3389/fphys.2018.01661. ISSN 1664-042X. PMC 6258788. PMID 30519193.
- ↑ Campbell Biology, 6th edition
- ↑ Johnston and Wu, p. 9.
- ↑ 5.0 5.1 Mummert H, Gradmann D (1991). "एसिटाबुलरिया में कार्य क्षमता: वोल्टेज-गेटेड फ्लक्स का मापन और अनुकरण". Journal of Membrane Biology. 124 (3): 265–73. doi:10.1007/BF01994359. PMID 1664861. S2CID 22063907.
- ↑ Lieb WR, Stein WD (1986). "Chapter 2. Simple Diffusion across the Membrane Barrier". सेल मेम्ब्रेन में परिवहन और प्रसार. San Diego: Academic Press. pp. 69–112. ISBN 978-0-12-664661-0.
- ↑ Hodgkin AL, Keynes RD (1955). "'सेपिया' और 'लोलिगो' से विशाल एक्सन में धनायन का सक्रिय परिवहन". J. Physiol. 128 (1): 28–60. doi:10.1113/jphysiol.1955.sp005290. PMC 1365754. PMID 14368574.
- ↑ Caldwell PC, Hodgkin AL, Keynes RD, Shaw TI (1960). "'लोलिगो' के विशाल एक्सन में आयनों के सक्रिय परिवहन पर ऊर्जा से भरपूर फॉस्फेट यौगिकों को इंजेक्ट करने के प्रभाव". J. Physiol. 152 (3): 561–90. doi:10.1113/jphysiol.1960.sp006509. PMC 1363339. PMID 13806926.
- ↑ Steinbach HB, Spiegelman S (1943). "स्क्वीड नर्व एक्सोप्लाज्म में सोडियम और पोटेशियम संतुलन". J. Cell. Comp. Physiol. 22 (2): 187–96. doi:10.1002/jcp.1030220209.
- ↑ Hodgkin AL (1951). "तंत्रिका और पेशी में विद्युत गतिविधि का आयनिक आधार". Biol. Rev. 26 (4): 339–409. doi:10.1111/j.1469-185X.1951.tb01204.x. S2CID 86282580.
- ↑ Eisenman G (1961). "On the elementary atomic origin of equilibrium ionic specificity". In A Kleinzeller; A Kotyk (eds.). झिल्ली परिवहन और चयापचय पर संगोष्ठी. New York: Academic Press. pp. 163–79.Eisenman G (1965). "Some elementary factors involved in specific ion permeation". प्रक्रिया। 23वां अंतरराष्ट्रीय कांग्रेस फिजियोल। विज्ञान।, टोक्यो. Amsterdam: Excerta Med. Found. pp. 489–506.
* Diamond JM, Wright EM (1969). "जैविक झिल्ली: आयन का भौतिक आधार और कोई भी इलेक्ट्रोलाइट चयनात्मकता". Annual Review of Physiology. 31: 581–646. doi:10.1146/annurev.ph.31.030169.003053. PMID 4885777. - ↑ Cai SQ, Li W, Sesti F (2007). "Multiple modes of a-type potassium current regulation". Curr. Pharm. Des. 13 (31): 3178–84. doi:10.2174/138161207782341286. PMID 18045167.
- ↑ Goldin AL (2007). "Neuronal Channels and Receptors". In Waxman SG (ed.). आणविक न्यूरोलॉजी. Burlington, MA: Elsevier Academic Press. pp. 43–58. ISBN 978-0-12-369509-3.
- ↑ Purves et al., pp. 28–32; Bullock, Orkand, and Grinnell, pp. 133–134; Schmidt-Nielsen, pp. 478–480, 596–597; Junge, pp. 33–35
- ↑ Sanes, Dan H.; Takács, Catherine (1993-06-01). "Activity-dependent Refinement of Inhibitory Connections". European Journal of Neuroscience (in English). 5 (6): 570–574. doi:10.1111/j.1460-9568.1993.tb00522.x. ISSN 1460-9568. PMID 8261131. S2CID 30714579.
- ↑ KOFUJI, P.; NEWMAN, E. A. (2004-01-01). "Potassium buffering in the central nervous system". Neuroscience. 129 (4): 1045–1056. doi:10.1016/j.neuroscience.2004.06.008. ISSN 0306-4522. PMC 2322935. PMID 15561419.
- ↑ Sanes, Dan H.; Reh, Thomas A (2012-01-01). Development of the nervous system (Third ed.). Elsevier Academic Press. pp. 211–214. ISBN 9780080923208. OCLC 762720374.
- ↑ Tosti, Elisabetta (2010-06-28). "Dynamic roles of ion currents in early development". Molecular Reproduction and Development. 77 (10): 856–867. doi:10.1002/mrd.21215. ISSN 1040-452X. PMID 20586098. S2CID 38314187.
- ↑ Boyet, M.R.; Jewell, B.R. (1981). "Analysis of the effects of changes in rate and rhythm upon electrical activity in the heart". Progress in Biophysics and Molecular Biology. 36 (1): 1–52. doi:10.1016/0079-6107(81)90003-1. ISSN 0079-6107. PMID 7001542.
- ↑ Spinelli, Valentina; Sartiani, Laura; Mugelli, Alessandro; Romanelli, Maria Novella; Cerbai, Elisabetta (2018). "Hyperpolarization-activated cyclic-nucleotide-gated channels: pathophysiological, developmental, and pharmacological insights into their function in cellular excitability". Canadian Journal of Physiology and Pharmacology. 96 (10): 977–984. doi:10.1139/cjpp-2018-0115. hdl:1807/90084. ISSN 0008-4212. PMID 29969572. S2CID 49679747.
- ↑ Jones, Brian L.; Smith, Stephen M. (2016-03-30). "Calcium-Sensing Receptor: A Key Target for Extracellular Calcium Signaling in Neurons". Frontiers in Physiology. 7: 116. doi:10.3389/fphys.2016.00116. ISSN 1664-042X. PMC 4811949. PMID 27065884.
- ↑ Debanne, Dominique; Inglebert, Yanis; Russier, Michaël (2019). "Plasticity of intrinsic neuronal excitability" (PDF). Current Opinion in Neurobiology (in English). 54: 73–82. doi:10.1016/j.conb.2018.09.001. PMID 30243042. S2CID 52812190.
- ↑ Davenport, Bennett; Li, Yuan; Heizer, Justin W.; Schmitz, Carsten; Perraud, Anne-Laure (2015-07-23). "Signature Channels of Excitability no More: L-Type Channels in Immune Cells". Frontiers in Immunology. 6: 375. doi:10.3389/fimmu.2015.00375. ISSN 1664-3224. PMC 4512153. PMID 26257741.
- ↑ Sakmann, Bert (2017-04-21). "From single cells and single columns to cortical networks: dendritic excitability, coincidence detection and synaptic transmission in brain slices and brains". Experimental Physiology. 102 (5): 489–521. doi:10.1113/ep085776. ISSN 0958-0670. PMC 5435930. PMID 28139019.
- ↑ Franco R, Bortner CD, Cidlowski JA (January 2006). "Potential roles of electrogenic ion transport and plasma membrane depolarization in apoptosis". J. Membr. Biol. 209 (1): 43–58. doi:10.1007/s00232-005-0837-5. PMID 16685600. S2CID 849895.
- ↑ Purves et al., pp. 32–33; Bullock, Orkand, and Grinnell, pp. 138–140; Schmidt-Nielsen, pp. 480; Junge, pp. 35–37
- ↑ Spangler SG (1972). "डाइवेलेंट और मोनोवैलेंट दोनों आयनों को शामिल करने के लिए स्थिर क्षेत्र समीकरण का विस्तार". Alabama Journal of Medical Sciences. 9 (2): 218–23. PMID 5045041.
- ↑ पूर्वेस एट अल।, पी। 34; थिओडोर होम्स बुलॉक, ऑरकांड, और ग्रिनेल, पी। 134; नट श्मिट-नीलसन | श्मिट-नीलसन, पीपी। 478–480.
- ↑ Purves et al., pp. 33–36; Bullock, Orkand, and Grinnell, p. 131.
- ↑ 30.0 30.1 Magnuson DS, Morassutti DJ, Staines WA, McBurney MW, Marshall KC (Jan 14, 1995). "In vivo electrophysiological maturation of neurons derived from a multipotent precursor (embryonal carcinoma) cell line". Developmental Brain Research. 84 (1): 130–41. doi:10.1016/0165-3806(94)00166-W. PMID 7720212.
- ↑ Juusola M, Kouvalainen E, Järvilehto M, Weckström M (Sep 1994). "Contrast gain, signal-to-noise ratio, and linearity in light-adapted blowfly photoreceptors". J Gen Physiol. 104 (3): 593–621. doi:10.1085/jgp.104.3.593. PMC 2229225. PMID 7807062.
- ↑ Laughlin SB, de Ruyter van Steveninck RR, Anderson JC (May 1998). "The metabolic cost of neural information". Nat. Neurosci. 1 (1): 36–41. doi:10.1038/236. PMID 10195106. S2CID 204995437.
- ↑ Ghoshal K, et al. (December 2017). "Dielectric properties of plasma membrane: A signature for dyslipidemia in diabetes mellitus". Arch Biochem Biophys. 635: 27–36. doi:10.1016/j.abb.2017.10.002. PMID 29029878.
अग्रिम पठन
- Alberts et al. Molecular Biology of the Cell. Garland Publishing; 4th Bk&Cdr edition (March, 2002). ISBN 0-8153-3218-1. Undergraduate level.
- Guyton, Arthur C., John E. Hall. Textbook of medical physiology. W.B. Saunders Company; 10th edition (August 15, 2000). ISBN 0-7216-8677-X. Undergraduate level.
- Hille, B. Ionic Channel of Excitable Membranes Sinauer Associates, Sunderland, MA, USA; 1st Edition, 1984. ISBN 0-87893-322-0
- Nicholls, J.G., Martin, A.R. and Wallace, B.G. From Neuron to Brain Sinauer Associates, Inc. Sunderland, MA, USA 3rd Edition, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Biological Membranes: Theory of Transport, Potentials and Electric Impulses. Cambridge University Press (September 26, 2002). ISBN 0-521-81018-3. Graduate level.
- National Medical Series for Independent Study. Physiology. Lippincott Williams & Wilkins. Philadelphia, PA, USA 4th Edition, 2001. ISBN 0-683-30603-0