कीटोन
कार्बनिक रसायन विज्ञान में, एक कीटोन /ˈkiːtoʊn/ संरचना R−C(=O)−R' के साथ एक कार्यात्मक समूह है, जहां R और R' विभिन्न प्रकार के कार्बन युक्त पदार्थ हो सकते हैं। कीटोन्स में एक कार्बोनिल समूह −C(=O)− (जिसमें कार्बन-ऑक्सीजन द्वि-आबंध C = O होता है) होता है। सरलतम कीटोन एसीटोन है (जहाँ R और R' मिथाइल है), सूत्र (CH3)2CO के साथ। जीव विज्ञान और उद्योग में कई कीटोन्स का बहुत महत्व है। उदाहरणों में कई शर्कराऐं (किटोस), कई स्टेरॉयड (जैसे, टेस्टोस्टेरॉन),और विलायक एसीटोन सम्मिलित हैं।[1]
नामकरण और व्युत्पत्ति
कीटोन शब्द एसीटोन के लिए एक पुराने जर्मन शब्द एकेटन से लिया गया है।[2][3] IUPAC नामकरण के नियमों के अनुसार, कीटोन नाम मूल एल्केन के अनुलग्न -ane को -anone में बदलकर प्राप्त किया जाता है। आमतौर पर, कार्बोनिल समूह की स्थिति को एक संख्या द्वारा दर्शाया जाता है, लेकिन पारंपरिक गैर-व्यवस्थित नाम अभी भी आम तौर पर सबसे महत्वपूर्ण कीटोन्स के लिए उपयोग किए जाते हैं, उदाहरण के लिए एसीटोन और बेंजोफेनोन। इन गैर-व्यवस्थित नामों को बनाए रखना IUPAC नाम माना जाता है,[4] हालांकि कुछ परिचयात्मक रसायन विज्ञान की पाठ्यपुस्तकों में सरलतम कीटोन (CH3−C(=O)−CH3) की बजाय "एसीटोन" के लिए "2-प्रोपेनोन" या "प्रोपेन-2-वन" जैसे व्यवस्थित नामों का उपयोग किया गया है।
कीटोन्स के व्युत्पन्न नाम कार्बोनिल समूह से जुड़े दो एल्काइल समूहों के नाम अलग-अलग लिखकर प्राप्त किए जाते हैं, जिसके बाद कीटोन को एक अलग शब्द के रूप में लिखा जाता है। परंपरागत रूप से एल्काइल समूहों के नाम बढ़ती जटिलता के क्रम में लिखे गए थे, उदाहरण के लिए मिथाइल एथिल कीटोन। हालाँकि, IUPAC नामकरण के नियमों के अनुसार, एल्काइल समूहों को वर्णानुक्रम में लिखा जाता है, उदाहरण के लिए एथिल मिथाइल कीटोन। जब दो ऐल्किल समूह समान होते हैं, तो ऐल्किल समूह के नाम के पहले पूर्वलग्न ''di-'' जोड़ दिया जाता है। अन्य समूहों की स्थितियों को ग्रीक अक्षरों द्वारा निर्दिष्ट किया जाता है, α-कार्बन कार्बोनिल समूह से संलग्न परमाणु है।
यद्यपि कभी-कभी उपयोग किया जाता है, ऑक्सो ऑक्सो समूह (= O) के लिए IUPAC नामकरण है और कीटोन की उच्चतम प्राथमिकता नहीं होने पर पूर्वलग्न (प्रीफिक्स) के रूप में उपयोग किया जाता है। हालाँकि, अन्य उपसर्गों का भी उपयोग किया जाता है। कुछ सामान्य रसायनों के लिए (मुख्य रूप से जैव रसायन में), कीटो कीटोन कार्यात्मक समूह को संदर्भित करता है।
संरचना और गुण

कीटोन कार्बन को अक्सर sp2 संकरित के रूप में वर्णित किया जाता है, एक ऐसा विवरण जिसमें उनकी इलेक्ट्रॉनिक और आणविक संरचना दोनों सम्मिलित हैं। कीटोन्स लगभग 120° के C–C–O और C–C–C बंधन कोण के साथ, केटोनिक कार्बन के चारों ओर त्रिकोणीय समतल हैं। कीटोन्स एल्डिहाइड से भिन्न होते हैं जिसमें कार्बोनिल समूह (C = O) कार्बन ढांचा के भीतर दो कार्बन से बंधा होता है। एल्डिहाइड में, कार्बोनिल एक कार्बन और एक हाइड्रोजन से जुड़ा होता है और कार्बन श्रृंखला के शीर्षों पर स्थित होता है। कीटोन्स अन्य कार्बोनिल युक्त कार्यात्मक समूहों से भी भिन्न होते हैं, जैसे कार्बोक्जिलिक एसिड, एस्टर और एमाइड्स।[5]
कार्बोनिल समूह ध्रुवीय है क्योंकि ऑक्सीजन की वैद्युतीयऋणात्मकता कार्बन की तुलना में अधिक है। इस प्रकार, कीटोन ऑक्सीजन पर नाभिकरागी (न्यूक्लियोफिलिक) और कार्बन पर इलेक्ट्रॉनरागी (इलेक्ट्रोफिलिक) होते हैं। क्योंकि कार्बोनिल समूह हाइड्रोजन बंध द्वारा जल के साथ अंत:क्रिया करता है, कीटोन्स आमतौर पर संबंधित मेथिलीन यौगिकों की तुलना में जल में अधिक घुलनशील होते हैं। कीटोन्स हाइड्रोजन-बंध ग्राही हैं। कीटोन्स आमतौर पर हाइड्रोजन-बंध दाता नहीं होते हैं और स्वयं से हाइड्रोजन-बंध नहीं कर सकते हैं। हाइड्रोजन-बंध दाता और ग्राही दोनों के रूप में सेवा करने में उनकी अक्षमता के कारण, कीटोन स्वयं-सहयोगी नहीं होते हैं और अल्कोहल और तुलनीय आणविक भार के कार्बोक्जिलिक एसिड की तुलना में अधिक अस्थिर होते हैं। ये कारक गंध-द्रव्य में और विलायक के रूप में कीटोन्स की व्यापकता से संबंधित हैं।
कीटोन्स की श्रेणियां
कीटोन्सको उनके प्रतिस्थापन के आधार पर वर्गीकृत किया गया है। कार्बोनिल केंद्र से जुड़े दो कार्बनिक पदार्थों की समतुल्यता के आधार पर, एक व्यापक वर्गीकरण कीटोन्सको सममित और असममित डेरिवेटिव में उप-विभाजित करता है। एसीटोन और बेंजोफेनोन ((C6H5)2CO) सममित कीटोन हैं। acetophenone (C6H5C(O)CH3) एक असममित कीटोन है।
डाइकेटोन्स
कई प्रकार के डिकीटोन ज्ञात हैं, कुछ असामान्य गुणों के साथ। सबसे सरल डायसेटाइल है (CH3C(O)C(O)CH3), एक बार पॉपकॉर्न में मक्खन-सुगंध के रूप में उपयोग किया जाता था। एसिटाइलैसटोन (पेंटेन-2,4-डायोन) वस्तुतः एक मिथ्या नाम (अनुचित नाम) है क्योंकि यह प्रजाति मुख्य रूप से मोनोएनोल के रूप में मौजूद है CH3C(O)CH=C(OH)CH3. इसका एनोलेट समन्वय रसायन विज्ञान में एक सामान्य लिगैंड है।
असंतृप्त कीटोन्स
एल्केन और alkyne इकाइयों वाले कीटोन्स को अक्सर असंतृप्त कीटोन कहा जाता है। यौगिकों के इस वर्ग का सबसे व्यापक रूप से इस्तेमाल किया जाने वाला सदस्य मिथाइल विनाइल कीटोन है, CH3C(O)CH=CH2, जो रॉबिन्सन एनुलेशन रिएक्शन में उपयोगी है। ऐसा न हो कि कोई भ्रम हो, एक कीटोन अपने आप में असंतृप्ति का स्थल है; यानी इसे हाइड्रोजनीकृत किया जा सकता है।
चक्रीय कीटोन्स
कई कीटोन चक्रीय होते हैं। सबसे सरल वर्ग का सूत्र है (CH2)nCO, जहाँ n साइक्लोप्रोपेनोन के लिए 2 से भिन्न होता है ((CH2)2CO) दसियों तक। बड़े डेरिवेटिव मौजूद हैं। साइक्लोहेक्सानोन ((CH2)5CO), एक सममित चक्रीय कीटोन, नायलॉन के उत्पादन में एक महत्वपूर्ण मध्यवर्ती है। आइसोफोरोन, एसीटोन से प्राप्त होता है, एक असंतृप्त, असममित कीटोन है जो अन्य पॉलिमर का अग्रदूत है। मस्कोन, 3-मिथाइलपेंटाडेकेनोन, एक पशु फेरोमोन है। एक अन्य चक्रीय कीटोन साइक्लोबुटानोन है, जिसका सूत्र है (CH2)3CO.
केटो-एनोल टॉटोमेराइज़ेशन
कीटोन्सजिनमें कम से कम एक अल्फा हाइड्रोजन होता है, कीटो-enol टॉटोमेराइजेशन से गुजरते हैं; टॉटोमर एक एनोल है। टॉटोमेराइज़ेशन अम्ल और क्षार दोनों द्वारा उत्प्रेरित होता है। आमतौर पर कीटो फॉर्म एनोल की तुलना में अधिक स्थिर होता है। यह संतुलन एल्केनीज़ की हाइड्रेशन प्रतिक्रिया के माध्यम से कीटोन्सको तैयार करने की अनुमति देता है।
कीटोन्स के अम्ल/क्षार गुण
C−H कीटोन्समें कार्बोनिल से सटे बंधन अधिक अम्लीय होते हैं अम्ल पृथक्करण स्थिरांक|pKa≈ 20) की तुलना में C−H अल्केन में बांड (pKa≈ 50). यह अंतर अवक्षेपण पर बनने वाले एनोलेट आयन के अनुनाद स्थिरीकरण को दर्शाता है। कीटोन्स और अन्य कार्बोनिल यौगिकों की एनोलाइज़ेशन प्रतिक्रियाओं में α-हाइड्रोजन की सापेक्ष अम्लता महत्वपूर्ण है। Α-हाइड्रोजन की अम्लता भी कीटोन्स और अन्य कार्बोनिल यौगिकों को उस स्थिति में न्यूक्लियोफाइल के रूप में प्रतिक्रिया करने की अनुमति देती है, या तो स्टोइकोमेट्रिक और उत्प्रेरक आधार के साथ। लिथियम डायसोप्रोपाइलमाइड (LDA, pKa संयुग्म एसिड ~ 36) गैर-संतुलन स्थितियों के तहत (-78 °C, THF में 1.1 इक्विव LDA, बेस में कीटोन जोड़ा गया), कम-प्रतिस्थापित काइनेटिक एनोलेट चुनिंदा रूप से उत्पन्न होता है, जबकि ऐसी स्थितियाँ जो संतुलन के लिए अनुमति देती हैं (उच्च तापमान, बेस कमजोर या अघुलनशील क्षारों का उपयोग करके कीटोन में जोड़ा जाता है, उदाहरण के लिए, सोडियम एथोक्साइड|CH3CH2ONa इथेनॉल में|CH3CH2OH, या सोडियम हाइड्राइड) अधिक-प्रतिस्थापित थर्मोडायनामिक एनोलेट प्रदान करता है।
कीटोन्सभी कमजोर क्षार होते हैं, जो ब्रोंस्टेड एसिड की उपस्थिति में कार्बोनिल ऑक्सीजन पर प्रोटोनेशन से गुजरते हैं। केटोनियम आयन (यानी, प्रोटोनेटेड केटोन्स) पीके के साथ मजबूत एसिड होते हैंa मान -5 और -7 के बीच कहीं होने का अनुमान है।[6][7] हालांकि कार्बनिक रसायन विज्ञान में पाए जाने वाले एसिड शायद ही कभी पूरी तरह से कीटोन्सको प्रोटोनेट करने के लिए पर्याप्त मजबूत होते हैं, उदाहरण के लिए, एसिटल के गठन की तरह कई सामान्य कार्बनिक प्रतिक्रियाओं के तंत्र में प्रोटोनेटेड कीटोन्सके संतुलन सांद्रता का गठन एक महत्वपूर्ण कदम है। एक pK के साथ पाइरिडिनियम केशन जितना कमजोर एसिड (जैसा कि पाइरिडिनियम टॉसिलेट में पाया जाता है)।a प्रोटोनेशन के लिए अत्यधिक प्रतिकूल संतुलन स्थिरांक (Keq < 10-10).
लक्षण वर्णन
एक एल्डिहाइड एक कीटोन से भिन्न होता है जिसमें इसके कार्बोनिल समूह से हाइड्रोजन परमाणु जुड़ा होता है, जिससे एल्डिहाइड को ऑक्सीकरण करना आसान हो जाता है। कीटोन्समें कार्बोनिल समूह से जुड़ा हाइड्रोजन परमाणु नहीं होता है, और इसलिए ऑक्सीकरण के लिए अधिक प्रतिरोधी होते हैं। वे केवल शक्तिशाली ऑक्सीकरण एजेंटों द्वारा ऑक्सीकृत होते हैं जिनमें कार्बन-कार्बन बांडों को बंधने की क्षमता होती है।
स्पेक्ट्रोस्कोपी
कीटोन्सऔर एल्डिहाइड अवरक्त स्पेक्ट्रोस्कोपी में दृढ़ता से अवशोषित करते हैं | इन्फ्रा-रेड स्पेक्ट्रम 1700 तरंग संख्या के पास | सेमी-1. चोटी की सटीक स्थिति प्रतिस्थापन पर निर्भर करती है।
जबकि प्रोटोन NMR|1एच एनएमआर स्पेक्ट्रोस्कोपी आमतौर पर कीटोन, कार्बन-13 एनएमआर की उपस्थिति स्थापित करने के लिए उपयोगी नहीं है|13सी एनएमआर स्पेक्ट्रा संरचना के आधार पर 200 भाग-प्रति नोटेशन#पीपीएम के कुछ डाउनफ़ील्ड संकेतों को प्रदर्शित करता है। ऐसे संकेत आम तौर पर परमाणु ओवरहॉसर प्रभावों की अनुपस्थिति के कारण कमजोर होते हैं। चूंकि एल्डिहाइड समान रासायनिक पारियों में प्रतिध्वनित होते हैं, एल्डिहाइड और कीटोन्सको निश्चित रूप से अलग करने के लिए कई अनुनाद प्रयोगों को नियोजित किया जाता है।
गुणात्मक जैविक परीक्षण
कीटोन्सब्रैडी के परीक्षण में सकारात्मक परिणाम देते हैं, 2,4-डाइनिट्रोफेनिलहाइड्राज़ीन के साथ प्रतिक्रिया से संबंधित हाइड्राज़ोन देने के लिए। कीटोन्सको एल्डिहाइड से टोलेंस के अभिकर्मक या फेहलिंग के समाधान के साथ नकारात्मक परिणाम देकर अलग किया जा सकता है। आयोडोफॉर्म परीक्षण के लिए मिथाइल कीटोन सकारात्मक परिणाम देते हैं।[8] बैंगनी रंग देने के लिए तनु सोडियम हाइड्रॉक्साइड की उपस्थिति में एम-डाइनिट्रोबेंजीन के साथ इलाज करने पर कीटोन भी सकारात्मक परिणाम देते हैं।
संश्लेषण
औद्योगिक पैमाने और शैक्षणिक प्रयोगशालाओं में कीटोन्स तैयार करने के लिए कई तरीके मौजूद हैं। कीटोन्स जीवों द्वारा विभिन्न तरीकों से भी निर्मित किए जाते हैं; नीचे जैव रसायन पर अनुभाग देखें।
उद्योग में, सबसे महत्वपूर्ण विधि में अक्सर हवा के साथ हाइड्रोकार्बन का ऑक्सीकरण सम्मिलित होता है। उदाहरण के लिए, cyclohexane के एरोबिक ऑक्सीकरण द्वारा सालाना एक अरब किलोग्राम साइक्लोहेक्सानोन का उत्पादन किया जाता है। क्यूमीन प्रक्रिया द्वारा एसीटोन तैयार किया जाता है। क्यूमीन का वायु-ऑक्सीकरण।
विशेष या छोटे पैमाने पर कार्बनिक संश्लेषण अनुप्रयोगों के लिए, कीटोन्सअक्सर अल्कोहल ऑक्सीकरण # ऑक्सीकरण से कीटोन्सद्वारा तैयार किए जाते हैं:
- R2CH(OH) + "O" → R2C=O + H2O
विशिष्ट मजबूत कार्बनिक ऑक्सीकरण (उपरोक्त प्रतिक्रिया में ओ का स्रोत) में पोटेशियम परमैंगनेट या क्रोमियम | सीआर (VI) यौगिक सम्मिलित हैं। हल्की स्थितियाँ डेस-मार्टिन पीरियोडिनेन या स्वर्न ऑक्सीकरण | मोफेट-स्वर्न विधियों का उपयोग करती हैं।
कई अन्य तरीके विकसित किए गए हैं, उदाहरणों में सम्मिलित हैं:[9]
- जेमिनल हैलाइड हाइड्रोलिसिस द्वारा।[10]
- एल्काइन्स की जलयोजन प्रतिक्रिया द्वारा।[11] ऐसी प्रक्रियाएं एनोल के माध्यम से होती हैं और एक एसिड और पारा (द्वितीय) सल्फेट की उपस्थिति की आवश्यकता होती है (HgSO4). बाद में एनोल-कीटो टॉटोमेराइजेशन एक कीटोन देता है। यह प्रतिक्रिया हमेशा एक कीटोन पैदा करती है, यहां तक कि टर्मिनल एल्केनी के साथ भी, एसिटिलीन का हाइड्रेशन एकमात्र अपवाद है, जो एसीटैल्डिहाइड पैदा करता है।
- वेनरेब कीटोन सिंथेसिस से स्टोइकियोमेट्रिक ऑर्गेनोमेटेलिक अभिकर्मकों का उपयोग करना।
- फ्रीडेल-क्राफ्ट एसाइलेशन में सुगंधित कीटोन तैयार किए जा सकते हैं,[12] संबंधित ह्यूबेन-होश प्रतिक्रिया,[13] और फ्राइज़ पुनर्व्यवस्था।[11]* ओजोनोलिसिस, और संबंधित डाइहाइड्रॉक्सिलेशन/ऑक्सीडेटिव अनुक्रम, एल्कीन प्रतिस्थापन पैटर्न के आधार पर, एल्डिहाइड या कीटोन्सदेने के लिए एल्केन्स को साफ करते हैं।[14]
- कोर्नब्लम-डेलामेयर पुनर्विन्यास कीटोन्स परॉक्साइड्स और बेस से तैयार किए जाते हैं।
- रुज़िका चक्रीकरण मेंडाइकारबॉक्सिलिक एसिड अम्लों से चक्रीय कीटोन तैयार किए जाते हैं।
- नेफ अभिक्रिया में द्वितीयक नाइट्रो यौगिकों के लवणों के जल-अपघटन से कीटोन बनते हैं।[15]
- फुकुयामा युग्मन में, कीटोन एक थायोस्टर और एक ऑर्गेनोजिंक यौगिक से बनते हैं।
- ऑर्गनोकैडमियम यौगिकों या ऑर्गेनोकॉपर यौगिकों के साथ एक एसिड क्लोराइड की प्रतिक्रिया से।
- डैकिन-वेस्ट प्रतिक्रिया कार्बोक्जिलिक एसिड से कुछ मिथाइल कीटोन्सकी तैयारी के लिए एक कुशल विधि प्रदान करती है।[16]
- ग्रिग्नार्ड अभिकर्मकों की नाइट्राइल के साथ प्रतिक्रिया, उसके बाद हाइड्रोलिसिस द्वारा कीटोन्सभी तैयार किए जा सकते हैं।[17]
- कार्बोक्जिलिक एनहाइड्राइड के डिकार्बोजाइलेशन द्वारा।
- हेलो कीटोन्स के रिडक्टिव डिहैलोजनेशन में हैलोकीटोन्ससे कीटोन्सतैयार किए जा सकते हैं।
- केटोनिक डीकार्बाक्सिलेशन में कार्बोक्जिलिक एसिड से सममित कीटोन तैयार किए जाते हैं।[11][18]
- आयरन (III) क्लोराइड के साथ अमीन्स का ऑक्सीकरण।[19]
- संतृप्त और असंतृप्त यौगिकों की हाइड्रोलिसिस माध्यमिक (रसायन विज्ञान) एमाइड्स,[20] अल्फा और बीटा कार्बन | β-केटो एसिड एस्टर,[11]या β-diketones।
- Diol#Vicinal diols|1,2-diols की एसिड-उत्प्रेरित पुनर्व्यवस्था।[11]
प्रतिक्रियाएं
कीटोन्सकई कार्बनिक प्रतिक्रियाओं में संलग्न हैं। सबसे महत्वपूर्ण प्रतिक्रियाएं कार्बोनिल कार्बन की न्यूक्लियोफिलिक जोड़ की संवेदनशीलता और इलेक्ट्रोफिल में जोड़ने के लिए एनोलेट्स की प्रवृत्ति का अनुसरण करती हैं।
न्यूक्लियोफिलिक परिवर्धन में उनकी व्यापकता के अनुमानित क्रम में सम्मिलित हैं:[9]* पानी (हाइड्रेशन) के साथ जेमिनल डायोल देता है, जो आमतौर पर प्रशंसनीय (या देखने योग्य) मात्रा में नहीं बनता है
- α-hydroxyalkyne देने के लिए एक एसिटिलाइड के साथ
- अमोनिया या एक प्राथमिक ऐमीन के साथ एक मुझे मेरा देता है
- द्वितीयक अमाइन के साथ एक enamine देता है
- ग्रिग्नार्ड अभिकर्मक और ऑर्गेनोलिथियम अभिकर्मकों के साथ, जलीय वर्कअप के बाद, एक तृतीयक अल्कोहल
- अल्कोहल या एल्कोक्साइड के साथ [[हेमिअगर पूछा जाए ]] या इसके संयुग्म आधार देता है। केतल को एक डायोल के साथ। यह प्रतिक्रिया कीटोन्स की सुरक्षा के लिए नियोजित है।
- सोडियम एमाइड के साथ C-C बॉन्ड क्लीवेज के परिणामस्वरूप एमाइड RCONH का निर्माण होता है2 और एल्केन या एरेन आर'एच, एक प्रतिक्रिया जिसे हॉलर-बाउर प्रतिक्रिया कहा जाता है।[21]
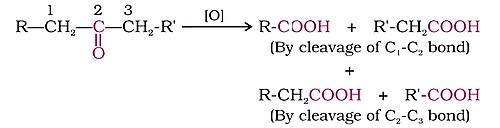
- कार्बोक्जिलिक एसिड देने के लिए मजबूत ऑक्सीकरण एजेंटों के साथ। कीटोन्सआमतौर पर जोरदार परिस्थितियों में, यानी मजबूत ऑक्सीकरण एजेंटों और ऊंचे तापमान पर ऑक्सीकृत होते हैं। उनके ऑक्सीकरण में कार्बन-कार्बन बॉन्ड क्लीवेज सम्मिलित है, जो कार्बोक्जिलिक एसिड के मिश्रण को वहन करने के लिए मूल कीटोन की तुलना में कार्बन परमाणुओं की संख्या कम होती है।
* इलेक्ट्रोफाइल जोड़, इलेक्ट्रोफिलिक के साथ प्रतिक्रिया एक प्रतिध्वनि स्थिरीकरण देती है
- फास्फोनियम यलाइड्स के साथ विटिग अभिक्रिया में एल्कीन देते हैं
- थायोएसेटल देने के लिए थिओल्स के साथ
- [[हाइड्रोज़ोन]] देने के लिए हाइड्राज़ीन या हाइड्राज़ीन के 1-विघटित व्युत्पन्न (रसायन विज्ञान) के साथ।
- धातु हाइड्राइड से मेटल एल्कोक्साइड नमक मिलता है, जिसके हाइड्रोलिसिस से अल्कोहल बनता है, कीटोन कमी का एक उदाहरण
- हलोजन के साथ हलोकीटोन बनाने के लिए, एक प्रतिक्रिया जो एक एनोल के माध्यम से आगे बढ़ती है (हेलोफॉर्म प्रतिक्रिया देखें)
- भारी पानी के साथ deuterated कीटोन देने के लिए
- प्रकाशरासायनिक नॉर्रिश अभिक्रिया में विखंडन
- रॉबिन्सन-गेब्रियल संश्लेषण में निर्जलीकरण द्वारा 1,4-अमीनोडिकीटोन की ऑक्साज़ोल्स की प्रतिक्रिया
- ऐरिल-एल्किल कीटोन के मामले में, सल्फर और एक ऐमीन के साथ विलगेरोड्ट अभिक्रिया में एमाइड देते हैं
- ऑक्सिम्स का उत्पादन करने के लिए hydroxylamine के साथ
- कम करने वाले एजेंटों के साथ माध्यमिक अल्कोहल बनाने के लिए
- बेयर-विलिगर ऑक्सीकरण में एस्टर बनाने के लिए पेरोक्सी एसिड के साथ
जैव रसायन
कीटोन प्रकृति में व्यापक हैं। प्रकाश संश्लेषण में कार्बनिक यौगिकों का निर्माण कीटोन राइबुलोज-1,5-बिस्फोस्फेट के माध्यम से होता है। कई शक्कर कीटोन होते हैं, जिन्हें सामूहिक रूप से केटोस के रूप में जाना जाता है। सबसे प्रसिद्ध कीटोज फ्रुक्टोज है; यह ज्यादातर चक्रीय हेमिकेटल के रूप में मौजूद होता है, जो कीटोन कार्यात्मक समूह को मास्क करता है। फैटी एसिड संश्लेषण कीटोन्सके माध्यम से आगे बढ़ता है। एसीटोएसीटेट क्रेब्स चक्र में एक मध्यवर्ती है जो शर्करा और कार्बोहाइड्रेट से ऊर्जा जारी करता है।[22] चिकित्सा में, एसीटोन, एसीटोसेटेट और बीटा-हाइड्रॉक्सीब्यूटाइरेट को सामूहिक रूप से कीटोन निकाय कहा जाता है, जो मनुष्यों सहित अधिकांश कशेरुकियों में कार्बोहाइड्रेट, वसा अम्ल और एमिनो एसिड से उत्पन्न होता है। रात की नींद सहित, उपवास के बाद कीटोन बॉडी रक्त (किटोसिस) में बढ़ जाती है; भुखमरी में रक्त और मूत्र दोनों में; हाइपोग्लाइसीमिया में, हाइपरिन्सुलिनमिक हाइपोग्लाइसीमिया के अलावा अन्य कारणों से; चयापचय की विभिन्न जन्मजात त्रुटि में, और जानबूझकर एक केटोजेनिक आहार के माध्यम से प्रेरित, और कीटोअसिदोसिस (आमतौर पर मधुमेह मेलेटस के कारण)। हालांकि कीटोएसिडोसिस विघटित या अनुपचारित टाइप 1 मधुमेह की विशेषता है, कुछ परिस्थितियों में मधुमेह मेलेटस टाइप 2 में किटोसिस या कीटोएसिडोसिस भी हो सकता है।
अनुप्रयोग
सॉल्वैंट्स, पॉलिमर प्रीकर्सर और फार्मास्यूटिकल्स के रूप में उद्योग में बड़े पैमाने पर कीटोन्सका उत्पादन किया जाता है। पैमाने के संदर्भ में, सबसे महत्वपूर्ण कीटोन एसीटोन, मिथाइल एथिल कीटोन और साइक्लोहेक्सानोन हैं।[23] वे जैव रसायन में भी आम हैं, लेकिन सामान्य तौर पर कार्बनिक रसायन से कम हैं। हाइड्रोकार्बन का दहन एक अनियंत्रित ऑक्सीकरण प्रक्रिया है जो कीटोन्स के साथ-साथ कई अन्य प्रकार के यौगिक देती है।
विषाक्तता
हालांकि यौगिकों के इतने व्यापक वर्ग की विषाक्तता पर सामान्यीकरण करना मुश्किल है, साधारण कीटोन सामान्य रूप से अत्यधिक विषैले नहीं होते हैं। यह विशेषता सॉल्वैंट्स के रूप में उनकी लोकप्रियता का एक कारण है। इस नियम के अपवाद संतृप्त और असंतृप्त यौगिक कीटोन हैं जैसे मिथाइल विनाइल कीटोन LD50 7 मिलीग्राम/किग्रा (मौखिक)।[23]
यह भी देखें
- डाइकेटोन
- कीटोन निकाय
- थायोकेटोन
- ट्राइकटोन
- कोई नहीं
- केटोसिस
संदर्भ
- ↑ Raymond, Kenneth W. (2010). General Organic and Biological Chemistry (3rd ed.). Wiley. p. 297.
- ↑ Harper, Douglas. "ketone". Online Etymology Dictionary.
- ↑ The word "ketone" was coined in 1848 by the German chemist Leopold Gmelin. See: Leopold Gmelin, ed., Handbuch der organischen Chemie: Organische Chemie im Allgemeinen … (Handbook of organic chemistry: Organic chemistry in general … ), 4th ed., (Heidelberg, (Germany): Karl Winter, 1848), volume 1, p. 40. From page 40: "Zu diesen Syndesmiden scheinen auch diejenigen Verbindungen zu gehören, die als Acetone im Allegemeinen (Ketone?) bezeichnet werden." (To these syndesmides*, those compounds also seem to belong, which are designated as acetones in general (ketones?).") [*Note: In 1844, the French chemist Auguste Laurent suggested a new nomenclature for organic compounds. One of his new classes of compounds was "syndesmides", which were compounds formed by the combination of two or more simpler organic molecules (from the Greek σύνδεσμος (syndesmos, union) + -ide (indicating a group of related compounds)). For example, acetone could be formed by the dry distillation of metal acetates, so acetone was the syndesmide of two acetate ions. See: Laurent, Auguste (1844) "Classification chimique," Comptes rendus, 19 : 1089–1100 ; see especially p. 1097.
- ↑ List of retained IUPAC names retained IUPAC names Link
- ↑ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ↑ Evans, David A. (4 November 2005). "इवांस पीकेए टेबल" (PDF). Evans group website. Archived from the original (PDF) on 19 June 2018. Retrieved 14 June 2018.
- ↑ Smith, Michael B. (2013). मार्च की उन्नत कार्बनिक रसायन (7th ed.). Hoboken, N.J.: Wiley. pp. 314–315. ISBN 978-0-470-46259-1.
- ↑ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7
- ↑ 9.0 9.1 Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ↑ Marvel, C. S.; Sperry, W. M. (1928). "benzophenone". Organic Syntheses. 8: 26. doi:10.15227/orgsyn.008.0026.
- ↑ 11.0 11.1 11.2 11.3 11.4 Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). व्यावहारिक कार्बनिक रसायन शास्त्र की वोगेल की पाठ्यपुस्तक (5th ed.). London: Longman Science & Technical. pp. 612–623, 976–977, 982–983. ISBN 9780582462366.
- ↑ Allen, C. F. H.; Barker, W. E. (1932). "Desoxybenzoin". Organic Syntheses. 12: 16. doi:10.15227/orgsyn.012.0016.
- ↑ Gulati, K. C.; Seth, S.R.; Venkataraman, K. (1935). "क्लोरोएसेटोफेनोन". Organic Syntheses. 15: 70. doi:10.15227/orgsyn.015.0070.
- ↑ Tietze, Lutz F.; Bratz, Matthias (1993). "Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates: Dimethyl Mesoxalate". Organic Syntheses. 71: 214. doi:10.15227/orgsyn.071.0214.
- ↑ Heinzelman, R. V. (1955). "ओ-मेथॉक्सीफेनिलएसीटोन". Organic Syntheses. 35: 74. doi:10.15227/orgsyn.035.0074.
- ↑ Wiley, Richard H.; Borum, O. H. (1953). "3-Acetamido-2-butanone". Organic Syntheses. 33: 1. doi:10.15227/orgsyn.033.0001.
- ↑ Moffett, R. B.; Shriner, R. L. (1941). "ω-Methoxyacetophenone". Organic Syntheses. 21: 79. doi:10.15227/orgsyn.021.0079.
- ↑ Thorpe, J. F.; Kon, G. A. R. (1925). "साइक्लोपेंटेनोन". Organic Syntheses. 5: 37. doi:10.15227/orgsyn.005.0037.
- ↑ Fieser, Louis F. (1937). "1,2-Naphthoquinone". Organic Syntheses. 17: 68. doi:10.15227/orgsyn.017.0068.
- ↑ Herbst, R. M.; Shemin, D. (1939). "फेनिलपायरुविक एसिड". Organic Syntheses. 19: 77. doi:10.15227/orgsyn.019.0077.
- ↑ Haller–Bauer Reaction. homeip.net
- ↑ Nelson, D. L.; Cox, M. M. (2000) Lehninger, Principles of Biochemistry. 3rd Ed. Worth Publishing: New York. ISBN 1-57259-153-6.
- ↑ 23.0 23.1 Siegel, Hardo; Eggersdorfer, Manfred (2000). "Ketones". उलमन्स एनसाइक्लोपीडिया ऑफ इंडस्ट्रियल केमिस्ट्री. doi:10.1002/14356007.a15077 (inactive 31 December 2022). ISBN 9783527306732.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link)
बाहरी संबंध
 Media related to Ketones at Wikimedia Commons
Media related to Ketones at Wikimedia Commons