कीटोन
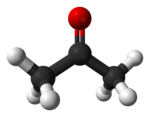
कार्बनिक रसायन विज्ञान में, एक कीटोन /ˈkiːtoʊn/ संरचना R−C(=O)−R' के साथ एक कार्यात्मक समूह है, जहां R और R' विभिन्न प्रकार के कार्बन युक्त पदार्थ हो सकते हैं। कीटोन्स में एक कार्बोनिल समूह −C(=O)− (जिसमें कार्बन-ऑक्सीजन द्वि-आबंध C = O होता है) होता है। सरलतम कीटोन एसीटोन है (जहाँ R और R' मिथाइल है), सूत्र (CH3)2CO के साथ। जीव विज्ञान और उद्योग में कई कीटोन्स का बहुत महत्व है। उदाहरणों में कई शर्कराऐं (किटोस), कई स्टेरॉयड (जैसे, टेस्टोस्टेरॉन),और विलायक एसीटोन सम्मिलित हैं।[1]
नामकरण और व्युत्पत्ति
कीटोन शब्द एसीटोन के लिए एक पुराने जर्मन शब्द एकेटन से लिया गया है।[2][3] IUPAC नामकरण के नियमों के अनुसार, कीटोन नाम मूल एल्केन के अनुलग्न -ane को -anone में बदलकर प्राप्त किया जाता है। आमतौर पर, कार्बोनिल समूह की स्थिति को एक संख्या द्वारा दर्शाया जाता है, लेकिन पारंपरिक गैर-व्यवस्थित नाम अभी भी आम तौर पर सबसे महत्वपूर्ण कीटोन्स के लिए उपयोग किए जाते हैं, उदाहरण के लिए एसीटोन और बेंजोफेनोन। इन गैर-व्यवस्थित नामों को बनाए रखना IUPAC नाम माना जाता है,[4] हालांकि कुछ परिचयात्मक रसायन विज्ञान की पाठ्यपुस्तकों में सरलतम कीटोन (CH3−C(=O)−CH3) की बजाय "एसीटोन" के लिए "2-प्रोपेनोन" या "प्रोपेन-2-वन" जैसे व्यवस्थित नामों का उपयोग किया गया है।
कीटोन्स के व्युत्पन्न नाम कार्बोनिल समूह से जुड़े दो एल्काइल समूहों के नाम अलग-अलग लिखकर प्राप्त किए जाते हैं, जिसके बाद कीटोन को एक अलग शब्द के रूप में लिखा जाता है। परंपरागत रूप से एल्काइल समूहों के नाम बढ़ती जटिलता के क्रम में लिखे गए थे, उदाहरण के लिए मिथाइल एथिल कीटोन। हालाँकि, IUPAC नामकरण के नियमों के अनुसार, एल्काइल समूहों को वर्णानुक्रम में लिखा जाता है, उदाहरण के लिए एथिल मिथाइल कीटोन। जब दो ऐल्किल समूह समान होते हैं, तो ऐल्किल समूह के नाम के पहले पूर्वलग्न ''di-'' जोड़ दिया जाता है। अन्य समूहों की स्थितियों को ग्रीक अक्षरों द्वारा निर्दिष्ट किया जाता है, α-कार्बन कार्बोनिल समूह से संलग्न परमाणु है।
यद्यपि कभी-कभी उपयोग किया जाता है, ऑक्सो ऑक्सो समूह (= O) के लिए IUPAC नामकरण है और कीटोन की उच्चतम प्राथमिकता नहीं होने पर पूर्वलग्न (प्रीफिक्स) के रूप में उपयोग किया जाता है। हालाँकि, अन्य उपसर्गों का भी उपयोग किया जाता है। कुछ सामान्य रसायनों के लिए (मुख्य रूप से जैव रसायन में), कीटो कीटोन कार्यात्मक समूह को संदर्भित करता है।
संरचना और गुण

कीटोन कार्बन को अक्सर sp2 संकरित के रूप में वर्णित किया जाता है, एक ऐसा विवरण जिसमें उनकी इलेक्ट्रॉनिक और आणविक संरचना दोनों सम्मिलित हैं। कीटोन्स लगभग 120° के C–C–O और C–C–C बंधन कोण के साथ, कीटोनिक कार्बन के चारों ओर त्रिकोणीय समतल हैं। कीटोन्स एल्डिहाइड से भिन्न होते हैं जिसमें कार्बोनिल समूह (C = O) कार्बन ढांचा के भीतर दो कार्बन से बंधा होता है। एल्डिहाइड में, कार्बोनिल एक कार्बन और एक हाइड्रोजन से जुड़ा होता है और कार्बन श्रृंखला के शीर्षों पर स्थित होता है। कीटोन्स अन्य कार्बोनिल युक्त कार्यात्मक समूहों से भी भिन्न होते हैं, जैसे कार्बोक्सिलिक अम्ल, एस्टर और एमाइड्स।[5]
कार्बोनिल समूह ध्रुवीय है क्योंकि ऑक्सीजन की वैद्युतीयऋणात्मकता कार्बन की तुलना में अधिक है। इस प्रकार, कीटोन ऑक्सीजन पर नाभिकरागी (न्यूक्लियोफिलिक) और कार्बन पर इलेक्ट्रॉनरागी (इलेक्ट्रोफिलिक) होते हैं। क्योंकि कार्बोनिल समूह हाइड्रोजन बंध द्वारा जल के साथ अंत:क्रिया करता है, कीटोन्स आमतौर पर संबंधित मेथिलीन यौगिकों की तुलना में जल में अधिक घुलनशील होते हैं। कीटोन्स हाइड्रोजन-बंध ग्राही हैं। कीटोन्स आमतौर पर हाइड्रोजन-बंध दाता नहीं होते हैं और स्वयं से हाइड्रोजन-बंध नहीं कर सकते हैं। हाइड्रोजन-बंध दाता और ग्राही दोनों के रूप में सेवा करने में उनकी अक्षमता के कारण, कीटोन स्वयं-सहयोगी नहीं होते हैं और अल्कोहल और तुलनीय आणविक भार के कार्बोक्सिलिक अम्ल की तुलना में अधिक अस्थिर होते हैं। ये कारक गंध-द्रव्य में और विलायक के रूप में कीटोन्स की व्यापकता से संबंधित हैं।
कीटोन्स की श्रेणियां
कीटोन्स को उनके प्रतिस्थापन के आधार पर वर्गीकृत किया गया है। कार्बोनिल केंद्र से जुड़े दो कार्बनिक पदार्थों की समतुल्यता के आधार पर, एक व्यापक वर्गीकरण कीटोन्स को सममित और असममित यौगिक (डेरिवेटिव) में उप-विभाजित करता है। एसीटोन और बेंजोफेनोन ((C6H5)2CO) सममित कीटोन हैं। ऐसीटोफीनोन (C6H5C(O)CH3) एक असममित कीटोन है।
डाइकीटोन
कुछ असामान्य गुणों के साथ, कई प्रकार के डाइकीटोन ज्ञात हैं | सबसे शुद्धडाइएसिटिल (CH3C(O)C(O)CH3) है, जिसे एक बार पॉपकॉर्न में मक्खन-सुगंध के रूप में उपयोग किया जाता था। एसिटाइलसेटोन (पेंटेन-2,4-डाइओन) वास्तव में एक मिथ्यानाम (अनुचित नाम) है क्योंकि यह वर्ग मुख्य रूप से मोनोएनोल CH3C(O)CH=C(OH)CH3 के रूप में उपस्थित है। इसका एनोलेट समन्वय रसायन विज्ञान में एक सामान्य लिगैंड है।
असंतृप्त कीटोन्स
एल्केन और एल्काइन इकाइयों वाले कीटोन्स को अक्सर असंतृप्त कीटोन कहा जाता है। यौगिकों के इस वर्ग का सबसे व्यापक रूप से उपयोग किया जाने वाला सदस्य मेथिल विनाइल कीटोन, CH3C(O)CH=CH2 है, जो रॉबिन्सन एनुलेशन प्रतिक्रिया में उपयोगी है। ऐसा न हो कि कोई भ्रम हो, एक कीटोन अपने आप में असंतृप्ति का स्थल (साइट) है; यानी इसे हाइड्रोजनीकृत किया जा सकता है।
चक्रीय कीटोन्स
कई कीटोन चक्रीय होते हैं। सबसे सामान्य वर्ग का सूत्र (CH2)nCO है, जहाँ n साइक्लोप्रोपेनोन ((CH2)2CO) के लिए दो से दस तक भिन्न होता है। बड़े यौगिक (डेरिवेटिव) उपस्थित हैं। साइक्लोहेक्सानोन ((CH2)5CO), एक सममित चक्रीय कीटोन तथा नायलॉन के उत्पादन में एक महत्वपूर्ण मध्यवर्ती है। आइसोफोरोन, एसीटोन से प्राप्त एक असंतृप्त, असममित कीटोन है, जो अन्य पॉलिमर का अग्रगामी है। मस्कोन, 3-मेथिलपेंटाडेकेनोन एक पशु फेरोमोन है। एक अन्य चक्रीय कीटोन साइक्लोबुटानोन है, जिसका सूत्र है (CH2)3CO है।
कीटो-एनोल टॉटोमेराइज़ेशन
कीटोन्स जिनमें कम से कम एक अल्फा हाइड्रोजन होता है, कीटो-एनोल टॉटोमेराइजेशन से गुजरते हैं; टॉटोमर एक एनोल है। टॉटोमेराइज़ेशन अम्ल और क्षार दोनों द्वारा उत्प्रेरित होता है। आमतौर पर कीटो रूप एनोल की तुलना में अधिक स्थिर होता है। यह संतुलन ऐल्काइनों के हाइड्रेशन के माध्यम से कीटोन्स को तैयार करने की अनुमति देता है।
कीटोन्स के अम्ल/क्षार गुण
कीटोन्स में कार्बोनिल से संलग्न C−H बंध एल्केन में C−H बंधों (pKa≈ 50) की तुलना में अधिक अम्लीय pKa ≈ 20) हैं। यह अंतर अवक्षेपण पर बनने वाले एनोलेट आयन के अनुनाद स्थिरीकरण को दर्शाता है। कीटोन्स और अन्य कार्बोनिल यौगिकों की ईनोलीकरण प्रतिक्रियाओं में α-हाइड्रोजन की सापेक्ष अम्लता महत्वपूर्ण है। α-हाइड्रोजन की अम्लता भी कीटोन्स और अन्य कार्बोनिल यौगिकों को रससमीकरणमितीय और उत्प्रेरक क्षार के साथ उस स्थिति में न्यूक्लियोफाइल के रूप में प्रतिक्रिया करने की अनुमति देती है। असंतुलित स्थितियों (-78 °C, THF में 1.1 समतुल्य LDA, क्षार में कीटोन जोड़ा गया) के तहत लिथियम डायसोप्रोपाइलमाइड (LDA, संयुग्मी अम्ल ~ 36 का pKa ) जैसे अतिप्रबल क्षारों का उपयोग करना, कम-प्रतिस्थापित काइनेटिक एनोलेट वरणक्षमतापूर्वक उत्पन्न होता है, जबकि ऐसी स्थितियाँ जो संतुलन के लिए अनुमति देती हैं (उच्च तापमान, दुर्बल या अघुलनशील क्षारों का उपयोग करके कीटोन में जोड़ा गया क्षार तथा उदाहरण के लिए, CH3CH2ONa में CH3CH2OH, या NaH) अधिक-प्रतिस्थापित थर्मोडायनामिक एनोलेट प्रदान करता है।
कीटोन्स भी दुर्बल क्षार होते हैं, जो ब्रोंस्टेड अम्लों की उपस्थिति में कार्बोनिल ऑक्सीजन पर प्रोटॉनीकरण से गुजरते हैं। कीटोनियम आयन (यानी, प्रोटोनित कीटोन्स) प्रबल अम्ल होते हैं, pKa मान -5 और -7 के बीच कहीं होने का अनुमान है।[6][7] हालांकि कार्बनिक रसायन में पाए जाने वाले अम्ल शायद ही कभी पूरी तरह से कीटोन्स को प्रोटोनित करने के लिए पर्याप्त प्रबल होते हैं, उदाहरण के लिए, एसिटल के निर्माण की तरह कई सामान्य कार्बनिक प्रतिक्रियाओं के तंत्र में प्रोटोनित कीटोन्स के संतुलन सांद्रता का निर्माण एक महत्वपूर्ण कदम है। 5.2 के pKa के साथ पाइरिडिनियम धनायन (जैसा कि पाइरिडिनियम टॉसिलेट में पाया जाता है) के रूप में अम्ल इस संदर्भ में उत्प्रेरक के रूप में काम करने में समर्थ हैं, प्रोटॉनीकरण के लिए अत्यधिक प्रतिकूल संतुलन स्थिरांक होने के बावजूद (Keq < 10-10) है|
विशेषीकरण
एक एल्डिहाइड एक कीटोन से भिन्न होता है जिसमें इसके कार्बोनिल समूह से हाइड्रोजन परमाणु जुड़ा होता है, जिससे एल्डिहाइड को ऑक्सीकरण करना आसान हो जाता है। कीटोन्स में कार्बोनिल समूह से जुड़ा हाइड्रोजन परमाणु नहीं होता है, और इसलिए ऑक्सीकरण के लिए अधिक अघुलनशील होते हैं। वे केवल प्रबल ऑक्सीकरण पदार्थों (एजेंटों) द्वारा ऑक्सीकृत होते हैं जिनमें कार्बन-कार्बन बंधों को तोड़ने की क्षमता होती है।
स्पेक्ट्रोस्कोपी
कीटोन्स और एल्डिहाइड 1700 cm−1 के पास अवरक्त स्पेक्ट्रम में दृढ़ता से अवशोषित होते हैं। चोटी की सटीक स्थिति प्रतिस्थापन पर निर्भर करती है।
जबकि 1H NMR स्पेक्ट्रोस्कोपी आमतौर पर कीटोन की उपस्थिति स्थापित करने के लिए उपयोगी नहीं है, 13C NMR स्पेक्ट्रा संरचना के आधार पर 200 ppm के कुछ डाउनफ़ील्ड संकेत प्रदर्शित करता है। ऐसे संकेत आम तौर पर परमाणु ओवरहॉसर प्रभावों की अनुपस्थिति के कारण दुर्बल होते हैं। चूंकि एल्डिहाइड समान रासायनिक सृति (शिफ्ट) में अनुनादन होते हैं, एल्डिहाइड और कीटोन्स को निश्चित रूप से अलग करने के लिए कई अनुनाद प्रयोगों को नियोजित किया जाता है।
गुणात्मक जैविक परीक्षण
कीटोन्स ब्रैडी के परीक्षण में , 2,4-डाइनिट्रोफेनिलहाइड्राज़ीन के साथ प्रतिक्रिया से संबंधित हाइड्राज़ोन देने के लिए सकारात्मक परिणाम देते हैं। कीटोन्स को एल्डिहाइड से टोलेंस के अभिकर्मक या फेलिंग के विलयन के साथ नकारात्मक परिणाम देकर अलग किया जा सकता है। आयोडोफॉर्म परीक्षण के लिए मेथिल कीटोन सकारात्मक परिणाम देते हैं।[8] बैंगनी रंग देने के लिए तनु सोडियम हाइड्रॉक्साइड की उपस्थिति में एम-डाइनाइट्रोबेन्जीन के साथ अभिक्रियित करने पर कीटोन भी सकारात्मक परिणाम देते हैं।
संश्लेषण
औद्योगिक पैमाने और शैक्षणिक प्रयोगशालाओं में कीटोन्स तैयार करने के लिए कई तरीके उपलब्ध हैं। कीटोन्स जीवों द्वारा विभिन्न तरीकों से भी निर्मित किए जाते हैं; नीचे जैव रसायन पर अनुभाग देखें।
उद्योग में, सबसे महत्वपूर्ण विधि में अक्सर हवा के साथ हाइड्रोकार्बन का ऑक्सीकरण सम्मिलित होता है। उदाहरण के लिए, साइक्लोहेक्सेन के एरोबिक ऑक्सीकरण द्वारा प्रतिवर्ष एक अरब किलोग्राम साइक्लोहेक्सानोन का उत्पादन किया जाता है। क्यूमीन के वायु-ऑक्सीकरण द्वारा एसीटोन तैयार किया जाता है।
विशेष या छोटे पैमाने पर कार्बनिक सिंथेटिक अनुप्रयोगों के लिए, कीटोन्स अक्सर द्वितीयक अल्कोहल के ऑक्सीकरण द्वारा तैयार किए जाते हैं:
- R2CH(OH) + "O" → R2C=O + H2O
विशिष्ट प्रबल ऑक्सीकारकों (उपरोक्त प्रतिक्रिया में "O" का स्रोत) में पोटेशियम परमैंगनेट या Cr(VI) यौगिक सम्मिलित हैं। सौम्य स्थितियाँ डेस-मार्टिन पीरियोडिनेन या मोफेट-स्वर्न विधियों का उपयोग करती हैं।
कई अन्य तरीके विकसित किए गए हैं, उदाहरणों में सम्मिलित हैं:[9]
- जेमिनल हैलाइड जल-अपघटन द्वारा।[10]
- एल्काइन्स के जलयोजन द्वारा।[11] ऐसी प्रक्रियाएं एनोल के माध्यम से होती हैं और एक एसिड और पारा (II) सल्फेट (HgSO4) की उपस्थिति की आवश्यकता होती है। बाद में एनोल-कीटो टॉटोमेराइजेशन एक कीटोन देता है। यह प्रतिक्रिया हमेशा एक कीटोन का निर्माण करती है, यहां तक कि टर्मिनल ऐल्काइन के साथ भी, एसिटिलीन का जलयोजन एकमात्र अपवाद है, जो एसीटैल्डिहाइड का निर्माण करता है।
- वेनरेब एमाइड्स से उचित तत्वानुपातकीय कार्बधात्विक अभिकर्मकों का उपयोग करना।
- फ्रीडेल-क्राफ्ट एसिलकरण,[12] संबंधित हौबेन-होश प्रतिक्रिया[13] और फ्रीस पुनर्विन्यास [11]में ऐरोमैटिक कीटोन्स तैयार किए जा सकते हैं।
- ओजोनी अपघटन, और संबंधित डाइहाइड्रॉक्सिलेशन/ऑक्सीकर अनुक्रम, एल्केन प्रतिस्थापन पैटर्न के आधार पर एल्डिहाइड या कीटोन्स देने के लिए एल्केन्स को साफ करते हैं।[14]
- कोर्नब्लम-डेलामेयर पुनर्विन्यास कीटोन्स परॉक्साइड्स और क्षार से तैयार किए जाते हैं।
- रुज़िका चक्रीकरण में डाइकार्बोक्सिलिक अम्लों से चक्रीय कीटोन तैयार किए जाते हैं।
- नेफ अभिक्रिया में द्वितीयक नाइट्रो यौगिकों के लवणों के जल-अपघटन से कीटोन बनते हैं।[15]
- फुकुयामा युग्मन में, कीटोन एक थायोस्टर और एक ऑर्गेनोजिंक यौगिक से बनते हैं।
- ऑर्गनोकैडमियम यौगिकों या ऑर्गनोकॉपर यौगिकों के साथ एक एसिड क्लोराइड की प्रतिक्रिया से।
- डैकिन-वेस्ट अभिक्रिया कार्बोक्सिलिक अम्ल से कुछ मेथिल कीटोन्स की तैयारी के लिए एक कुशल विधि प्रदान करती है।[16]
- कीटोन्स ग्रिग्नार्ड अभिकर्मकों की नाइट्राइल के साथ प्रतिक्रिया से भी तैयार किए जा सकते हैं, जिसके बाद जल अपघटन होता है।[17]
- कार्बोक्सिलिक एनहाइड्राइड के डीकार्बोक्सिलीकरण द्वारा।
- हेलो कीटोन्स के रिडक्टिव डिहैलोजनेशन में हैलोकीटोन्स से कीटोन्स तैयार किए जा सकते हैं।
- कीटोनिक डीकार्बोक्सिलीकरण में कार्बोक्सिलिक अम्ल से सममित कीटोन तैयार किए जाते हैं।[11][18]
- आयरन (III) क्लोराइड के साथ अमीन्स का ऑक्सीकरण।[19]
- असंतृप्त द्वितीयक एमाइड्स,[20] β-कीटो अम्ल एस्टर[11]या β-अम्ल एस्टर का जल अपघटन|
- 1,2-डायोल्स का अम्ल-उत्प्रेरित पुनर्विन्यास।[11]
प्रतिक्रियाएं
कीटोन्स कई कार्बनिक प्रतिक्रियाओं में संलग्न हैं। सबसे महत्वपूर्ण प्रतिक्रियाएं कार्बोनिल कार्बन की न्यूक्लियोफिलिक संकलन की सुग्राहिता और इलेक्ट्रोफिल में संकलन के लिए एनोलेट्स की प्रवृत्ति का पालन करती हैं।
न्यूक्लियोफिलिक संकलन में उनकी व्यापकता के अनुमानित क्रम में सम्मिलित हैं:[9]
*जल (जलयोजन) के साथ जेमिनल डायोल देता है, जो आमतौर पर पर्याप्त (या प्रेक्षणीय) मात्रा में नहीं बनता है
- α-हाइड्रॉक्सिलकाइन देने के लिए एक एसिटिलाइड के साथ
- अमोनिया या एक प्राथमिक ऐमीन के साथ एक इमाइन देता है
- द्वितीयक ऐमीन के साथ एक एनामाइन देता है
- ग्रिग्नार्ड और ऑर्गेनोलिथियम अभिकर्मकों के साथ, जलीय कार्य के बाद, एक तृतीयक अल्कोहल
- अल्कोहल या ऐल्कॉक्साइड के साथ हेमिकेटल या इसके संयुग्मी क्षारक देता है। केटल को एक डाइऑल के साथ। यह प्रतिक्रिया कीटोन्स की सुरक्षा के लिए नियोजित है।
- सोडियम एमाइड के साथ एमाइड RCONH2 और ऐल्केन या एरीन R'H के निर्माण के साथ C–C आबंध विदलन (क्लीवेज) के परिणामस्वरूप, एक प्रतिक्रिया जिसे हॉलर-बाउर प्रतिक्रिया कहा जाता है।[21]
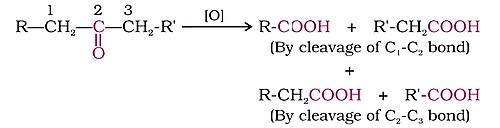
- कार्बोक्सिलिक अम्ल देने के लिए प्रबल ऑक्सीकरण कर्मकों के साथ। कीटोन्स आमतौर पर उद्योगी परिस्थितियों में, यानी प्रबल ऑक्सीकरण कर्मकों और उन्नयित ताप पर ऑक्सीकृत होते हैं। उनके ऑक्सीकरण में कार्बन-कार्बन आबंध विदलन सम्मिलित है, जो कार्बोक्सिलिक अम्ल के मिश्रण को वहन करने के लिए मूल कीटोन की तुलना में कार्बन परमाणुओं की संख्या कम होती है।
* इलेक्ट्रोफिलिक संकलन, इलेक्ट्रोफिलिक के साथ प्रतिक्रिया एक अनुनाद स्थायीकृत देती है
- विटिग प्रतिक्रिया में फास्फोनियम यलाइड्स के साथ एल्केन्स देने के लिए
- थायोएसीटल देने के लिए थिओल्स के साथ
- हाइड्राज़ोन देने के लिए हाइड्राज़ीन या हाइड्राज़ीन के 1-विघटित डेरिवेटिव के साथ।
- एक धातु हाइड्राइड से एक धातु एल्कोक्साइड नमक मिलता है, जिसके जल अपघटन से अल्कोहल बनता है, कीटोन अपचयन का एक उदाहरण
- हैलोजन के साथ हेलोकीटोन बनाने के लिए, एक प्रतिक्रिया जो एक एनोल के माध्यम से आगे बढ़ती है (हेलोफॉर्म प्रतिक्रिया देखें)
- डयूटरित कीटोन देने के लिए खारे जल के साथ
- प्रकाशरासायनिक नॉर्रिश अभिक्रिया में विखंडन
- रॉबिन्सन-गेब्रियल संश्लेषण में निर्जलीकरण द्वारा 1,4-अमीनोडिकीटोन की ऑक्साज़ोल्स की प्रतिक्रिया
- ऐरिल-एल्किल कीटोन की स्थिति में, सल्फर और एक ऐमीन के साथ विलगेरोड्ट अभिक्रिया में एमाइड देते हैं
- ऑक्सिम्स का उत्पादन करने के लिए हाइड्रॉक्सिलऐमीन के साथ
- अपचायकों के साथ द्वितीयक ऐल्कोहॉल बनाने के लिए
- बेयर-विलिगर ऑक्सीकरण में एस्टर बनाने के लिए पेरॉक्सी अम्ल के साथ
जैव रसायन
कीटोन प्रकृति में व्यापक हैं। प्रकाश संश्लेषण में कार्बनिक यौगिकों का निर्माण कीटोन राइबुलोज-1,5-बिस्फोस्फेट के माध्यम से होता है। कई शक्कर कीटोन होते हैं, जिन्हें सामूहिक रूप से कीटोस के रूप में जाना जाता है। सबसे प्रसिद्ध कीटोज फ्रुक्टोज है; यह ज्यादातर चक्रीय हेमिकेटल के रूप में मौजूद होता है, जो कीटोन कार्यात्मक समूह को मास्क करता है। फैटी एसिड संश्लेषण कीटोन्सके माध्यम से आगे बढ़ता है। एसीटोएसीटेट क्रेब्स चक्र में एक मध्यवर्ती है जो शर्करा और कार्बोहाइड्रेट से ऊर्जा जारी करता है।[22] चिकित्सा में, एसीटोन, एसीटोसेटेट और बीटा-हाइड्रॉक्सीब्यूटाइरेट को सामूहिक रूप से कीटोन निकाय कहा जाता है, जो मनुष्यों सहित अधिकांश कशेरुकियों में कार्बोहाइड्रेट, वसा अम्ल और एमिनो एसिड से उत्पन्न होता है। रात की नींद सहित, उपवास के बाद कीटोन बॉडी रक्त (किटोसिस) में बढ़ जाती है; भुखमरी में रक्त और मूत्र दोनों में; हाइपोग्लाइसीमिया में, हाइपरिन्सुलिनमिक हाइपोग्लाइसीमिया के अलावा अन्य कारणों से; चयापचय की विभिन्न जन्मजात त्रुटि में, और जानबूझकर एक कीटोजेनिक आहार के माध्यम से प्रेरित, और कीटोअसिदोसिस (आमतौर पर मधुमेह मेलेटस के कारण)। हालांकि कीटोएसिडोसिस विघटित या अनुपचारित टाइप 1 मधुमेह की विशेषता है, कुछ परिस्थितियों में मधुमेह मेलेटस टाइप 2 में किटोसिस या कीटोएसिडोसिस भी हो सकता है।
अनुप्रयोग
सॉल्वैंट्स, पॉलिमर प्रीकर्सर और फार्मास्यूटिकल्स के रूप में उद्योग में बड़े पैमाने पर कीटोन्सका उत्पादन किया जाता है। पैमाने के संदर्भ में, सबसे महत्वपूर्ण कीटोन एसीटोन, मिथाइल एथिल कीटोन और साइक्लोहेक्सानोन हैं।[23] वे जैव रसायन में भी आम हैं, लेकिन सामान्य तौर पर कार्बनिक रसायन से कम हैं। हाइड्रोकार्बन का दहन एक अनियंत्रित ऑक्सीकरण प्रक्रिया है जो कीटोन्स के साथ-साथ कई अन्य प्रकार के यौगिक देती है।
विषाक्तता
हालांकि यौगिकों के इतने व्यापक वर्ग की विषाक्तता पर सामान्यीकरण करना मुश्किल है, साधारण कीटोन सामान्य रूप से अत्यधिक विषैले नहीं होते हैं। यह विशेषता सॉल्वैंट्स के रूप में उनकी लोकप्रियता का एक कारण है। इस नियम के अपवाद संतृप्त और असंतृप्त यौगिक कीटोन हैं जैसे मिथाइल विनाइल कीटोन LD50 7 मिलीग्राम/किग्रा (मौखिक)।[23]
यह भी देखें
- डाइकीटोन
- कीटोन निकाय
- थायोकीटोन
- ट्राइकटोन
- कोई नहीं
- कीटोसिस
संदर्भ
- ↑ Raymond, Kenneth W. (2010). General Organic and Biological Chemistry (3rd ed.). Wiley. p. 297.
- ↑ Harper, Douglas. "ketone". Online Etymology Dictionary.
- ↑ The word "ketone" was coined in 1848 by the German chemist Leopold Gmelin. See: Leopold Gmelin, ed., Handbuch der organischen Chemie: Organische Chemie im Allgemeinen … (Handbook of organic chemistry: Organic chemistry in general … ), 4th ed., (Heidelberg, (Germany): Karl Winter, 1848), volume 1, p. 40. From page 40: "Zu diesen Syndesmiden scheinen auch diejenigen Verbindungen zu gehören, die als Acetone im Allegemeinen (Ketone?) bezeichnet werden." (To these syndesmides*, those compounds also seem to belong, which are designated as acetones in general (ketones?).") [*Note: In 1844, the French chemist Auguste Laurent suggested a new nomenclature for organic compounds. One of his new classes of compounds was "syndesmides", which were compounds formed by the combination of two or more simpler organic molecules (from the Greek σύνδεσμος (syndesmos, union) + -ide (indicating a group of related compounds)). For example, acetone could be formed by the dry distillation of metal acetates, so acetone was the syndesmide of two acetate ions. See: Laurent, Auguste (1844) "Classification chimique," Comptes rendus, 19 : 1089–1100 ; see especially p. 1097.
- ↑ List of retained IUPAC names retained IUPAC names Link
- ↑ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ↑ Evans, David A. (4 November 2005). "इवांस पीकेए टेबल" (PDF). Evans group website. Archived from the original (PDF) on 19 June 2018. Retrieved 14 June 2018.
- ↑ Smith, Michael B. (2013). मार्च की उन्नत कार्बनिक रसायन (7th ed.). Hoboken, N.J.: Wiley. pp. 314–315. ISBN 978-0-470-46259-1.
- ↑ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7
- ↑ 9.0 9.1 Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ↑ Marvel, C. S.; Sperry, W. M. (1928). "benzophenone". Organic Syntheses. 8: 26. doi:10.15227/orgsyn.008.0026.
- ↑ 11.0 11.1 11.2 11.3 11.4 Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). व्यावहारिक कार्बनिक रसायन शास्त्र की वोगेल की पाठ्यपुस्तक (5th ed.). London: Longman Science & Technical. pp. 612–623, 976–977, 982–983. ISBN 9780582462366.
- ↑ Allen, C. F. H.; Barker, W. E. (1932). "Desoxybenzoin". Organic Syntheses. 12: 16. doi:10.15227/orgsyn.012.0016.
- ↑ Gulati, K. C.; Seth, S.R.; Venkataraman, K. (1935). "क्लोरोएसेटोफेनोन". Organic Syntheses. 15: 70. doi:10.15227/orgsyn.015.0070.
- ↑ Tietze, Lutz F.; Bratz, Matthias (1993). "Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates: Dimethyl Mesoxalate". Organic Syntheses. 71: 214. doi:10.15227/orgsyn.071.0214.
- ↑ Heinzelman, R. V. (1955). "ओ-मेथॉक्सीफेनिलएसीटोन". Organic Syntheses. 35: 74. doi:10.15227/orgsyn.035.0074.
- ↑ Wiley, Richard H.; Borum, O. H. (1953). "3-Acetamido-2-butanone". Organic Syntheses. 33: 1. doi:10.15227/orgsyn.033.0001.
- ↑ Moffett, R. B.; Shriner, R. L. (1941). "ω-Methoxyacetophenone". Organic Syntheses. 21: 79. doi:10.15227/orgsyn.021.0079.
- ↑ Thorpe, J. F.; Kon, G. A. R. (1925). "साइक्लोपेंटेनोन". Organic Syntheses. 5: 37. doi:10.15227/orgsyn.005.0037.
- ↑ Fieser, Louis F. (1937). "1,2-Naphthoquinone". Organic Syntheses. 17: 68. doi:10.15227/orgsyn.017.0068.
- ↑ Herbst, R. M.; Shemin, D. (1939). "फेनिलपायरुविक एसिड". Organic Syntheses. 19: 77. doi:10.15227/orgsyn.019.0077.
- ↑ Haller–Bauer Reaction. homeip.net
- ↑ Nelson, D. L.; Cox, M. M. (2000) Lehninger, Principles of Biochemistry. 3rd Ed. Worth Publishing: New York. ISBN 1-57259-153-6.
- ↑ 23.0 23.1 Siegel, Hardo; Eggersdorfer, Manfred (2000). "Ketones". उलमन्स एनसाइक्लोपीडिया ऑफ इंडस्ट्रियल केमिस्ट्री. doi:10.1002/14356007.a15077 (inactive 31 December 2022). ISBN 9783527306732.
{{cite book}}: CS1 maint: DOI inactive as of December 2022 (link)
बाहरी संबंध
 Media related to Ketones at Wikimedia Commons
Media related to Ketones at Wikimedia Commons